Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение потенциала оптического действия одной клетки в кардиомиоцитах, полученных из человеческих плюрипотентных стволовых клеток
В этой статье
Резюме
Здесь мы описываем оптический захват и характеристику потенциалов действия из индуцированных кардиомиоцитов, полученных из плюрипотентных стволовых клеток, с использованием высокоскоростной модульной фотометрической системы.
Аннотация
Обычные внутриклеточные микроэлектродные методы количественной оценки электрофизиологии кардиомиоцитов чрезвычайно сложны, трудоемки и обычно выполняются с низкой пропускной способностью. Быстрое и постоянное расширение технологии индуцированных плюрипотентных стволовых клеток (iPSC) представляет собой новый стандарт в сердечно-сосудистых исследованиях, и в настоящее время необходимы альтернативные методы для увеличения пропускной способности электрофизиологических данных на уровне одной клетки. VF2.1Cl - это недавно полученный чувствительный к напряжению краситель, который обеспечивает быстрый одноканальный, высокодиалентный отклик на колебания мембранного потенциала. Он обладает кинетикой, превосходящей кинетику других существующих индикаторов напряжения, и делает доступными функциональные данные, эквивалентные традиционным методам микроэлектрода. Здесь мы демонстрируем упрощенную, неинвазивную характеристику потенциала действия в кардиомиоцитах человека, полученных из IPSC, с использованием модульной и очень доступной системы фотометрии.
Введение
Электрофизиологическое моделирование кардиомиоцитов и построение эффективных платформ для скрининга сердечных препаратов имеет важное значение для разработки терапевтических стратегий при различных аритмических расстройствах. Быстрое расширение технологии индуцированных плюрипотентных стволовых клеток (iPSC) привело к многообещающим прониканиям в моделирование заболеваний человека и фармакологическое исследование с использованием изолированных кардиомиоцитов пациента (iPSC-CM). Методы «золотого стандарта» для электрофизиологической характеристики этих клеток с помощью патч-зажима (ток-зажим) могут количественно определять морфологию и продолжительность потенциала действия (AP), однако этот метод невероятно сложен и медленный, и не очень хорошо подходит для сбора данных с высокой пропускной способностью1. Регулярно сообщается, что iPSC-CMs имеют повышенный потенциал диастолической мембраны и повышенный ток утечки по сравнению со взрослыми нативными кардиомиоцитами2. Предполагается, что меньший размер ячейки и уменьшенная емкость мембраны, наблюдаемые в iPSC-CMs, могут привести к некоторой систематической ошибке при использовании метода тока-зажима, возможно, объясняя эти отклонения3. Чтобы максимизировать полезность платформы iPSC-CM, полезен дополнительный метод для увеличения пропускной способности и обеспечения точности данных при характеристике трансмембранных изменений напряжения на уровне одной ячейки в iPSC-CM.
Чувствительные к напряжению красители (VSD) уже давно предлагают метод для обеспечения более быстрого, неинвазивного и эквивалентного анализа кинетики сердечной АП по сравнению с традиционными методами4. Недавнее исследование продемонстрировало пригодность ратиометрической чувствительной к напряжению зондовой фотометрии для точной количественной оценки сердечного AP5. Кроме того, способность легко масштабировать подходы оптической фотометрии дает этот метод крупномасштабным скринингам кардиотоксичности, критически важным для разработки терапевтических препаратов (например, CiPA). Разработка стандартизированных протоколов кардиотоксичности в слепом многосайтовом исследовании с использованием микроэлектродной матрицы и оптических методов измерения напряжения продемонстрировала ключевую ценность этого подхода6.
Многие потенциометрические красители коммерчески доступны, и продолжающаяся синтетическая разработка новых зондов показывает захватывающий потенциал для оптимизации их эффективности в различных сердечных и нейронных конструкциях. Идеальный VSD будет иметь расширенную кинетику и чувствительность, при этом отображая снижение емкостной нагрузки, фотоотбеливания и цитотоксичности. Недавно синтезированный VF2.1Cl (FluoVolt) выражает многие из этих полезных свойств в значительной степени благодаря своей новой молекулярной структуре на основе проводов, разделяемой другими членами нового семейства VoltageFluor (VF)7. В отличие от обычных электрохромных VSD, в которых простые зонды молекулярно и электрически сопряжены с плазматической мембраной, этот краситель состоит из пассивно вставленной, охватывающей мембрану синтетической проволоки, которая соединяет богатого электронами донора с модифицированным флуорофором флуоресцеина (FITC). Механистические детали приведены на рисунке 1. Этот краситель демонстрирует отличную чувствительность к колебаниям напряжения мембраны, отображая изменение интенсивности излучения на 27% на 100 мВ по сравнению с ~ 10%, наблюдаемым в других распространенных датчиках на сопоставимых скоростях7. Кроме того, проводные системы PeT напрямую не взаимодействуют с электрическим полем сотовой связи, что создает минимальные электрические помехи и незначительные изменения емкостной нагрузки сотовой связи.
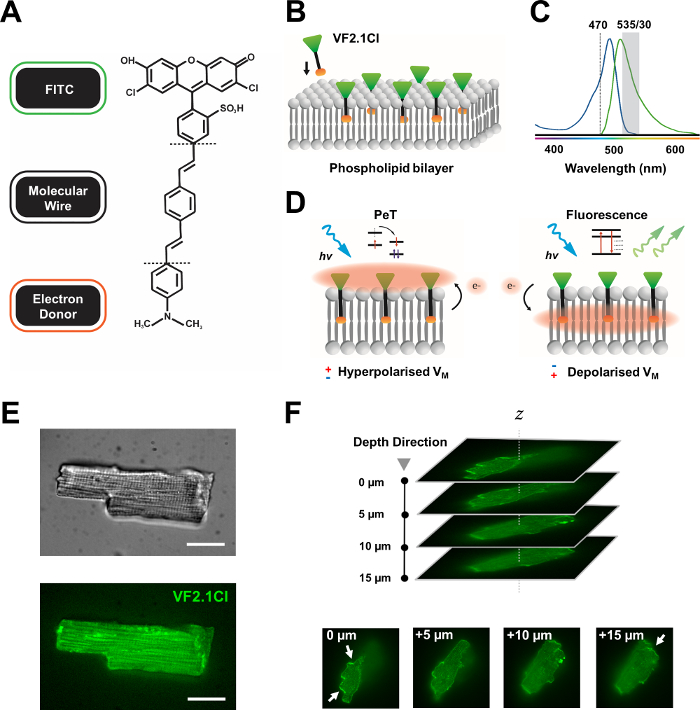
Рисунок 1: Химические, спектральные и механистические параметры красителя VF2.1Cl. (A) Химическая структура VF2.1Cl. Следует отметить, что молекулярные особенности включают несколько алкильных групп в молекулярной проволоке фениленвинилена, которые облегчают введение в плазматическую мембрану. Отрицательно заряженная группа сульфоновой кислоты, конъюгированная с зондом FITC, обеспечивает стабилизацию флуорофора на внеклеточной поверхности и помогает вблизи перпендикулярной вставки относительно электрического поля липидного бислоя. (B) Упрощенная схема встраивания перпендикулярного VF2.1Cl в плазматическую мембрану клетки-мишени. (C)Спектры поглощения и излучения красителя VF2.1Cl. Спектры идентичны спектру стандартных датчиков FITC и GFP. (D)Изображение механистического способа действия VF2.1Cl. В условиях покоя (гиперполяризованных) отрицательные внутриклеточные напряжения гоняют свободные электроны к ростральному флуорофору. Содержание электронов обеспечивает фотоиндуцированный перенос электронов (PeT) в качестве пути выхода из возбужденного состояния после оптического возбуждения, эффективно гася флуоресценцию. Напротив, деполяризованный мембранный потенциал влияет на нисходящее движение электронов, благоприятствуя флуоресценции при оптическом возбуждении. Результирующий флуоресцентный отклик линейно связан с напряжением мембраны и может быть точно использован для сбора подробной временной информации о клеточной электрофизиологической кинетике. (E)Репрезентативные ярко-полевая (верхняя) и флуоресцентная при 470 нм (нижняя) изображения лепориновых кардиомиоцитов, загруженных стеком VF2.1Cl.(F)Z одного загруженного кардиомиоцита. Стрелки указывают участки четкой локализации VF2.1Cl на клеточной мембране. Изображения были получены с помощью конфокальной системы вращающегося диска, состоящей из конфокальной головки вращающегося диска X-lightv3 с 50-мкм точечным рисунком; Осветитель LDI-7; Камера Prime95B и объектив PlanApo Lambda 100x. Шкала: 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Датчик FITC, сопряженный с VF2.1Cl, обеспечивает его эффективное использование в стандартных конфигурациях фильтров и фильтров GFP, и для этого требуется только одноканальная система сбора данных, обе из которых являются общими чертами флуоресцентных платформ визуализации. Анализ плотных человеческих монослоев iPSC-CM с этим красителем был недавно зарегистрирован8,9,10,11. Наш протокол отличается от этих исследований из-за нашего исследования одиночных, изолированных iPSC-CMs, невозмущаемых электрическими и паракринными влияниями плотных синцитиальных монослоев, и нашим использованием доступной и настраиваемой системы фотометрии в отличие от сложных конфокальных или широкоугольных механизмов визуализации.
Здесь мы описываем наш протокол для быстрого сбора и анализа надежных оптических ТОП из изолированных кардиомиоцитов человека, полученных из iPSC, и нативных кардиомиоцитов (см. Дополнительный файл). Мы используем VF2.1Cl в сочетании с настраиваемой современной платформой для одноэлекторных фотометрических измерений. Эти экспериментальные протоколы были одобрены комитетом по этике Университетского медицинского центра Геттингена (No 10/9/15).
протокол
1. Клеточные препараты
ПРИМЕЧАНИЕ: Человеческие ИПСК, используемые в этом протоколе, были получены от здоровых доноров и дифференцированы в монослоях с использованием полностью определенной маломолекулярной модуляции сигналов WNT и методов очистки лактата, какописано ранее 12,13,14. iPSC-CMs поддерживались каждые 2-3 дня с культурой, описанной ниже.
- Готовят культуральную среду из базальной среды (RPMI 1640) и 2% добавки (B27). Хранить при 4 °C. Использовать при комнатной температуре (RT).
- Готовят гальваническое средство из базальной среды (RPMI 1640), 2% добавки (B27) и ингибитора ROCK 1:2000. Хранить при 4 °C. Используйте на RT.
- Покрыть стерилизованное 10 мм круглое стекло #0 крышками со 150 мкл 1:60 факторной свободной базальной мембранной матрицей и инкубировать при 4 °C в течение 4 ч.
ПРИМЕЧАНИЕ: Оптимизация объема крышки необходима для обеспечения покрытия всего стекла при сохранении адекватного поверхностного натяжения для предотвращения разлива. 150 мкл рекомендуется для 10 мм круглых крышек. Размер партии, тип крышки, объем крышки и тип культуры могут соответствовать потребностям экспериментаторов. - Начните диссоциацию iPSC-CM с реагентом диссоциации клеток на основе ЭДТА. Убедитесь, что монослой полностью отслоен, осторожно промывая пипеткой 1000 мкл.
- Переложите клеточную суспензию в пробирку объемом 15 мл и добавьте среду для нанесения покрытия двойного объема. Центрифуга в течение 10 мин при 100 х г.
- Повторное суспендирование гранулы с желаемым объемом (объемом повторного суспензии) гальванических сред. Подсчитывайте ячейки вручную или в электронном виде.
- Выберите оптимальную плотность на один покров (15 000), которая позволит пролила изолированный клеточный анализ позже.
- Рассчитайте объем «активной» клеточной суспензии (А), необходимый для покрытия всех облицовок при этой желаемой плотности. Нанесите следующую формулу и вывести в отдельную пробирку:

- Рассчитайте объем дополнительной гальваночной среды (B), необходимой для размещения каждого чехлового листа на желаемом объеме. Нанесите следующую формулу и добавьте полученный объем в тюбик активной суспензии:
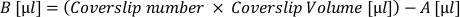
- Снимите матрицу с обложек и нанесите «объем крышки» клеточной суспензии (A + B) на каждый обтеканий. Регулярно повторно суспендировать в трубке, чтобы обеспечить равномерное клеточное распределение.
- Инкубировать при 37 °C в течение 1 ч. Аккуратно наполните колодец гальваноплающей средой.
- Через 24 ч обмениваются средой с обычной питательной средой и выдерживая каждые 2-3 дня.
2. Экспериментальная установка
- Оснастите для проведения экспериментов перевернутый эпифлуоресцентный микроскоп с 40-кратным увеличением, линзой с высокой числовой диафрагмой (N.A: > 0,75).
- Соедините быстро переключаемый теплый белый светодиод с передаваемым портом освещения микроскопа. Вставьте простой красный фильтр 660 нм в путь пропускаемого света.
ПРИМЕЧАНИЕ: Этот свет может быть активирован во время фотометрических экспериментов для наблюдения за образцом без заражения зеленым флуоресцентным сигналом. - Установите быстро переключаемую светодиодную головку 470 нм для фотометрической записи. Вставьте фильтр возбуждения 470/40 в эпифлуоресцентный порт микроскопа, чтобы очистить свет, генерируемый светодиодом.
ПРИМЕЧАНИЕ: Для оптимальной количественной оценки сигнала рекомендуется система освещения с высокоскоростным управлением обратной связью оптического выхода. - Вставьте куб микроскопа, содержащий разветвитель пучка длиной 495 нм, в карусель зеркального блока внутри микроскопа.
- Установите маниктор обнаружения, содержащий регулируемую полевую диафрагму, к порту C-mount микроскопа, чтобы обеспечить возможность выбора интересующего региона.
- Отдельно соедините детектор фотоумножителя (PMT) и USB-камеру к микроскопу. Это ляжит в основу системы обнаружения выбросов.
- Вставьте в порт PMT куб фильтра, содержащий разветвитель пучка дальнего прохода 565 нм и эмиссионные фильтры 535/50. Это разделяет эмиссионные источники света между двумя детекторами.
ПРИМЕЧАНИЕ: Камера, прикрепленная к передаваемому порту системы обнаружения излучения, может обнаруживать проходящий свет под ярким полем во всех экспериментах. - Соедините PMT с блоком питания и усилителем PMT. Подключите выход усилителя PMT к аналоговой входной контакту системы сбора данных.
- Фильтрация аналоговых данных от PMT на частоте 1 кГц или выше.
- Оцифровывайте данные на частоте, которая по меньшей мере вдвое превышает частоту самой высокой частоты, присутствующей в аналоговом сигнале (2 кГц или выше), чтобы соответствовать критериям Найквиста и предотвращать сглаживание.
3. Сотовая загрузка с VF2.1Cl
ПРИМЕЧАНИЕ: Все этапы, связанные с этим красителем, должны выполняться в условиях низкой освещенности.
- Приготовьте раствор для ванны Tyrode (в мМ): 140 NaCl, 10 HEPES, 10 глюкозы, 4 KCl, 1 MgCl2,2 CaCl2,pH = 7,35 и теплый до 37 °C.
- Готовят аликвоту загрузочного раствора в микроцентрифужной трубке путем смешивания 5 мкл 1000x VF2.1Cl и 50 мкл 20% солюбилизирующего раствора полоксамера.
- Нанесите 5 мкл нагрузочного раствора на 5 мл подогретого раствора Тирода (общая концентрация красителя 0,1x) в чашке Петри 20 мм.
ПРИМЕЧАНИЕ: Конечная концентрация красителя составляет 0,1x. Это 1/10, что предложил производитель. Это экономит ресурсы, обеспечивает незначительную цитотоксичность и, что важно, сохраняет четкие оптические сигналы от нагруженных ячеек с высоким соотношением сигнал/шум. - Добавьте в блюдо одну крышку iPSC-CM и высиживайте при 37 °C в течение 20 минут.
- Соберите нагретую камеру визуализации живых клеток. Установите на ступень микроскопа и заполните 500 мкл свежего раствора Tyrode.
- Промойте крышку свежим раствором Tyrode при 37 °C.
- Осторожно нанесите крышку iPSC-CM на предварительно нагретую ванную камеру с помощью мелкоточечных щипцов.
ПРИМЕЧАНИЕ: Убедитесь, что камера и ее содержимое всегда нагреваются при физиологических температурах. При желании начинают с непрерывной перфузии нагретого раствора Тирода.
4. Стимуляция электрического поля
ПРИМЕЧАНИЕ: Внешнее срабатывание iPSC-CM является необязательным, но полезным для стандартизации клеточной динамики и экспериментальных параметров. Это повышает простоту анализа и позволяет проводить исследования частотно-зависимых эффектов.
- Прикрепите стимулирующую вставку с двумя платиновыми электродами, расположенными на 5 мм друг от друга, в камеру записи.
- Подключите внешний стимулятор к стимулирующей вставке. Установите биполярные импульсы поля 5 мс при частоте 0,5 Гц.
- Определить оптимальное напряжение стимуляции путем увеличения стимула от 1 В вверх. Пороговый стимул определяется как самое низкое напряжение, при котором клетки начинают сокращаться. Подайте напряжение примерно на 25% выше этого порога. Нормальный диапазон составляет от 1 В до 30 В.
- Зафиксируйте частоту стимуляции с помощью внешнего стимулятора или запустите ее с помощью программного обеспечения для сбора.
5. Приобретение потенциала оптического действия
ПРИМЕЧАНИЕ: Этот протокол использует коммерческое программное обеспечение для сбора и анализа.
- Визуализируйте миоциты в ярком поле зрения, используя проходящий световой путь и USB-камеру.
- Выберите изолированную ячейку и плотно обрежьте ее оптический путь с помощью полевой диафрагмы, гарантируя, что контролируется только свет от интересующей ячейки.
- Активируйте усилитель PMT и установите напряжение питания PMT на 750 В.
- Запустите протокол стимуляции (см. шаг 4) вместе с программным обеспечением для сбора и одновременно активируйте свет возбуждения 470 нм. Последнее может быть сделано через удаленную панель или автоматизировано с фиксированной интенсивностью (сигнал TTL).
- Отрегулируйте коэффициент усиления и смещение усилителя PMT, чтобы убедиться, что сигнал не насыщается и оптимизирован для диапазона обнаружения системы записи.
- Запись 10 разверток, обеспечивающих обнаружение стабильных потенциалов действия.
- Продолжайте запись и немедленно перемещайте ступень микроскопа, чтобы ненадолго получить фоновый сигнал из области, лишенной клеток. Выключите свет возбуждения.
ПРИМЕЧАНИЕ: Это фоновое значение(смещение F) будет использоваться для учета любой фоновой флуоресценции. - При желании местно перфузировать референтные препараты, такие как 1 мкМ нифедипина, для выявления клеточных реакций на фармакологические манипуляции.
- Последовательно повторяйте шаги 5.2–5.7, каждый раз выбирая новую ячейку. При желании замените крышки, чтобы обеспечить высокую экспериментальную оборачиваемость за один присест.
ПРИМЕЧАНИЕ: Протоколы загрузки и получения изображений описаны на рисунке 2.
6. Анализ данных
- Откройте сохраненную запись с помощью программного обеспечения для анализа и в среднем 10 разверток, содержащих стимулируемые потенциалы действия от одной клетки.
- Возьмем среднее значение базового сигнала, представляющегосмещение F, и вычтите его из усредненной трассировки.
- Вычислите ∆F/F0 по следующей формуле (где F измеряется флуоресценция, а F0 — диастолическая флуоресценция):
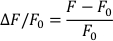
- Определите базовую линию трассировки (диастолическую) и область интереса (AP) и измерьте желаемые параметры потенциала сердечного действия. Это включает, но не ограничивается временем распада для 50% (APD50)и 90% (APD90)реполяризации.
- Экспортируйте данные из этой одной ячейки в программное обеспечение для работы с электронными таблицами.
- Повторите шаги 6.1 – 6.5 для всех записей. Оцените результаты с помощью соответствующих непарных тестов или анализа дисперсии.
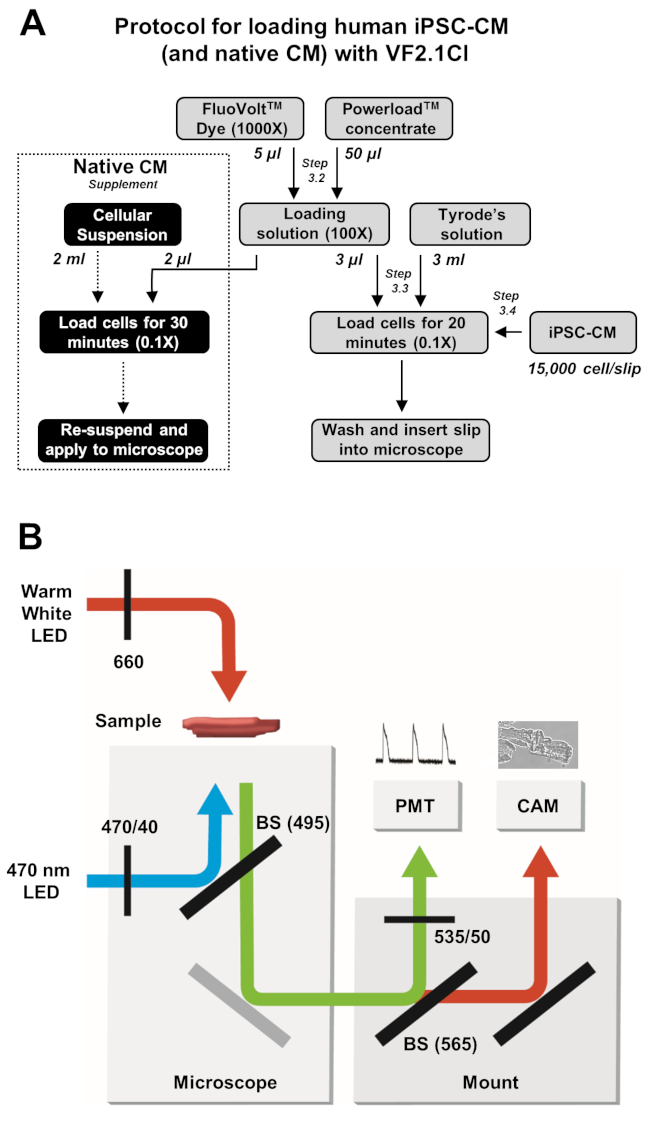
Рисунок 2: Протоколы загрузки и получения изображений. (A) Блок-схема полного протокола загрузки VF2.1Cl для iPSC-CMs и нативных кардиомиоцитов. (B)Упрощенная схема конфигураций светоделителя (BS) и фильтра, используемых в настоящем протоколе для возбуждения и обнаружения излучения VF2.1Cl в ответ на изменения трансмембранного напряжения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
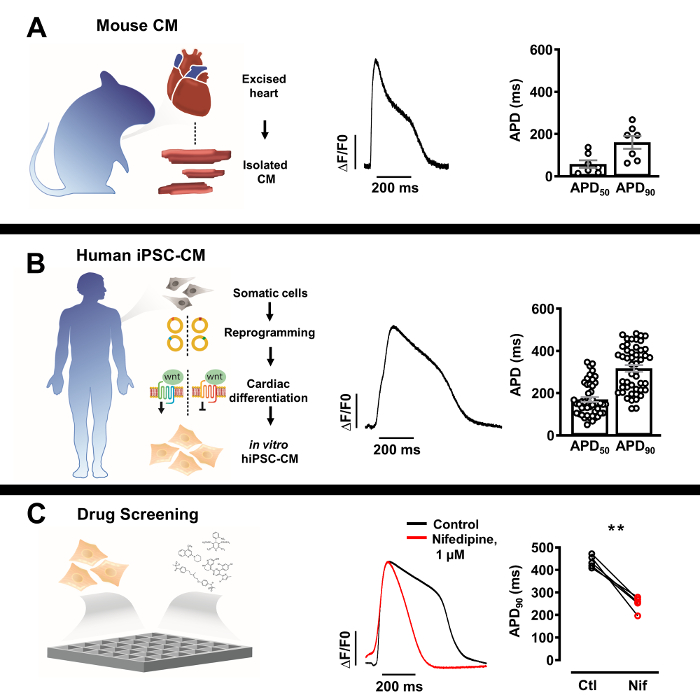
Рисунок 3: Профили оптического потенциала действия (AP) изолированных нативных кардиомиоцитов и кардиомиоцитов, полученных из плюрипотентных стволовых клеток человека (iPSC-CM). (A) Репрезентативная оптическ?...
Обсуждение
Здесь мы описываем базовый протокол для легкого получения подробных профилей AP из изолированных iPSC-CMs, подходящих для электрофизиологического моделирования и скрининга сердечных препаратов. Мы обнаруживаем регулярные, надежные FP из наших разрозненных iPSC-CMs, что предполагает как функц...
Раскрытие информации
Cairn Research Ltd поддержала эту публикацию, покрыв расходы на производство видеофайла.
Благодарности
Авторы хотели бы выразить признательность компании Cairn Research Ltd. за их собственный финансовый вклад, который покрыл производственные расходы на эту публикацию. Кроме того, мы благодарим г-жу Инес Мюллер и г-жу Стефани Кестель за их прекрасную техническую поддержку.
Исследования авторов поддерживаются Немецким центром сердечно-сосудистых исследований (DZHK), Deutsche Forschungsgemeinschaft (DFG, Немецкий исследовательский фонд, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 и в рамках Стратегии передового опыта Германии - EXC 2067/1- 390729940) и Фондом Эльзе-Крёнер-Фрезениуса (EKFS 2016_A20).
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
Ссылки
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochemistry. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены