Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan kaynaklı Pluripotent Kök Hücre Türevli Kardiyomiyositlerde Tek Hücreli Optik Eylem Potansiyeli Ölçümü
Bu Makalede
Özet
Burada, yüksek hızlı modüler fotometri sistemi kullanarak indüklenmiş pluripotent kök hücre türetilmiş kardiyomiyositlerden kaynaklanan eylem potansiyellerinin optik edinimi ve karakterizasyonu açıklanmaktadır.
Özet
Kardiyomiyosit elektrofizyolojisini ölçmek için geleneksel hücre içi mikroelektrot teknikleri son derece karmaşık, emek yoğun ve tipik olarak düşük verimde gerçekleştirilir. İndüklenmiş pluripotent kök hücre (iPSC) teknolojisinin hızlı ve sürekli genişlemesi kardiyovasküler araştırmalarda yeni bir standart sunun ve elektrofizyolojik verilerin verimini tek bir hücre düzeyinde artırmak için alternatif yöntemler artık gereklidir. VF2.1Cl, membran potansiyelindeki dalgalanmalara hızlı bir tek kanallı, yüksek büyüklükte tepki sağlayan yakın zamanda türetilmiş voltaja duyarlı bir boyadır. Diğer mevcut voltaj göstergelerinden daha üstün kinetiklere sahiptir ve geleneksel mikroelekrod tekniklerine eşdeğer işlevsel verileri kullanıma sunmaktadır. Burada, modüler ve son derece uygun fiyatlı bir fotometri sistemi kullanarak harici tempolu insan iPSC türevli kardiyomiyositlerde basitleştirilmiş, invaziv olmayan eylem potansiyeli karakterizasyonunu gösteriyoruz.
Giriş
Kardiyomiyositlerin elektrofizyolojik modellemesi ve kardiyak ilaç taraması için verimli platformların inşası, çeşitli aritmik bozukluklar için terapötik stratejilerin geliştirilmesi için gereklidir. İndüklenmiş pluripotent kök hücre (iPSC) teknolojisinin hızlı genişlemesi, izole hasta türevli kardiyomiyositler (iPSC-CM) kullanılarak insan hastalığı modellemesi ve farmakolojik araştırmalara umut verici yollar üretmiştir. Bu hücrelerin yama kelepçesi (akım kelepçesi) yoluyla elektrofizyolojik karakterizasyonu için "altın standart" teknikler, eylem potansiyelini (AP) morfolojiyi ve süresini ölçebilir, ancak bu yöntem inanılmaz derecede karmaşık ve yavaştır ve yüksek verimli veri toplama için uygun değildir1. iPSC-CM'lerin düzenli olarak yetişkin yerli kardiyomiyositlere kıyasla diastolik membran potansiyelinin ve artan sızıntı akımının arttığı bildirilmektedir2. iPSC-CM'lerde gözlenen daha küçük hücre büyüklüğü ve azaltılmış membran kapasitansının, akım kelepçe tekniğini kullanırken, belki de bu sapmaları açıklarken bazı sistematik hatalar üretebileceği öne sürülmüştür3. Bir iPSC-CM platformunun kullanışlılığını en üst düzeye çıkarmak için, iPSC-CM'lerde transmembran voltaj değişikliklerini tek bir hücre düzeyinde karakterize ederken verimi artırmak ve veri doğruluğunu sağlamak için ek bir yöntem değerlidir.
Voltaja duyarlı boyalar (VSD) uzun zamandır geleneksel tekniklerle karşılaştırmalı olarak kardiyak AP kinetiğinin daha hızlı, non-invaziv ve eşdeğer analizini sağlamak için önerilen bir yöntemdir4. Yeni bir çalışma, kardiyak AP 5'i doğru bir şekilde ölçmek için oranmetrik voltaja duyarlı prob fotometrisinin uygunluğunugöstermiştir. Ayrıca, optik fotometri yaklaşımlarını kolayca ölçeklendirme yeteneği, bu tekniği terapötik ilaç geliştirmede kritik öneme sahip büyük ölçekli kardiyotoksikite ekranlarına (örneğin, CiPA) ödünç verir. Mikroelekrod dizisi ve voltaj algılama optik teknikleri kullanılarak körleştirilmiş çok sahalı bir çalışmada standartlaştırılmış kardiyotoksiklik protokollerinin geliştirilmesi bu yaklaşımın temel değerini göstermiştir6.
Birçok potansiyometrik boya ticari olarak mevcuttur ve yeni probların devam eden sentetik gelişimi, çeşitli kardiyak ve sinirsel yapılarda etkinliklerini kolaylaştırmak için heyecan verici bir potansiyel göstermektedir. İdeal VSD artırılmış kinetik ve hassasiyete sahip olurken, azaltılmış kapasitif yük, fotobleaching ve sitotoksiklik gösterecektir. Yakın zamanda sentezlenen VF2.1Cl (FluoVolt), bu faydalı özelliklerin çoğunu büyük ölçüde yeni VoltageFluor (VF) ailesinin diğer üyeleri tarafından paylaşılan yeni tel tabanlı moleküler yapısı nedeniyle ifade eder7. Basit probların plazma zarına moleküler ve elektriksel olarak eşleştiği yaygın elektrokromik VSD'lerin aksine, bu boya, elektron bakımından zengin bir donörü modifiye floresan florofor (FITC) ile eşleştiren pasif olarak yerleştirilmiş, membran yayılan sentetik bir telden oluşur. Mekanistik detaylar Şekil 1 'de verilmiştir. Bu boya, membran voltaj dalgalanmalarına karşı mükemmel hassasiyet gösterir ve karşılaştırılabilir hızlarda diğer yaygın problarda görülen ~ % 10'un aksine 100 mV başına emisyon yoğunluğunda%27'likbir değişiklik gösterir 7 . Buna ek olarak, tel tabanlı PeT sistemleri, hücresel kapasitif yükte minimum elektrik paraziti ve ihmal edilebilir değişiklikler üreten hücresel elektrik alanıyla doğrudan etkileşime girmez.
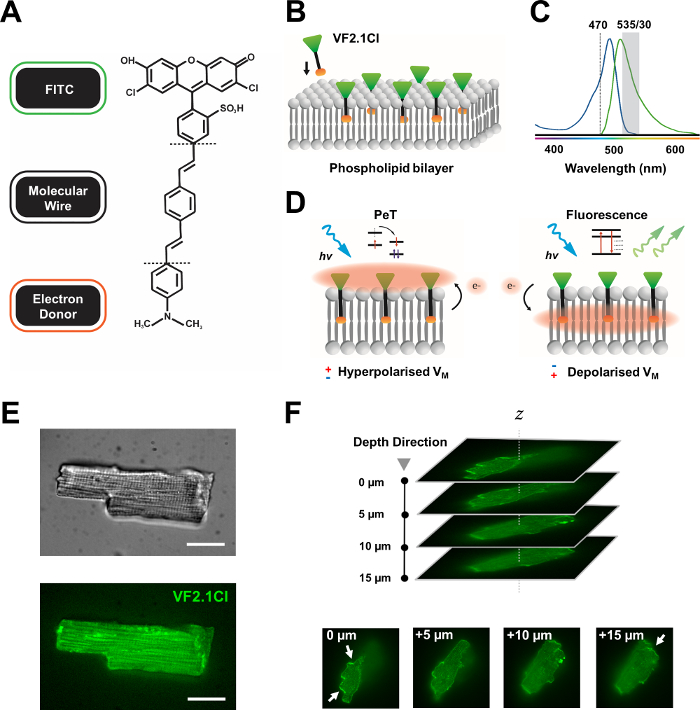
Şekil 1: VF2.1Cl boyanın kimyasal, spektral ve mekanistik parametreleri. (A) VF2.1Cl.'nin kimyasal yapısıKamuyel özellikler, plazma membranına takılmayı kolaylaştıran fenilen vinilen moleküler tel içinde birden fazla alkil grubu içerir. FITC probuna konjuge edilen negatif yüklü sülfinik asit grubu, hücre dışı yüzeyde florofor stabilizasyonu sağlar ve lipid bilayer'in elektrik alanına göre dik yerleştirmeye yakın yardımcı olur. (B) Hedef hücrenin plazma zarına gömülmek için dik VF2.1Cl'nin basitleştirilmiş şeması. (C) VF2.1Cl boya emilimi ve emisyon spektrumu. Spectra, standart FITC ve GFP problarıyla aynıdır. (D) VF2.1Cl'nin mekanistik eylem modunun tasviri. Dinlenme koşullarında (hiperpolarize), negatif hücre içi gerilimler serbest elektronları rostral florofora doğru yönlendirmektedir. Elektron bolluğu, foto-indüklenen elektron transferinin (PeT) optik uyarılmadan sonra heyecanlı durumdan bir çıkış yolu olarak tercih edilmesini sağlar ve floresanlığı etkili bir şekilde söndürür. Buna karşılık, depolarize bir membran potansiyeli, optik ekssitasyon üzerine floresandan yana aşağı doğru elektron hareketini etkiler. Ortaya çıkan floresan yanıt doğrusal olarak membran voltajı ile ilgilidir ve hücresel elektrofizyolojik kinetik hakkında ayrıntılı zamansal bilgi toplamak için hassas bir şekilde kullanılabilir. (E) Temsili brightfield (üst) ve floresan 470 nm (alt) görüntülerde leporin kardiyomiyositler VF2.1Cl. (F) Z yığını tek bir yüklü kardiyomiyosit yığını. Oklar, VF2.1Cl'nin hücresel zara net lokalizasyon alanlarını gösterir. Görüntüler, 50 μm pim deliği desenli bir X-lightv3 dönen disk konfokal kafasından oluşan bir dönen disk konfokal sistemi ile elde edildi; LDI-7 aydınlatıcı; Prime95B kamera ve PlanApo Lambda 100x hedef. Ölçek çubuğu: 20 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
VF2.1Cl'ye eşlenen FITC probu, standart ve GFP filtre yapılandırmaları altında etkin bir şekilde kullanılabilmesini sağlar ve her ikisi de floresan görüntüleme platformlarının ortak özellikleri olan tek bir kanal alma sistemi gerektirir. Bu boya ile yoğun insan iPSC-CM monolayerlerinin analizi son zamanlardabildirilmiştir 8,9,10,11. Protokolümüz, yoğun senkriyal monolayerlerin elektriksel ve parakrin etkilerinden etkilenmeyen tek, izole iPSC-CM'leri araştırmamız ve karmaşık konfokal veya geniş alan görüntüleme düzenlemelerinin aksine uygun fiyatlı ve özelleştirilebilir bir fotometri sistemi kullanmamız nedeniyle bu çalışmalardan farklıdır.
Burada, izole edilmiş insan iPSC türevi kardiyomiyositlerden ve yerel kardiyomiyositlerden sağlam optik AP'lerin hızlı bir şekilde alınması ve analizi için protokolümüzü açıklıyoruz (bkz. Ek Dosya). Tek hücreli fotometri ölçümleri için VF2.1Cl'i özelleştirilebilir bir sanat platformuyla birleştiğinde kullanıyoruz. Bu deneysel protokoller Göttingen Üniversitesi Tıp Merkezi etik kurulu tarafından onaylanmıştır (No. 10/9/15).
Protokol
1. Hücresel hazırlıklar
NOT: Bu protokolde kullanılan insan iPSC'leri sağlıklı donörlerden türetilmiş ve daha önce açıklandığı gibi WNT sinyalizasyon ve laktat saflaştırma tekniklerinin tam tanımlı küçük molekül modülasyonu kullanılarak monolayerlerde farklılaştırılmıştır12,13,14. iPSC-CM'ler her 2-3 günde bir aşağıda özetlenen bir kültür ortamı ile sürdürülmektedir.
- Bazal ortam (RPMI 1640) ve %2 takviye (B27) kültür ortamı hazırlayın. 4 °C'de saklayın. Oda sıcaklığında (RT) kullanın.
- Bazal ortam (RPMI 1640), %2 takviye (B27) ve 1:2000 ROCK inhibitörü kaplama ortamı hazırlayın. 4 °C'de saklayın. RT'de kullanın.
- Ceket sterilize 10 mm yuvarlak cam #0 kapaklar ile 150 μL 1:60 faktörsüz bodrum membran matrisi ve 4 saat boyunca 4 °C'de kuluçkaya yatır.
NOT: Dökülmeyi önlemek için yeterli yüzey gerilimini korurken camın tamamının kaplanmasını sağlamak için kapak hacminin optimizasyonu gereklidir. 10 mm yuvarlak kapaklar için 150 μL önerilir. Parti boyutu, kapak tipi, kapak hacmi ve kültür plakası tipi deneycilerin ihtiyaçlarına uygun olabilir. - EDTA tabanlı bir hücre ayrışması reaktifi ile iPSC-CM ayrışmaya başlayın. 1.000 μL pipetle hafifçe yıkanarak monolayerin tamamen ayrıldığından emin olun.
- Hücresel süspansiyonu 15 mL'lik bir tüpe aktarın ve çift hacimli kaplama ortamı ekleyin. 100 x g'da10 dakika santrifüj.
- Peletin kaplama ortamının istenen hacmi (resüspensyon hacmi) ile yeniden ıslatır. Hücreleri el ile veya elektronik olarak sayın.
- Daha sonra yalıtılmış hücresel analize izin verecek kapak sapanı başına en uygun yoğunluğu (15.000) seçin.
- Tüm kapakları istenen yoğunlukta kaplamak için gereken 'aktif' hücresel süspansiyonun (A) hacmini hesaplayın. Aşağıdaki formülü uygulayın ve ayrı bir tüpe çekin:

- Her kapak kapağını istenen bir hacme yerleştirmek için gereken ekstra kaplama ortamının (B) hacmini hesaplayın. Aşağıdaki formülü uygulayın ve elde eden hacmi aktif süspansiyon tüpüne ekleyin:
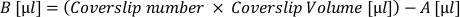
- Matrisi kapaklardan çıkarın ve her kapak parçasına hücre süspansiyonunun (A+B) 'kapak hacmi'ni uygulayın. Hücresel dağılımı bile sağlamak için tüpte düzenli olarak yeniden diriltme.
- 37 °C'de 1 saat kuluçkaya yatır. Kuyuyu yavaşça kaplama ortamı ile doldurun.
- 24 saat sonra, normal kültür ortamı ile medya alışverişi ve her 2-3 günde bir koruyun.
2. Deneysel kurulum
- Deneyler yapmak için ters epifluoresans mikroskobu 40x büyütme, yüksek sayısal diyaframlı lens (N.A: > 0.75) ile donatın.
- Mikroskobun iletilen aydınlatma portunu hızlı bir şekilde değiştiren sıcak beyaz LED'i bir ikiye birleyin. İletilen ışık yoluna basit bir kırmızı 660 nm filtre yerleştirin.
NOT: Bu ışık, yeşil floresan sinyalini kirletmeden numuneyi gözlemlemek için fotometri deneyleri boyunca etkinleştirilebilir. - Fotometri kaydı için hızlı geçişli 470 nm LED kafa takin. LED tarafından üretilen ışığı temizlemek için mikroskobun epifluoresan bağlantı noktasına 470/40 ekscitasyon filtresi yerleştirin.
NOT: Optimum sinyal nicelemesi için optik çıkışın yüksek hızlı geri bildirim kontrolüne sahip bir aydınlatma sistemi önerilir. - Mikroskop içindeki ayna ünitesi atlıkarıncasına 495 nm uzunluğunda geçiş ışını ayırıcı içeren bir mikroskop küpü yerleştirin.
- İlgi alanı seçimine izin vermek için mikroskop C montaj bağlantı noktasına ayarlanabilir bir alan diyaframı içeren bir algılama kolu takın.
- Mikroskop için ayrı ayrı bir fotomultiplier dedektörü (PMT) ve bir USB kamerayı birbirinden ayırın. Bu, emisyon tespit sisteminin temelini oluşturacaktır.
- PMT bağlantı noktasına 565 nm uzunluğunda geçiş ışını ayırıcısı ve 535/50 emisyon filtresi içeren bir filtre küpü yerleştirin. Bu, emisyon ışığını iki dedektör arasında böler.
NOT: Emisyon algılama sisteminin iletilen bağlantı noktasına bağlı bir kamera, tüm deneyler boyunca brightfield altında iletilen ışığı algılayabilir. - PMT'yi bir güç kaynağına ve bir PMT amplifikatörüne birleştirdi. PMT amplifikatör çıkışını bir veri toplama sisteminin analog giriş pimine bağlayın.
- PMT'den analog verileri 1 kHz veya daha yüksek bir hızda filtreleyin.
- Nyquist kriterlerini karşılamak ve takma adı önlemek için analog sinyalde (2 kHz veya daha yüksek) bulunan en yüksek frekansın en az iki katı olan bir frekansta verileri dijitalleştirin.
3. VF2.1Cl ile hücresel yükleme
NOT: Bu boya ile ilgili tüm adımlar düşük ışık koşullarında yapılmalıdır.
- Bir Tyrode banyo çözeltisi hazırlayın (mM): 140 NaCl, 10 HEPES, 10 Glikoz, 4 KCl, 1 MgCl2, 2 CaCl2, pH = 7.35 ve 37 °C'ye ısıtın.
- 1.000x VF2.1Cl'lik 5 μL'lik ve %20'lik çözünür poloksamer çözeltisinin 50 μL'sini karıştırarak mikrosantrifüj tüpünde bir aliquot yükleme çözeltisi hazırlayın.
- 20 mm Petri kabına 5 mL ısıtılmış Tyrode çözeltisine (toplam 0,1x boya konsantrasyonu) 5 μL yükleme çözeltisi uygulayın.
NOT: Son boya konsantrasyonu 0,1x'tir. Bu, üretici tarafından önerilen1/10'udur. Bu, kaynakları korur, ihmal edilebilir sitotoksiklik sağlar ve daha da önemlisi, yüksek sinyal ve gürültü oranlarına sahip yüklü hücrelerden gelen net optik sinyalleri korur. - Çanağa tek bir iPSC-CM kapak fişi ekleyin ve 37 °C'de 20 dakika kuluçkaya yatırın.
- Isıtılmış bir canlı hücre görüntüleme odasını birleştirin. Mikroskop aşamasına monte edin ve 500 μL taze Tyrode çözeltisi ile doldurun.
- Kapak kapağını taze Tyrode çözeltisi ile 37 °C'de yıkayın.
- iPSC-CM kapak kapağını ince noktalı tokmaklar kullanarak önceden ısıtılmış banyo odasına dikkatlice uygulayın.
NOT: Odanın ve içeriğinin her zaman fizyolojik sıcaklıklarda ısıtıldığından emin olun. İstenirse, ısıtılmış Tyrode çözeltisinin sürekli perfüzyonu ile başlayın.
4. Elektrik alanı stimülasyonu
NOT: iPSC-CM'nin harici tetiklenmesi isteğe bağlıdır, ancak hücresel dinamiklerin ve deneysel parametrelerin standartlaştırılması için yararlıdır. Analiz kolaylığını arttırır ve frekansa bağlı etkilerin araştırılmasını sağlar.
- Kayıt odasına 5 mm aralıklı iki platin elektrotlu bir stimülasyon kesici ucu takın.
- Harici bir uyarıcıyı stimülasyon kesici ucuna bağlayın. 0,5 Hz'de 5 ms bipolar alan darbelerine ayarlayın.
- Uyaranı 1 V'tan yukarı doğru artırarak optimum stimülasyon voltajını belirleyin. Eşik uyaranı, hücrelerin büznmeye başladığı en düşük voltaj olarak tanımlanır. Bu eşiğin yaklaşık %25 üzerinde voltaj uygulayın. Normal aralık 1 V ile 30 V arasındadır.
- Harici stimülatör ile stimülasyon frekansını düzeltin veya edinme yazılımı ile tetikleyin.
5. Optik eylem potansiyeli kazanımı
NOT: Bu protokol, satın alma ve analiz için ticari bir yazılım kullanır.
- İletilen ışık yolunu ve USB kamerayı kullanarak miyositleri parlak alan görünümünde görselleştirin.
- Yalıtılmış bir hücre seçin ve optik yolunu alan diyaframı ile sıkıca kırparak yalnızca ilgi hücresinden gelen ışığın izlenmesini sağlayın.
- PMT amplifikatörü etkinleştirin ve PMT beslemesini 750 V olarak ayarlayın.
- Satın alma yazılımıyla birlikte stimülasyon protokolünü çalıştırın (bkz. adım 4) ve aynı anda 470 nm uyarma ışığını etkinleştirin. İkincisi uzak bir panel üzerinden yapılabilir veya sabit bir yoğunlukta (TTL sinyali) otomatik olarak yapılabilir.
- Sinyalin doymadığını ve kayıt sisteminin algılama aralığı için optimize edilmiş olduğundan emin olmak için PMT amplifikatörünün kazancını ve uzaklığını ayarlayın.
- Kararlı eylem potansiyellerinin algılanmasını sağlayan 10 tarama kaydedin.
- Kaydetmeye devam edin ve hücrelerden yoksun bir bölgeden kısa bir süre arka plan sinyali almak için mikroskop aşamasını hemen hareket ettinin. Heyecan ışığını kapat.
NOT: Bu arka plan değeri (Fuzaklığı), herhangi bir arka plan floresansını hesaba katmak için kullanılacaktır. - İstenirse, farmakolojik manipülasyona hücresel yanıtları tanımlamak için 1 μM nifedipin gibi referans ilaçları yerel olarak perfuse edin.
- Sıralı bir şekilde, her seferinde yeni bir hücre seçerek 5.2–5.7 adımlarını yineleyin. Tek bir oturuşta yüksek deneysel ciro sağlamak için istenirse kapak örtülerini değiştirin.
NOT: Yükleme ve görüntü alma protokolleri Şekil 2'de açıklanmıştır.
6. Veri analizi
- Analiz yazılımı ve tek bir hücreden uyarılmış eylem potansiyelleri içeren ortalama 10 tarama ile kaydedilmiş bir kayıt açın.
- Fuzaklığını temsil eden taban çizgisi sinyalinin bir ortalamasını alın ve bunu ortalama izlemeden çıkarın.
- aşağıdaki formülle ∆F/F0'yi hesaplayın (burada F floresan ölçülür ve F0 diyastolik floresandır):
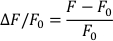
- İzleme taban çizgisini (diyastolik) ve ilgi alanını (AP) tanımlayın ve istenen kardiyak etki potansiyeli parametrelerini ölçün. Bu, %50 (APD 50) ve%90 (APD 90)repolarizasyon için çürüme süresini içerir ancak bunlarla sınırlı değildir.
- Verileri bu tek hücreden elektronik tablo yazılımına verin.
- Tüm kayıtlar için 6.1 – 6.5 adımlarını yineleyin. Sonuçları uygun eşleşmemiş testler veya varyans analizi ile değerlendirin.
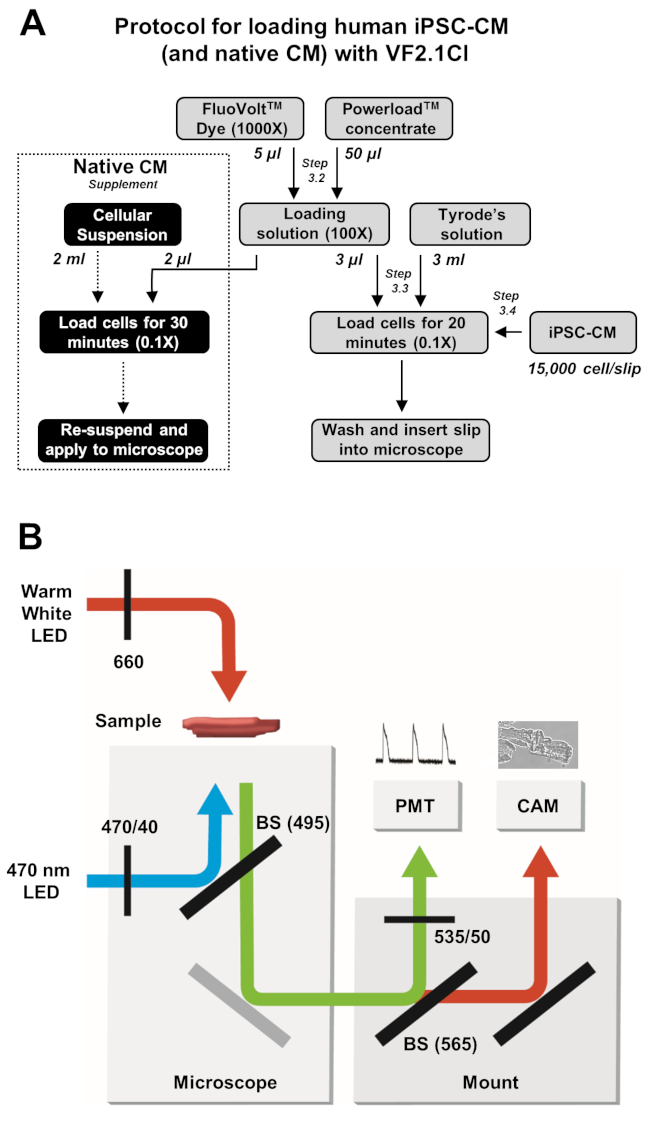
Şekil 2: Yükleme ve görüntü alma protokolleri. (A) iPSC-CM'ler ve yerel kardiyomiyositler için tam VF2.1Cl yükleme protokolünün akış şeması. (B) Transmembran voltajındaki değişikliklere yanıt olarak VF2.1Cl emisyonunun çıkarılması ve algılanması için bu protokolde kullanılan ışın ayırıcı (BS) ve filtre konfigürasyonlarının basitleştirilmiş şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
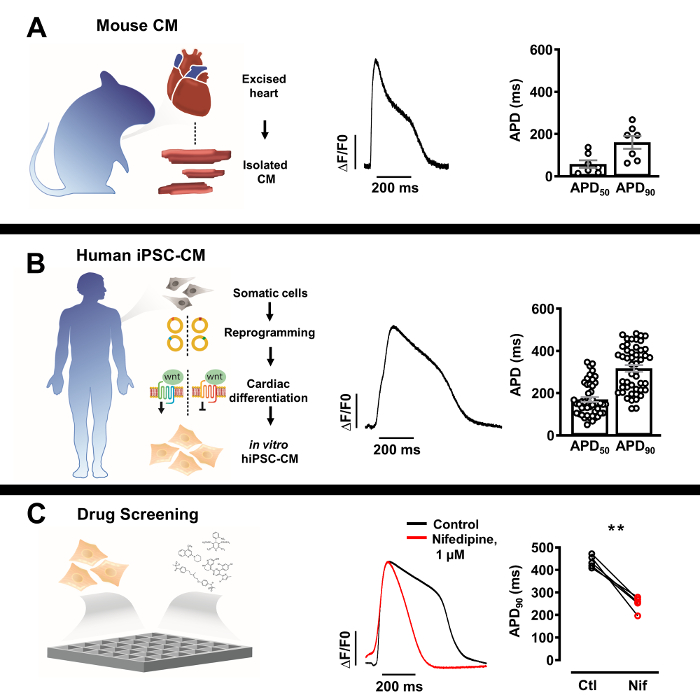
Şekil 3: İzole edilmiş yerli kardiyomiyositlerin optik eylem potansiyeli (AP) profilleri ve insan kaynaklı pluripotent kök hücre türetilmiş kardiyomiyositler (iPSC-CM). (A) APD 50 ve APD90'ın Ortalama ± SEM'i(n = 7, sağ) ile tek bir murine kardiyomiyosit (ortada) temsili optik AP. (B) TEK bir insan iPSC türetilmiş kardiy...
Tartışmalar
Burada, elektrofizyolojik modelleme ve kardiyak ilaç taraması için uygun izole iPSC-CM'lerden ayrıntılı AP profillerini kolayca elde etmek için temel bir protokol açıklıyoruz. Seyrek tohumlu iPSC-CM'lerimizden hem gösterge işlevselliğini hem de metodolojik doğruluğu öneren düzenli ve sağlam AP'ler tespit ediyoruz.
iPSC yeniden programlama için geniş ticari metodoloji yelpazesi ve kardiyak farklılaşma protokolleri için standardizasyon eksikliği nedeniyle, iPSC tabanlı m...
Açıklamalar
Cairn Research Ltd, video dosyasının üretim maliyetlerini karşılayarak bu yayını destekledi.
Teşekkürler
Yazarlar Cairn Research Ltd.'yi bu yayının üretim maliyetlerini kapsayan nazik finansal katkıları için kabul etmek istiyor. Ayrıca, Bayan Ines Mueller ve Bayan Stefanie Kestel'e mükemmel teknik destekleri için teşekkür ederiz.
Yazarların araştırmaları Alman Kardiyovasküler Araştırmalar Merkezi (DZHK), Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 ve Almanya'nın Mükemmellik Stratejisi - EXC 2067/1- 390729940) ve Else-Kröner-Fresenius Stiftung (EKFS 2016_A20) kapsamında.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
Referanslar
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochemistry. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır