Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Einzelzellige optische Aktionspotentialmessung in human induzierten pluripotenten Stammzell-abgeleiteten Kardiomyozyten
In diesem Artikel
Zusammenfassung
Hier beschreiben wir die optische Erfassung und Charakterisierung von Aktionspotentialen aus induzierten pluripotenten Stammzell-abgeleiteten Kardiomyozyten mit einem modularen Hochgeschwindigkeits-Photometriesystem.
Zusammenfassung
Herkömmliche intrazelluläre Mikroelektrodentechniken zur Quantifizierung der Kardiomyozyten-Elektrophysiologie sind extrem komplex, arbeitsintensiv und werden typischerweise bei niedrigem Durchsatz durchgeführt. Die schnelle und kontinuierliche Expansion der Technologie der induzierten pluripotenten Stammzellen (iPSC) stellt einen neuen Standard in der kardiovaskulären Forschung dar, und alternative Methoden sind jetzt notwendig, um den Durchsatz elektrophysiologischer Daten auf Einzelzellebene zu erhöhen. VF2.1Cl ist ein kürzlich abgeleiteter spannungsempfindlicher Farbstoff, der eine schnelle einkanalige, hohe Reaktion auf Schwankungen des Membranpotentials bietet. Es verfügt über eine Kinetik, die der anderer vorhandener Spannungsindikatoren überlegen ist, und stellt funktionale Daten zur Verfügung, die denen herkömmlicher Mikroelektrodentechniken entsprechen. Hier demonstrieren wir eine vereinfachte, nicht-invasive Charakterisierung des Aktionspotentials in extern beschleunigten menschlichen iPSC-abgeleiteten Kardiomyozyten mit einem modularen und äußerst erschwinglichen Photometriesystem.
Einleitung
Die elektrophysiologische Modellierung von Kardiomyozyten und der Aufbau effizienter Plattformen für das kardiale Arzneimittelscreening sind essentiell für die Entwicklung therapeutischer Strategien für eine Vielzahl von Arrhythmusstörungen. Die rasche Expansion der Technologie der induzierten pluripotenten Stammzellen (iPSC) hat vielversprechende Fortschritte in der Modellierung menschlicher Krankheiten und pharmakologischen Untersuchungen mit isolierten patientenbasierten Kardiomyozyten (iPSC-CM) ermöglicht. "Goldstandard" -Techniken zur elektrophysiologischen Charakterisierung dieser Zellen durch Patch-Clamp (Strom-Clamp) können die Morphologie und Dauer des Aktionspotentials (AP) quantifizieren, diese Methode ist jedoch unglaublich komplex und langsam und nicht gut für die Datenerfassung mit hohem Durchsatz geeignet1. Es wird regelmäßig berichtet, dass iPSC-CMs im Vergleich zu adulten nativen Kardiomyozyten ein erhöhtes diastolisches Membranpotenzial und einen erhöhten Ableitstrom aufweisen2. Es wird vermutet, dass eine kleinere Zellgröße und eine reduzierte Membrankapazität, die in iPSC-CMs beobachtet werden, bei der Verwendung der Strom-Klemm-Technik zu systematischen Fehlern führen können, was vielleicht diese Abweichungen erklärt3. Um die Nützlichkeit einer iPSC-CM-Plattform zu maximieren, ist eine zusätzliche Methode wertvoll, um den Durchsatz zu erhöhen und die Datengenauigkeit bei der Charakterisierung von Transmembranspannungsänderungen auf Einzelzellenebene in iPSC-CMs sicherzustellen.
Spannungsempfindliche Farbstoffe (VSD) sind seit langem eine vorgeschlagene Methode, um eine schnellere, nicht-invasive und gleichwertige Analyse der kardialen AP-Kinetik im Vergleich zu denen herkömmlicher Techniken zu ermöglichen4. Eine aktuelle Studie hat die Eignung der ratiometrischen spannungsempfindlichen Sondenphotometrie zur genauen Quantifizierung des kardialen AP5nachgewiesen. Darüber hinaus verleiht die Fähigkeit, optische Photometrieansätze leicht zu skalieren, diese Technik für groß angelegte Kardiotoxizitätsbildschirme, die für die Entwicklung therapeutischer Medikamente (z. B. CiPA) von entscheidender Bedeutung sind. Die Entwicklung standardisierter Kardiotoxizitätsprotokolle in einer verblindeten Multi-Site-Studie unter Verwendung von Mikroelektrodenarrays und optischen Spannungssensoren hat den Schlüsselwert dieses Ansatzes gezeigt6.
Viele potentiometrische Farbstoffe sind kommerziell erhältlich, und die laufende synthetische Entwicklung neuer Sonden zeigt ein aufregendes Potenzial, ihre Wirksamkeit über eine Vielzahl von kardialen und neuronalen Konstrukten hinweg zu rationalisieren. Der ideale VSD hat eine erhöhte Kinetik und Empfindlichkeit und zeigt gleichzeitig eine verminderte kapazitive Belastung, Photobleaching und Zytotoxizität. Das kürzlich synthetisierte VF2.1Cl (FluoVolt) drückt viele dieser vorteilhaften Eigenschaften aus, hauptsächlich aufgrund seiner neuartigen drahtbasierten Molekülstruktur, die von anderen Mitgliedern der neuen VoltageFluor (VF) -Familie geteilt wird7. Im Gegensatz zu herkömmlichen elektrochromen VSDs, bei denen einfache Sonden molekular und elektrisch mit der Plasmamembran konjugieren, besteht dieser Farbstoff aus einem passiv eingefügten, membranübergreifenden synthetischen Draht, der einen elektronenreichen Donor mit einem modifizierten Fluoreszeinfluorophor (FITC) paart. Mechanistische Details sind in Abbildung 1 dargestellt. Dieser Farbstoff zeigt eine ausgezeichnete Empfindlichkeit gegenüber Membranspannungsschwankungen und zeigt eine Änderung der Emissionsintensität um 27% pro 100 mV im Gegensatz zu ~ 10% bei anderen gängigen Sonden bei vergleichbaren Geschwindigkeiten7. Darüber hinaus interagieren drahtbasierte PeT-Systeme nicht direkt mit dem zellulären elektrischen Feld, was zu minimalen elektrischen Störungen und vernachlässigbaren Änderungen der zellulären kapazitiven Last führt.
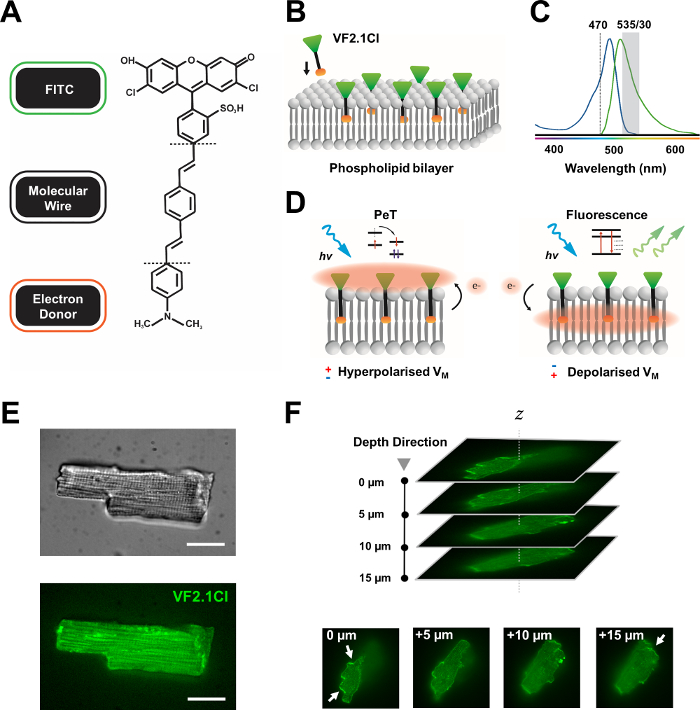
Abbildung 1: Chemische, spektrale und mechanistische Parameter des VF2.1Cl-Farbstoffs. (A) Chemische Struktur von VF2.1Cl. Zu den zu beachtenen molekularen Merkmalen gehören mehrere Alkylgruppen innerhalb des molekularen Phenylenvinylendrahtes, die das Einsetzen in die Plasmamembran erleichtern. Eine negativ geladene Sulfonsäuregruppe, die mit der FITC-Sonde konjugiert ist, sorgt für eine Fluorophorstabilisierung auf der extrazellulären Oberfläche und unterstützt die nahezu senkrechte Insertion relativ zum elektrischen Feld der Lipiddoppelschicht. (B) Vereinfachtes Schema der senkrechten VF2.1Cl-Einbettung in die Plasmamembran einer Zielzelle. (C) Absorptions- und Emissionsspektren des VF2.1Cl-Farbstoffs. Spectra ist identisch mit denen von Standard-FITC- und GFP-Sonden. (D) Darstellung der mechanistischen Wirkungsweise von VF2.1Cl. Unter Ruhebedingungen (hyperpolarisiert) treiben negative intrazelluläre Spannungen freie Elektronen in Richtung des rostralen Fluorophors. Die Elektronenhäufigkeit stellt sicher, dass der photoinduzierte Elektronentransfer (PeT) als Weg aus dem angeregten Zustand nach der optischen Anregung bevorzugt wird, wodurch die Fluoreszenz effektiv abgeschreckt wird. Im Gegensatz dazu beeinflusst ein depolarisiertes Membranpotential die Elektronenbewegung nach unten und begünstigt die Fluoreszenz bei optischer Anregung. Die resultierende Fluoreszenzantwort ist linear mit der Membranspannung verbunden und kann präzise genutzt werden, um detaillierte zeitliche Informationen über die zelluläre elektrophysiologische Kinetik zu sammeln. (E) Repräsentative Hellfeld- (obere) und Fluoreszenzaufnahmen bei 470 nm (unten) von Leporin-Kardiomyozyten, die mit VF2.1Cl. (F) Z-Stapel eines einzelnen geladenen Kardiomyozyten beladen sind. Pfeile zeigen Bereiche mit klarer Lokalisation von VF2.1Cl auf der Zellmembran an. Die Bilder wurden mit einem konfokalen System mit rotierender Scheibe aufgenommen, das aus einem konfokalen X-lightv3-Spinnscheibenkopf mit einem 50 μm-Lochmuster besteht. LDI-7 Beleuchtung; Prime95B Kamera und ein PlanApo Lambda 100x Objektiv. Maßstabsleiste: 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die mit VF2.1Cl konjugierte FITC-Sonde stellt sicher, dass sie effektiv unter Standard- und GFP-Filterkonfigurationen eingesetzt werden kann und nur ein Einkanalerfassungssystem benötigt, die beide gemeinsame Merkmale von fluoreszierenden Bildgebungsplattformen sind. Die Analyse dichter menschlicher iPSC-CM-Monoschichten mit diesem Farbstoff wurde kürzlich berichtet8,9,10,11. Unser Protokoll unterscheidet sich von diesen Studien aufgrund unserer Untersuchung einzelner, isolierter iPSC-CMs, die von den elektrischen und parakrinen Einflüssen dichter synzytriler Monoschichten unbeirrt sind, und unserer Verwendung eines erschwinglichen und anpassbaren Photometriesystems im Gegensatz zu komplexen konfokalen oder Weitfeld-Bildgebungsanordnungen.
Hier beschreiben wir unser Protokoll zur schnellen Erfassung und Analyse robuster optischer APs aus isolierten humanen iPSC-abgeleiteten Kardiomyozyten und nativen Kardiomyozyten (siehe Ergänzungsdatei). Wir verwenden VF2.1Cl in Verbindung mit einer anpassbaren State-of-the-Art-Plattform für Einzelzell-Photometrie-Messungen. Diese Versuchsprotokolle wurden von der Ethikkommission der Universitätsmedizin Göttingen genehmigt (Nr. 09.10.15).
Protokoll
1. Zelluläre Präparate
HINWEIS: Menschliche iPSCs, die in diesem Protokoll verwendet werden, wurden von gesunden Spendern abgeleitet und in Monoschichten unter Verwendung vollständig definierter niedermolekularer Modulations- von WNT-Signal- und Laktatreinigungstechniken wie zuvor beschrieben12,13,14unterschieden. iPSC-CMs wurden alle 2-3 Tage mit einem unten beschriebenen Kulturmedium gepflegt.
- Bereiten Sie ein Kulturmedium aus Basalmedium (RPMI 1640) und 2% Ergänzung (B27) vor. Bei 4 °C lagern. Bei Raumtemperatur (RT) verwenden.
- Bereiten Sie ein Beschichtungsmedium aus Basalmedium (RPMI 1640), 2% Ergänzung (B27) und 1:2000 ROCK-Inhibitor vor. Bei 4 °C lagern. Verwendung bei RT.
- Beschichtet sterilisierte 10 mm Runde Glas #0 Decklippen mit 150 μL 1:60 Faktor freie Basalmembranmatrix und inkubieren bei 4 °C für 4 h.
HINWEIS: Die Optimierung des Deckabdeckelvolumens ist notwendig, um sicherzustellen, dass das gesamte Glas bedeckt ist, während eine ausreichende Oberflächenspannung erhalten bleibt, um ein Verschütten zu verhindern. 150 μL wird für 10 mm runde Abdecklippen empfohlen. Losgröße, Abdeckscheintyp, Abdeckvolumen und Kulturplattentyp können für die Bedürfnisse der Experimentatoren geeignet sein. - Beginnen Sie die iPSC-CM-Dissoziation mit einem EDTA-basierten Zelldissoziationsreagenz. Stellen Sie sicher, dass sich die Monoschicht vollständig löst, indem Sie mit einer 1.000 μL-Pipette vorsichtig spülen.
- Die Zellsuspension in ein 15-ml-Röhrchen geben und doppeltes Beschichtungsmedium hinzufügen. Zentrifuge für 10 min bei 100 x g.
- Resuspendieren Sie das Pellet mit einem gewünschten Volumen (Resuspensionsvolumen) des Beschichtungsmediums. Zellen manuell oder elektronisch zählen.
- Wählen Sie die optimale Dichte pro Abdecklippe (15.000), die später die isolierte Zellanalyse ermöglicht.
- Berechnen Sie das Volumen der "aktiven" Zellsuspension (A), das benötigt wird, um alle Abdeckungslippen mit dieser gewünschten Dichte zu plattieren. Die folgende Formel auftragen und in ein separates Röhrchen zurückziehen:

- Berechnen Sie das Volumen des zusätzlichen Beschichtungsmediums (B), das erforderlich ist, um jeden Abdeckrutsch in einem gewünschten Volumen unterzubringen. Wenden Sie die folgende Formel an und fügen Sie das resultierende Volumen in das Rohr der aktiven Suspension hinzu:
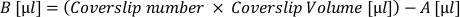
- Entfernen Sie die Matrix von den Coverlips und tragen Sie das "Coverslip Volume" der Zellsuspension (A + B) auf jeden Coverslip auf. Regelmäßig in der Röhre resuspendieren, um eine gleichmäßige Zellverteilung zu gewährleisten.
- Bei 37 °C für 1 h inkubieren. Füllen Sie den Brunnen vorsichtig mit Beschichtungsmedium.
- Tauschen Sie nach 24 Stunden die Medien mit dem normalen Kulturmedium aus und pflegen Sie es alle 2-3 Tage.
2. Versuchsaufbau
- Rüsten Sie ein invertiertes Epifluoreszenzmikroskop mit einer 40-fachen Vergrößerung, Linse mit hoher numerischer Apertur (N.A:> 0,75) aus, um Experimente durchzuführen.
- Koppeln Sie eine schnell umschaltend warmweiße LED an den durchgelassenen Beleuchtungsanschluss des Mikroskops. Setzen Sie einen einfachen roten 660-nm-Filter in den Durchlichtpfad ein.
HINWEIS: Dieses Licht kann während photometrischer Experimente aktiviert werden, um die Probe zu beobachten, ohne das grün fluoreszierende Signal zu kontaminieren. - Montieren Sie einen schnell schaltenden 470 nm LED-Kopf für die Photometrieaufzeichnung. Setzen Sie einen 470/40-Anregungsfilter am Epifluoreszenzanschluss des Mikroskops ein, um das von der LED erzeugte Licht zu reinigen.
HINWEIS: Für eine optimale Signalquantifizierung wird ein Beleuchtungssystem mit Hochgeschwindigkeits-Feedback-Steuerung der optischen Ausgabe empfohlen. - Setzen Sie einen Mikroskopwürfel mit einem 495 nm langen Passstrahlteiler in das Spiegeleinheitskarussell innerhalb des Mikroskops ein.
- Passen Sie einen Detektionsarm mit einer einstellbaren Feldmembran an den C-Mount-Anschluss des Mikroskops an, um die Auswahl der interessierenden Bereiche zu ermöglichen.
- Koppeln Sie separat einen Photomultiplierdetektor (PMT) und eine USB-Kamera an das Mikroskop. Dies wird die Grundlage für das Emissionsdetektionssystem bilden.
- Setzen Sie einen Filterwürfel mit einem 565 nm langen Passstrahlteiler und einem 535/50-Emissionsfilter in den PMT-Anschluss ein. Dadurch wird das Emissionslicht zwischen den beiden Detektoren aufgeteilt.
HINWEIS: Eine Kamera, die an den Sendeanschluss des Emissionserkennungssystems angeschlossen ist, kann während aller Experimente durchgelassenes Licht unter Hellfeld erkennen. - Koppeln Sie das PMT an ein Netzteil und einen PMT-Verstärker. Schließen Sie den PMT-Verstärkerausgang an einen analogen Eingangspin eines Datenerfassungssystems an.
- Filtern Sie analoge Daten aus dem PMT bei 1 kHz oder höher.
- Digitalisieren Sie Daten mit einer Frequenz, die mindestens doppelt so hoch ist wie die höchste Frequenz, die im analogen Signal vorhanden ist (2 kHz oder höher), um die Nyquist-Kriterien zu erfüllen und Aliasing zu verhindern.
3. Mobilfunkladung mit VF2.1Cl
HINWEIS: Alle Schritte mit diesem Farbstoff müssen bei schlechten Lichtverhältnissen durchgeführt werden.
- Bereiten Sie eine Tyrode-Badelösung von (in mM) vor: 140 NaCl, 10 HEPES, 10 Glucose, 4 KCl, 1MgCl2,2 CaCl2,pH = 7,35 und warm auf 37 °C.
- Bereiten Sie eine Aliquot-Ladelösung in einem Mikrozentrifugenröhrchen vor, indem Sie 5 μL 1.000x VF2.1Cl und 50 μL 20% lösliche Poloxamerlösung mischen.
- 5 μL der Ladelösung auf 5 ml erwärmte Tyrode-Lösung (insgesamt 0,1-fache Farbstoffkonzentration) in einer 20 mm Petrischale auftragen.
HINWEIS: Die endgültige Farbstoffkonzentration beträgt 0,1x. Dies ist 1/10der vom Hersteller vorgeschlagene. Dies schont Ressourcen, sorgt für eine vernachlässigbare Zytotoxizität und vor allem für klare optische Signale von geladenen Zellen mit hohem Signal-Rausch-Verhältnis. - Einen einzelnen iPSC-CM-Deckelr in die Schüssel geben und bei 37 °C für 20 min inkubieren.
- Bauen Sie eine beheizte Lebendzell-Bildgebungskammer zusammen. Auf den Mikroskopstand montieren und mit 500 μL frischer Tyrode-Lösung füllen.
- Waschen Sie den Abdecklappen mit frischer Tyrode-Lösung bei 37 °C.
- Tragen Sie den iPSC-CM-Abdeckr vorsichtig mit einer Feinpunktzette auf die vorgewärmte Badkammer auf.
HINWEIS: Stellen Sie sicher, dass die Kammer und ihr Inhalt immer bei physiologischen Temperaturen erhitzt werden. Falls gewünscht, beginnen Sie mit der kontinuierlichen Perfusion der erwärmten Tyrode-Lösung.
4. Elektrische Feldstimulation
HINWEIS: Die externe Triggerung von iPSC-CM ist optional, aber nützlich für die Standardisierung der zellulären Dynamik und experimenteller Parameter. Es erhöht die Analysefreundlichkeit und ermöglicht die Untersuchung frequenzabhängiger Effekte.
- Befestigen Sie einen Stimulationseinsatz mit zwei Platinelektroden im Abstand von 5 mm in der Aufnahmekammer.
- Schließen Sie einen externen Stimulator an den Stimulationseinsatz an. Eingestellt auf 5 ms bipolare Feldimpulse bei 0,5 Hz.
- Bestimmen Sie die optimale Stimulationsspannung, indem Sie den Reiz von 1 V nach oben erhöhen. Der Schwellenreiz ist definiert als die niedrigste Spannung, bei der sich die Zellen zusammenzuziehen beginnen. Wenden Sie Spannungen etwa 25% über diesem Schwellenwert an. Der normale Bereich liegt zwischen 1 V und 30 V.
- Fixieren Sie die Stimulationsfrequenz mit dem externen Stimulator oder lösen Sie sie mit einer Erfassungssoftware aus.
5. Optische Wirkungspotenzialerfassung
HINWEIS: Dieses Protokoll verwendet eine kommerzielle Software für die Erfassung und Analyse.
- Visualisieren Sie die Myozyten in der Hellfeldansicht mit dem durchgelassenen Lichtweg und der USB-Kamera.
- Wählen Sie eine isolierte Zelle aus und schneiden Sie ihren optischen Weg mit der Feldmembran eng zu, um sicherzustellen, dass nur das Licht der interessierenden Zelle überwacht wird.
- Aktivieren Sie den PMT-Verstärker und stellen Sie die PMT-Versorgung auf 750 V ein.
- Führen Sie das Stimulationsprotokoll (siehe Schritt 4) zusammen mit der Erfassungssoftware aus und aktivieren Sie gleichzeitig das 470 nm Anregungslicht. Letzteres kann über ein Remote-Panel erfolgen oder mit einer festen Intensität (TTL-Signal) automatisiert werden.
- Passen Sie die Verstärkung und den Offset des PMT-Verstärkers an, um sicherzustellen, dass das Signal nicht sättigt und für den Erfassungsbereich des Aufnahmesystems optimiert ist.
- Zeichnen Sie 10 Sweeps auf, um sicherzustellen, dass stabile Aktionspotentiale erkannt werden.
- Setzen Sie die Aufnahme fort und bewegen Sie sofort den Mikroskopstand, um kurz das Hintergrundsignal aus einer Region ohne Zellen zu erfassen. Schalten Sie die Erregerleuchte aus.
HINWEIS: Dieser Hintergrundwert(F-Offset) wird verwendet, um jede Hintergrundfluoreszenz zu berücksichtigen. - Falls gewünscht, lokal Referenzarzneimittel wie 1 μM Nifedipin perfundieren, um zelluläre Reaktionen auf pharmakologische Manipulationen zu identifizieren.
- Wiederholen Sie sequenziell die Schritte 5.2 bis 5.7, wobei Sie jedes Mal eine neue Zelle auswählen. Tauschen Sie auf Wunsch Coverlips aus, um einen hohen experimentellen Umsatz in einer einzigen Sitzung zu gewährleisten.
HINWEIS: Lade- und Bilderfassungsprotokolle sind in Abbildung 2beschrieben.
6. Datenanalyse
- Öffnen Sie eine gespeicherte Aufzeichnung mit der Analysesoftware und durchschnittlich 10 Sweeps mit stimulierten Aktionspotentialen aus einer einzelnen Zelle.
- Nehmen Sie einen Mittelwert des Basisliniensignals, das denF-Offset darstellt, und subtrahieren Sie diesen von der gemittelten Spur.
- Berechnen Sie ∆F/F0 mit der folgenden Formel (wobei F fluoresziert und F0 diastolische Fluoreszenz ist):
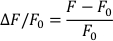
- Identifizieren Sie die Trace-Baseline (diastolisch) und das Interessengebiet (AP) und messen Sie die gewünschten Parameter des Kardipotenzials. Dies beinhaltet, ist aber nicht beschränkt auf die Zerfallszeit für 50% (APD50)und 90% (APD90)Repolarisation.
- Exportieren Sie die Daten aus dieser einzelnen Zelle in eine Tabellenkalkulationssoftware.
- Wiederholen Sie die Schritte 6.1 – 6.5 für alle Aufzeichnungen. Bewerten Sie die Ergebnisse mit geeigneten ungepaarten Tests oder varianzanalysen.
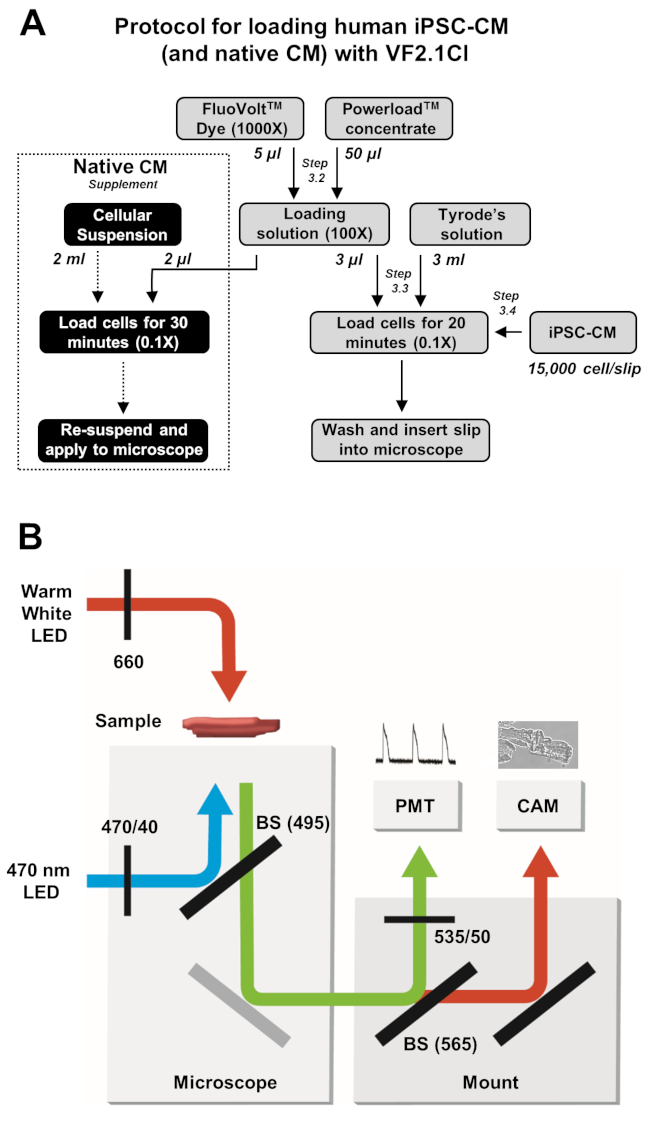
Abbildung 2: Lade- und Bilderfassungsprotokolle. (A) Flussdiagramm des vollständigen VF2.1Cl-Ladeprotokolls für iPSC-CMs und native Kardiomyozyten. (B) Ein vereinfachtes Schema der Strahlteiler- (BS) und Filterkonfigurationen, die in diesem Protokoll zur Anregung und Detektion von VF2.1Cl-Emissionen als Reaktion auf Änderungen der Transmembranspannung verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
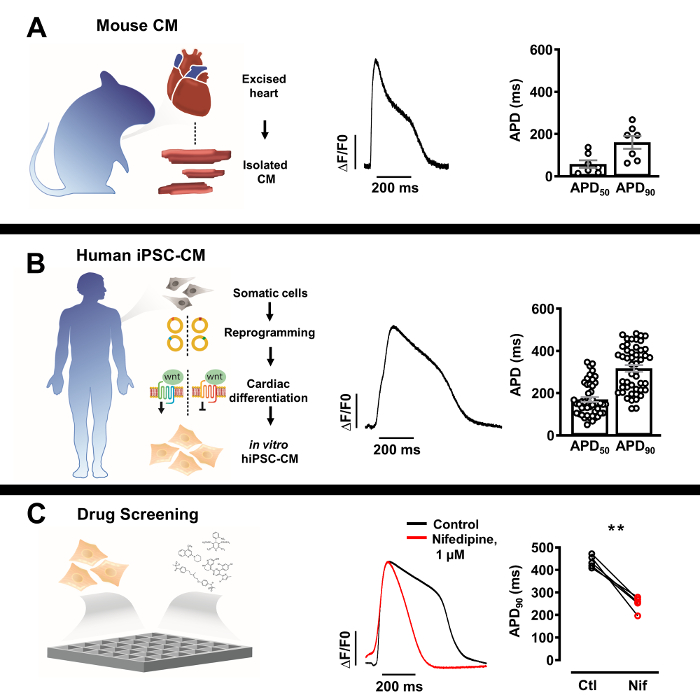
Abbildung 3: Profile des optischen Aktionspotentials (AP) isolierter nativer Kardiomyozyten und humaner induzierter pluripotenter Stammzell-abgeleiteter Kardiomyozyten (iPSC-CM). (A) Repräsentativer optischer AP eines einzelnen murinen Kardiomyozyten (Mitte) mit mittlerer ± SEM von APD50 und APD90 (n = 7, rechts). (B) Repräsentati...
Diskussion
Hier beschreiben wir ein grundlegendes Protokoll, um auf einfache Weise detaillierte AP-Profile von isolierten iPSC-CMs zu erfassen, die für die elektrophysiologische Modellierung und das kardiale Drogenscreening geeignet sind. Wir erkennen regelmäßige, robuste APs aus unseren spärlich gesäten iPSC-CMs, was sowohl auf Indikatorfunktionalität als auch auf methodische Genauigkeit hindeutet.
Aufgrund des breiten Spektrums kommerzieller Methoden für die iPSC-Reprogrammierung und der fehlend...
Offenlegungen
Cairn Research Ltd unterstützte diese Veröffentlichung durch die Übernahme der Produktionskosten der Videodatei.
Danksagungen
Die Autoren danken Cairn Research Ltd. für ihren freundlichen finanziellen Beitrag, der die Produktionskosten dieser Veröffentlichung gedeckt hat. Darüber hinaus danken wir Frau Ines Mueller und Frau Stefanie Kestel für die hervorragende technische Unterstützung.
Die Forschung der Autoren wird vom Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK), der Deutschen Forschungsgemeinschaft (DFG, Vo 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 und im Rahmen der Exzellenzstrategie - EXC 2067/1- 390729940) und der Else-Kröner-Fresenius Stiftung (EKFS 2016_A20) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
Referenzen
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochemistry. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten