A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
حقن الجرو والكبار لRNAi و CRISPR تحرير الجينات في Nasonia vitripennis
In This Article
Summary
هنا، ونحن نصف أساليب لحقن الجرو والكبار كفاءة في Nasonia vitripennis كبدائل يمكن الوصول إليها للتحنيم الدقيق الجنين، وتمكين التحليل الوظيفي للجينات ذات الأهمية باستخدام إما الحمض النووي الريبي إسكات عن طريق تدخل الحمض النووي الريبي (RNAAi) أو خروج المغلوب الجينات عن طريق CRISPR / Cas9 تحرير الجينوم.
Abstract
دبور جوهرة، Nasonia vitripennis،أصبح نظام نموذج فعال لدراسة علم الوراثة اللاجينية لتحديد الجنس haplo-diploid، بيولوجيا كروموسوم B، التفاعلات المضيفة- symbiont، speciation، وتوليف السم. على الرغم من توافر العديد من الأدوات الجزيئية، بما في ذلك CRISPR/Cas9، لا تزال الدراسات الوراثية الوظيفية محدودة في هذا الكائن الحي. وينبع القيد الرئيسي لتطبيق تكنولوجيا CRISPR/Cas9 في N. vitripennis من تحديات الميكروبيكشن الجنيني. حقن الأجنة صعبة بشكل خاص في هذا الكائن الحي وبشكل عام في العديد من الدبابير الطفيليات ، بسبب صغر حجم الجنين ومتطلبات جروة مضيفة للتطور الجنيني. ولمعالجة هذه التحديات، تم تحسين الولادة المعقدة للريبونوكليوبروتين Cas9 إلى المبيضين الإناث عن طريق حقن البالغين، بدلا من الحقن المجهري الجنيني، مما أدى إلى تعديلات جرثومية جسدية وقابلة للتكرار. تم تحسين إجراءات الحقن في الخوادر والدبابير الأنثوية باستخدام إما التحكم في ReMOT (تحويل المبيض بوساطة المستقبلات للشحن) أو BAPC (كبسولات الببتيد الأمفيفيلية المتفرعة). وتبين أن هذه الأساليب بدائل فعالة لحقن الأجنة، مما يتيح حدوث طفرات جرثومية محددة الموقع وقابلة للتكسيت.
Introduction
CRISPR/Cas9 تحرير الجينات هي تقنية قوية للدراسات الوراثية الوظيفية، وخاصة في العديد من الكائنات الحية نموذج ارتفاع مثل دبور جوهرة، Nasonia vitripennis. سهولة تربية وتوافر الجينوم الكامل يجعل دبور جوهرة نظام تجريبي مهم لتوضيح الآليات الجزيئية للعمليات البيولوجية المختلفة. على سبيل المثال، N. vitripennis وقد استخدمت مؤخرا لكشف الأساس اللاجيني لنظام تحديد الجنس haplodiploid1،2، وبيولوجيا الكروموسومات B3،4،5،6، والأساس الوراثي للتنظيم circadian والموسمية7،8. بعض الميزات التي تجعل N. vitripennis قابلة للعمل مع تشمل وقت الجيل القصير (~ 2 أسابيع عند 25 درجة مئوية)، وارتفاع معدلات الإنجاب، وسهولة فصل الجنس في مرحلة pupal، والقدرة على diapause وتخزين سلالات في 4 درجة مئوية. تبدأ دورة الحياة مع الدبابير الإناث تطفل الخوادر من الذبابة ، بولاتا التابوت. من خلال ovipositor بهم ، تضع الإناث ما يصل إلى 50 بيضة في حالة الجراء من الذبابة. البيض تتطور إلى اليرقات التي تتغذى على الجراء S. بولاتا، تستمر في التطور على مدى الأيام القليلة المقبلة، ومن ثم pupate، تليها eclosion الكبار والظهور من puparium المضيف9.
الأدوات الجزيئية لإجراء الدراسات الجينية الوظيفية في N. vitripennis, مثل تدخل الحمض النووي الريبي (RNAAi)10 و CRISPR/Cas911,12, متوفرة, ولكنها محدودة, ويرجع ذلك في المقام الأول إلى صعوبات في إجراء الميكروبيكشنات الجنينية13. كما N. vitripennis البيض تتطلب مضيف الجرو للتنمية، والتلاعب البيض هو صعب للغاية. يجب جمع الأجنة مرحلة ما قبل blastoderm من الخوادر blowfly المضيف، وميكرونجيكت بسرعة، ونقلها على الفور مرة أخرى إلى المضيف للتنمية13. تتطلب هذه الخطوات الدقة والتدريب المتخصص لتجنب إتلاف الأجنة المجهرية أو يستضيف الجرو13. وعلاوة على ذلك ، فإن البيض صغير جدا وهش ، خاصة بعد الاحتراط الدقيق ، مع السيتوبلازم اللزج جدا مما يسبب انسداد مستمر لإبرة الحقن13. هذه الميزات تجعل الاختبارات الدقيقة الجنينية صعبة بشكل استثنائي ، مما يتطلب مشغلين مدربين تدريبا عاليا ومعدات متخصصة غائبة في معظم مختبرات N. vitripennis.
ومن شأن تحسين أساليب الحقن البديلة لتوصيل الكواشف CRISPR أن يسهم في توطيد N. vitripennis ككائن حي نموذجي. التلاعب من الخوخ والبالغين هو أقل تحديا من التلاعب الأجنة ويمكن تحقيقه مع الإعداد حقن الأساسية. هنا، يتم وصف بروتوكولين لحقن الخوادر والبالغين: واحد ينطوي على معدات متخصصة للحقن، والآخر ينطوي على استخدام تجميع أنبوب التنفس مزودة إبرة شعرية زجاجية. استخدام أنبوب التنفس مناسب بشكل خاص للمختبرات التي لا يمكنها الوصول إلى المعدات المتخصصة للأنابيب الدقيقة للجنين. يتم إظهار الحقن الفعالة لمراحل النمو المختلفة من N. vitripennis، بما في ذلك الخوخ الأبيض أو الأسود والدبابير البالغة. الدبابير في مرحلة الجرو الأبيض مناسبة بشكل خاص لتجارب الضربة القاضية بوساطة RNAi. على الرغم من أن RNAi في ناسونيا وصفت لأول مرة من قبل لينش وديسبلان في 200610, لا يوجد إجراء بصري متاح لكيفية إجراء حقن RNAi. وقد استخدمت مؤخرا RNAi لاكتشاف الجين haploidizer من B-كروموسوم PSR(نسبة الجنس الأبوي) 3 ودراسة مشاركة الجين على مدار الساعة, الفترة, في N. vitripennis الإيقاعات البيولوجية7.
يمكن استخدام الخوادر السوداء والدبابير البالغة للحث على تحرير الجينات الجرثومية CRISPR/Cas9 باستخدام ReMOT Control (تحويل المبيض بوساطة المستقبلات للشحن) وبروتوكولات BAPC (كبسولات الببتيد الأمفيفيلية المتفرعة). وقد وصفت هذه الطرق تسليم المبيض اثنين مؤخرا لتكون فعالة في ناسونيا لتوليد الطفرات الجرثومية في الجين المستهدف, cinnabar7,12. هنا ، يتم توفير بروتوكول مبسط للحقن بما في ذلك إجراء بصري لمنهجية خطوة بخطوة لكل من الحقن الجروية وحقن البالغين التي يمكن استخدامها لتوليد دراسات علم الوراثة الوظيفية في Nasonia وعلى الأرجح في الدبابير الطفيليات الأخرى ، دون الحاجة إلى معدات متخصصة وتجاوز التجميل الجنيني الدقيق.
Protocol
1. تربية ناسونيا
- إعداد ~ 20 الإناث تزاوج بشكل فريد في أنابيب اختبار الزجاج الصغيرة موصولة بالقطن.
ملاحظة: لتقليل مساحة التنشئة، تعد أنابيب 4 مل مثالية 10 × 85 سم. تتميز الإناث بسهولة عن الذكور بسبب الأجنحة الكبيرة ووجود ovipositor(الشكل 1A). ويمكن أيضا أن توجد بروتوكولات مفصلة لتربية N. vitripennis في الأدب الأخرى13،14،15.- أضف مضيفين S. bullata لكل أنبوب ، وحافظ على الدبابير عند 25 ± 1 درجة مئوية ورطوبة نسبية بنسبة 30٪ ، مع دورة 12:12 ضوء داكن لمدة 2-3 أيام.
ملاحظة: يمكن الحفاظ على الدبابير في درجة حرارة أقل أو درجة حرارة الغرفة؛ ومع ذلك، سوف يتباطأ التنمية.
- أضف مضيفين S. bullata لكل أنبوب ، وحافظ على الدبابير عند 25 ± 1 درجة مئوية ورطوبة نسبية بنسبة 30٪ ، مع دورة 12:12 ضوء داكن لمدة 2-3 أيام.
- بعد 2-3 أيام، مع مساعدة من فرشاة الطلاء غرامة تلميح، وإزالة بلطف الإناث لتجنب oviposition المستمر وغير متزامنة في تطوير النسل.
ملاحظة: يمكن اختياريا إعادة استضافة الإناث أو تخزينهن عند درجة حرارة 5 درجات مئوية لمدة تصل إلى شهر.- الحفاظ على المضيف المظلل عند 25 درجة مئوية والرطوبة النسبية 30٪، مع دورة 12:12 ضوء الظلام لمدة 7 أيام إذا كانت مرحلة الحقن المطلوب يتطلب الخوخ الأبيض. لمدة 13 يوما إذا كانت مرحلة النمو المطلوبة هي الخوادر السوداء؛ أو 14 يوما للبالغين الشباب الناشئين حديثا.
ملاحظة: يمكن أيضا تخزين الخوادر الصفراء والسوداء عند 5 درجات مئوية لمدة تصل إلى أسبوع واحد. سيزيد التخزين الأطول من تكرار الديابوس في اليرقات للجيل القادم ، مما يجعل فحص ما بعد الحقن وإنشاء خطوط متحولة أكثر صعوبة. - الكراك فتح puparium المضيف مع إبرة تشريح لاسترداد N. vitripennis pupae والبالغين في المرحلة المرجوة(الشكل 1A).
ملاحظة: للحقن في سن البلوغ معينة أو لجمع الإناث العذراء، فمن المستحسن لإزالة الخوادر الظلام في اليوم 13 من المضيف، منفصلة عن طريق الجنس، وجمع البالغين بعد ظهورها.
- الحفاظ على المضيف المظلل عند 25 درجة مئوية والرطوبة النسبية 30٪، مع دورة 12:12 ضوء الظلام لمدة 7 أيام إذا كانت مرحلة الحقن المطلوب يتطلب الخوخ الأبيض. لمدة 13 يوما إذا كانت مرحلة النمو المطلوبة هي الخوادر السوداء؛ أو 14 يوما للبالغين الشباب الناشئين حديثا.
2. محاذاة الخوخ الأبيض والأسود
- إعداد شريحة زجاجية عن طريق تطبيق خط من الغراء المدرسة في المركز. نشر الغراء مع إبرة تشريح للحصول على طبقة سميكة (الشكل 1B)، والتي سيتم استخدامها لمحاذاة الخوادر. السماح للغراء الجافة ل ~ 2 دقيقة قبل نقل الخوخ.
ملاحظة: لا overdry الغراء، وإلا فإن الخوادر لا تعلق بشكل صحيح على الشريحة، وسوف تنزلق خلال الحقن. - تحت المجهر تشريح، وذلك باستخدام إبرة تشريح، وتطبيق الغراء على الجزء الخلفي من رأس الجرو.
- إرفاق الخوخ إلى طبقة الغراء على الشريحة مع بطنها التي تواجه ما يصل. محاذاة 20-30 pupae جنبا إلى جنب على الشريحة (الشكل 1C).
ملاحظة: تجنب لمس البطن مع الغراء، وتجنب غمر الخوادر في الغراء. وإلا فإن البالغين لن يتمكنوا من الظهور. - وضع الشريحة مع pupae في طبق بيتري للسماح للغراء الجافة لمدة 10 دقيقة ~ . قبل البدء في الحقن، اختبار الالتزام من الخوادر إلى الغراء عن طريق دفعها بلطف مع إبرة تشريح. إذا تم تخفيف معظم الخوادر، وإعداد شريحة جديدة. بدلا من ذلك، إزالة كل الخوادر التي هي فضفاضة، والمضي قدما لحقن تلك التي تعلق بشكل صحيح إلى الشريحة.
3. إعداد إبرة
- قم بتحميل أنبوب زجاجي شعري واحد في جرافة إبرة، واسحب الإبر باتباع تعليمات الشركة المصنعة.
ملاحظة: يتم استخدام P-1000 البلاتين خيوط إبرة سحب والألمنيوم الشعيرات الدموية الزجاج سيليكات في هذه المظاهرة. دليل التشغيل لهذا الصك (انظر جدول المواد)يشرح كيفية تحميل أنابيب زجاجية شعرية بشكل صحيح وإعداد برامج على هذا الصك. استخدم المعلمات التالية (الحرارة: 536; سحب: 80; فيل: 100; تأخير: 70) على الألومنيوم الشعيرات الدموية الزجاج سيليكات لحقن الخوادر الصفراء، الخوادر السوداء، والبالغين.
وبالإضافة إلى ذلك، تم استخدام P-2000 إبرة سحب لإعداد إبر الكوارتز بعد المعلمات (الحرارة: 805; سحب: 145; فيل: 50؛ 50؛ 50؛ 50؛ 50؛ التأخير: 145). يوفر الدليل تعليمات لتحميل أنابيب الكوارتز الشعرية وإعداد البرامج في هذا الصك. في حالة عدم وجود سحب، يتوفر زجاج شعري قابل للتخصيص. - تحميل الإبرة مع 5 ميكرولتر من خليط الحقن (أعدت مسبقا بعد البروتوكولات السابقة لRNAi10 أو CRISPR/Cas9 ريبونوكليوبروتين12 (RNP) الحقن في N. vitripennis) باستخدام نصائح ماصة محمل صغير.
ملاحظة: أثناء المظاهرة ، يتم تحميل الإبرة مع الحمض النووي الريبي المزدوج (dsRNA) جنبا إلى جنب مع الصبغة الحمراء (انظر جدول المواد)لحقن الخوخ المرحلة البيضاء ومع BAPC-Cas9-sgRNA لحقن الدبابير الخوادر السوداء والبالغين. هذه الكواشف ستستهدف جين السينابار الدبابير التي يتم هدمها بنجاح / الخروج سوف تظهر عيون حمراء بدلا من العيون البنية البرية. - فتح الإبرة، انزلاق طرف على سطح مصنوعة من اثنين من الشرائح المتداخلة (الشكل 1D). بدلا من ذلك ، افتح طرف الإبرة بزوج من ملقط ناعم لإنشاء حافة حادة أو عن طريق ثقب الصدر أو البطن ببطء من الدبابير.
4. حقن الجراء مع femtojet
- ضع الشريحة مع الخوادر المنحازة تحت مجهر تشريح. أدخل الإبرة في أنبوب حقن femtojet وشد رأس القبضة.
- النظر في الإبرة تحت المجهر، بدوره على femtojet وإعداد معلمات حقن الكمبيوتر وبي عن طريق تدوير المقابض الدوارة.
ملاحظة: يوصى بقيمة كمبيوتر شخصي تبلغ 600 hPa لتدفق مستمر للسائل. تعتمد قيمة الكمبيوتر الشخصي على فتح الإبرة. بالنسبة للإبر المعدة باستخدام المعلمات المشار إليها في سحب الإبر P-1000، تنتج قيم الكمبيوتر الشخصي بين 500 hPa و 700 hPa تدفقا ثابتا. إذا كانت القيم المنخفضة للكمبيوتر مطلوبة ، فهذا يشير إلى أن الفتحة قد تكون كبيرة جدا ويمكن أن تلحق الضرر بالحشرات ، في حين تشير القيم الأعلى إلى أن الإبرة لا تزال مغلقة ، أو أن الفتحة صغيرة جدا. - أدخل الإبرة بعناية بين 2 و 3 أجزاء البطن مرئية مع زاوية عمودية من حوالي 30 درجة (الشكل 1E). حقن مع تدفق مستمر حتى يتحول البطن كله الوردي في حالة الخوادر المرحلة البيضاء، أو حتى يزيد البطن في الحجم في حالة الخوادر السوداء. توقف عن الحقن عندما يكون من الواضح أن البطن لا يمكن أن تأخذ أي أكثر من السائل، أو عندما يبدأ السائل تتدفق من الجسم. التحرك بعناية إلى pupa المقبل وتكرار هذه الخطوات.
ملاحظة: تجنب لمس وتخريب ovipositor مع الإبرة أثناء الحقن. - نقل الشريحة مع الخوخ حقن إلى طبق بيتري تحتوي على منشفة ورقية غارقة في الماء deionized للحفاظ على الرطوبة. غطي الطبق بغطاءه، وضعيه عند 25 درجة مئوية حتى ظهور الزبور(الشكل 1F).
5. حقن الجراء مع أنبوب أسبيراتور
- حساب كمية مزيج الحقن باستخدام عامل: 4 pupae حقن/ 1 ميكرولتر الحل.
ملاحظة: حقن نموذجي من 20-30 الخوخ يتطلب ~ 5-8 ميكرولتر من ريبونوكليوبروتين (RNP) مزيج معقد سابونين أو RNP مع BAPC12. - محاذاة الخوادر، كما هو مقترح في القسم 2، ووضع شريحة واحدة مع الخوادر محاذاة تحت المجهر تشريح(الشكل 1E).
- تأخذ واحدة من الإبر الشعرية وكسر الطرف بين اثنين من الشرائح الزجاجية، كما هو مبين في الخطوة 3.4(الشكل 1D). تأكد من أن طرف الإبرة مفتوح بما يكفي للسماح لمحلول الحقن بالخروج عن طريق نفخ الهواء بالفم ، ولكن ليس مفتوحا جدا لتجنب فقدان السائل وإتلاف الخوادر(الشكل 1E).
ملاحظة: هذه الخطوة حاسمة لأن المستخدم سوف يستخدم الهواء من الفم لدفع خليط الحقن في الهيموليم الحشرات. فمن الأفضل لممارسة وذلك للتأكد من أي نوع من فتحة إبرة هو الأمثل ل لزوجة مزيج حل معين. خمس مجموعات من الحقن من 20 pupae لكل مجموعة قد تكون كافية لتعتاد على نظام حقن الفم. - قم بتحميل إبرة واحدة بمحلول ريبونوكليوبروتين12 باستخدام طرف تحميل صغير، وأدخل الإبرة في حزمة الموصل لتجميع أنبوب التنفس.
ملاحظة: أثناء المظاهرة، يتم تحميل الإبرة مع BAPC-Cas9-sgRNA استهداف الجين cinnabar Nasonia 12. - أدخل الإبرة بعناية بين 2 و 3 أجزاء البطن مرئية مع زاوية عمودية من حوالي 30 درجة (الشكل 1E). حقن مع تدفق مستمر حتى يتحول البطن كله الوردي في حالة الخوخ المرحلة البيضاء أو حتى يزيد حجم البطن في حالة الخوادر السوداء. توقف عن الحقن عندما يكون واضحا أن البطن لا يمكن أن تأخذ أي أكثر السائل أو عندما يبدأ السائل تتدفق من الجسم. الانتقال بعناية إلى الخوخ التالي وتكرار هذه الخطوات
ملاحظة: تجنب لمس وتخريب ovipositor مع الإبرة أثناء الحقن. - نقل الشريحة مع الخوخ حقن إلى طبق بيتري تحتوي على منشفة ورقية غارقة في الماء deionized للحفاظ على الرطوبة. تغطية الطبق مع غطاء ووضعها في 25 درجة مئوية حتى ظهور الدبابير (الشكل 1F).
6. حقن الكبار مع أنبوب أسبيراتور
- لإعداد الكبار، مجموعات منفصلة من 20 أنثى عذراء في أنبوب اختبار صغير نظيف مع فرشاة طلاء ناعمة. ضع الأنبوب على الجليد لمدة 5 دقائق حتى يتم تخدير الإناث. بدلا من ذلك، يمكن تخدير الإناث وحقنهن باستخدامثانيأكسيد الكربون .
ملاحظة: من الأفضل أن يكون الثلج مخدرا لأن الدبابير البالغة تتحمل البرد وتتعافى بسهولة بعد الحقن. يمكن للإناث تناول سائل عن طريق الحقن أكثر من الخوانق: يمكن استخدام 1 ميكرولتر من المحلول لثلاث إناث بدلا من أربعة جرو. إعداد وحدات التخزين وفقا لذلك. - إعداد دلو الثلج، ووضع شريحة زجاجية واحدة على رأس الجليد. محاذاة الإناث جنبا إلى جنب على الشريحة الباردة مع البطن التي تواجه(الشكل 1E)تحت نطاق تشريح.
- قم بتحميل إبرة واحدة بمحلول ريبونوكليوبروتين12 باستخدام طرف تحميل صغير، وأدخل الإبرة في حزمة الموصل لتجميع أنبوب التنفس. دعم الإناث من الجانب الآخر مع الإبر تشريح حادة في حين حقن ببطء في البطن من الجانب الآخر. تجنب لمس ovipositor، وهذا سوف تلحق ضررا بالغا هذا الهيكل التناسلي الحرجة (الشكل 1E).
ملاحظة: إما الاتجاه مقبول، اعتمادا على تفضيل عامل التشغيل. - أدخل الإبرة بعناية بين 2 و 3 أجزاء البطن مرئية مع زاوية عمودية من حوالي 30 درجة (الشكل 1E). حقن الحل في البطن الإناث، ووقف عندما لا يمكن أن يدخل المزيد من السائل، أو عند تسرب محلول الفائض لوحظ. الانتقال بعناية إلى الكواسب التالي وتكرار هذه الخطوات
ملاحظة: حقن ببطء، وترك الإبرة داخل البطن لمدة 3 ق قبل إزالته ببطء شديد. وهذا سوف يساعد على ضبط ضغط السائل الداخلي وتجنب تسرب الحل من موقع الحقن بعد إزالة إبرة. - عند الانتهاء، نقل بلطف الإناث حقن واحد إلى أنبوب جديد مع مضيف واحد باستخدام فرشاة الطلاء. ترك لاسترداد في درجة حرارة الغرفة لمدة ساعة تقريبا، مما يؤكد البقاء على قيد الحياة، ومن ثم العودة الأنابيب إلى حاضنة تربية.
ملاحظة: أثناء المظاهرة، يتم تحميل الإبرة مع BAPC-Cas9-sgRNA استهداف الجين cinnabar Nasonia 12.
7. الرعاية بعد الحقن وفحص متحولة
- بعد eclosion الكبار من الخوخ حقن، وضع الدبابير واحد في أنبوب زجاجي موصول بالقطن وإدراج واحد S. بولاتا المضيف(الشكل 1G). في المقابل، ضع حقن الإناث في أنابيب فردية مع المضيفين مباشرة بعد الحقن.
- بالنسبة لتجارب خروج المغلوب CRISPR/Cas9 ، اسمح للإناث بتطفل المضيفين ليوم واحد ، واستبدال المضيف كل يوم لمدة ثلاثة أيام متتالية.
ملاحظة: بسبب نظام تحديد الجنس haplodiploid في N. vitripennis16، سوف تنتج الإناث العذراء حضنات الذكور haploid ، مما يسهل الكشف عن الطفرات. لضربة قاضية عن طريق RNAi من الجينات الخاصة بالذكور ، يمكن تزاوج الأفراد المحقونين بشكل فريد مع أفراد من النوع البري والسماح لهم بتطفل المضيفين. استخدم مضيف واحد في اليوم، واستبدل المضيفين استنادا إلى الإعداد التجريبي. - ضع المضيفين المظليين عند 25 درجة مئوية حتى ظهور ذرية G0 الذكور (لمدة 13-14 يوما تقريبا).
- تحت المجهر تشريح، شاشة G0 الذكور للأنماط الظاهرية تحور. جين cinnabar هو المسؤول عن تصبغ العين12: الدبابير ذات العيون البنية هي نوع بري ، والدبابير ذات العيون الحمراء الساطعة أو الاختلافات بين العيون الحمراء والبنية هي متحولة(الشكل 1H).
8. الصلبان بعد الحقن وتربية
- وضع جميع الذكور G0 متحولة مع عيون حمراء (الجين cinnabar12تعطلت phenotypically) مع نوع البرية الإناث العذراء لمدة 1-2 أيام(الشكل 2A).
ملاحظة: إذا لم يمنح الجين المعطل نمطا ظاهرا مرئيا ، فإن تفاعل البوليميراز المتسلسل (PCR) يليه تسلسل الجين المستهدف مطلوب لتحديد الحيوانات المتحولة. قبل الحصول على الحمض النووي من الذكور G0 لPCR، سيكون مثاليا لتزاوج لهم مع الإناث البرية نوع العذراء. بدلا من ذلك، استخراج الحمض النووي من ساق ذكر G0 لتحديد المسوخ، ورفيقة فقط أولئك الذين يعانون من طفرات التحقق منها. - إضافة اثنين من المضيفين S. bullata لكل أنثى، والسماح لoviposit في 25 درجة مئوية و 30٪ الرطوبة النسبية مع دورة 12:12 ضوء الظلام. استبدال المضيفين كل 2-3 أيام.
- تخزين المضيفين تطفل في 25 درجة مئوية و 30٪ الرطوبة النسبية، مع دورة 12:12 ضوء الظلام لمدة 10 أيام تقريبا.
- بعد ~ 10 أيام ، الكراك فتح المضيف تطفل مع إبرة تشريح ، وإزالة كل N. vitripennis pupa من المضيف.
- مع مساعدة من فرشاة الطلاء غرامة تلميح، حدد الجراء الإناث (الشكل 1A).
ملاحظة: الإناث هي ديبلويد و heterozygous، وبالتالي فإن لون العين يكون نوع البرية.
- ضع 15-20 أنثى الخوادر في أنابيب زجاجية عند 25 درجة مئوية حتى ظهورها. بعد ظهور، إضافة ~ 20 S. بولاتا المضيفين والسماح للإناث G1 العذراء تطفل المضيفين لمدة 2-3 أيام.
ملاحظة: هذه الإناث سوف تنتج 50٪ G2 الذكور متحولة.- تخزين المضيفين تطفل في 25 درجة مئوية و 30٪ الرطوبة النسبية، مع دورة 12:12 ضوء الظلام حتى G2 ظهور الذكور الكبار.
- ضع الخوادر G1 المتبقية عند 5 درجات مئوية لمدة 8-10 أيام. بعد هذه الفترة، إزالتها ووضعها في 25 درجة مئوية و 30٪ الرطوبة النسبية، مع دورة 12:12 ضوء الظلام حتى ظهور (الشكل 2A).
- بعد ظهور الذكور G2 في الخطوة 8.3.1، شاشة لوجود النمط الظاهري متحولة حمراء العينين. مع مساعدة من فرشاة الطلاء غرامة تلميح، منفصلة الذكور أحمر العينين من الذكور نوع البرية.
ملاحظة: يشير وجود الدبابير ذات العيون الحمراء في هذا الجيل (G2، الشكل 2A)إلى أن تحرير الجينات حدث في الجرثومة، وأن الطفرة وراثية. - وضع الذكور أحمر العينين مع الإناث G1 ظهرت حديثا في الخطوة 8.3.2(الشكل 2A)،والسماح لهم رفيقة لمدة 1-2 أيام. أضف مضيفين S. bullata لكل أنثى ، ووضعها عند 25 درجة مئوية ورطوبة نسبية بنسبة 30٪ مع دورة 12:12 ضوء داكن لمدة 10-11 يوما.
- بعد 10-11 يوما ، الكراك فتح المضيف تطفل مع إبرة تشريح ، وإزالة كل N. vitripennis pupa من المضيف(الشكل 2A).
- بمساعدة فرشاة طلاء ذات طرف رفيع ، دبابير حمراء العينين منفصلة (ذكور وإناث) من النوع البري(الشكل 1H). استمر في تربية الدبابير ذات العيون الحمراء معا في أنابيب زجاجية ، ولا تختلط مع الدبابير البرية.
ملاحظة: في هذه المرحلة (G3, الشكل 2A), الذكور haploid والإناث diploid تحمل وتظهر الأنماط الظاهرية للطفرات cinnabar. إذا كان الجين المصاب يشفر لنمط ظاهري غير مرئي ، عبر G0 الذكور بشكل فريد مع أنثى واحدة من النوع البري لمدة ~ 1 يوم. ثم، إزالة الذكور لتوصيف الجزيئية للطفرة عن طريق PCR والتسلسل، والسماح للإناث تطفل المضيف. مواصلة مخطط العبور فقط مع ذرية من الذكور متحولة مؤكدة (الشكل 2B). إذا كان الهدف هو الضربة القاضية من قبل RNAI من الجينات المرشحة، وإجراء المقايسة الوظيفية المطلوبة (مثل الفتك، والعقم، أو اختبار التعريفي diapause3،7) مباشرة باستخدام الأفراد حقن مع dsRNA. كما RNAi عابرة، فإنه ليس من الممكن لتوليد مستعمرة مع النمط الظاهري المطلوب (الشكل 2C)3،7.

الشكل 1: الجدول الزمني للجرو والكبار ناسونيا vitripennis microinjection. (أ)يتم جمع الذكور والإناث البيضاء (أعلى) والأسود (أسفل) الخوادر،(ب-C)محاذاة ولصقها على شريحة زجاجية للحقن. (د)يتم إعداد إبرة الشعرية وفتحها، والانزلاق على اثنين من الشرائح المتداخلة. (ه) يتم إرفاق إبرة إما إلى Femtojet (أعلى) أو إلى أنبوب الطامح (أسفل) للحقن. (F)يتم نقل الخوادر المحقونة على الشريحة إلى طبق بيتري مع نسيج رطب في الأسفل للحفاظ على الرطوبة. عند ظهورها ، يتم وضع الإناث(G)بشكل فريد في أنابيب زجاجية صغيرة ويسمح لها ب oviposit على جروة التابوت. (ح)فحص النسل للكشف عن المسوخ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
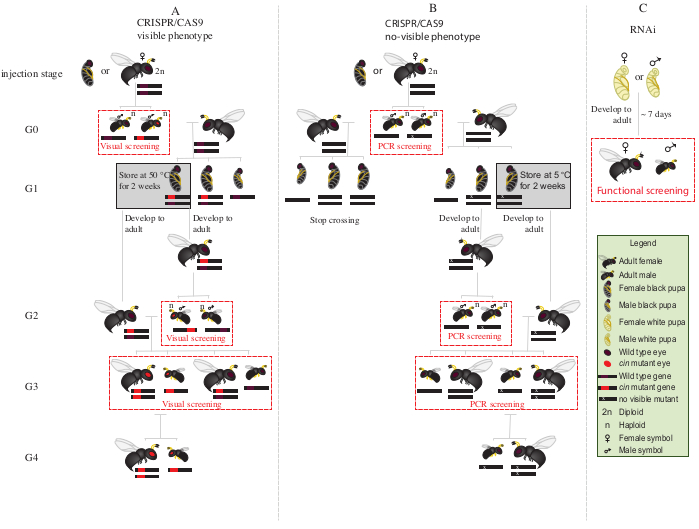
الشكل 2: مخطط العبور بعد الحقن. التمثيل التخطيطي لإجراءات مخطط العبور في حالة تحرير الجينات بوساطة CRISPR/Cas9 للجينات (A) التي تحفز النمط الظاهري المرئي و (B) التي لا تمنح النمط الظاهري المرئي. (ج) التمثيل التخطيطي لإجراء فحص ال RNAi. المختصرات: cin = cinnabar; PCR = تفاعل البوليميراز المتسلسل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تقدم هذه الورقة طريقتين سهلتين للتشخيص المجهري للجرو والكبار ، إما باستخدام femtojet أو أنبوب أسبيراتور. الطريقة الأولى تسمح بحقن أكثر دقة من السائل، وهو أمر مهم لاتساق RNAi، في حين أن الطريقة الثانية تسمح بحقن كميات أكبر من السائل في الجراء Nasonia أو البالغين.
Discussion
مع الاستخدام المتزايد مؤخرا من nasonia vitripennis ككائن حي نموذجي لمختلف الأسئلة البيولوجية2،3،7،17، هناك حاجة لتطوير وتحسين أساليب الحقن لتمكين بروتوكول مبسط وفعال للتحليل الوظيفي لجينات N. vitripennis. الأساليب الحالية ا...
Disclosures
وقد قدمت JLR وDCR لحماية براءات الاختراع المؤقتة على تكنولوجيا التحكم ReMOT. O.S.A هي مؤسسة شركة Agragene، ولديها حصة في الأسهم، وتعمل في المجلس الاستشاري العلمي للشركة. جميع المؤلفين الآخرين لا يعلنون عن مصالح متنافسة.
Acknowledgements
وقد تم دعم هذا العمل جزئيا من قبل صناديق بدء UCSD الموجهة إلى O.S.A. ومنحة NSF/BIO 1645331 إلى J.L.R.
Materials
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
References
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved