需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
纳索尼亚维特里彭尼斯的 Rnai 和克里斯普基因编辑的普帕尔和成人注射
摘要
在这里,我们将 纳索尼亚维特里彭尼斯 高效注射 pupal 和成人注射的方法描述为胚胎微注射的可访问替代品,通过 RNA 干扰 (RNAi) 或通过 CRISPR/Cas9 基因组编辑进行基因敲除,实现感兴趣的基因的功能分析。
摘要
宝石黄蜂 ,纳索尼亚维特里彭尼斯,已成为一个有效的模型系统,研究表观遗传学的单体双体性别测定,B染色体生物学,宿主共生相互作用,斑点和毒液合成。尽管有多种分子工具,包括CRISPR/Cas9,但这种生物体的功能性基因研究仍然有限。在 N.维特里彭尼斯 应用CRISPR/Cas9技术的主要限制源于胚胎微注射的挑战。由于胚胎体小,而且胚胎发育需要宿主幼崽,因此在这个生物体和一般许多寄生虫黄蜂中,胚胎的注射尤其困难。为了应对这些挑战,Cas9核糖核蛋白通过成人注射而不是胚胎微注射复杂地输送到女性卵巢,从而进行了体细胞和遗传性生殖系的编辑。注射程序优化在幼虫和雌性黄蜂使用REMOT控制(受体介导卵巢转导货物)或BAPC(分支的两栖肽胶囊)。这些方法被证明是胚胎注射的有效替代品,使部位特定和遗传性生殖系突变。
引言
CRISPR/Cas9基因编辑是功能遗传研究的有力技术,特别是在许多新兴的模型生物体,如宝石黄蜂,纳索尼亚维特里彭尼斯。养殖的便利性和完整基因组的可用性使宝石黄蜂成为阐明不同生物过程分子机制的重要实验系统。例如,N.vitripennis最近被用来解开单体性测定系统1、2、B染色体3、4、5、6的生物学以及昼夜和季节性规则7、8的遗传基础的表观遗传基础。使N. vitripennis适合工作的一些功能包括短的生成时间 (+2 周在 25 °C), 高繁殖率, 容易在 pupal 阶段的性别分离, 以及在 4 °C 下诊断和存储菌株的能力。 生命周期开始于雌性黄蜂寄生在萤虫的幼崽,石棺牛拉塔。通过它们的卵子,雌性在吹飞的幼崽中产下多达50个卵子。卵子发育成幼虫,以S.牛油为食,在接下来的几天里继续发育,然后幼虫,然后成年的萎缩和从宿主puparium 9中出现。
在N.维特里彭尼斯进行功能性遗传研究的分子工具,如RNA干扰(RNAi)10和CRISPR/Cas911,12,是可用的,但有限,主要是因为在执行胚胎微注射13困难。由于N.维特里彭尼斯鸡蛋需要一个幼崽宿主来发展,鸡蛋操纵是非常具有挑战性的。预爆胎阶段胚胎必须从宿主吹飞幼虫中采集,迅速微注入,并立即移植回宿主进行发育13。这些步骤需要精确和专门的训练,以避免损害微注入胚胎或幼崽宿主13。此外,鸡蛋非常小和脆弱,特别是在微注射后,非常粘稠的细胞质导致注射针13的连续堵塞。这些特征使得胚胎微注射极具挑战性,需要训练有素的操作员和大多数N.维特里彭尼斯实验室都不存在的专门设备。
优化用于交付CRISPR试剂的替代注射方法将有助于巩固N.维特里彭尼斯作为模型有机体的地位。与操纵胚胎相比,对幼崽和成人的操纵挑战性较小,可以通过基本的注射设置来完成。在这里,描述了注射幼虫和成人的两个协议:一个涉及注射的专用设备,另一个涉及使用装有玻璃毛细管的吸气管总成。使用吸气管特别适合无法获得胚胎微注射专用设备的实验室。展示了不同发育阶段的N.维特里彭尼斯的有效注射,包括白或黑幼虫和成年黄蜂。白幼崽阶段的黄蜂特别适合 RNAi 调解的击倒实验。虽然在纳索尼亚的RNAi在2006年首次被林奇和德斯普兰描述10,但没有视觉程序可用于如何RNA注射进行。RNAi最近被用来发现B染色体PSR(父性比例)3的增生基因,并研究时钟基因的参与,周期,在N.维特里彭尼斯生物节律7。
黑幼虫和成年黄蜂可用于利用REMOT控制(受体介导的货物卵巢转导)和BAPC(分支两栖肽胶囊)协议诱导CRISPR/Cas9细菌基因编辑。这两种卵巢输送方法最近被描述为在纳索尼亚产生生殖系突变的目标基因,辛纳巴7,12有效。在这里,为注射提供了简化的协议,包括一个循序渐进的方法的视觉程序,可用于在纳索尼亚产生功能遗传学研究,并可能在其他寄生虫黄蜂,而无需专门设备和绕过胚胎微注射。
研究方案
1. 纳索尼亚饲养
- 将~20名雌性女性单独设置在用棉布插上的小玻璃试管中。
注意:为了减少饲养空间,10 x 85 厘米,4 mL 管是最佳的。女性很容易与男性区别,因为更大的翅膀和存在卵子(图1A)。饲养N.维特里彭尼斯的详细协议也可以在其他文献13,14,15中找到。- 每管增加两个 S. bullata 主机 ,并将黄蜂保持在 25 ± 1 °C 和 30% 的相对湿度,12:12 的光暗周期为 2-3 天。
注:黄蜂可以在较低的温度或室温下保持:然而,发展将放缓。
- 每管增加两个 S. bullata 主机 ,并将黄蜂保持在 25 ± 1 °C 和 30% 的相对湿度,12:12 的光暗周期为 2-3 天。
- 2-3天后,在细尖油漆刷的帮助下,轻轻取出女性,以避免在后代发育中持续的异位和异步。
注:删除的女性可以选择地重新托管或存储在5°C长达一个月。- 将寄生宿主保持在 25 °C 和 30% 的相对湿度,如果所需的注射阶段需要白色 pupae,则 12:12 的光暗周期为 7 天;如果所需的发育阶段是黑色幼崽,则为13天:或14天的年轻,新出现的成年人。
注:黄色和黑色的 pupae 也可以存储在 5 °C 长达一个星期。更长的储存将增加下一代幼虫的腹泻频率,使注射后筛查和建立突变线更加困难。 - 用解剖针打开宿主,在所需的阶段恢复N.维特里彭尼斯小狗和成人(图1A)。
注意:对于特定成年年龄的注射或收集处女女性,建议在13日从宿主身上取出黑脓液,按性别分开,并在出现后收集成人。
- 将寄生宿主保持在 25 °C 和 30% 的相对湿度,如果所需的注射阶段需要白色 pupae,则 12:12 的光暗周期为 7 天;如果所需的发育阶段是黑色幼崽,则为13天:或14天的年轻,新出现的成年人。
2. 白色和黑色的对齐
- 在中心涂上一排学校胶水,准备玻璃滑梯。用解剖针铺上胶水,获得厚层(图1B),用于对齐幼虫。让胶水干燥约2分钟,然后再转移幼胶。
注意:不要过度涂上胶水,否则将不能正确连接到滑梯上,并在注射过程中滑倒。 - 在解剖显微镜下,使用解剖针,在头部背面涂上胶水。
- 将 pupa 连接到滑梯上的胶水层上,其腹部朝上。在幻灯片上并排对齐 20-30 pupae (图 1C)。
注意:避免用胶水触摸腹部,避免将脓液浸入胶水中:否则,成年人将无法出现。 - 将滑梯与小狗放在培养皿中,让胶水干燥约10分钟。在开始注射之前,用解剖针轻轻推压粘合剂,测试脓液对胶水的粘附性。如果大部分脓液松动,准备一张新的幻灯片。或者,取出所有松动的 pupae,然后继续注入正确连接到幻灯片的 pupae。
3. 针头制备
- 将一根毛细血管玻璃管装载到针拔管中,并按照制造商的说明拉针。
注:本次演示使用了P-1000铂金丝针拉拔器和硅酸铝玻璃毛细管。此仪器的操作手册(参见 材料表)解释了如何正确加载毛细血管玻璃管并在该仪器上设置程序。使用以下参数(热度:536:拉:80:维尔: 100;延迟: 70) 铝硅酸盐玻璃毛细细丝注射黄色 pupae, 黑小狗, 和成人。
此外,P-2000针拔针机用于按照参数(热:805:拉力: 145:维尔: 50;延迟: 145).手册提供了装载毛细管石英管和在此仪器中设置程序的说明。在没有拉拔器的情况下,可定制毛细细金玻璃。 - 使用微加载器移液器提示,将针头与注射混合物的 5 μL(按照 RNAi10或 CRISPR/Cas9 核蛋白12 (RNP) 注射以前的协议提前准备)。
注:在演示过程中,针头装有双链RNA(dsRNA)与红色染料(见 材料表)相结合,用于注射白色阶段幼虫,并配以BAPC-Cas9-sgRNA注射黑小狗黄蜂和成人。这些试剂将针对 肉桂棒 基因。黄蜂被成功击倒/击倒将显示红眼睛,而不是野生类型的棕色眼睛。 - 打开针头,在由两个重叠的滑梯(图1D)制成的表面上滑动尖端。或者,用一对细钳打开针尖,形成锋利的边缘,或慢慢刺穿黄蜂的胸腔或腹部。
4. 普帕尔注射与女性喷气机
- 将幻灯片与对齐的小狗放在解剖显微镜下。将针头插入女性喷射管,并拧紧抓地力头。
- 看着显微镜下的针头,打开股骨,通过旋转旋转旋钮设置Pc和Pi注射参数。
注:建议连续流动液体,建议使用 600 hPa 的 Pc 值。Pc 值取决于针的开口。对于使用 P-1000 针拔针器中指示参数准备的针头,500 hPa 和 700 hPa 之间的 Pc 值产生恒定流量。如果需要较低的 Pc 值,则表示开口可能太大,可能会损坏昆虫,而较高值表示针头仍然关闭,或开口太小。 - 小心地将针头插入 2 和 3 可见腹部段之间,垂直角度约为 30° (图 1E)。注射一个连续的流动,直到整个腹部变成粉红色的情况下,白色阶段的幼崽,或直到腹部在黑色脓肿的情况下,增加大小。当腹部明显不能再吸收液体,或者当液体开始流出身体时,停止注射。小心地移动到下一个 pupa,并重复这些步骤。
注意:避免在注射过程中用针头触摸和损坏卵射器。 - 将滑梯与注射的 pupae 一起转移到培养皿中,其中含有浸泡在除离子水中的纸巾,以保持湿度。用盖子盖住盘子,放在25°C,直到黄蜂出现(图1F)。
5. 带吸气管的普帕尔注射
- 使用该因子计算注射混合量:4 个注射 pupae/1 μL 溶液。
注:典型的注射20-30 pupae需要~5-8微L的核糖核蛋白(RNP)复合皂素混合或RNP与BAPC12。 - 按照第 2 节的建议,将 pupae 对齐,并将一张幻灯片与对齐的小狗放在解剖显微镜下 (图 1E)下。
- 取一根毛细细针,在两个玻璃滑梯之间折断尖端,如步骤 3.4(图 1D)所示。确保针尖足够开放,允许注射液通过用嘴吹气出去,但不要太开放,以避免失去液体和损坏脓液(图1E)。
注意:此步骤至关重要,因为用户将使用口腔中的空气将注射混合物推入昆虫淋巴中。最好练习,以确定哪种类型的针孔径最适合特定溶液组合的粘度。每套注射5套20 pupae可能足以适应口腔注射系统。 - 使用微加载尖端用核糖核蛋白溶液12 装载一根针,并将针头插入吸气管组件的连接器包中。
注:在演示过程中,针头装有针对 纳索尼亚辛纳巴 基因12的BAPC-Cas9-sgRNA。 - 小心地将针头插入 2 和 3 可见腹部段之间,垂直角度约为 30° (图 1E)。注射一个连续的流动,直到整个腹部变成粉红色的情况下,白色阶段的幼崽,或直到腹部增加大小的情况下,黑色脓肿。当腹部不能再吸收液体或液体开始流出身体时,停止注射。小心地移动到下一个小狗,并重复这些步骤
注意:避免在注射过程中用针头触摸和损坏卵射器。 - 将滑梯与注射的 pupae 一起转移到培养皿中,其中含有浸泡在除离子水中的纸巾,以保持湿度。用盖子盖住盘子,放在25°C,直到黄蜂出现(图1F)。
6. 成人注射与吸气管
- 对于成人准备,20名处女女性在一个干净的小试管与精细的画笔单独组。将管子放在冰上5分钟,直到女性麻醉。或者,女性可以麻醉和注射使用CO2。
注意:冰最好作为麻醉剂,因为成年黄蜂耐寒,注射后很容易恢复。女性可以比小狗多服用注射液体:1μL的溶液可用于三个女性,而不是四个幼崽。相应地准备卷。 - 准备一个冰桶,在冰上放一个玻璃滑梯。在冷滑梯上并排对齐女性,在解剖范围内将腹部朝上(图1E)。
- 使用微加载尖端用核糖核蛋白溶液12装载一根针,并将针头插入吸气管组件的连接器包中。用钝化解剖针支持对方的女性,同时从另一侧缓慢地注射到腹部。避免接触卵细胞体,这将严重损害这个关键的生殖结构(图1E)。
注意:根据操作员的偏好,任一方向都是可以接受的。 - 小心地将针头插入 2 和 3 可见腹部段之间,垂直角度约为 30° (图 1E)。将溶液注射到女性腹部,在没有液体进入时停止,或观察到多余的溶液泄漏时停止。小心地移动到下一个黄蜂,并重复这些步骤
注意:慢慢注射,将针头留在腹部约3s,然后慢慢取出。这将有助于调整内部液体压力,避免针头去除后从注射部位泄漏溶液。 - 完成后,用画笔将单注射的女性轻轻转移到新管中,并用一个主机。离开,在室温下恢复约1小时,确认生存,然后返回管子到饲养孵化器。
注:在演示过程中,针头装有针对 纳索尼亚辛纳巴 基因12的BAPC-Cas9-sgRNA。
7. 注射后护理和突变筛查
- 成人从注射的幼崽中脱口而出后,将单黄蜂放入用棉布插入的玻璃管中,并插入一个 S. bullata 主机(图 1G)。相比之下,注射后立即将女性注射到单独的管子里,并立即与宿主一起注射。
- 对于CRISPR/Cas9淘汰赛实验,允许女性将宿主寄生一天,并连续三天每天更换主机。
注:由于16号的单体性别测定系统,处女雌性将产生单体雄性育雏,从而有助于突变的检测。对于通过RNAI敲除男性特异性基因,注射的个人可以与野生类型的个体奇异地配对,并允许寄生宿主。每天使用一个主机,并根据实验设置替换主机。 - 将寄生宿主置于 25 °C,直到 G0 雄性后代出现(持续 13-14 天)。
- 在解剖显微镜下,对G0男性进行变异表型筛查。肉桂棒基因负责眼睛色素化12:有棕色眼睛的黄蜂是野生的类型,而红眼睛明亮的黄蜂或红褐色眼睛之间的变化是突变体(图1H)。
8. 注射后交叉和饲养
- 放置所有突变的G0雄性与红眼睛(表型破坏肉桂12基因)与野生类型处女女性1-2天(图2A)。
注:如果被破坏的基因没有赋予可见的表型,聚合酶链反应(PCR)随后需要对目标基因进行测序,以确定突变动物。在从 G0 雄性获得 PCR 的 DNA 之前,最好与野生类型的处女雌配。或者,从G0雄性腿部提取DNA来识别突变体,并且只与那些经过验证的突变的突变者交配。 - 每位女性添加两个 S. bullata 主机,允许在 25 °C 和 30% 的相对湿度下以 12:12 的光暗周期进行渗透。每 2-3 天更换一次主机。
- 以 25 °C 和 30% 的相对湿度存储寄生主机,12:12 的光暗周期为 10 天。
- 10天后,用解剖针打开寄生宿主,从主机中取出每个 N.维特里彭尼斯 普帕。
- 在细尖画笔的帮助下,选择雌性小狗(图1A)。
注意:雌性是双体和异质的,因此眼睛的颜色将是野生的类型。
- 将 15-20 只雌性幼崽放在玻璃管中,在 25 °C 处,直到出现。出现后,添加~20 S.牛拉塔 主机,让处女G1女性将主机寄生2-3天。
注意:这些女性将产生50%的G2突变雄性。- 存储寄生主机在25°C和30%的相对湿度,与12:12光暗周期,直到G2男性成人出现。
- 将剩余的 G1 pupae 放置在 5 °C,为期 8-10 天。在此期间之后,取出它们,并将其放置在 25 °C 和 30% 的相对湿度,与 12:12 光暗周期,直到出现 (图 2A)。
- G2雄性在步骤8.3.1出现后,屏幕显示红眼突变表型的存在。在细尖画笔的帮助下,红眼雄性与野性雄性分开。
注:这一代红眼黄蜂的存在(G2, 图2A)表明基因编辑发生在生殖系中,突变是遗传性的。 - 将红眼雄性与G1女性一起放在第8.3.2步(图2A),让它们交配1-2天。每位女性添加2 个S.牛拉塔 主机,并将它们放置在25°C和30%的相对湿度,12:12光暗周期为10-11天。
- 10-11天后,用解剖针打开寄生宿主,从主机中取出每个N.维特里彭尼斯小狗(图2A)。
- 在细尖画笔的帮助下,红眼黄蜂(雄性与雌性)与野生类型(图1H)分离。继续在玻璃管中一起饲养红眼黄蜂,不要与野生黄蜂混合。
注:在这个阶段(G3,图2A),单体雄性和双体雌性携带和显示表型的肉桂棒突变。如果受影响的基因编码为隐形表型,交叉G0雄性奇异与一个野生类型的女性约1天。然后,通过PCR和测序去除男性对突变的分子特征,让女性寄生宿主。继续交叉计划,只与确认突变男性的后代 (图 2B) 。如果目标是 RNAi 敲除候选基因,则直接使用注射 dsRNA 的个人执行所需的功能检测(如致命性、不育性或诱导检测3、7)。由于 RNAi 是瞬态的,因此不可能生成具有所需表型(图 2C)3、7的殖民地。

图1:普帕尔和成人纳索尼亚维特里彭尼斯微注射的时间表。(A) 收集男性和女性白色(上)和黑色(下)pupae,(B-C)对齐并粘在玻璃滑梯上进行注射。(D) 毛细金针准备和打开,滑动它在两个重叠的幻灯片上。(E) 针头要么连接到女性喷气机(顶部)或吸气管(底部)注射。(F) 滑梯上的注射脓被转移到底部有湿组织的培养皿中,以保持湿度。出现后,(G)雌性被奇异地放置在小玻璃管中,并允许在石棺上渗出。(H) 筛选后代以检测突变体。请单击此处查看此图的较大版本。
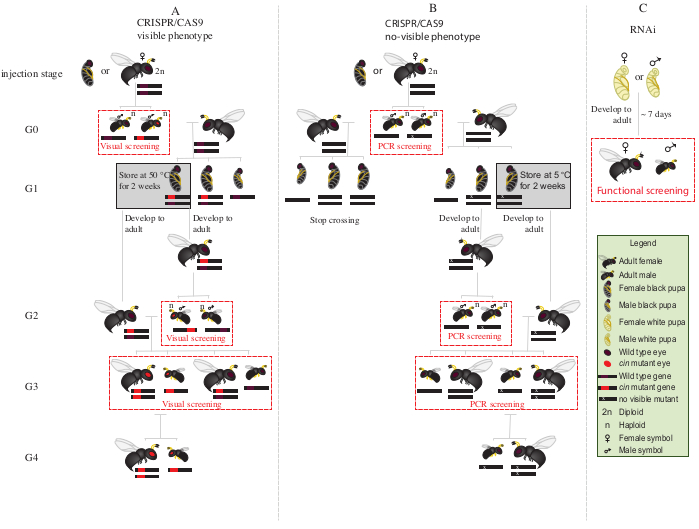
图2:注射后的交叉方案。 在CRISPR/Cas9介导基因编辑(A)的情况下,交叉方案程序的示意图表示,这些基因会诱导一个可见的表型和(B)不赋予可见表型。(C) RNAi筛查程序的示意图表示。缩写: cin =辛纳巴;五氯苯酚=聚合酶链反应。请单击此处查看此图的较大版本。
结果
本文提出了两个简单的方法,为 pupal 和成人微注射,无论是使用女性喷气机或呼吸管。第一种方法允许更精确地注射液体,这对 RNAi 的一致性很重要,而第二种方法允许向 纳索尼亚 pupae 或成人注射更多液体。
表1中显示的代表性结果显示存活率良好(从20%到89%)使用此处描述的注射方法获得所需的表型(?...
讨论
随着最近越来越多的使用纳索尼亚维特里彭尼斯作为模型生物体的各种生物问题2,3,7,17,有必要开发和优化注射方法,使一个简化和有效的协议,为N.维特里彭尼斯基因的功能分析。目前涉及基因编辑试剂胚胎微注入的方法具有挑战性,需要专门设备和训练有素的人...
披露声明
JLR 和 DCR 已申请了关于再MOT 控制技术的临时专利保护。O.S.A是阿格拉金公司的创始人,拥有股权,并在公司的科学顾问委员会任职。所有其他作者都宣称没有相互竞争的利益。
致谢
这项工作部分得到了UCSD启动基金的支持,这些基金拨给O.S.A.和NSF/BIO赠款1645331给J.L.R.
材料
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
参考文献
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。