A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זריקות פואפאל ומבוגרים לעריכת גנים RNAi ו- CRISPR בנסוניה ויטריפניס
In This Article
Summary
כאן, אנו מתארים שיטות להזרקות יעילות של פופלים ומבוגרים בנסוניה ויטריפניס כחלופות נגישות למיקרו-אינטרנציקציה של עוברים, המאפשרות ניתוח פונקציונלי של גנים בעלי עניין באמצעות השתקת RNA באמצעות הפרעת RNA (RNAi) או נוקאאוט גנים באמצעות עריכת גנום CRISPR/Cas9.
Abstract
צרעת התכשיטים, נסוניה ויטריפניס, הפכה למערכת מודל יעילה לחקר אפיגנטיקה של קביעת מין haplo-diploid, ביולוגיה של כרומוזום B, אינטראקציות מארח סימביונט, דגימה, סינתזת ארס. למרות הזמינות של מספר כלים מולקולריים, כולל CRISPR /Cas9, מחקרים גנטיים תפקודיים עדיין מוגבלים באורגניזם זה. המגבלה העיקרית של יישום טכנולוגיית CRISPR/Cas9 ב- N. vitripennis נובעת מהאתגרים של מיקרו-אינג'ים עובריים. זריקות של עוברים קשות במיוחד באורגניזם זה ובכלל בצרעות טפיליות רבות, בשל גודל עובר קטן והדרישה של גולם מארח להתפתחות עוברית. כדי להתמודד עם אתגרים אלה, Cas9 ribonucleoprotein משלוח מורכב לתוך השחלות הנשיות על ידי הזרקת מבוגרים, ולא microinjection עוברי, היה אופטימיזציה, וכתוצאה מכך הן עריכות נבט סומטי תורשה. הליכי ההזרקה היו אופטימיזציה של גורים וצרעות נקבה באמצעות בקרת ReMOT (טרנסדוקציה השחלות בתיווך קולטן של מטען) או BAPC (קפסולות פפטיד אמפיפיליות מסועפות). שיטות אלה מוצגות כאלטרנטיבות יעילות להזרקת עוברים, המאפשרות מוטציות חיידקים ספציפיות לאתר ותורמיות.
Introduction
CRISPR / Cas9 עריכת גנים היא טכנולוגיה רבת עוצמה למחקרים גנטיים תפקודיים, במיוחד באורגניזמים מודל עולה רבים כגון צלופת התכשיט, Nasonia vitripennis. קלות ההתרבות והזמינות של גנום שלם הופכים את צלופת התכשיט למערכת ניסיונית חשובה להבהרת המנגנונים המולקולריים של תהליכים ביולוגיים שונים. לדוגמה, N. vitripennis שימש לאחרונה כדי לפענח את הבסיס האפיגנטי של מערכת קביעת מין haplodiploid1,2, הביולוגיה של כרומוזומי B3,4,5,6, ואת הבסיס הגנטי עבור ויסות ביולוגי ועונתי7,8. חלק מהתכונות שהופכות N. vitripennis נוח לעבוד עם כוללים זמן הדור הקצר (~ 2 שבועות ב 25 °C (69 °F), שיעורי רבייה גבוהים, הפרדת מין קלה בשלב pupal, ואת היכולת diapause ולאחסן זנים ב 4 °C (69 °F). מחזור החיים מתחיל עם צרעות נקבה טפילים הגומות של blowfly, סרקופגה bullata. דרך הביצית שלהם, הנקבות מטילות עד 50 ביצים במקרה הפופאלי של הזיוף. ביצים מתפתחות לזחלים הניזונים מגולם S. bullata, ממשיכים להתפתח במהלך הימים הקרובים, ולאחר מכן גור, ואחריו eclosion למבוגרים והופעתו מן puparium המארח9.
כלים מולקולריים לביצוע מחקרים גנטיים תפקודיים ב- N. vitripennis, כגון הפרעות RNA (RNAi)10 ו- CRISPR/Cas911,12, זמינים, אך מוגבלים, בעיקר בשל קשיים בביצוע microinjections עוברי13. כמו N. vitripennis ביצים דורשים מארח pupal לפיתוח, מניפולציה ביצה הוא מאוד מאתגר. יש לאסוף עוברי במה שלפני הפיצוץ מהגלמים המארחים, לעבור במהירות מיקרו-אינג'פקט, ולהעבירם מיד חזרה למארח לפיתוח13. צעדים אלה דורשים דיוק והכשרה מיוחדת כדי למנוע פגיעה בעוברים microinjected או המארחים pupal13. יתר על כן, הביצים קטנות מאוד ושבירות, במיוחד לאחר microinjections, עם ציטופלסמה צמיגה מאוד גורם סתימת מתמשך של מחט הזרקת13. תכונות אלה הופכות את המיקרו-אינג'ים העובריים למאתגרים במיוחד, ודורשים מפעילים מיומנים וציוד מיוחד הנעדר ברוב מעבדות N. vitripennis.
אופטימיזציה של שיטות הזרקה חלופיות לאספקת ריאגנטים CRISPR יתרום לאיחוד של N. vitripennis כאורגניזם מודל. המניפולציה של גולם ומבוגרים היא פחות מאתגרת מאשר מניפולציה עוברים והוא יכול להתבצע עם הגדרת הזרקה בסיסית. כאן מתוארים שני פרוטוקולים להזרקת גלמים ומבוגרים: האחד כולל ציוד מיוחד לזריקות, והשני כולל שימוש במכלול צינור שאיפה המצויד במחט נימי זכוכית. השימוש בצינור שאיפה מתאים במיוחד למעבדות שאין להן גישה לציוד מיוחד למיקרו-אינג'ים של עוברים. זריקות יעילות של שלבים התפתחותיים שונים של N. vitripennis, כולל גולים לבנים או שחורים וצעות למבוגרים, הם הפגינו. צרעות בשלב הגומה הלבנה מתאימות במיוחד לניסויי הפלה בתיווך RNAi. למרות RNAi ב Nasonia תואר לראשונה על ידי לינץ 'ו Desplan בשנת 200610, אין הליך חזותי זמין עבור איך זריקות RNAi מבוצעים. RNAi שימש לאחרונה כדי לגלות את הגן haploidizer של PSR כרומוזום B (יחס מין אבהי)3 וללמוד את המעורבות של גן השעון, נקודה, במקצבים ביולוגיים N. vitripennis 7.
ניתן להשתמש בגולם שחור ובצרעות למבוגרים כדי לגרום לעריכת גנים של נבטים CRISPR/Cas9 באמצעות ReMOT Control (התמרת השחלות בתיווך קולטן של מטען) ופרוטוקולי BAPC (כמוסות פפטיד אמפיפיליות מסועפות). שתי שיטות אלה משלוח השחלות תוארו לאחרונה להיות יעיל Nasonia ליצירת מוטציות נבט בגן היעד, cinnabar7,12. כאן, פרוטוקול פשוט מסופק עבור זריקות כולל הליך חזותי של מתודולוגיה צעד אחר צעד עבור זריקות ומבוגרים כאחד שניתן להשתמש בהם כדי ליצור מחקרים גנטיים תפקודיים Nasonia וסביר צרעות טפיליות אחרות, ללא צורך בציוד מיוחד ועקיפת microinjections עוברי.
Protocol
1. גידול נסוניה
- הגדר ~ 20 נקבות מזווגות באופן ייחודי במבחנות זכוכית קטנות המחוברות מכותנה.
הערה: כדי להפחית את שטח גידול, 10 x 85 ס"מ, 4 צינורות מ"ל הם אופטימליים. הנקבות נבדלות בקלות מהזכרים בגלל הכנפיים הגדולות יותר ונוכחותו של הביוביפוסטור(איור 1A). פרוטוקולים מפורטים לגידול N. vitripennis ניתן למצוא גם בספרות אחרת13,14,15.- הוסף שני מארחי S. bullata לכל צינור, ולשמור על הצרעות ב 25 ± 1 °C (60 °F) ו 30% לחות יחסית, עם מחזור 12:12 כהה בהיר במשך 2-3 ימים.
הערה: צרעות ניתן לשמור בטמפרטורה נמוכה יותר או בטמפרטורת החדר; עם זאת, הפיתוח יואט.
- הוסף שני מארחי S. bullata לכל צינור, ולשמור על הצרעות ב 25 ± 1 °C (60 °F) ו 30% לחות יחסית, עם מחזור 12:12 כהה בהיר במשך 2-3 ימים.
- לאחר 2-3 ימים, בעזרת מברשת צבע עדינה, להסיר בעדינות את הנקבות, כדי למנוע oviposition מתמשך אסינכרוני בהתפתחות צאצאים.
הערה: ניתן לארח מחדש או לאחסן נקבות שהוסרו ב-5°C למשך חודש.- שמור על המארח טפילי ב 25 °C (69 °F) ו 30% לחות יחסית, עם מחזור 12:12 כהה בהיר במשך 7 ימים אם שלב ההזרקה הרצוי דורש גלפה לבנה; במשך 13 ימים אם השלב ההתפתחותי הנדרש הוא גולם שחור; או 14 ימים למבוגרים צעירים שזה עתה יצאו.
הערה: ניתן גם לאחסן גלפים צהובים ושחורים ב-5 מעלות צלזיוס למשך שבוע. אחסון ארוך יותר יגדיל את תדירות הדיפאוזה בזחלים עבור הדור הבא, מה שהופך את ההקרנה שלאחר ההזרקה והקמת קווי מוטנטים לקשה יותר. - סדקו את הפופאריום המארח עם מחט מנתחת כדי לשחזר את גולם N. vitripennis ומבוגרים בשלב הרצוי(איור 1A).
הערה: עבור זריקות בגיל מבוגר מסוים או לאיסוף נקבות בתולה, מומלץ להסיר את הגומות הכהות ביום 13 מהמארח, להיפרד על ידי מין, ולאסוף מבוגרים לאחר הופעתה.
- שמור על המארח טפילי ב 25 °C (69 °F) ו 30% לחות יחסית, עם מחזור 12:12 כהה בהיר במשך 7 ימים אם שלב ההזרקה הרצוי דורש גלפה לבנה; במשך 13 ימים אם השלב ההתפתחותי הנדרש הוא גולם שחור; או 14 ימים למבוגרים צעירים שזה עתה יצאו.
2. יישור של גלמי לבן ושחור
- הכן שקופית זכוכית על-ידי החלת קו של דבק בית הספר במרכז. מורחים את הדבק עם מחט מנתחת כדי להשיג שכבה עבה (איור 1B), אשר ישמש כדי ליישר את הגומות. תן את הדבק יבש ~ 2 דקות לפני העברת גלם.
הערה: אל תגזים את הדבק, אחרת גלם לא יהיה מחובר כראוי לשקופית יחליק במהלך הזריקות. - תחת מיקרוסקופ מנתח, באמצעות מחט מנתחת, להחיל דבק על החלק האחורי של הראש של גלם.
- חבר את הגום לשכבת הדבק בשקופית כאשר בטנו פונה כלפי מעלה. ישר 20-30 גולם זה לצד זה בשקופית (איור 1C).
הערה: הימנע מנגיעה בבטן עם הדבק, ולהימנע מהשקעת הגומי בדבק; אחרת, המבוגרים לא יוכלו לצאת. - מניחים את המגלשה עם גלם בצלחת פטרי לתת את הדבק יבש במשך ~ 10 דקות. לפני תחילת הזריקות, לבדוק את הדבקות של גלם לדבק על ידי דחיפת אותם בעדינות עם המחט מנתח. אם רוב הגומים משוחררים, הכינו שקופית חדשה. לחלופין, להסיר את כל הגומי כי הם רופף, ולהמשיך להזריק אלה המחוברים כראוי לשקופית.
3. הכנת מחט
- לטעון צינור זכוכית נימי אחד לתוך מושך מחט, ולמשוך מחטים בעקבות הוראות היצרן.
הערה: P-1000 חוט פלטינה מחט מושך נימי זכוכית אלומיניום סיליקט משמשים הדגמה זו. מדריך הפעולה עבור מכשיר זה (ראה טבלה של חומרים)מסביר כיצד לטעון כראוי צינורות זכוכית נימי ולהגדיר תוכניות על מכשיר זה. השתמש בפרמטרים הבאים (חום: 536; משוך: 80; Vel: 100; עיכוב: 70) על נימי זכוכית אלומיניום סיליקט להזריק גלמי צהוב, גלמי שחור, ומבוגרים.
בנוסף, P-2000 מחט פולר שימש להכנת מחטי קוורץ בעקבות הפרמטרים (חום: 805; משיכה: 145; Vel: 50; עיכוב: 145). המדריך מספק הוראות לטעינת צינורות קוורץ נימי והתקנת תוכניות במכשיר זה. בהיעדר מושך, זכוכית נימי להתאמה אישית זמינה. - טען את המחט עם 5 μL של תערובת ההזרקה (מוכן מראש בעקבות פרוטוקולים קודמים עבור RNAi10 או CRISPR / Cas9 ריבונוקלאופרוטאין12 (RNP) זריקות N. vitripennis) באמצעות טיפים פיפטה microloader.
הערה: במהלך ההדגמה, המחט עמוסה RNA דו גדילי (dsRNA) בשילוב עם צבע אדום (ראה טבלה של חומרים)להזרקה של גלמי במה לבנה עם BAPC-Cas9-sgRNA להזרקה של צרעות גלמים שחורים ומבוגרים. ריאגנטים אלה יתמקדו בגן הסינבאר. צרעות כי הם הפילו בהצלחה / החוצה יראה עיניים אדומות במקום עיניים חומות סוג פראי. - פתחו את המחט והחליקו את הקצה על משטח העשוי משתי שקופיות חופפות (איור 1D). לחלופין, פתח את קצה המחט עם זוג מלקחיים עדינים כדי ליצור קצה חד או על ידי חודר לאט את בית החזה או הבטן של הצרעה.
4. הזרקת פופל עם פמטוג'ט
- מקם את השקופית עם הגומה המיושרת תחת מיקרוסקופ מנתח. הכנס את המחט לתוך צינור ההזרקה של femtojet ולהדק את ראש האחיזה.
- כשמסתכלים על המחט מתחת למיקרוסקופ, מפעילים את הפמטוג'ט ומגדירים פרמטרים של הזרקת מחשב ופיי על ידי סיבוב הידיות הסיבוביות.
הערה: ערך מחשב של 600 hPa מומלץ עבור זרימה רציפה של הנוזל. ערך המחשב תלוי בפתיחת המחט. עבור מחטים שהוכנו באמצעות הפרמטרים שצוינו P-1000 מחט מושך, ערכי מחשב בין 500 hPa ו 700 hPa לייצר זרימה מתמדת. אם נדרשים ערכים נמוכים יותר של מחשב, הדבר מצביע על כך שהפתח עשוי להיות גדול מדי ועלול לגרום נזק לחרקים, בעוד שערכים גבוהים יותר מצביעים על כך שהמחט עדיין סגורה, או שהפתח קטן מדי. - הכנס בזהירות את המחט בין 2 ל-3 מקטעי הבטן הנראים לעין בזווית אנכית של כ-30°(איור 1E). להזריק עם זרימה רציפה עד הבטן כולה הופך ורוד במקרה של גולם בשלב לבן, או עד הבטן עולה בגודל במקרה של גולם שחור. להפסיק להזריק כאשר ברור כי הבטן לא יכול לקחת עוד נוזלים, או כאשר הנוזל מתחיל לזרום מהגוף. עבור בזהירות אל הגום הבא וחזור על שלבים אלה.
הערה: הימנע מנגיעה ופגיעה ovipositor עם המחט במהלך ההזרקה. - מעבירים את המגלשה עם הגומי המוזרק לצלחת פטרי המכילה מגבת נייר ספוגה במים שעברו דהיונים לשמירה על לחות. מכסים את המנה במכסה שלה, ומניחים אותה על 25 מעלות צלזיוס עד הופעתה של צרעה(איור 1F).
5. הזרקת פופל עם צינור שאיפה
- לחשב את כמות תערובת ההזרקה באמצעות הגורם: 4 גולם מוזרק/1 פתרון μL.
הערה: זריקה טיפוסית של 20-30 גלמים דורשת ~ 5-8 μL של ריבונוקלאופרוטאין (RNP) תערובת מורכבת-סאפונין או RNP עם BAPC12. - יישרו את הגומי, כפי שהוצע בסעיף 2, והניחו שקופית אחת עם הגומה המיושרת תחת מיקרוסקופ מנתח(איור 1E).
- קח את אחת המחטים נימי לשבור את הקצה בין שתי שקופיות זכוכית, כפי שצוין בשלב 3.4 (איור 1D). ודאו שקצה המחט פתוח מספיק כדי לאפשר לפתרון ההזרקה לצאת החוצה על ידי ניפוח אוויר בפה, אך לא פתוח מדי כדי למנוע איבוד נוזלים ופגיעה בשלמות(איור 1E).
הערה: שלב זה הוא קריטי כי המשתמש ישתמש באוויר מהפה כדי לדחוף את תערובת ההזרקה לתוך hemolymph חרקים. עדיף לתרגל כדי לברר איזה סוג של צמצם מחט הוא אופטימלי עבור הקרביים של תערובת פתרון מסוים. חמש קבוצות של זריקות של 20 גולמים לכל קבוצה עשוי להיות מספיק כדי להתרגל למערכת הזרקת הפה. - לטעון מחט אחת עם פתרון ריבונוקלאופרוטאין12 באמצעות קצה microloading, ולהכניס את המחט לתוך חבילת המחבר של הרכבת צינור השואף.
הערה: במהלך ההפגנה, המחט עמוסה BAPC-Cas9-sgRNA מיקוד הגן נסוניה cinnabar 12. - הכנס בזהירות את המחט בין 2 ל-3 מקטעי הבטן הנראים לעין בזווית אנכית של כ-30°(איור 1E). להזריק עם זרימה רציפה עד הבטן כולה הופך ורוד במקרה של גולם בשלב לבן או עד הבטן מגדילה את גודל במקרה של גולם שחור. להפסיק להזריק כאשר ברור כי הבטן לא יכול לקחת עוד נוזלים או כאשר הנוזל מתחיל לזרום מהגוף. עבור בזהירות אל הגום הבא וחזור על שלבים אלה
הערה: הימנע מנגיעה ופגיעה ovipositor עם המחט במהלך ההזרקה. - מעבירים את המגלשה עם הגומי המוזרק לצלחת פטרי המכילה מגבת נייר ספוגה במים שעברו דהיונים לשמירה על לחות. מכסים את המנה במכסה ומניחים אותה על 25 מעלות צלזיוס עד להופעתה של צרעה(איור 1F).
6. הזרקת מבוגרים עם צינור שאיפה
- להכנת מבוגרים, קבוצות נפרדות של 20 נקבות בתולה במבחנה קטנה ונקייה עם מכחול דק. מניחים את הצינור על הקרח במשך 5 דקות עד שהנקבות מורדמת. לחלופין, ניתן לרופד ולהזריק נקבות באמצעות CO2.
הערה: קרח עדיף כמו הרדמה כמו צרעות מבוגרים הם עמידים קר להתאושש בקלות לאחר הזריקות. נקבות יכולות לקחת נוזל מוזרק יותר מאשר גולם: 1 μL של פתרון יכול לשמש שלוש נקבות במקום ארבעה גולמים. הכן אמצעי אחסון בהתאם. - הכינו דלי קרח, מניחים מגלשת זכוכית אחת על הקרח. יישר את הנקבות זו לצד זו בשקופית הקרה כאשר הבטן פונה כלפי מעלה (איור 1E) תחת טווח ניתוח.
- לטעון מחט אחת עם פתרון ריבונוקלאופרוטאין12 באמצעות קצה microloading, ולהכניס את המחט לתוך חבילת המחבר של הרכבת צינור השואף. תמיכה הנקבות מהצד הנגדי עם מחטים ניתוח קהה תוך הזרקת לאט לתוך הבטן מהצד השני. הימנע מנגיעה ביציפוסיטור, הדבר יפגע קשות במבנה הרבייה הקריטי הזה (איור 1E).
הערה: כל כיוון מקובל, בהתאם להעדפת האופרטור. - הכנס בזהירות את המחט בין 2 ל-3 מקטעי הבטן הנראים לעין בזווית אנכית של כ-30°(איור 1E). להזריק את הפתרון לתוך הבטן הנשית, לעצור כאשר אין יותר נוזל יכול להיכנס, או כאשר דליפה של פתרון עודף נצפתה. עבור בזהירות לצפצה הבאה וחזור על שלבים אלה
הערה: להזריק לאט, משאיר את המחט בתוך הבטן במשך כ 3 שניות לפני הסרתו לאט מאוד. זה יעזור להתאים את הלחץ הנוזלי הפנימי ולמנוע דליפת פתרון מאתר ההזרקה לאחר הסרת מחט. - בסיום, מעבירים בעדינות נקבות מוזרקות בודדות לצינור חדש עם מארח אחד באמצעות מברשת צבע. השאירו להתאושש בטמפרטורת החדר כ 1 שעות, המאשר הישרדות, ולאחר מכן להחזיר את הצינורות לחממה גידול.
הערה: במהלך ההפגנה, המחט עמוסה BAPC-Cas9-sgRNA מיקוד הגן נסוניה cinnabar 12.
7. טיפול לאחר הזרקה והקרנת מוטנטים
- לאחר הרחקת מבוגרים מהגומה המוזרקת, הניחו צרעות בודדות בצינור זכוכית המחובר מכותנה והכניסו מארח S. bullata אחד(איור 1G). לעומת זאת, המקום הזריק נקבות בצינורות בודדים עם מארחים מיד לאחר ההזרקה.
- לניסויי נוקאאוט CRISPR/Cas9, אפשרו לנקבות לשתק את המארחים ליום אחד, ולהחליף את המארח בכל יום במשך שלושה ימים רצופים.
הערה: בשל מערכת קביעת מין haplodiploid ב N. vitripennis16, נקבות בתולה ייצרו broods זכר haploid, אשר מקל על גילוי מוטציות. להפלה באמצעות RNAi של גנים ספציפיים לגברים, אנשים מוזרקים יכולים להיות מזדווגים באופן ייחודי עם אנשים מסוג פראי מותר טפיל מארחים. השתמש במחשב מארח אחד ביום והחלף את המחשבים המארחים בהתבסס על ההתקנה הניסיונית. - מניחים את המארחים טפילי ב 25 מעלות צלזיוס עד הופעתה של צאצאי זכר G0 (במשך ~ 13-14 ימים).
- תחת מיקרוסקופ מנתח, זכרי מסך G0 עבור פנוטיפים שעברו מוטציה. גן הסינאבר אחראי לפיגמנטציה של העיניים12: צרעות עם עיניים חומות הן מסוג פראי, וצרות עם עיניים אדומות בוהקות או וריאציות בין עיניים אדומות לחומות הן מוטציות(איור 1H).
8. לאחר הזרקה צלבים וגידול
- מניחים את כל זכרי G0 המוטנטים בעיניים אדומות (הגן cinnabar12משובש פנוטיפית) עם נקבות בתולות מסוג בר למשך 1-2 ימים(איור 2A).
הערה: אם הגן המשובש אינו מעניק פנוטיפ גלוי, תגובת שרשרת פולימראז (PCR) ואחריה רצף של גן היעד נדרשת כדי לזהות את בעלי החיים המוטנטים. לפני קבלת ה-DNA מזכרים G0 עבור PCR, זה יהיה אידיאלי להזדווג איתם עם נקבות בתולה סוג פראי. לחלופין, יש לחלץ דנ"א מרגל של זכר G0 כדי לזהות מוטנטים, ולהזדווג רק עם מוטציות מאומתות. - הוסף שני מארחי S. bullata לנקבה, ולאפשר oviposit ב 25 °C (69 °F) ו 30% לחות יחסית עם מחזור 12:12 כהה בהיר. החלף את המארחים כל 2-3 ימים.
- אחסן מארחים טפיליים ב 25 °C (60 °F) ו 30% לחות יחסית, עם מחזור 12:12 כהה בהיר במשך ~ 10 ימים.
- לאחר ~ 10 ימים, לפצח לפתוח את המארח טפיל עם מחט לנתח, ולהסיר כל גולם N. vitripennis מהמארח.
- בעזרת מברשת צבע עדינה, בחרו גולם נשי (איור 1A).
הערה: הנקבות הן דיפלואידיות והטרוזיגניות, ולכן צבע העיניים יהיה פראי.
- מניחים 15-20 גלמים נקבה בצינורות זכוכית ב 25 מעלות צלזיוס עד הופעתה. לאחר הופעתה, להוסיף ~ 20 S. bullata המארחים ולתת את הנקבות G1 בתולה טפיל המארחים במשך 2-3 ימים.
הערה: נקבות אלה ייצרו 50% זכרים מוטנטים G2.- יש לאחסן מארחים טפיליים ב-25°C ו-30% לחות יחסית, עם מחזור של 12:12 בהיר-כהה עד להופעת זכר G2.
- מניחים את גלמי G1 הנותרים ב 5 מעלות צלזיוס במשך 8-10 ימים. לאחר תקופה זו, הסר אותם והנח אותם ב 25 °C (70 °F) ו 30% לחות יחסית, עם מחזור 12:12 כהה בהיר עד הופעתה (איור 2A).
- לאחר הופעתם של זכרי G2 בשלב 8.3.1, מסך לנוכחות של פנוטיפ מוטציה עיניים אדומות. בעזרת מברשת צבע עדינה, נפרדים זכרים אדומי עיניים מזכרים מסוג פראי.
הערה: נוכחותן של צרעות אדומות עיניים בדור זה (G2, איור 2A)מצביעה על כך שעריכת גנים התרחשה בחיידק, ושהמוטציה היא תורשתית. - הניחו זכרים אדומי עיניים עם נקבות ה-G1 שהתגלו לאחרונה בשלב 8.3.2(איור 2A),ותנו להם להזדווג במשך יום-יומיים. הוסף 2 מארחי בולטה S. לנקבה, ומניחים אותם ב 25 °C (60 °F) ו 30% לחות יחסית עם מחזור 12:12 כהה בהיר במשך 10-11 ימים.
- לאחר 10-11 ימים, פתחו את המארח הטפילי במחט מנתחת, והוציאו כל גולם של N. vitripennis מהמארח(איור 2A).
- בעזרת מברשת צבע עדינה, צרעות נפרדות אדומות עיניים (זכרים ונקבות) מסוג פראי (איור 1H). ממשיכים לגדל צרעות אדומות עיניים יחד בצינורות זכוכית, ואינם מתערבבים עם צרעות מסוג בר.
הערה: בשלב זה (G3, איור 2A), זכרים הפלואידים ונקבות דיפלואידיות נושאים ומראים פנוטיפים למוטציות הסינבאר. אם הגן המושפע מקודד פנוטיפ בלתי נראה, לחצות זכר G0 באופן ייחודי עם נקבה אחת סוג פראי במשך ~ 1 יום. לאחר מכן, להסיר את הזכר עבור אפיון מולקולרי של המוטציה על ידי PCR רצף, ולתת לנקבה טפילים מארח. המשיכו את תוכנית המעבר רק עם צאצאיו של זכר מוטנט מאושר(איור 2B). אם המטרה היא הפלה על ידי RNAi של גן מועמד, לבצע את הבדיקה התפקודית הרצויה (כגון קטלניות, סטריליות, או בדיקת אינדוקציה diapause3,7) ישירות באמצעות אנשים מוזרקים עם dsRNA. מכיוון ש-RNAi הוא ארעי, לא ניתן ליצור מושבה עם הפנוטיפ הרצוי (איור 2C)3,7.

איור 1: ציר זמן למיקרו-injection של סופאל ומבוגרת של נסוניה ויטריפניס. (A) גלמים לבנים (עליונים) ושחורים (תחתונים) נאספים, (B-C) מיושרים ומודבקים לשקופית זכוכית להזרקה. (D)מחט נימי מוכן ונפתח, מחליק אותו על שתי שקופיות חופפות. (E)מחט מחוברת גם Femtojet (למעלה) או צינור שאיפה (למטה) עבור זריקות. (ו)הגומי המוזרק על המגלשה מועברים לצלחת פטרי עם רקמה רטובה בתחתית כדי לשמור על לחות. עם הופעתן,(G)הנקבות ממוקמות באופן ייחודי בצינורות זכוכית קטנים ומורשים לביזיפוסיט על גלם סרקופגה. (ח)הקרנת הצאצאים לגילוי מוטנטים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
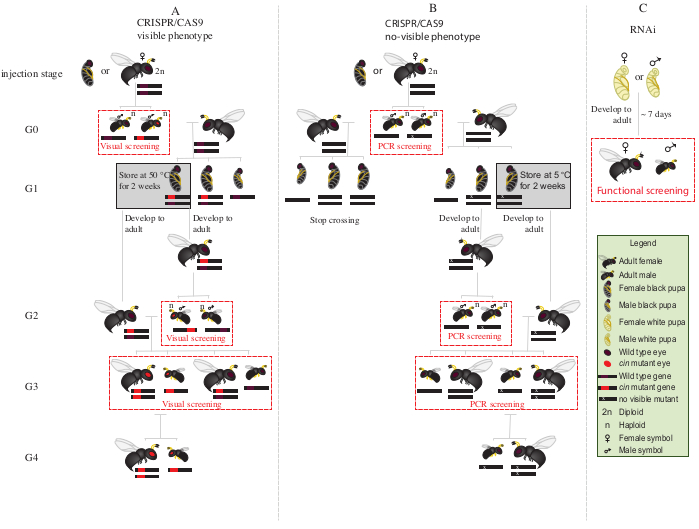
איור 2: ערכת חצייה לאחר ההזרקה. ייצוג סכמטי של הליך ערכת חצייה במקרה של עריכת גנים בתיווך CRISPR/Cas9 של גנים (A) שגורמים לפניוטיפ גלוי ו- (B) שאינם מעניקים פנוטיפ גלוי. (ג) ייצוג סכמטי של הליך סינון RNAi. קיצורים: cin = סינבאר; PCR = תגובת שרשרת פולימראז. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
נייר זה מציג שתי שיטות קלות עבור pupal ו microinjection למבוגרים, או באמצעות femtojet או צינור שאיפה. השיטה הראשונה מאפשרת הזרקה מדויקת יותר של נוזל, אשר חשוב עבור עקביות RNAi, ואילו השני מאפשר הזרקה של כמויות גדולות יותר של נוזל לתוך גולם Nasonia או מבוגרים.
Discussion
עם השימוש המוגבר האחרון של Nasonia vitripennis כאורגניזם מודל לשאלות ביולוגיות שונות2,3,7,17, יש צורך לפתח ולייעל שיטות הזרקה כדי לאפשר פרוטוקול פשוט ויעיל לניתוח תפקודי של N. vitripennis גנים. השיטות הנוכחיות הכרוכות במיקרו-א?...
Disclosures
JLR ו- DCR הגישו בקשה להגנה זמנית על פטנטים בטכנולוגיית ReMOT Control. O.S.A. הוא מייסד אגראג'ין בע"מ, בעל עניין במניות, ומשמש בוועדה המדעית המייעצת של החברה. כל הסופרים האחרים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי קרנות סטארט-אפ UCSD המופנות למענק O.S.A. ו- NSF / BIO 1645331 לג'יי.אל.אר.
Materials
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
References
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved