Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Инъекции куколки и взрослых для редактирования генов РНКи и CRISPR в Nasonia vitripennis
В этой статье
Резюме
Здесь мы описываем методы эффективных инъекций куколок и взрослых в Nasonia vitripennis как доступные альтернативы микроинъекции эмбриона, позволяющие проводить функциональный анализ генов, представляющих интерес, с использованием либо ГЛУШЕНИЯ РНК через РНК-интерференцию (РНКи), либо нокаута гена с помощью редактирования генома CRISPR / Cas9.
Аннотация
Ювелирная сова, Nasonia vitripennis,стала эффективной модельной системой для изучения эпигенетики гапло-диплоидного определения пола, биологии В-хромосомы, взаимодействий хозяин-симбионт, видообразования и синтеза яда. Несмотря на наличие нескольких молекулярных инструментов, включая CRISPR / Cas9, функциональные генетические исследования все еще ограничены в этом организме. Основное ограничение применения технологии CRISPR/Cas9 в N. vitripennis связано с проблемами эмбриональных микроинъекций. Инъекции эмбрионов особенно сложны в этом организме и в целом у многих паразитоидных ос из-за небольшого размера эмбриона и потребности куколки хозяина для эмбрионального развития. Для решения этих проблем была оптимизирована доставка комплекса рибонуклеопротеинов Cas9 в женские яичники путем инъекции взрослым, а не эмбриональной микроинъекции, что привело как к соматическим, так и к наследственным изменениям зародышевой линии. Процедуры инъекций были оптимизированы для куколок и самок ос с использованием ReMOT Control (рецепторно-опосредованная яичниковая трансдукция груза) или BAPC (разветвленные амфифильные пептидные капсулы). Показано, что эти методы являются эффективными альтернативами инъекции эмбриона, позволяющими создавать специфические для сайта и на наследственные мутации зародышевой линии.
Введение
Редактирование генов CRISPR/Cas9 является мощной технологией для функциональных генетических исследований, особенно во многих растущих модельных организмах, таких как ювелирная ось, Nasonia vitripennis. Легкость выращивания и наличие полного генома делает ювелирную ось важной экспериментальной системой для выяснения молекулярных механизмов различных биологических процессов. Например, N. vitripennis недавно был использован для разгадки эпигенетических основ гаплодиплоидной системы определения пола1,2,биологии В-хромосом3,4,5,6и генетической основы циркадной и сезонной регуляции7,8. Некоторые из особенностей, которые делают N. vitripennis поддается работе, включают короткое время генерации (~ 2 недели при 25 ° C), высокие темпы размножения, легкое разделение пола на стадии куколки и способность к диапаузе и хранению штаммов при 4 ° C. Жизненный цикл начинается с того, что самки ос паразитируют на куколках летуча, Sarcophaga bullata. Через свой яйцеклад самки откладывают до 50 яиц в случае куколки летухи. Яйца развиваются в личинок, которые питаются куколками S. bullata, продолжают развиваться в течение следующих нескольких дней, а затем окукливаются, после чего происходит взрослая эклозия и появление из хозяина puparium9.
Молекулярные инструменты для выполнения функциональных генетических исследований у N. vitripennis,такие как РНК-интерференция(РНКи) 10 и CRISPR/Cas911,12,имеются, но ограничены, в первую очередь из-за трудностей в выполнении эмбриональных микроинъекций13. Поскольку яйца N. vitripennis требуют хозяина куколки для развития, манипуляции с яйцами очень сложны. Эмбрионы предструстодельной стадии должны быть собраны из куколок вмастерской летучки, быстро микроинъектированы и немедленно перенесены обратно хозяину для развития13. Эти шаги требуют точности и специализированной подготовки, чтобы избежать повреждения микроинъекций эмбрионов или хозяев куколки13. Кроме того, яйца очень маленькие и хрупкие, особенно после микроинъекций, с очень вязкой цитоплазмой, вызывающей непрерывное засорение инъекционной иглы13. Эти особенности делают эмбриональные микроинъекции исключительно сложными, требуя высококвалифицированных операторов и специализированного оборудования, которое отсутствует в большинстве лабораторий N. vitripennis.
Оптимизация альтернативных методов впрыска для доставки реагентов CRISPR будет способствовать консолидации N. vitripennis в качестве модельного организма. Манипуляции с куколками и взрослыми особями менее сложны, чем манипулирование эмбрионами, и могут быть выполнены с помощью базовой инъекционной установки. Здесь описаны два протокола для инъекций куколок и взрослых: один включает специализированное оборудование для инъекций, а другой включает использование аспираторной трубки в сборе, оснащенной стеклянной капиллярной иглой. Использование аспираторной трубки особенно подходит для лабораторий, которые не имеют доступа к специализированной технике для микроинъекций эмбрионов. Продемонстрированы эффективные инъекции различных стадий развития N. vitripennis,включая белых или черных куколок и взрослых ос. Осы на стадии белой куколки особенно подходят для экспериментов с нокдаунами, опосредованных РНКи. Хотя РНКи в Насонии был впервые описан Линчем и Деспаном в 2006году10,нет никакой визуальной процедуры, доступной для того, как выполняются инъекции РНКи. РНКи был недавно использован для открытия гена гаплоидизатора В-хромосомы PSR (Отцовское соотношение полов)3 и для изучения участия часового гена, периода,в биологических ритмах N. vitripennis 7.
Черные куколки и взрослые осы могут быть использованы для индуцирования редактирования генов зародышевой линии CRISPR / Cas9 с использованием протоколов ReMOT Control (Receptor-Mediated Ovary Transduction of Cargo) и BAPC (Branched Amphiphilic Peptide Capsules). Эти два метода доставки яичники были недавно описаны как эффективные в Насонии для генерации мутаций зародышевой линии в гене-мишени, киновари7,12. Здесь для инъекций предусмотрен упрощенный протокол, включающий визуальную процедуру пошаговой методологии как для куколок, так и для взрослых инъекций, которая может быть использована для проведения исследований функциональной генетики в Насонии и, вероятно, у других паразитоидных ос, не требуя специализированного оборудования и обходя эмбриональные микроинъекции.
протокол
1. Выращивание Насонии
- Установите ~ 20 спаренных самок исключительно в небольших стеклянных пробирках, заткнунных хлопком.
ПРИМЕЧАНИЕ: Для уменьшения пространства для выращивания оптимальными являются трубки размером 10 x 85 см, 4 мл. Самок легко отличить от самцов из-за более крупных крыльев и наличия яйцеклада(рисунок 1А). Подробные протоколы выращивания N. vitripennis также можно найти в другой литературе13,14,15.- Добавьте два хозяина S. bullata на трубку и поддерживайте ос при 25 ± 1 ° C и относительной влажности 30% с циклом 12: 12 светло-темный в течение 2-3 дней.
ПРИМЕЧАНИЕ: Осы могут поддерживаться при более низкой температуре или комнатной температуре; однако развитие будет замедлено.
- Добавьте два хозяина S. bullata на трубку и поддерживайте ос при 25 ± 1 ° C и относительной влажности 30% с циклом 12: 12 светло-темный в течение 2-3 дней.
- Через 2-3 дня с помощью мелкодисперсной кисти аккуратно удалить самок, чтобы избежать непрерывной яйцекладки и асинхронности в развитии потомства.
ПРИМЕЧАНИЕ: Удаленные самки могут быть повторно размещены или сохранены при 5 °C в течение месяца.- Поддерживать паразитирующего хозяина при 25 °C и относительной влажности 30% с циклом 12:12 светло-темный в течение 7 дней, если желаемая стадия инъекции требует белых куколок; в течение 13 дней, если требуемой стадией развития является черная куколка; или 14 дней для молодых, недавно появившихся взрослых.
ПРИМЕЧАНИЕ: Желтые и черные куколки также могут храниться при 5 °C в течение одной недели. Более длительное хранение увеличит частоту диапаузы в личинких для следующего поколения, что затруднит постукционный скрининг и создание мутантных линий. - Трещина вскрытия пупариума хозяина рассекающей иглой для восстановления куколок N. vitripennis и взрослых особей на нужной стадии(рисунок 1А).
ПРИМЕЧАНИЕ: Для инъекций в определенном взрослом возрасте или для сбора девственных самок рекомендуется удалить темных куколок на 13-й день у хозяина, отделить по полу и собрать взрослых после появления.
- Поддерживать паразитирующего хозяина при 25 °C и относительной влажности 30% с циклом 12:12 светло-темный в течение 7 дней, если желаемая стадия инъекции требует белых куколок; в течение 13 дней, если требуемой стадией развития является черная куколка; или 14 дней для молодых, недавно появившихся взрослых.
2. Выравнивание белых и черных куколок
- Подготовьте стеклянную горку, нанеся линию школьного клея в центре. Выкладываем клей рассекающей иглой для получения толстого слоя(рисунок 1В),который будет использоваться для выравнивания куколок. Дайте клею высохнуть в течение ~2 мин, прежде чем переносить куколки.
ПРИМЕЧАНИЕ: Не переужайте клей, иначе куколки не будут должным образом прикреплены к слайду и будут скользить во время инъекций. - Под рассекающим микроскопом, используя рассекающую иглу, нанесите клей на заднюю часть головки куколки.
- Прикрепите куколку к клеевом слою на горке животом вверх. Выровнять 20-30 куколок бок о бок на слайде(рисунок 1С).
ПРИМЕЧАНИЕ: Избегайте прикосновения к животу с помощью клея и избегайте погружения куколок в клей; в противном случае взрослые особи не смогут появиться. - Поместите горку с куколками в чашку Петри, чтобы клей высох в течение ~ 10 минут. Перед началом инъекций проверьте прилипание куколок к клею, осторожно толкая их рассекающей иглой. Если большая часть куколок разрыхлена, приготовьте новую горку. Кроме того, удалите все куколки, которые являются свободными, и приступайте к инъекции тех, которые правильно прикреплены к слайду.
3. Подготовка иглы
- Загрузите одну капиллярную стеклянную трубку в съемник иглы и потяните иглы в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: В этой демонстрации используется платиновый съемник иглы нити P-1000 и капилляры алюминиевого силикатного стекла. В руководстве по эксплуатации этого прибора (см. Таблицу материалов)объясняется, как правильно загружать капиллярные стеклянные трубки и настраивать программы на этом приборе. Используйте следующие параметры (Тепло: 536; Тяга: 80; Вел: 100; Задержка: 70) на капилляры силикатного стекла алюминия для инъекции желтых куколок, черных куколок и взрослых особей.
Кроме того, игольчатый съемник П-2000 использовался для приготовления кварцевых игл по параметрам(Теплота: 805; Тяга: 145; Вел: 50; Задержка: 145). В руководстве приведены инструкции по загрузке капиллярных кварцевых трубок и настройке программ в этом приборе. При отсутствии съемника доступно настраиваемое капиллярное стекло. - Загрузите иглу 5 мкл инъекционной смеси (приготовленной заранее в соответствии с предыдущими протоколами для инъекцийРНКи 10 или РИБОНУклеопротеина12 (RNP) CRISPR/Cas9 в N. vitripennis)с помощью наконечников пипеток микрозагрузчика.
ПРИМЕЧАНИЕ: Во время демонстрации иглу нагружают двухцепочечной РНК (дцРНК) в сочетании с красным красителем (см. Таблицу материалов)для инъекций куколок белой стадии и с BAPC-Cas9-sgRNA для инъекций черных куколок ос и взрослых. Эти реагенты будут нацелены на ген киновари. Осы, которые успешно сбиты с ног, будут показывать красные глаза вместо карих глаз дикого типа. - Откройте иглу, скользя наконечником по поверхности, сделанной из двух перекрывающихся слайдов(рисунок 1D). В качестве альтернативы, откройте кончик иглы парой тонких щипцов для создания острого края или медленно прокалывая грудную клетку или брюшко осы.
4. Инъекция пупаля с фемтоджетом
- Поместите слайд с выровненными куколками под рассекающий микроскоп. Вставьте иглу в инъекционную трубку фемтоджета и затяните головку захвата.
- Посмотрев на иглу под микроскопом, включите фемтоджет и настройте параметры инъекции Pc и Pi, вращая поворотные ручки.
ПРИМЕЧАНИЕ: Для непрерывного потока жидкости рекомендуется значение Pc 600 гПа. Значение Pc зависит от отверстия иглы. Для игл, приготовленных с использованием указанных параметров в съемнике иглЫ P-1000, значения Pc между 500 гПа и 700 гПа создают постоянный поток. Если требуются более низкие значения Pc, это указывает на то, что отверстие может быть слишком большим и может повредить насекомых, тогда как более высокие значения указывают на то, что игла все еще закрыта или что отверстие слишком маленькое. - Осторожно вставьте иглу между 2 и 3 видимыми брюшными сегментами с вертикальным углом около 30°(рисунок 1Е). Вводят непрерывным потоком до тех пор, пока все брюшко не станет розовым в случае куколок белой стадии или пока брюшко не увеличится в размерах в случае черных куколок. Прекращайте инъекции, когда становится ясно, что живот не может больше принимать жидкость, или когда жидкость начинает вытекать из организма. Осторожно перейдите к следующей куколки и повторите эти шаги.
ПРИМЕЧАНИЕ: Избегайте прикосновения и повреждения яйцеклада иглой во время инъекции. - Переложите слайд с введенными куколками в чашку Петри, содержащую бумажное полотенце, пропитанное деионизированной водой для поддержания влажности. Накройте блюдо крышкой и поместите при 25 °C до появления ось(рисунок 1F).
5. Инъекция куколки с трубкой аспиратора
- Рассчитайте количество инъекционной смеси, используя коэффициент: 4 куколки в инъекционном виде/1 мкл раствора.
ПРИМЕЧАНИЕ: Типичная инъекция 20-30 куколок требует ~ 5-8 мкл комплекса рибонуклеопротеина (RNP) - сапониновой смеси или RNP с BAPC12. - Выровняйте куколки, как предложено в разделе 2, и поместите один слайд с выровненными куколками под рассекающим микроскопом(рисунок 1E).
- Возьмите одну из капиллярных игл и разбейте наконечник между двумя стеклянными слайдами, как показано на шаге 3.4(рисунок 1D). Убедитесь, что наконечник иглы достаточно открыт, чтобы раствор для инъекции вышел наружу, выдувая воздух ртом, но не слишком открыт, чтобы избежать потери жидкости и повреждения куколок(рисунок 1E).
ПРИМЕЧАНИЕ: Этот шаг имеет решающее значение, потому что пользователь будет использовать воздух изо рта, чтобы протолкнуть инъекционную смесь в гемолимфу насекомого. Лучше попрактиковаться, чтобы выяснить, какой тип игольчатого отверстия является оптимальным для вязкости конкретной смеси раствора. Пяти наборов инъекций по 20 куколок в комплекте может быть достаточно, чтобы привыкнуть к системе инъекций в рот. - Загрузите одну иглу с раствором12 рибонуклеопротеина с помощью микронагрузочного наконечника и вставьте иглу в соединительный пакет аспираторной трубки в сборе.
ПРИМЕЧАНИЕ: Во время демонстрации игла загружается BAPC-Cas9-sgRNA, нацеленной на ген киновари Nasonia 12. - Осторожно вставьте иглу между 2 и 3 видимыми брюшными сегментами с вертикальным углом около 30°(рисунок 1Е). Вводят непрерывным потоком до тех пор, пока все брюшко не станет розовым в случае куколок белой стадии или пока брюшко не увеличится в размерах в случае черных куколок. Прекратите инъекции, когда ясно, что живот не может больше принимать жидкость или когда жидкость начинает вытекать из организма. Осторожно переходите к следующей куколки и повторяйте эти шаги
ПРИМЕЧАНИЕ: Избегайте прикосновения и повреждения яйцеклада иглой во время инъекции. - Переложите слайд с введенными куколками в чашку Петри, содержащую бумажное полотенце, пропитанное деионизированной водой для поддержания влажности. Накройте блюдо крышкой и поместите при 25 °C до появления ось(рисунок 1F).
6. Взрослый инъектор с трубкой аспиратора
- Для приготовления взрослых особей выделяют группы из 20 девственных самок в чистую маленькую пробирку с тонкой кистью. Поместите трубку на лед на 5 минут, пока самки не будут обезболены. В качестве альтернативы, самки могут быть обезболенными и введены с использованием CO2.
ПРИМЕЧАНИЕ: Лед предпочтительнее в качестве анестетика, так как взрослые осы холодоустойчивы и легко восстанавливаются после инъекций. Самки могут потронуть больше вводимой жидкости, чем куколки: 1 мкл раствора можно использовать для трех самок вместо четырех куколок. Подготовьте объемы соответствующим образом. - Подготовьте ведро со льдом, положив одну стеклянную горку поверх льда. Выровняйте самок бок о бок на холодном скольжении брюшками, обращенными вверх(рисунок 1Е)под рассекающим прицелом.
- Загрузите одну иглу с раствором12 рибонуклеопротеина с помощью микронагрузочного наконечника и вставьте иглу в соединительный пакет аспираторной трубки в сборе. Поддерживайте самок с противоположной стороны притупленными рассекающими иглами, медленно вводя в живот с другой стороны. Избегайте прикосновения к яйцекладу, это серьезно повредит эту критическую репродуктивную структуру(рисунок 1Е).
ПРИМЕЧАНИЕ: Любая ориентация приемлема, в зависимости от предпочтений оператора. - Осторожно вставьте иглу между 2 и 3 видимыми брюшными сегментами с вертикальным углом около 30°(рисунок 1Е). Вводят раствор в женский живот, останавливаясь, когда больше жидкости не может попасть, или когда наблюдается вытекание излишков раствора. Осторожно перейдите к следующей wasp и повторите эти шаги
ПРИМЕЧАНИЕ: Вводите медленно, оставляя иглу внутри живота в течение примерно 3 с, прежде чем удалить ее очень медленно. Это поможет отрегулировать внутреннее давление жидкости и избежать утечки раствора из места инъекции после удаления иглы. - Когда закончите, аккуратно перенесите одиночных введенных самок в новую трубку с одним хозяином с помощью кисти. Оставьте восстанавливаться при комнатной температуре примерно на 1 ч, подтвердив выживаемость, а затем верните трубки в инкубатор для выращивания.
ПРИМЕЧАНИЕ: Во время демонстрации игла загружается BAPC-Cas9-sgRNA, нацеленной на ген киновари Nasonia 12.
7. Пост-инъекционный уход и мутантный скрининг
- После эклозии взрослого человека из введенных куколок поместите одиночных ос в стеклянную трубку, закупоренный хлопком, и вставьте одного хозяина S. bullata (рисунок 1G). Напротив, поместите введенных самок в отдельные трубки с хозяевами сразу после инъекции.
- Для нокаут-экспериментов CRISPR / Cas9 позвольте самкам паразитировать на хозяевах в течение одного дня и заменять хозяина каждый день в течение трех последовательных дней.
ПРИМЕЧАНИЕ: Благодаря гаплодиплоидной системе определения пола у N. vitripennis16,девственные самки будут производить гаплоидные мужские выводки, что облегчает обнаружение мутаций. Для нокдауна через РНКи мужских специфических генов введенные особи могут быть единично соединены с особями дикого типа и допущены паразитировать на хозяевах. Используйте один хост в день и заменяйте хосты на основе экспериментальной установки. - Поместите паразитированных хозяев при 25 °C до появления мужского потомства G0 (в течение ~13-14 дней).
- Под рассекающим микроскопом проверяют самцов G0 на наличие мутировавших фенотипов. Ген киноварии отвечает за пигментацию глаз12:осы с карими глазами относятся к дикому типу, а осы с ярко-красными глазами или вариациями между красными и карими глазами являются мутантами(рисунок 1H).
8. Кресты после впрыска и вздымания
- Поместите всех самцов-мутантов G0 с красными глазами (фенотипически нарушенный ген киновари12)с дикими девственными самками на 1-2 дня(рисунок 2A).
ПРИМЕЧАНИЕ: Если нарушенный ген не дает видимого фенотипа, для идентификации мутантных животных требуется полимеразная цепная реакция (ПЦР) с последующим секвенированием гена-мишени. Прежде чем получить ДНК от самцов G0 для ПЦР, было бы идеально спаривать их с дикими девственными самками. В качестве альтернативы, извлеките ДНК из ноги самца G0 для идентификации мутантов и спаривайте только тех, у кого есть проверенные мутации. - Добавьте двух хозяев S. bullata на самку и дайте яйцекладу при 25 °C и относительной влажности 30% с циклом 12:12 светло-темный. Заменяйте хозяев каждые 2-3 дня.
- Храните паразитированных хозяев при 25 ° C и относительной влажности 30% с циклом 12: 12 светло-темный в течение ~ 10 дней.
- Через ~ 10 дней вскрывают паразитирующего хозяина рассекающей иглой и удаляют каждую куколку N. vitripennis из хозяина.
- С помощью мелкодисперсной кисти выберите самок куколок(рисунок 1А).
ПРИМЕЧАНИЕ: Самки диплоидные и гетерозиготные, и, таким образом, цвет глаз будет дикого типа.
- Поместите 15-20 самок куколок в стеклянные трубки при 25 °C до появления. После появления на свет добавьте ~20 S. bullata hosts и позвольте девственным самкам G1 паразитировать на хозяевах в течение 2-3 дней.
ПРИМЕЧАНИЕ: Эти самки будут производить 50% самцов-мутантов G2.- Храните паразитированных хозяев при 25 ° C и относительной влажности 30%, с циклом 12: 12 светло-темный до появления взрослой взрослой особи G2.
- Поместите оставшиеся куколки G1 при 5 °C в течение 8-10 дней. По истечении этого периода удалите их и поместите при температуре 25 °C и относительной влажности 30%, с циклом 12:12 свет-темнота до появления(рисунок 2A).
- После появления самцов G2 на этапе 8.3.1, скрининг на наличие красноглазого мутантного фенотипа. С помощью мелкой кисти отделяйте красноглазых самцов от самцов дикого типа.
ПРИМЕЧАНИЕ: Присутствие красноглазых ос в этом поколении (G2, рисунок 2A)указывает на то, что редактирование генов произошло в зародышевой линии, и что мутация является наследственной. - Поместите красноглазых самцов с самками G1, недавно появившимися на этапе 8.3.2(рисунок 2A),и дайте им спариваться в течение 1-2 дней. Добавьте 2 хозяева S. bullata на самку и поместите их при 25 ° C и относительной влажности 30% с циклом 12: 12 светло-темный в течение 10-11 дней.
- Через 10-11 дней вскрывают паразитирующего хозяина рассекающей иглой, и удаляют из хозяина каждую куколку N. vitripennis (рисунок 2А).
- С помощью мелкоглазой кисти отделяйте красноглазых ос (самцов и самок) от дикого типа(рисунок 1Н). Продолжайте выращивание красноглазых ос вместе в стеклянных трубках и не смешивайте с осами дикого типа.
ПРИМЕЧАНИЕ: На этом этапе (G3, рисунок 2A)гаплоидные самцы и диплоидные самки несут и показывают фенотипы для мутаций киновари. Если пораженный ген кодирует невидимый фенотип, скрестите самца G0 в одиночку с одной самкой дикого типа в течение ~ 1 дня. Затем удалите самца для молекулярной характеристики мутации путем ПЦР и секвенирования, и пусть самка паразитирует на хозяине. Продолжайте схему скрещивания только с потомством подтвержденного самца-мутанта(рисунок 2В). Если целью является нокдаун РНКи гена-кандидата, выполните желаемый функциональный анализ (например, анализ летальности, стерильности или диапаузы3,7)непосредственно с использованием лиц, которым вводили дцРНК. Поскольку РНКи является переходным, невозможно создать колонию с желаемым фенотипом(Рисунок 2С)3,7.

Рисунок 1:Хронология микроинъекции куколки и взрослой особи Nasonia vitripennis. (A) Самцы и самки белых (сверху) и черных (снизу) куколок собирают,(B-C)выравнивают и приклеивают к стеклянной горке для инъекций. (D) Капиллярную иглу готовят и открывают, скользя по двум перекрывающимся слайдам. (E)Игла прикрепляется либо к Фемтоджету (сверху), либо к трубке аспиратора (снизу) для инъекций. (F)Введенные куколки на слайде переносятся в чашку Петри с влажной тканью на дне для поддержания влажности. При появлении(G)самок помещают отдельно в небольшие стеклянные трубки и дают яйцекладу на куколке саркофага. (H) Скрининг потомства для выявления мутантов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
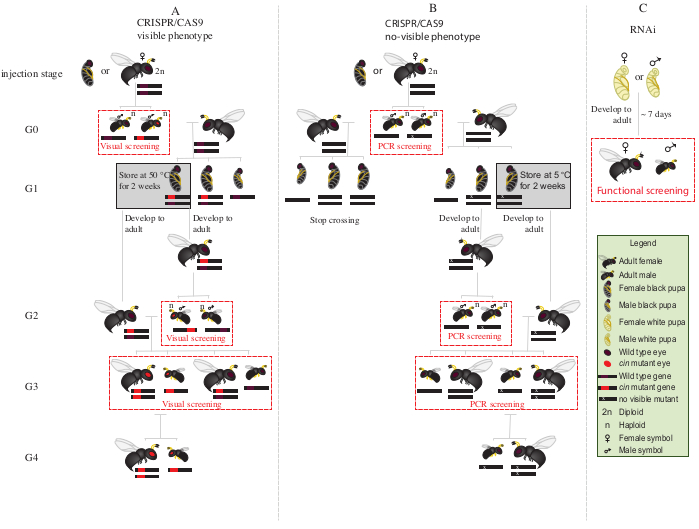
Рисунок 2:Схема скрещивания после инъекции. Схематическое представление процедуры скрещивания схемы в случае CRISPR/Cas9-опосредованного редактирования генов (A), которые индуцируют видимый фенотип и (B), которые не дают видимого фенотипа. (C) Схематическое изображение процедуры скрининга РНКи. Сокращения: цин = киноварь; ПЦР = полимеразная цепная реакция. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
В этой статье представлены два простых метода микроинъекции куколок и взрослых особей, либо с использованием фемтоджетной или аспираторной трубки. Первый способ позволяет более точно впрыскивать жидкость, что важно для консистенции РНКи, тогда как второй позволяет в...
Обсуждение
В связи с недавним увеличением использования Nasonia vitripennis в качестве модельного организма для различных биологических вопросов2,3,7,17возникла необходимость в разработке и оптимизации методов инъекций для обеспеч...
Раскрытие информации
JLR и DCR подали заявку на предварительную патентную охрану по технологии ReMOT Control. O.S.A является основателем Agragene, Inc., имеет долю в акционерном капитале и входит в состав Научно-консультативного совета компании. Все остальные авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была частично поддержана стартовыми фондами UCSD, направленными в O.S.A. и грантом NSF / BIO 1645331 J.L.R.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
Ссылки
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены