Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inyecciones pupales y para adultos para RNAi y edición de genes CRISPR en Nasonia vitripennis
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, se describen los métodos para las inyecciones pupales y adultos eficientes en Nasonia vitripennis como alternativas accesibles a la microinyección embrionaria, lo que permite el análisis funcional de los genes de interés utilizando ya sea arn-silenciamiento a través de la interferencia de ARN (RNAi) o knockout gen a través de CRISPR / Cas9 edición del genoma.
Resumen
La avispa joya, Nasonia vitripennis,se ha convertido en un sistema modelo eficiente para estudiar la epigenética de la determinación del sexo haplo-diploide, la biología del cromosoma B, las interacciones huésped-simbionte, la especiación y la síntesis de veneno. A pesar de la disponibilidad de varias herramientas moleculares, incluyendo CRISPR/Cas9, los estudios genéticos funcionales todavía son limitados en este organismo. La principal limitación de la aplicación de la tecnología CRISPR/Cas9 en N. vitripennis se deriva de los desafíos de las microinyecciones embrionarias. Las inyecciones de embriones son particularmente difíciles en este organismo y en general en muchas avispas parasitoides, debido al pequeño tamaño del embrión y el requisito de una pupa huésped para el desarrollo embrionario. Para abordar estos desafíos, se optimizó la entrega del complejo de ribonucleoproteína Cas9 en los ovarios femeninos por inyección adulta, en lugar de microinyección embrionaria, lo que resultó en ediciones de línea germinal somáticas y heredables. Los procedimientos de inyección se optimizaron en pupas y avispas hembras utilizando ReMOT Control (Receptor-Mediated Ovary Transduction of Cargo) o BAPC (Branched Amphiphilic Peptide Capsules). Estos métodos han demostrado ser alternativas eficaces a la inyección de embriones, lo que permite mutaciones de la línea germinal hereditarias y específicas del sitio.
Introducción
La edición de genes CRISPR/Cas9 es una poderosa tecnología para estudios genéticos funcionales, especialmente en muchos organismos modelo ascendentes como la avispa joya, Nasonia vitripennis. La facilidad de cría y la disponibilidad de un genoma completo hacen de la avispa joya un importante sistema experimental para dilucidar los mecanismos moleculares de diferentes procesos biológicos. Por ejemplo, N. vitripennis se ha utilizado recientemente para desentrañar la base epigenética del sistema de determinación de sexo haplodiploide1,2,la biología de los cromosomas B3,4,5,6,y la base genética para la regulación circadiana y estacional7,8. Algunas de las características que hacen que N. vitripennis sea susceptible de trabajar incluyen un corto tiempo de generación (~ 2 semanas a 25 ° C), altas tasas de reproducción, fácil separación sexual en la etapa pupal y la capacidad de diapausa y almacenar cepas a 4 ° C. El ciclo de vida comienza con las avispas hembras parasitando las pupas de la luciérnga, Sarcophaga bullata. A través de su ovipositor, las hembras ponen hasta 50 huevos en el caso pupal de la 8ra. Los huevos se convierten en larvas que se alimentan de la pupa de S. bullata, continúan desarrollándose durante los próximos días, y luego pupan, seguidos de eclosión adulta y la aparición del pupario huésped9.
Se dispone de herramientas moleculares para realizar estudios genéticos funcionales en N. vitripennis,tales como la interferencia de ARN (ARNi)10 y CRISPR/Cas911,12,pero son limitadas, principalmente debido a las dificultades en la realización de microinyecciones embrionarias13. Como los huevos de N. vitripennis requieren un huésped pupal para el desarrollo, la manipulación de huevos es muy difícil. Los embriones en etapa pre-blastodermo deben ser recolectados de las pupas de la luciérnga del huésped, microinyectados rápidamente y transferidos inmediatamente de vuelta al huésped para su desarrollo13. Estos pasos requieren precisión y entrenamiento especializado para evitar dañar los embriones microinyectados o los hospedadores pupales13. Además, los óvulos son muy pequeños y frágiles, especialmente después de microinyecciones, con un citoplasma muy viscoso que provoca una obstrucción continua de la aguja de inyección13. Estas características hacen que las microinyecciones embrionarias sean excepcionalmente desafiantes, requiriendo operadores altamente capacitados y equipos especializados que están ausentes en la mayoría de los laboratorios de N. vitripennis.
La optimización de métodos alternativos de inyección para la administración de reactivos CRISPR contribuiría a la consolidación de N. vitripennis como organismo modelo. La manipulación de pupas y adultos es menos difícil que la manipulación de embriones y se puede lograr con una configuración básica de inyección. Aquí, dos protocolos se describen para la inyección de pupas y adultos: uno que implica el equipo especializado para las inyecciones, y el otro que implica el uso de un conjunto del tubo del aspirador cabido con una aguja capilar de cristal. El uso de un tubo aspirador es particularmente adecuado para laboratorios que no tienen acceso a equipos especializados para microinyecciones de embriones. Se demuestran inyecciones eficientes de diferentes etapas de desarrollo de N. vitripennis,incluyendo pupas blancas o negras y avispas adultas. Las avispas en la etapa de pupa blanca son particularmente adecuadas para experimentos de derribo mediados por RNAi. Aunque RNAi en Nasonia fue descrito por primera vez por Lynch y Desplan en 200610, no hay ningún procedimiento visual disponible para cómo se realizan las inyecciones de RNAi. RNAi fue utilizado recientemente para descubrir el gen haploidizador del cromosoma B PSR (Paternal Sex Ratio)3 y para estudiar la implicación del gen reloj, período,en los ritmos biológicos de N. vitripennis 7.
Las pupas negras y las avispas adultas se pueden utilizar para inducir la edición de genes de línea germinal CRISPR/Cas9 utilizando los protocolos ReMOT Control (Receptor-Mediated Ovary Transduction of Cargo) y BAPC (Branched Amphiphilic Peptide Capsules). Estos dos métodos de administración de ovarios se han descrito recientemente como eficaces en Nasonia para generar mutaciones en la línea germinal en el gen diana, el cinabrio7,12. Aquí, se proporciona un protocolo simplificado para las inyecciones que incluye un procedimiento visual de una metodología paso a paso para inyecciones pupales y adultas que se pueden utilizar para generar estudios de genética funcional en Nasonia y probablemente en otras avispas parasitoides, sin requerir equipo especializado y evitando microinyecciones embrionarias.
Protocolo
1. Cría de Nasonia
- Configure ~ 20 hembras apareadas singularmente en pequeños tubos de ensayo de vidrio tapados con algodón.
NOTA: Para reducir el espacio de cría, los tubos de 10 x 85 cm, 4 mL son óptimos. Las hembras se distinguen fácilmente de los machos debido a las alas más grandes y la presencia del ovipositor (Figura 1A). Los protocolos detallados para la cría de N. vitripennis también se pueden encontrar en otrasliteraturas 13,14,15.- Agregue dos hospedadores de S. bullata por tubo y mantenga las avispas a 25 ± 1 ° C y 30% de humedad relativa, con un ciclo de luz-oscuridad de 12:12 durante 2-3 días.
NOTA: Las avispas se pueden mantener a menor temperatura o temperatura ambiente; sin embargo, el desarrollo se ralentizará.
- Agregue dos hospedadores de S. bullata por tubo y mantenga las avispas a 25 ± 1 ° C y 30% de humedad relativa, con un ciclo de luz-oscuridad de 12:12 durante 2-3 días.
- Después de 2-3 días, con la ayuda de un pincel de punta fina, retire suavemente las hembras para evitar la oviposición continua y la asincronía en el desarrollo de la descendencia.
NOTA: Las hembras eliminadas pueden ser opcionalmente re-alojadas o almacenadas a 5 °C durante un mes.- Mantener el huésped parasitado a 25 °C y 30% de humedad relativa, con un ciclo claro-oscuro de 12:12 durante 7 días si la etapa de inyección deseada requiere pupas blancas; durante 13 días si la etapa de desarrollo requerida es pupas negras; o 14 días para adultos jóvenes recién surgidos.
NOTA: Las pupas amarillas y negras también se pueden almacenar a 5 °C durante un hasta una semana. Un almacenamiento más largo aumentará la frecuencia de diapausa en larvas para la próxima generación, lo que dificultará la detección posterior a la inyección y el establecimiento de líneas mutantes. - Abra el pupario huésped con una aguja de disección para recuperar las pupas de N. vitripennis y los adultos en la etapa deseada (Figura 1A).
NOTA: Para inyecciones a una edad adulta particular o para recoger hembras vírgenes, se recomienda eliminar las pupas oscuras el día 13 del huésped, separadas por sexo, y recoger a los adultos después de la emergencia.
- Mantener el huésped parasitado a 25 °C y 30% de humedad relativa, con un ciclo claro-oscuro de 12:12 durante 7 días si la etapa de inyección deseada requiere pupas blancas; durante 13 días si la etapa de desarrollo requerida es pupas negras; o 14 días para adultos jóvenes recién surgidos.
2. Alineación de pupas blancas y negras
- Prepare un portaobjetos de vidrio aplicando una línea de pegamento escolar en el centro. Extender el pegamento con una aguja de disección para obtener una capa gruesa(Figura 1B),que se utilizará para alinear las pupas. Deje secar el pegamento durante ~ 2 minutos antes de transferir las pupas.
NOTA: No sobredry el pegamento, de lo contrario las pupas no se unirán correctamente a la diapositiva y se deslizarán durante las inyecciones. - Bajo un microscopio de disección, usando la aguja de disección, aplique pegamento en la parte posterior de la cabeza de la pupa.
- Coloque la pupa a la capa de pegamento en la diapositiva con su abdomen hacia arriba. Alinee 20-30 pupas una al lado de la otra en la diapositiva (Figura 1C).
NOTA: Evite tocar el abdomen con el pegamento y evite sumergir las pupas en el pegamento; de lo contrario, los adultos no podrán emerger. - Coloque el portaobjetos con las pupas en una placa de Petri para dejar que el pegamento se seque durante ~ 10 min. Antes de comenzar las inyecciones, pruebe la adherencia de las pupas al pegamento empujándolas suavemente con la aguja de disección. Si la mayoría de las pupas se aflojan, prepare una nueva diapositiva. Alternativamente, retire todas las pupas que estén sueltas, y proceda a inyectar las que estén correctamente unidas a la diapositiva.
3. Preparación de la aguja
- Cargue un tubo de vidrio capilar en un tirador de agujas y tire de las agujas siguiendo las instrucciones del fabricante.
NOTA: En esta demostración se utiliza un tirador de agujas de filamento de platino P-1000 y capilares de vidrio de silicato de aluminio. El manual de operación de este instrumento (ver Tabla de Materiales)explica cómo cargar correctamente los tubos de vidrio capilar y configurar programas en este instrumento. Utilice los siguientes parámetros (Calor: 536; Tirón: 80; Vel: 100; Retraso: 70)en capilares de vidrio de silicato de aluminio para inyectar pupas amarillas, pupas negras y adultos.
Además, se utilizó el tirador de agujas P-2000 para preparar agujas de cuarzo siguiendo los parámetros(Calor: 805; Tirón: 145; Vel: 50; Retraso: 145). El manual proporciona instrucciones para cargar tubos capilares de cuarzo y la configuración de los programas en este instrumento. En ausencia de un tirador, vidrio capilar personalizable está disponible. - Cargue la aguja con 5 μL de la mezcla de inyección (preparada de antemano siguiendo los protocolos anteriores para inyecciones de RNAi10 o CRISPR/Cas9 ribonucleoproteína12 (RNP) en N. vitripennis)utilizando puntas de pipeta microcargadora.
NOTA: Durante la demostración, la aguja se carga con ARN de doble cadena (dsRNA) combinado con colorante rojo (ver Tabla de Materiales)para inyección de pupas de etapa blanca y con BAPC-Cas9-sgRNA para inyección de avispas y adultos de pupas negras. Estos reactivos se dirigirán al gen del cinabrio. Las avispas que son derribadas / salidas con éxito mostrarán ojos rojos en lugar de los ojos marrones de tipo salvaje. - Abra la aguja, deslizando la punta sobre una superficie hecha de dos diapositivas superpuestas (Figura 1D). Alternativamente, abra la punta de la aguja con un par de pórceps finos para crear un borde afilado o perforando lentamente el tórax o el abdomen de la avispa.
4. Inyección pupal con femtojet
- Coloque el portaobjetos con las pupas alineadas bajo un microscopio de disección. Inserte la aguja en el tubo de inyección del femtojet y apriete el cabezal de agarre.
- Mirando la aguja bajo el microscopio, encienda el femtojet y configure los parámetros de inyección de Pc y Pi girando las perillas giratorias.
NOTA: Se recomienda un valor de Pc de 600 hPa para un flujo continuo del líquido. El valor de Pc depende de la apertura de la aguja. Para las agujas preparadas utilizando los parámetros indicados en el tirador de agujas P-1000, los valores de Pc entre 500 hPa y 700 hPa producen un flujo constante. Si se requieren valores más bajos de Pc, esto indica que la abertura puede ser demasiado grande y podría dañar a los insectos, mientras que los valores más altos indican que la aguja todavía está cerrada, o que la abertura es demasiado pequeña. - Inserte cuidadosamente la aguja entre los 2 y 3 segmentos abdominales visibles con un ángulo vertical de aproximadamente 30° (Figura 1E). Inyecte con un flujo continuo hasta que todo el abdomen se vuelva rosado en el caso de las pupas de etapa blanca, o hasta que el abdomen aumente de tamaño en el caso de las pupas negras. Deje de inyectarse cuando esté claro que el abdomen no puede tomar más líquido, o cuando el líquido comience a fluir fuera del cuerpo. Muévase con cuidado a la siguiente pupa y repita estos pasos.
NOTA: Evite tocar y dañar el ovipositor con la aguja durante la inyección. - Transfiera el portaobjetos con las pupas inyectadas a una placa de Petri que contenga una toalla de papel empapada con agua desionizada para mantener la humedad. Tapar el plato con su tapa, y colocarlo a 25 °C hasta la aparición de la avispa (Figura 1F).
5. Inyección pupal con tubo aspirador
- Calcule la cantidad de mezcla de inyección utilizando el factor: 4 pupas inyectadas/1 solución de μL.
NOTA: Una inyección típica de 20-30 pupas requiere ~ 5-8 μL de ribonucleoproteína (RNP) mezcla de complejo-saponina o RNP con BAPC12. - Alinee las pupas, como se sugiere en la sección 2, y coloque un portaobjetos con las pupas alineadas bajo un microscopio de disección (Figura 1E).
- Tome una de las agujas capilares y rompa la punta entre dos portaobjetos de vidrio, como se indica en el paso 3.4(Figura 1D). Asegúrese de que la punta de la aguja esté lo suficientemente abierta como para permitir que la solución inyectable se ata soplando aire con la boca, pero no demasiado abierta para evitar perder líquido y dañar las pupas (Figura 1E).
NOTA: Este paso es crítico porque el usuario va a utilizar el aire de la boca para empujar la mezcla de inyección en la hemolinfa de insectos. Es mejor practicar para determinar qué tipo de apertura de aguja es óptima para la viscosidad de una mezcla de solución en particular. Cinco series de inyecciones de 20 pupas por serie pueden ser suficientes para acostumbrarse al sistema de inyección bucal. - Cargue una aguja con la solución de ribonucleoproteína12 usando una punta de microcarga e inserte la aguja en el paquete conector del conjunto del tubo del aspirador.
NOTA: Durante la demostración, la aguja se carga con BAPC-Cas9-sgRNA apuntando al gen del cinabrio de Nasonia 12. - Inserte cuidadosamente la aguja entre los 2 y 3 segmentos abdominales visibles con un ángulo vertical de aproximadamente 30° (Figura 1E). Inyecte con un flujo continuo hasta que todo el abdomen se vuelva rosado en el caso de las pupas de etapa blanca o hasta que el abdomen aumente de tamaño en el caso de las pupas negras. Deje de inyectarse cuando esté claro que el abdomen no puede tomar más líquido o cuando el líquido comience a fluir fuera del cuerpo. Vaya con cuidado a la siguiente pupa y repita estos pasos
NOTA: Evite tocar y dañar el ovipositor con la aguja durante la inyección. - Transfiera el portaobjetos con las pupas inyectadas a una placa de Petri que contenga una toalla de papel empapada con agua desionizada para mantener la humedad. Tapar el plato con su tapa y colocarlo a 25 ºC hasta la aparición de la avispa (Figura 1F).
6. Inyección para adultos con tubo aspirador
- Para la preparación de adultos, grupos separados de 20 hembras vírgenes en un pequeño tubo de ensayo limpio con un pincel fino. Coloque el tubo sobre hielo durante 5 minutos hasta que las hembras sean anestesiadas. Alternativamente, las hembras pueden ser anestesiadas e inyectadas usando CO2.
NOTA: El hielo es preferible como anestésico ya que las avispas adultas son tolerantes al frío y se recuperan fácilmente después de las inyecciones. Las hembras pueden tomar más líquido inyectado que las pupas: 1 μL de solución se puede utilizar para tres hembras en lugar de para cuatro pupas. Prepare los volúmenes en consecuencia. - Prepare un cubo de hielo, colocando un portaobjetos de vidrio en la parte superior del hielo. Alinee las hembras una al lado de la otra en el tobogán frío con los abdomenes hacia arriba (Figura 1E) bajo un alcance de disección.
- Cargue una aguja con la solución de ribonucleoproteína12 usando una punta de microcarga e inserte la aguja en el paquete conector del conjunto del tubo del aspirador. Apoye a las hembras desde el lado opuesto con agujas de disección embotada mientras inyecta lentamente en el abdomen desde el otro lado. Evite tocar el ovipositor, esto dañará severamente esta estructura reproductiva crítica (Figura 1E).
Nota : cualquier orientación es aceptable, dependiendo de la preferencia del operador. - Inserte cuidadosamente la aguja entre los 2 y 3 segmentos abdominales visibles con un ángulo vertical de aproximadamente 30° (Figura 1E). Inyecte la solución en el abdomen femenino, deteniéndose cuando no pueda entrar más líquido, o cuando se observe una fuga de la solución sobrante. Muévase con cuidado a la siguiente avispa y repita estos pasos
NOTA: Inyecte lentamente, dejando la aguja dentro del abdomen durante aproximadamente 3 s antes de retirarla muy lentamente. Esto ayudará a ajustar la presión interna del líquido y evitará que la solución se escape del sitio de inyección después de la extracción de la aguja. - Cuando termine, transfiera suavemente hembras inyectadas individuales a un nuevo tubo con un huésped usando un pincel. Dejar recuperar a temperatura ambiente durante aproximadamente 1 h, confirmando la supervivencia, y luego devolver los tubos a la incubadora de cría.
NOTA: Durante la demostración, la aguja se carga con BAPC-Cas9-sgRNA apuntando al gen del cinabrio de Nasonia 12.
7. Atención postinyección y detección de mutantes
- Después de la eclosión adulta de las pupas inyectadas, coloque las avispas individuales en un tubo de vidrio tapado con algodón e inserte un huésped S. bullata (Figura 1G). En contraste, coloque a las hembras inyectadas en tubos individuales con huéspedes inmediatamente después de la inyección.
- Para los experimentos knockout CRISPR/Cas9, permita que las hembras parasiten a los huéspedes durante un día y reemplace al huésped cada día durante tres días consecutivos.
NOTA: Debido al sistema de determinación de sexo haplodiploide en N. vitripennis16,las hembras vírgenes producirán crías masculinas haploides, lo que facilita la detección de mutaciones. Para la caída a través de RNAi de genes específicos del hombre, los individuos inyectados pueden ser singularmente apareados con individuos de tipo salvaje y se les permite parasitar a los huéspedes. Utilice un host por día y reemplace los hosts en función de la configuración experimental. - Colocar los huéspedes parasitados a 25 °C hasta la aparición de la descendencia masculina G0 (durante ~13-14 días).
- Bajo un microscopio de disección, examine a los varones G0 para los fenotipos transformados. El gen cinabrio es responsable de la pigmentación ocular12:las avispas con ojos marrones son de tipo salvaje, y las avispas con ojos rojos brillantes o variaciones entre ojos rojos y marrones son mutantes(Figura 1H).
8. Cruces postinyección y crianza
- Coloque todos los machos mutantes G0 con ojos rojos (el gen cinabrio 12fenotípicamente interrumpido) con hembras vírgenes de tipo salvaje durante 1-2 días(Figura 2A).
NOTA: Si el gen interrumpido no confiere un fenotipo visible, se requiere la reacción en cadena de la polimerasa (PCR) seguida de la secuenciación del gen diana para identificar a los animales mutantes. Antes de obtener el ADN de machos G0 para PCR, lo ideal sería aparearlos con hembras vírgenes de tipo salvaje. Alternativamente, extraiga adn de una pierna de un macho G0 para identificar mutantes, y aparearse sólo aquellos con mutaciones verificadas. - Añadir dos hospedadores de S. bullata por hembra, y dejar ovipositar a 25 °C y 30% de humedad relativa con un ciclo de luz-oscuridad de 12:12. Reemplace los hosts cada 2-3 días.
- Almacene los huéspedes parasitados a 25 °C y 30% de humedad relativa, con un ciclo claro-oscuro de 12:12 durante ~ 10 días.
- Después de ~ 10 días, abra el huésped parasitado con una aguja de disección y retire cada pupa de N. vitripennis del huésped.
- Con la ayuda de un pincel de punta fina, seleccione pupas hembras (Figura 1A).
NOTA: Las hembras son diploides y heterocigotas, y por lo tanto el color de los ojos será de tipo salvaje.
- Colocar 15-20 pupas hembra en tubos de vidrio a 25 °C hasta la emergencia. Después de la emergencia, agregue ~ 20 S. bullata hosts y deje que las hembras vírgenes G1 parasitar a los anfitriones durante 2-3 días.
NOTA: Estas hembras producirán 50% G2 machos mutantes.- Almacenar hospedadores parasitados a 25 °C y 30% de humedad relativa, con un ciclo claro-oscuro de 12:12 hasta la aparición del adulto macho G2.
- Coloque las pupas G1 restantes a 5 °C durante 8-10 días. Después de este período, retíralos y colócalos a 25 °C y 30% de humedad relativa, con un ciclo claro-oscuro de 12:12 hasta la emergencia (Figura 2A).
- Después de la aparición de los machos G2 en el paso 8.3.1, pantalla para la presencia de fenotipo mutante de ojos rojos. Con la ayuda de un pincel de punta fina, separe a los machos de ojos rojos de los machos de tipo salvaje.
NOTA: La presencia de avispas de ojos rojos en esta generación (G2, Figura 2A)indica que la edición génica ocurrió en la línea germinal, y que la mutación es hereditaria. - Coloque los machos de ojos rojos con las hembras G1 recién emergidas en el paso 8.3.2 (Figura 2A), y déjelos aparearse durante 1-2 días. Agregue 2 S. bullata hosts por hembra, y colóquelos a 25 ° C y 30% de humedad relativa con un ciclo de luz-oscuridad de 12:12 durante 10-11 días.
- Después de 10-11 días, abra el huésped parasitado con una aguja de disección, y retire cada pupa de N. vitripennis del huésped (Figura 2A).
- Con la ayuda de un pincel de punta fina, separe las avispas de ojos rojos (machos y hembras) del tipo salvaje (Figura 1H). Continúe criando avispas de ojos rojos juntas en tubos de vidrio, y no mezcle con las avispas de tipo salvaje.
NOTA: En esta etapa (G3, Figura 2A),los machos haploides y las hembras diploides portan y muestran fenotipos para las mutaciones del cinabrio. Si el gen afectado codifica para un fenotipo invisible, cruce G0 macho singularmente con una hembra de tipo salvaje durante ~1 día. Luego, retire el macho para la caracterización molecular de la mutación por PCR y secuenciación, y deje que la hembra parasparasite a un huésped. Continuar el esquema de cruce sólo con la descendencia de un macho mutante confirmado (Figura 2B). Si el objetivo es la caída por RNAi de un gen candidato, realice el ensayo funcional deseado (como letalidad, esterilidad o ensayo de inducción de diapausa3,7)directamente utilizando individuos inyectados con dsRNA. Como el ARNi es transitorio, no es posible generar una colonia con el fenotipo deseado(Figura 2C)3,7.

Figura 1: Cronología para la microinyección pupal y adulta de Nasonia vitripennis. (A)Se recogen pupas masculinas y femeninas blancas (arriba) y negras (abajo),(B-C)alineadas y pegadas a un portaobjetos de vidrio para inyección. (D)La aguja capilar se prepara y se abre, deslizándola sobre dos portaobjetos superpuestos. (E)La aguja está unida al Femtojet (arriba) o a un tubo aspirador (abajo) para inyecciones. (F) Las pupas inyectadas en el portaobjetos se transfieren a una placa de Petri con un tejido húmedo en la parte inferior para mantener la humedad. Tras la emergencia,(G)las hembras se colocan singularmente en pequeños tubos de vidrio y se les permite ovipositar en Sarcophaga pupa. (H)Cribado de la descendencia para detectar mutantes. Haga clic aquí para ver una versión más amplia de esta figura.
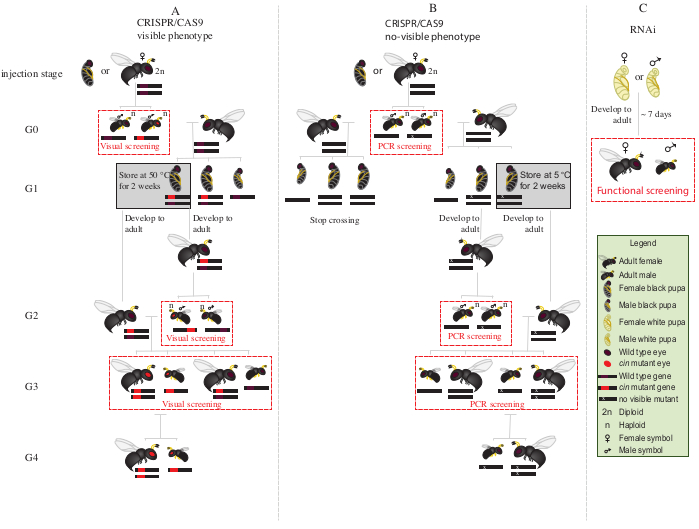
Figura 2:Esquema de cruce después de la inyección. Representación esquemática del procedimiento de esquema de cruce en el caso de la edición génica mediada por CRISPR/Cas9 de genes (A) que inducen un fenotipo visible y (B) que no confieren fenotipo visible. (C) Representación esquemática del procedimiento de cribado de RNAi. Abreviaturas: cin = cinabrio; PCR = reacción en cadena de la polimerasa. Haga clic aquí para ver una versión más amplia de esta figura.
Resultados
Este papel presenta dos métodos fáciles para la microinyección pupal y adulta, usando un femtojet o un tubo del aspirador. El primer método permite una inyección más precisa de líquido, que es importante para la consistencia de RNAi, mientras que el segundo permite la inyección de mayores cantidades de líquido en pupas nasonia o adultos.
Los resultados representativos presentados en la Tabla 1 ...
Discusión
Con el reciente aumento del uso de Nasonia vitripennis como organismo modelo para diversas cuestiones biológicas2,3,7,17,existe la necesidad de desarrollar y optimizar los métodos de inyección para permitir un protocolo simplificado y eficiente para el análisis funcional de los genes de N. vitripennis. Los métodos actuales que involucran la microinyección embrionaria de ...
Divulgaciones
JLR y DCR han solicitado la protección provisional de patentes sobre la tecnología de control ReMOT. O.S.A es fundador de Agragene, Inc., tiene una participación accionaria y forma parte del Consejo Asesor Científico de la compañía. Todos los demás autores declaran que no hay intereses contrapuestos.
Agradecimientos
Este trabajo fue apoyado en parte por los fondos de inicio de UCSD dirigidos a O.S.A. y NSF / BIO 1645331 de subvenciones a J.L.R.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
Referencias
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados