Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Injections de nymphes et d’adultes pour l’arNi et l’édition de gènes CRISPR chez Nasonia vitripennis
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous décrivons les méthodes d’injections pupales et adultes efficaces dans Nasonia vitripennis comme des alternatives accessibles à la microinjection embryonnaire, permettant l’analyse fonctionnelle des gènes d’intérêt en utilisant soit le silence de l’ARN via l’interférence ARN (ARNi), soit l’élimination du gène via l’édition du génome CRISPR / Cas9.
Résumé
La guêpe bijou, Nasonia vitripennis, est devenue un système modèle efficace pour étudier l’épigénétique de la détermination du sexe haplo-diploïde, de la biologie du chromosome B, des interactions hôte-symbiote, de la spéciation et de la synthèse du venin. Malgré la disponibilité de plusieurs outils moléculaires, dont CRISPR/Cas9, les études génétiques fonctionnelles sont encore limitées dans cet organisme. La principale limite de l’application de la technologie CRISPR/Cas9 à N. vitripennis provient des défis des microinjections embryonnaires. Les injections d’embryons sont particulièrement difficiles dans cet organisme et en général chez de nombreuses guêpes parasitoïdes, en raison de la petite taille de l’embryon et de la nécessité d’une chrysalide hôte pour le développement embryonnaire. Pour relever ces défis, l’administration complexe de ribonucléoprotéine Cas9 dans les ovaires femelles par injection adulte, plutôt que la microinjection embryonnaire, a été optimisée, ayant pour résultat des modifications somatiques et héritables de germline. Les procédures d’injection ont été optimisées dans les pupes et les guêpes femelles en utilisant soit reMOT Control (Receptor-Mediated Ovary Transduction of Cargo) ou BAPC (Branched Amphiphilic Peptide Capsules). Ces méthodes se sont avérées être des alternatives efficaces à l’injection d’embryon, permettant des mutations germinales spécifiques au site et héréditaires.
Introduction
L’édition du gène CRISPR/Cas9 est une technologie puissante pour les études génétiques fonctionnelles, en particulier dans de nombreux organismes modèles émergents tels que la guêpe bijou, Nasonia vitripennis. La facilité d’élevage et la disponibilité d’un génome complet font de la guêpe jewel un système expérimental important pour élucider les mécanismes moléculaires de différents processus biologiques. Par exemple, N. vitripennis a récemment été utilisé pour démêler la base épigénétique du système haplodiploïde de détermination du sexe1,2,la biologie des chromosomes B3,4,5,6et la base génétique de la régulation circadienne et saisonnière7,8. Certaines des caractéristiques qui rendent N. vitripennis facile à travailler incluent un temps de génération court (~ 2 semaines à 25 ° C), des taux de reproduction élevés, une séparation facile du sexe au stade nymphal et la capacité de diapause et de stocker des souches à 4 ° C. Le cycle de vie commence avec des guêpes femelles parasitant les pupes de la mouche à mouches, Sarcophaga bullata. Grâce à leur ovipositeur, les femelles pondent jusqu’à 50 œufs dans le cas nymphal de la mouche. Les œufs se développent en larves qui se nourrissent de la chrysalide de S. bullata, continuent de se développer au cours des prochains jours, puis se nymphosent, suivies de l’éclosion adulte et de l’émergence de l’hôte puparium9.
Des outils moléculaires permettant d’effectuer des études génétiques fonctionnelles chez N. vitripennis,tels que l’interférence ARN (ARNi)10 et CRISPR/Cas911,12,sont disponibles, mais sont limités, principalement en raison de difficultés à réaliser des microinjections embryonnaires13. Comme les œufs de N. vitripennis ont besoin d’un hôte nymphal pour leur développement, la manipulation des œufs est très difficile. Les embryons au stade pré-blastoderme doivent être prélevés sur les pupes de mouches à mouches hôtes, rapidement microinjectés et immédiatement transférés à l’hôte pour le développement13. Ces étapes nécessitent une précision et une formation spécialisée pour éviter d’endommager les embryons micro-injectés ou les hôtes nymphaux13. De plus, les œufs sont très petits et fragiles, surtout après microinjections, avec un cytoplasme très visqueux provoquant un colmatage continu de l’aiguille d’injection13. Ces caractéristiques rendent les microinjections embryonnaires exceptionnellement difficiles, nécessitant des opérateurs hautement qualifiés et un équipement spécialisé qui est absent dans la plupart des laboratoires de N. vitripennis.
L’optimisation des méthodes d’injection alternatives pour l’administration de réactifs CRISPR contribuerait à la consolidation de N. vitripennis en tant qu’organisme modèle. La manipulation des pupes et des adultes est moins difficile que la manipulation d’embryons et peut être accomplie avec une configuration d’injection de base. Ici, deux protocoles sont décrits pour l’injection de pupes et d’adultes : l’un impliquant un équipement spécialisé pour les injections, et l’autre impliquant l’utilisation d’un ensemble tube aspirateur équipé d’une aiguille capillaire en verre. L’utilisation d’un tube aspirateur est particulièrement adaptée aux laboratoires qui n’ont pas accès à des équipements spécialisés pour les microinjections embryonnaires. Des injections efficaces de différents stades de développement de N. vitripennis,y compris des pupes blanches ou noires et des guêpes adultes, sont démontrées. Les guêpes au stade nymphal blanc sont particulièrement adaptées aux expériences de knockdown médiées par l’ARNi. Bien que l’ARNi de Nasonia ait été décrit pour la première fois par Lynch et Desplan en 200610, il n’existe aucune procédure visuelle disponible pour la façon dont les injections d’ARNi sont effectuées. L’ARNi a récemment été utilisé pour découvrir le gène haploïdisant du chromosome B PSR (Paternal Sex Ratio)3 et pour étudier l’implication du gène horloge, période,chez N. vitripennis rythmes biologiques7.
Les pupes noires et les guêpes adultes peuvent être utilisées pour induire l’édition du gène crispr/cas9 germinal à l’aide des protocoles ReMOT Control (Receptor-Mediated Ovary Transduction of Cargo) et BAPC (Branched Amphiphilic Peptide Capsules). Ces deux méthodes d’administration d’ovaires ont été récemment décrites comme étant efficaces chez Nasonia pour générer des mutations germinales dans le gène cible, le cinabre7,12. Ici, un protocole simplifié est fourni pour les injections, y compris une procédure visuelle d’une méthodologie étape par étape pour les injections nymphales et adultes qui peut être utilisée pour générer des études de génétique fonctionnelle dans Nasonia et probablement chez d’autres guêpes parasitoïdes, sans nécessiter d’équipement spécialisé et en contournant les microinjections embryonnaires.
Protocole
1. Élevage de Nasonia
- Installer ~ 20 femelles accouplées singulièrement dans de petits tubes à essai en verre bouchés avec du coton.
REMARQUE: Pour réduire l’espace d’élevage, des tubes de 10 x 85 cm et 4 mL sont optimaux. Les femelles se distinguent facilement des mâles en raison des ailes plus grandes et de la présence de l’ovipositeur (Figure 1A). Des protocoles détaillés pour l’élevage de N. vitripennis peuvent également être trouvés dans d’autreslittératures 13,14,15.- Ajouter deux hôtes S. bullata par tube et maintenir les guêpes à 25 ± 1 °C et 30 % d’humidité relative, avec un cycle lumière-obscurité de 12 h 12 pendant 2 à 3 jours.
REMARQUE: Les guêpes peuvent être maintenues à une température inférieure ou à une température ambiante; toutefois, le développement sera ralenti.
- Ajouter deux hôtes S. bullata par tube et maintenir les guêpes à 25 ± 1 °C et 30 % d’humidité relative, avec un cycle lumière-obscurité de 12 h 12 pendant 2 à 3 jours.
- Après 2-3 jours, à l’aide d’un pinceau à pointe fine, retirez doucement les femelles pour éviter la ponte continue et l’asynchronie dans le développement de la progéniture.
REMARQUE: Les femelles retirées peuvent éventuellement être ré-hébergées ou stockées à 5 ° C jusqu’à un mois.- Maintenir l’hôte parasité à 25 °C et 30 % d’humidité relative, avec un cycle lumière-obscurité de 12:12 pendant 7 jours si le stade d’injection souhaité nécessite des pupes blanches; pendant 13 jours si le stade de développement requis est la pupe noire; ou 14 jours pour les jeunes adultes nouvellement émergés.
REMARQUE : Les pupes jaunes et noires peuvent également être conservées à 5 °C jusqu’à une semaine. Un stockage plus long augmentera la fréquence de la diapause chez les larves pour la prochaine génération, ce qui rendra le dépistage post-injection et l’établissement de lignées mutantes plus difficiles. - Ouvrir le puparium hôte à l’l’l’ouvrez à l’aiguille de dissection pour récupérer les pupes et les adultes de N. vitripennis au stade souhaité(figure 1A).
REMARQUE: Pour les injections à un âge adulte particulier ou pour la collecte de femelles vierges, il est recommandé d’enlever les pupes sombres du jour 13 de l’hôte, de les séparer par sexe et de recueillir les adultes après la levée.
- Maintenir l’hôte parasité à 25 °C et 30 % d’humidité relative, avec un cycle lumière-obscurité de 12:12 pendant 7 jours si le stade d’injection souhaité nécessite des pupes blanches; pendant 13 jours si le stade de développement requis est la pupe noire; ou 14 jours pour les jeunes adultes nouvellement émergés.
2. Alignement des pupes blanches et noires
- Préparez une lame de verre en appliquant une ligne de colle d’école au centre. Étaler la colle avec une aiguille de dissection pour obtenir une couche épaisse(figure 1B),qui sera utilisée pour aligner les pupes. Laissez sécher la colle pendant environ 2 min avant de transférer les pupes.
REMARQUE: Ne pas trop trop de colle, sinon les pupes ne seront pas correctement attachées à la lame et glisseront pendant les injections. - Sous un microscope de dissection, à l’aide de l’aiguille de dissection, appliquez de la colle à l’arrière de la tête de la chrysalide.
- Fixez la chrysalide à la couche de colle sur la lame avec son abdomen tourné vers le haut. Alignez 20 à 30 pupes côte à côte sur la diapositive(Figure 1C).
REMARQUE: Évitez de toucher l’abdomen avec la colle et évitez de plonger les pupes dans la colle; sinon, les adultes ne pourront pas émerger. - Placez la diapositive avec les pupes dans une boîte de Pétri pour laisser sécher la colle pendant environ 10 min. Avant de commencer les injections, testez l’adhérence des pupes à la colle en les poussant doucement avec l’aiguille de dissection. Si la plupart des pupes sont desserrées, préparez une nouvelle diapositive. Vous pouvez également retirer toutes les pupes qui sont desserrées et procéder à l’injection de celles qui sont correctement attachées à la lame.
3. Préparation de l’aiguille
- Chargez un tube de verre capillaire dans un tiroir à aiguilles et tirez les aiguilles en suivant les instructions du fabricant.
REMARQUE : Un tire-aiguille à filament de platine P-1000 et des capillaires en verre silicate d’aluminium sont utilisés dans cette démonstration. Le manuel d’utilisation de cet instrument (voir la table des matériaux)explique comment charger correctement les tubes de verre capillaire et mettre en place des programmes sur cet instrument. Utilisez les paramètres suivants( Chaleur: 536; Traction: 80; Vel: 100; Retard: 70) sur les capillaires en verre silicate d’aluminium pour injecter des pupes jaunes, des pupes noires et des adultes.
De plus, l’aiguille P-2000 a été utilisée pour préparer des aiguilles à quartz en suivant les paramètres (Chaleur : 805; Traction: 145; Vel: 50; Retard: 145). Le manuel fournit des instructions pour le chargement des tubes de quartz capillaire et la configuration des programmes dans cet instrument. En l’absence de pull-tireur, du verre capillaire personnalisable est disponible. - Chargez l’aiguille avec 5 μL du mélange d’injection (préparé à l’avance selon les protocoles précédents pour les injections d’ARNi10 ou de ribonucléoprotéine12 CRISPR/Cas9 (RNP) dans N. vitripennis)à l’aide de pointes de pipettes de microchargeur.
REMARQUE: Au cours de la démonstration, l’aiguille est chargée d’ARN double brin (ARNdb) combiné avec un colorant rouge (voir le tableau des matériaux)pour l’injection de pupes blanches et avec BAPC-Cas9-sgRNA pour l’injection de pupes noires guêpes et adultes. Ces réactifs cibleront le gène du cinabre. Les guêpes qui sont renversées / sorties avec succès montreront des yeux rouges au lieu des yeux bruns de type sauvage. - Ouvrez l’aiguille en faisant glisser la pointe sur une surface constituée de deux diapositives qui se chevauchent(Figure 1D). Vous pouvez également ouvrir le bout de l’aiguille avec une paire de pinces fines pour créer un bord tranchant ou en perçant lentement le thorax ou l’abdomen de la guêpe.
4. Injection de nymphe avec femtojet
- Placez la lame avec les pupes alignées sous un microscope de dissection. Insérez l’aiguille dans le tube d’injection du femtojet et serrez la tête de préhension.
- En regardant l’aiguille au microscope, allumez le femtojet et configurez les paramètres d’injection Pc et Pi en faisant pivoter les boutons rotatifs.
NOTA: Une valeur Pc de 600 hPa est recommandée pour un écoulement continu du liquide. La valeur Pc dépend de l’ouverture de l’aiguille. Pour les aiguilles préparées à l’aide des paramètres indiqués dans le tire-aiguille P-1000, les valeurs Pc comprises entre 500 hPa et 700 hPa produisent un débit constant. Si des valeurs plus faibles de Pc sont requises, cela indique que l’ouverture peut être trop grande et pourrait endommager les insectes, tandis que des valeurs plus élevées indiquent que l’aiguille est toujours fermée ou que l’ouverture est trop petite. - Insérez soigneusement l’aiguille entre les 2 et 3 segments abdominaux visibles avec un angle vertical d’environ 30° (Figure 1E). Injecter avec un flux continu jusqu’à ce que tout l’abdomen devienne rose dans le cas des pupes au stade blanc, ou jusqu’à ce que l’abdomen augmente en taille dans le cas des pupes noires. Arrêtez d’injecter quand il est clair que l’abdomen ne peut plus prendre de liquide, ou quand le liquide commence à s’écouler du corps. Passez soigneusement à la pupe suivante et répétez ces étapes.
REMARQUE: Évitez de toucher et d’endommager l’ovipositeur avec l’aiguille pendant l’injection. - Transférer la lame avec les pupes injectées dans une boîte de Pétri contenant une serviette en papier imbibée d’eau désionisée pour maintenir l’humidité. Couvrez le plat avec son couvercle et placez-le à 25 °C jusqu’à l’émergence de la guêpe(figure 1F).
5. Injection de nymphe avec tube aspirateur
- Calculer la quantité de mélange d’injection en utilisant le facteur : 4 pupes injectées/1 solution de μL.
REMARQUE: Une injection typique de 20-30 pupes nécessite ~ 5-8 μL de mélange complexe-saponine ribonucléoprotéine (RNP) ou RNP avec BAPC12. - Alignez les pupes, comme suggéré à la section 2, et placez une lame avec les pupes alignées sous un microscope de dissection(figure 1E).
- Prenez l’une des aiguilles capillaires et cassez la pointe entre deux lames de verre, comme indiqué à l’étape 3.4(figure 1D). Assurez-vous que la pointe de l’aiguille est suffisamment ouverte pour permettre à la solution injectable de sortir en soufflant de l’air avec la bouche, mais pas trop ouverte pour éviter de perdre du liquide et d’endommager les pupes (Figure 1E).
REMARQUE: Cette étape est critique car l’utilisateur utilisera l’air de la bouche pour pousser le mélange d’injection dans l’hémolymphe de l’insecte. Il est préférable de pratiquer de manière à déterminer quel type d’ouverture d’aiguille est optimal pour la viscosité d’un mélange de solution particulier. Cinq séries d’injections de 20 pupes par ensemble peuvent suffire à s’habituer au système d’injection de la bouche. - Chargez une aiguille avec la solution de ribonucléoprotéine12 à l’aide d’une pointe de microcharge, et insérez l’aiguille dans le pack de connecteurs de l’ensemble tube aspirateur.
REMARQUE: Au cours de la démonstration, l’aiguille est chargée de BAPC-Cas9-sgRNA ciblant le gène du cinabre Nasonia 12. - Insérez soigneusement l’aiguille entre les 2 et 3 segments abdominaux visibles avec un angle vertical d’environ 30° (Figure 1E). Injecter avec un flux continu jusqu’à ce que tout l’abdomen devienne rose dans le cas des pupes au stade blanc ou jusqu’à ce que l’abdomen augmente en taille dans le cas des pupes noires. Arrêtez d’injecter quand il est clair que l’abdomen ne peut plus prendre de liquide ou quand le liquide commence à s’écouler du corps. Passez soigneusement à la pupe suivante et répétez ces étapes
REMARQUE: Évitez de toucher et d’endommager l’ovipositeur avec l’aiguille pendant l’injection. - Transférer la lame avec les pupes injectées dans une boîte de Pétri contenant une serviette en papier imbibée d’eau désionisée pour maintenir l’humidité. Couvrir le plat avec son couvercle et le placer à 25 °C jusqu’à l’émergence de la guêpe(figure 1F).
6. Injection adulte avec tube aspirateur
- Pour la préparation des adultes, séparez les groupes de 20 femelles vierges dans un petit tube à essai propre avec un pinceau fin. Placez le tube sur de la glace pendant 5 min jusqu’à ce que les femelles soient anesthésiées. Alternativement, les femelles peuvent être anesthésiées et injectées en utilisant du CO2.
REMARQUE: La glace est préférable comme anesthésique, car les guêpes adultes tolèrent le froid et se rétablissent facilement après les injections. Les femelles peuvent prendre plus de liquide injecté que les pupes : 1 μL de solution peut être utilisé pour trois femelles au lieu de quatre pupes. Préparez les volumes en conséquence. - Préparez un seau à glace en plaçant une lame de verre sur la glace. Alignez les femelles côte à côte sur la lame froide avec les abdomens tournés vers le haut(figure 1E)sous une portée de dissection.
- Chargez une aiguille avec la solution de ribonucléoprotéine12 à l’aide d’une pointe de microcharge, et insérez l’aiguille dans le pack de connecteurs de l’ensemble tube aspirateur. Soutenez les femelles du côté opposé avec des aiguilles de dissection émoussées tout en injectant lentement dans l’abdomen de l’autre côté. Évitez de toucher l’ovipositeur, cela endommagera gravement cette structure de reproduction critique (Figure 1E).
Remarque : l’une ou l’autre orientation est acceptable, selon la préférence de l’opérateur. - Insérez soigneusement l’aiguille entre les 2 et 3 segments abdominaux visibles avec un angle vertical d’environ 30° (Figure 1E). Injectez la solution dans l’abdomen de la femelle, en vous arrêtant lorsqu’aucun liquide ne peut entrer ou lorsqu’une fuite de solution excédentaire est observée. Passez soigneusement à la guêpe suivante et répétez ces étapes
REMARQUE: Injectez lentement, en laissant l’aiguille à l’intérieur de l’abdomen pendant environ 3 s avant de l’enlever très lentement. Cela aidera à ajuster la pression interne du liquide et à éviter que la solution ne s’échappe du site d’injection après le retrait de l’aiguille. - Lorsque vous avez terminé, transférez doucement les femelles injectées uniques dans un nouveau tube avec un hôte à l’aide d’un pinceau. Laisser récupérer à température ambiante pendant environ 1 h, confirmant la survie, puis retourner les tubes à l’incubateur d’élevage.
REMARQUE: Au cours de la démonstration, l’aiguille est chargée de BAPC-Cas9-sgRNA ciblant le gène du cinabre Nasonia 12.
7. Soins post-injection et dépistage des mutants
- Après l’éclosion adulte des pupes injectées, placez les guêpes simples dans un tube de verre bouché avec du coton et insérez un hôte S. bullata (Figure 1G). En revanche, placez les femelles injectées dans des tubes individuels avec des hôtes immédiatement après l’injection.
- Pour les expériences de knock-out CRISPR/Cas9, permettre aux femelles de parasiter les hôtes pendant une journée et remplacer l’hôte chaque jour pendant trois jours consécutifs.
REMARQUE: En raison du système de détermination du sexe haplodiploïde chez N. vitripennis16,les femelles vierges prodiront des couvées mâles haploïdes, ce qui facilite la détection des mutations. Pour le knockdown via l’ARNi de gènes spécifiques aux mâles, les individus injectés peuvent être singulièrement accouplé avec des individus de type sauvage et autorisés à parasiter les hôtes. Utilisez un hôte par jour et remplacez les hôtes en fonction de la configuration expérimentale. - Placer les hôtes parasités à 25 °C jusqu’à l’émergence de la progéniture mâle G0 (pendant environ 13 à 14 jours).
- Sous un microscope de dissection, cribler les mâles G0 pour les phénotypes mutés. Le gène du cinabre est responsable de la pigmentation oculaire12: les guêpes aux yeux bruns sont de type sauvage, et les guêpes aux yeux rouge vif ou aux variations entre yeux rouges et bruns sont mutantes(figure 1H).
8. Croix post-injection et élevage
- Placez tous les mâles mutants G0 aux yeux rouges (le gène phénotypiquement perturbé du cinabre12)avec des femelles vierges de type sauvage pendant 1-2 jours(figure 2A).
REMARQUE: Si le gène perturbé ne confère pas de phénotype visible, une réaction en chaîne de la polymérase (PCR) suivie du séquençage du gène cible est nécessaire pour identifier les animaux mutants. Avant d’obtenir l’ADN des mâles G0 pour la PCR, il serait idéal de les accoupler avec des femelles vierges de type sauvage. Alternativement, extraire l’ADN d’une jambe d’un mâle G0 pour identifier les mutants, et accoupler seulement ceux avec des mutations vérifiées. - Ajouter deux hôtes S. bullata par femelle et laisser opovier à 25 °C et 30 % d’humidité relative avec un cycle lumière-obscurité de 12:12. Remplacez les hôtes tous les 2-3 jours.
- Entreposer les hôtes parasités à 25 °C et à 30 % d’humidité relative, avec un cycle lumière-obscurité de 12 h 12 pendant environ 10 jours.
- Après environ 10 jours, ouvrez l’hôte parasité avec une aiguille de dissection et retirez chaque pupe de N. vitripennis de l’hôte.
- À l’aide d’un pinceau à pointe fine, sélectionnez des pupes femelles (Figure 1A).
REMARQUE: Les femelles sont diploïdes et hétérozygotes, et donc la couleur des yeux sera de type sauvage.
- Placer 15 à 20 pupes femelles dans des tubes de verre à 25 °C jusqu’à la levée. Après l’émergence, ajoutez ~20 hôtes S. bullata et laissez les femelles G1 vierges parasiter les hôtes pendant 2-3 jours.
REMARQUE: Ces femelles produiront 50% de mâles mutants G2.- Conserver les hôtes parasités à 25 °C et à 30 % d’humidité relative, avec un cycle lumière-obscurité de 12:12 jusqu’à l’émergence du mâle G2 adulte.
- Placer les pupes G1 restantes à 5 °C pendant 8 à 10 jours. Après cette période, retirez-les et placez-les à 25 °C et 30 % d’humidité relative, avec un cycle lumière-obscurité de 12 h 12 jusqu’à l’émergence(figure 2A).
- Après apparition des mâles G2 à l’étape 8.3.1, cribler la présence du phénotype de mutant aux yeux rouges. À l’aide d’un pinceau à pointe fine, séparez les mâles aux yeux rouges des mâles de type sauvage.
REMARQUE : La présence de guêpes aux yeux rouges dans cette génération (G2, figure 2A)indique que l’édition du gène s’est produite dans la lignée germinale et que la mutation est héréditaire. - Placez les mâles aux yeux rouges avec les femelles G1 nouvellement émergées à l’étape 8.3.2 (Figure 2A), et laissez-les s’accoupler pendant 1-2 jours. Ajouter 2 hôtes S. bullata par femelle et les placer à 25 °C et 30 % d’humidité relative avec un cycle lumière-obscurité de 12 h 12 pendant 10 à 11 jours.
- Après 10 à 11 jours, ouvrir l’hôte parasité à l’l’aiguille de dissection et retirer chaque chrysalide de N. vitripennis de l’hôte (figure 2A).
- À l’aide d’un pinceau à pointe fine, séparez les guêpes aux yeux rouges (mâles et femelles) du type sauvage(figure 1H). Continuez l’élevage des guêpes aux yeux rouges ensemble dans des tubes de verre et ne mélangez pas avec les guêpes de type sauvage.
REMARQUE : À ce stade (G3, figure 2A),les mâles haploïdes et les femelles diploïdes portent et présentent des phénotypes pour les mutations du cinabre. Si le gène affecté code pour un phénotype invisible, croiser le mâle G0 singulièrement avec un type sauvage femelle pendant ~1 jour. Ensuite, retirez le mâle pour la caractérisation moléculaire de la mutation par PCR et séquençage, et laissez la femelle parasiter un hôte. Continuer le schéma de croisement uniquement avec la progéniture d’un mâle mutant confirmé (Figure 2B). Si l’objectif est le knockdown par l’ARNi d’un gène candidat, effectuer le test fonctionnel souhaité (tel que la létalité, la stérilité, ou le test d’induction de diapause3,7)directement en utilisant des individus injectés avec de l’ARNdb. L’ARNi étant transitoire, il n’est pas possible de générer une colonie avec le phénotype désiré (figure 2C)3,7.

Figure 1: Chronologie pour la microinjection pupale et adulte de Nasonia vitripennis. (A) Les pupes blanches (en haut) et noires (en bas) mâles et femelles sont collectées, (B-C) alignées et collées sur une lame de verre pour injection. (D) L’aiguille capillaire est préparée et ouverte, en la faisant glisser sur deux lames qui se chevauchent. (E) L’aiguille est fixée soit au Femtojet (en haut), soit à un tube aspirateur (en bas) pour les injections. (F) Les pupes injectées sur la lame sont transférées dans une boîte de Petri avec un tissu humide sur le fond pour maintenir l’humidité. Lors de l’émergence, les femelles(G)sont placées singulièrement dans de petits tubes de verre et laissées opoviposer sur la chrysalide de Sarcophaga. (H) Criblage de la progéniture pour détecter les mutants. Veuillez cliquer ici pour voir une version plus grande de cette figure.
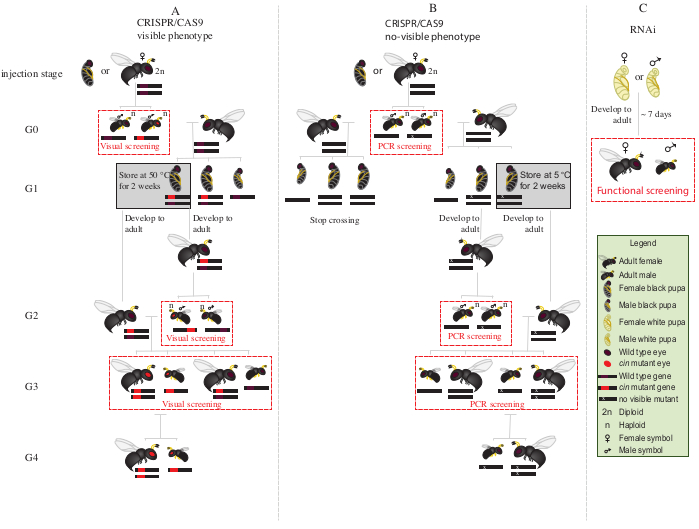
Figure 2: Schéma de croisement après injection. Représentation schématique de la procédure de schéma de croisement dans le cas de l’édition de gènes crispr/Cas9-négocié des gènes (A) qui induisent un phénotype visible et (B) qui ne confèrent pas le phénotype visible. C) Représentation schématique de la procédure de dépistage de l’ARNi. Abréviations : cin = cinabre; PCR = réaction en chaîne de la polymérase. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Résultats
Ce document présente deux méthodes faciles pour la pupale et la microinjection adulte, utilisant un femtojet ou un tube d’aspirateur. La première méthode permet une injection plus précise de liquide, ce qui est important pour la cohérence de l’ARNi, tandis que la seconde permet l’injection de plus grandes quantités de liquide dans les pupes nasonia ou les adultes.
Les résultats représentatifs présentés ...
Discussion
Avec l’utilisation accrue récente de Nasonia vitripennis comme organisme modèle pour diverses questions biologiques2,3,7,17,il est nécessaire de développer et d’optimiser des méthodes d’injection pour permettre un protocole simplifié et efficace pour l’analyse fonctionnelle des gènes de N. vitripennis. Les méthodes actuelles impliquant la microinjection embryon...
Déclarations de divulgation
JLR et DCR ont déposé une demande de protection provisoire par brevet sur la technologie reMOT Control. O.S.A est l’un des fondateurs d’Agragene, Inc., d’une participation au capital et siège au conseil consultatif scientifique de la société. Tous les autres auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Ce travail a été soutenu en partie par des fonds de démarrage de l’UCSD dirigés vers O.S.A. et des 1645331 de subvention NSF /BIO à J.L.R.
matériels
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
Références
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon