È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Iniezioni pupali e adulte per l'editing genico RNAi e CRISPR a Nasonia al vetripennis
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, descriviamo i metodi per iniezioni pupali e adulte efficienti in Nasonia vitripennis come alternative accessibili alla microiniezione embrionale, consentendo l'analisi funzionale dei geni di interesse utilizzando il silenziamento dell'RNA tramite interferenza dell'RNA (RNAi) o knockout genico tramite l'editing del genoma CRISPR / Cas9.
Abstract
La vespa gioiello, Nasonia vitripennis, è diventata un efficiente sistema modello per studiare l'epigenetica della determinazione del sesso aplo-diploide, la biologia cromosomica B, le interazioni ospite-simbionte, la speciazione e la sintesi del veleno. Nonostante la disponibilità di diversi strumenti molecolari, tra cui CRISPR/Cas9, gli studi genetici funzionali sono ancora limitati in questo organismo. La principale limitazione dell'applicazione della tecnologia CRISPR/Cas9 in N. vitripennis deriva dalle sfide delle microiniezioni embrionali. Le iniezioni di embrioni sono particolarmente difficili in questo organismo e in generale in molte vespe parassitoidi, a causa delle piccole dimensioni dell'embrione e del requisito di una pupa ospite per lo sviluppo embrionale. Per affrontare queste sfide, cas9 ribonucleoproteina consegna complessa nelle ovaie femminili per iniezione adulta, piuttosto che microiniezione embrionale, è stato ottimizzato, con conseguente modifica della linea germinale somatica ed ericolabile. Le procedure di iniezione sono state ottimizzate nelle pupe e nelle vespe femminili utilizzando remot control (trasduzione ovarica mediata dal recettore del carico) o BAPC (capsule peptidiche anfifile ramificate). Questi metodi si dimostrano efficaci alternativi all'iniezione embrionale, consentendo mutazioni germinali site-specific ed heritable.
Introduzione
L'editing genico CRISPR/Cas9 è una potente tecnologia per studi genetici funzionali, specialmente in molti organismi modello in ascesa come la vespa gioiello Nasonia vitripennis. La facilità di allevamento e la disponibilità di un genoma completo rendono la vespa gioiello un importante sistema sperimentale per chiarire i meccanismi molecolari dei diversi processi biologici. Ad esempio, N. vitripennis è stato recentemente utilizzato per svelare la base epigenetica del sistema di determinazione sessuale aplodiploide1,2, la biologia dei cromosomi B3,4,5,6e la base genetica per la regolazione circadiana estagionale 7,8. Alcune delle caratteristiche che rendono N. vitripennis suscettibile di lavorare includono tempi di breve generazione (~ 2 settimane a 25 °C), alti tassi di riproduzione, facile separazione sessuale nella fase pupale e la capacità di diapausa e conservare ceppi a 4 °C. Il ciclo di vita inizia con le vespe femminili che parassitano le pupe della mosca soffiata, Sarcofago bullata. Attraverso il loro ovopositore, le femmine depongono fino a 50 uova nel caso pupale della mosca. Le uova si sviluppano in larve che si nutrono della pupa di S. bullata, continuano a svilupparsi nei prossimi giorni e poi si impupano, seguite dall'eclosion adulta e dall'emergere dal pupariumospite 9.
Sono disponibili strumenti molecolari per eseguire studi genetici funzionali in N. vitripennis, come l'interferenza dell'RNA (RNAi)10 e CRISPR/Cas911, 12, ma sono limitati, principalmente a causa delle difficoltà nell'esecuzione di microiniezioni embrionali13. Poiché le uova di N. vitripennis richiedono un ospite pupale per lo sviluppo, la manipolazione delle uova è molto impegnativa. Gli embrioni allo stadio pre-blastoderma devono essere raccolti dalle pupe della mosca soffiata ospite, rapidamente microiniettati e immediatamente trasferiti all'ospite per lo sviluppo13. Questi passaggi richiedono precisione e allenamento specializzato per evitare di danneggiare gli embrioni microiniettati o gli ospiti pupali13. Inoltre, le uova sono molto piccole e fragili, specialmente dopo le microiniezioni, con un citoplasma molto viscoso che causa un intasamento continuo dell'ago iniettabile13. Queste caratteristiche rendono le microiniezioni embrionali eccezionalmente impegnative, richiedendo operatori altamente qualificati e attrezzature specializzate assenti nella maggior parte dei laboratori N. vitripennis.
L'ottimizzazione di metodi di iniezione alternativi per la consegna di reagenti CRISPR contribuirebbe al consolidamento di N. vitripennis come organismo modello. La manipolazione di pupe e adulti è meno impegnativa rispetto alla manipolazione degli embrioni e può essere eseguita con una configurazione di iniezione di base. Qui vengono descritti due protocolli per l'iniezione di pupe e adulti: uno che coinvolge attrezzature specializzate per iniezioni e l'altro che comporta l'uso di un gruppo di tubi aspiratori dotato di un ago capillare in vetro. L'uso di un tubo aspiratore è particolarmente adatto per i laboratori che non hanno accesso a apparecchiature specializzate per microiniezioni embrionale. Vengono dimostrate iniezioni efficienti di diverse fasi di sviluppo di N. vitripennis, tra cui pupe bianche o nere e vespe adulte. Le vespe allo stadio pupale bianco sono particolarmente adatte per esperimenti di abbattimento mediati da RNAi. Sebbene RNAi in Nasonia sia stato descritto per la prima volta da Lynch e Desplan nel 200610, non è disponibile alcuna procedura visiva per il modo in cui vengono eseguite le iniezioni RNAi. RNAi è stato recentemente utilizzato per scoprire il gene aploidizzatore del PSR del cromosoma B (Rapporto sessuale paterno)3 e per studiare il coinvolgimento del gene dell'orologio, periodo, nei ritmi biologici N. vitripennis 7.
Pupe nere e vespe adulte possono essere utilizzate per indurre l'editing genico della linea germinale CRISPR /Cas9 utilizzando protocolli ReMOT Control (Receptor-Mediated Ovary Transduction of Cargo) e BAPC (Branched Amphiphilic Peptide Capsules). Questi due metodi di somministrazione dell'ovaio sono stati recentemente descritti come efficaci in Nasonia per generare mutazioni germinali nel gene bersaglio, cinabro7,12. Qui, viene fornito un protocollo semplificato per le iniezioni che include una procedura visiva di una metodologia passo-passo per iniezioni sia pupali che adulte che possono essere utilizzate per generare studi di genetica funzionale a Nasonia e probabilmente in altre vespe parassitoidi, senza richiedere attrezzature specializzate e bypassando le microiniezioni embrionali.
Protocollo
1. Allevamento nasonia
- Impostare ~ 20 femmine accoppiate singolarmente in piccole provette di vetro collegate con cotone.
NOTA: Per ridurre lo spazio di allevamento, 10 x 85 cm, i tubi da 4 ml sono ottimali. Le femmine si distinguono facilmente dai maschi a causa delle ali più grandi e della presenza dell'ovopositore (Figura 1A). Protocolli dettagliati per l'allevamento di N. vitripennis si trovano anche in altreletterature 13,14,15.- Aggiungere due host S. bullata per tubo e mantenere le vespe a 25 ± 1 °C e 30% di umidità relativa, con un ciclo luce-buio 12:12 per 2-3 giorni.
NOTA: Le vespe possono essere mantenute a temperatura più bassa o a temperatura ambiente; tuttavia, lo sviluppo sarà rallentato.
- Aggiungere due host S. bullata per tubo e mantenere le vespe a 25 ± 1 °C e 30% di umidità relativa, con un ciclo luce-buio 12:12 per 2-3 giorni.
- Dopo 2-3 giorni, con l'aiuto di un pennello a punta fine, rimuovere delicatamente le femmine per evitare ovideposizione continua e astronia nello sviluppo della prole.
NOTA: le femmine rimosse possono facoltativamente essere ri-ospitate o conservate a 5 °C per un massimo di un mese.- Mantenere l'ospite parassitato a 25 °C e al 30% di umidità relativa, con un ciclo luce-buio 12:12 per 7 giorni se lo stadio di iniezione desiderato richiede pupe bianche; per 13 giorni se lo stadio di sviluppo richiesto è pupe nere; o 14 giorni per giovani adulti appena emersi.
NOTA: Le pupe gialle e nere possono anche essere conservate a 5 °C per un massimo di una settimana. Una conservazione più lunga aumenterà la frequenza della diapausa nelle larve per la prossima generazione, rendendo più difficile lo screening post-iniezione e la creazione di linee mutanti. - Aprire il puparium ospite con un ago sezionante per recuperare n. vitripennis pupe e adulti nella fase desiderata(Figura 1A).
NOTA: Per le iniezioni in una particolare età adulta o per la raccolta di femmine vergini, si consiglia di rimuovere le pupe scure il giorno 13 dall'ospite, separate dal sesso, e raccogliere gli adulti dopo l'emergenza.
- Mantenere l'ospite parassitato a 25 °C e al 30% di umidità relativa, con un ciclo luce-buio 12:12 per 7 giorni se lo stadio di iniezione desiderato richiede pupe bianche; per 13 giorni se lo stadio di sviluppo richiesto è pupe nere; o 14 giorni per giovani adulti appena emersi.
2. Allineamento delle pupe bianche e nere
- Preparare uno scivolo di vetro applicando una linea di colla scolastica al centro. Stendere la colla con un ago di sezionazione per ottenere uno strato spesso (Figura 1B), che verrà utilizzato per allineare le pupe. Lasciare asciugare la colla per ~ 2 minuti prima di trasferire le pupe.
NOTA: Non inceffezionare escolare la colla, altrimenti le pupe non saranno correttamente attaccate allo scivolo e scivoleranno durante le iniezioni. - Al microscopio sezionato, utilizzando l'ago di sezionazione, applicare la colla sul retro della testa della pupa.
- Attaccare la pupa allo strato di colla sullo scivolo con l'addome rivolto verso l'alto. Allineare 20-30 pupe fianco a fianco sullo scivolo (Figura 1C).
NOTA: Evitare di toccare l'addome con la colla ed evitare di immergere le pupe nella colla; altrimenti, gli adulti non saranno in grado di emergere. - Posizionare lo scivolo con le pupe in una piastra di Petri per lasciare asciugare la colla per ~ 10 minuti. Prima di iniziare le iniezioni, testare l'aderenza delle pupe alla colla spingendole delicatamente con l'ago di sezionazione. Se la maggior parte delle pupe viene allentata, preparare una nuova diapositiva. In alternativa, rimuovere tutte le pupe sciolte e procedere a iniettare quelle correttamente attaccate alla diapositiva.
3. Preparazione dell'ago
- Caricare un tubo di vetro capillare in un estrattore di ago e tirare gli aghi seguendo le istruzioni del produttore.
NOTA: In questa dimostrazione vengono utilizzati un estrattore di aghi a filamento di platino P-1000 e capillari in vetro silicato di alluminio. Il manuale d'uso di questo strumento (vedi Tabella dei materiali)spiega come caricare correttamente tubi di vetro capillari e impostare programmi su questo strumento. Utilizzare i seguenti parametri (Calore: 536; Trazione: 80; Vel: 100; Ritardo: 70) sui capillari in vetro silicato di alluminio per iniettare pupe gialle, pupe nere e adulti.
Inoltre, l'estrattore ad ago P-2000 è stato utilizzato per preparare aghi al quarzo seguendo iparametri (Calore: 805; Trazione: 145; Vel: 50; Ritardo: 145). Il manuale fornisce istruzioni per il caricamento di tubi di quarzo capillari e l'installazione di programmi in questo strumento. In assenza di estrattore, è disponibile un vetro capillare personalizzabile. - Caricare l'ago con 5 μL della miscela di iniezione (preparata in anticipo seguendo i protocolli precedenti per iniezioni di ribonucleoproteina12 (RNP) RNAi10 o CRISPR/Cas9 in N. vitripennis)utilizzando punte di pipetta microloader.
NOTA: Durante la dimostrazione, l'ago viene caricato con RNA a doppio filamento (dsRNA) combinato con colorante rosso (vedi Tabella dei materiali)per l'iniezione di pupe a stadio bianco e con BAPC-Cas9-sgRNA per iniezione di vespe pupe nere e adulti. Questi reagenti prendono di mira il gene cinabro. Le vespe abbattute / fuori con successo mostreranno occhi rossi invece degli occhi marroni di tipo selvaggio. - Aprire l'ago, facendo scorrere la punta su una superficie composta da due diapositive sovrapposte (Figura 1D). In alternativa, aprire la punta dell'ago con un paio di pini fini per creare un bordo affilato o perforando lentamente il torace o l'addome della vespa.
4. Iniezione pupale con femtojet
- Posizionare la diapositiva con le pupe allineate al microscopio di sezionazione. Inserire l'ago nel tubo di iniezione del femtojet e stringere la testa di presa.
- Guardando l'ago al microscopio, accendere il femtojet e impostare i parametri di iniezione pc e pi ruotando le manopole rotanti.
NOTA: Un valore pc di 600 hPa è consigliato per un flusso continuo del liquido. Il valore del Pc dipende dall'apertura dell'ago. Per gli aghi preparati utilizzando i parametri indicati nell'estrattore dell'ago P-1000, i valori del Pc tra 500 hPa e 700 hPa producono un flusso costante. Se sono richiesti valori più bassi di Pc, ciò indica che l'apertura potrebbe essere troppo grande e potrebbe danneggiare gli insetti, mentre valori più alti indicano che l'ago è ancora chiuso o che l'apertura è troppo piccola. - Inserire con cura l'ago tra i 2 e i 3 segmenti addominali visibili con un angolo verticale di circa 30°(Figura 1E). Iniettare un flusso continuo fino a quando l'intero addome diventa rosa nel caso di pupe a stadio bianco o fino a quando l'addome aumenta di dimensioni nel caso di pupe nere. Interrompere l'iniezione quando è chiaro che l'addome non può assumere altro liquido o quando il liquido inizia a fluire fuori dal corpo. Spostarsi con attenzione alla pupa successiva e ripetere questi passaggi.
NOTA: Evitare di toccare e danneggiare l'ovopositore con l'ago durante l'iniezione. - Trasferire lo scivolo con le pupe iniettate in una piastra di Petri contenente un tovagliolo di carta imbevuto di acqua deionizzata per mantenere l'umidità. Coprire il piatto con il coperchio e posizionarlo a 25 °C fino all'emergere della vespa(Figura 1F).
5. Iniezione pupale con tubo aspiratore
- Calcolare la quantità di miscela di iniezione utilizzando il fattore: 4 pupe iniettate/1 μL soluzione.
NOTA: Un'iniezione tipica di 20-30 pupe richiede ~ 5-8 μL di ribonucleoproteina (RNP) miscela di saponina complessa o RNP con BAPC12. - Allineare le pupe, come suggerito nella sezione 2, e posizionare una diapositiva con le pupe allineate al microscopio di sezionamento (Figura 1E).
- Prendere uno degli aghi capillari e rompere la punta tra due vetrini, come indicato al passaggio 3.4 (Figura 1D). Assicurarsi che la punta dell'ago sia abbastanza aperta da consentire alla soluzione di iniezione di uscire soffiando aria con la bocca, ma non troppo aperta per evitare di perdere liquido e danneggiare le pupe(Figura 1E).
NOTA: Questo passaggio è fondamentale perché l'utente utilizzerà l'aria dalla bocca per spingere la miscela di iniezione nell'emolinfa dell'insetto. È meglio praticare in modo da accertare quale tipo di apertura dell'ago è ottimale per la viscosità di una particolare miscela di soluzioni. Cinque set di iniezioni di 20 pupe per set possono essere sufficienti per abituarsi al sistema di iniezione della bocca. - Caricare un ago con la soluzione di ribonucleoproteina12 utilizzando una punta di microcarico e inserire l'ago nel pacchetto di connettori dell'assieme del tubo aspiratore.
NOTA: Durante la dimostrazione, l'ago viene caricato con BAPC-Cas9-sgRNA che prende di mira il gene cinabro Nasonia 12. - Inserire con cura l'ago tra i 2 e i 3 segmenti addominali visibili con un angolo verticale di circa 30°(Figura 1E). Iniettare un flusso continuo fino a quando l'intero addome diventa rosa nel caso di pupe a stadio bianco o fino a quando l'addome aumenta di dimensioni nel caso di pupe nere. Interrompere l'iniezione quando è chiaro che l'addome non può assumere più liquido o quando il liquido inizia a fluire fuori dal corpo. Spostarsi con attenzione alla pupa successiva e ripetere questi passaggi
NOTA: Evitare di toccare e danneggiare l'ovopositore con l'ago durante l'iniezione. - Trasferire lo scivolo con le pupe iniettate in una piastra di Petri contenente un tovagliolo di carta imbevuto di acqua deionizzata per mantenere l'umidità. Coprire il piatto con il coperchio e posizionarlo a 25 °C fino all'emergere della vespa(Figura 1F).
6. Iniezione per adulti con tubo aspiratore
- Per la preparazione degli adulti, gruppi separati di 20 femmine vergini in una piccola provetta pulita con un pennello fine. Posizionare il tubo sul ghiaccio per 5 minuti fino a quando le femmine non vengono anestetizzate. In alternativa, le femmine possono essere anestetizzate e iniettate utilizzando CO2.
NOTA: Il ghiaccio è preferibile come anestetico in quanto le vespe adulte sono tolleranti al freddo e si riprendono facilmente dopo le iniezioni. Le femmine possono assumere più liquido iniettato rispetto alle pupe: 1 μL di soluzione può essere utilizzato per tre femmine invece che per quattro pupe. Preparare i volumi di conseguenza. - Preparare un secchio di ghiaccio, posizionando uno scivolo di vetro sopra il ghiaccio. Allineare le femmine fianco a fianco sullo scivolo freddo con gli addome rivolti verso l'alto (Figura 1E) sotto un mirino di sezionazione.
- Caricare un ago con la soluzione di ribonucleoproteina12 utilizzando una punta di microcarico e inserire l'ago nel pacchetto di connettori dell'assieme del tubo aspiratore. Sostenere le femmine dal lato opposto con aghi di sezionazione smussati mentre si inietta lentamente nell'addome dall'altro lato. Evitare di toccare l'ovopositore, ciò danneggerà gravemente questa struttura riproduttiva critica (Figura 1E).
NOTA: entrambi gli orientamenti sono accettabili, a seconda delle preferenze dell'operatore. - Inserire con cura l'ago tra i 2 e i 3 segmenti addominali visibili con un angolo verticale di circa 30°(Figura 1E). Iniettare la soluzione nell'addome femminile, fermandosi quando non può entrare più liquido o quando si osserva una perdita di soluzione in eccesso. Spostarsi con attenzione alla vespa successiva e ripetere questi passaggi
NOTA: Iniettare lentamente, lasciando l'ago all'interno dell'addome per circa 3 s prima di rimuoverlo molto lentamente. Ciò aiuterà a regolare la pressione interna del liquido ed evitare perdite di soluzione dal sito di iniezione dopo la rimozione dell'ago. - Al termine, trasferire delicatamente singole femmine iniettate in un nuovo tubo con un ospite utilizzando un pennello. Lasciare recuperare a temperatura ambiente per circa 1 h, confermando la sopravvivenza, quindi riportare i tubi all'incubatore di allevamento.
NOTA: Durante la dimostrazione, l'ago viene caricato con BAPC-Cas9-sgRNA che prende di mira il gene cinabro Nasonia 12.
7. Cura post-iniezione e screening mutante
- Dopo l'esclusione adulta dalle pupe iniettate, posizionare singole vespe in un tubo di vetro collegato con cotone e inserire un ospite S. bullata (Figura 1G). Al contrario, posizionare le femmine iniettate in singoli tubi con ospiti immediatamente dopo l'iniezione.
- Per gli esperimenti knockout CRISPR/Cas9, consentire alle femmine di parassitare gli ospiti per un giorno e sostituire l'ospite ogni giorno per tre giorni consecutivi.
NOTA: A causa del sistema di determinazione del sesso aplodiploide in N. vitripennis16, le femmine vergini produrranno covate maschili aploidi, il che facilita l'individuazione di mutazioni. Per il knockdown tramite RNAi di geni specifici maschili, gli individui iniettati possono essere singolarmente accoppiati con individui di tipo selvatico e autorizzati a parassitare gli ospiti. Utilizzare un host al giorno e sostituire gli host in base alla configurazione sperimentale. - Posizionare gli ospiti parassiti a 25 °C fino all'emergere della prole maschile G0 (per ~ 13-14 giorni).
- Al microscopio sezionato, schermo G0 maschi per i fenotipi mutati. Il gene cinabro è responsabile della pigmentazione oculare12:le vespe con gli occhi marroni sono di tipo selvaggio e le vespe con occhi rosso vivo o le variazioni tra gli occhi rossi e marroni sono mutanti(Figura 1H).
8. Croci e allevamento post-iniezione
- Posizionare tutti i maschi G0 mutanti con gli occhi rossi (il gene cinnabar12interrotto fenotipicamente)con femmine vergini di tipo selvatico per 1-2 giorni(Figura 2A).
NOTA: Se il gene interrotto non conferisce un fenotipo visibile, è necessaria una reazione a catena della polimerasi (PCR) seguita dal sequenziamento del gene bersaglio per identificare gli animali mutanti. Prima di ottenere il DNA dai maschi G0 per pcr, sarebbe l'ideale accoppiarli con femmine vergini di tipo selvatico. In alternativa, estrarre il DNA da una gamba di un maschio G0 per identificare i mutanti e accoppiare solo quelli con mutazioni verificate. - Aggiungere due ospiti S. bullata per femmina e lasciare ovoposit a 25 °C e 30% di umidità relativa con un ciclo luce-buio 12:12. Sostituisci i padroni di casa ogni 2-3 giorni.
- Conservare gli ospiti parassitizzati a 25 °C e al 30% di umidità relativa, con un ciclo luce-buio 12:12 per ~ 10 giorni.
- Dopo ~ 10 giorni, aprire l'ospite parassitato con un ago di sezionazione e rimuovere ogni pupa di N. vetripennis dall'ospite.
- Con l'aiuto di un pennello a punta fine, selezionare pupe femminili (Figura 1A).
NOTA: Le femmine sono diploidi ed eterozigoti, e quindi il colore degli occhi sarà di tipo selvaggio.
- Posizionare 15-20 pupe femminili in tubi di vetro a 25 °C fino all'emergenza. Dopo l'emergenza, aggiungi ~20 ospiti S. bullata e lascia che le femmine vergini G1 parassitano i padroni di casa per 2-3 giorni.
NOTA: Queste femmine produrranno il 50% di maschi mutanti G2.- Conservare gli ospiti parassitizzati a 25 °C e al 30% di umidità relativa, con un ciclo di buio chiaro 12:12 fino all'emergere adulto maschio G2.
- Posizionare le restanti pupe G1 a 5 °C per 8-10 giorni. Dopo questo periodo, rimuoverli e posizionarli a 25 °C e al 30% di umidità relativa, con un ciclo luce-buio 12:12 fino all'emergere(Figura 2A).
- Dopo l'emergere dei maschi G2 nel passaggio 8.3.1, schermo per la presenza di fenotipo mutante dagli occhi rossi. Con l'aiuto di un pennello a punta fine, separare i maschi dagli occhi rossi dai maschi di tipo selvatico.
NOTA: La presenza di vespe dagli occhi rossi in questa generazione (G2, Figura 2A) indica che l'editing genico si è verificato nella linea germinale e che la mutazione è ereditaria. - Posizionare i maschi dagli occhi rossi con le femmine G1 appena emerse nel passaggio 8.3.2 (Figura 2A), e lasciarli accoppiare per 1-2 giorni. Aggiungere 2 ospiti S. bullata per femmina e posizionarli a 25 °C e al 30% di umidità relativa con un ciclo di buio chiaro 12:12 per 10-11 giorni.
- Dopo 10-11 giorni, aprire l'ospite parassitato con un ago di sezionazione e rimuovere ogni pupa di N. vetripennis dall'ospite (Figura 2A).
- Con l'aiuto di un pennello a punta fine, separare le vespe dagli occhi rossi (maschi e femmine) dal tipo selvaggio(Figura 1H). Continuare l'allevamento di vespe dagli occhi rossi insieme in tubi di vetro e non mescolarsi con le vespe di tipo selvaggio.
NOTA: In questa fase (G3, Figura 2A),i maschi aploidi e le femmine diploidi trasportano e mostrano fenotipi per le mutazioni cinnabare. Se il gene interessato codifica per un fenotipo invisibile, attraversare G0 maschio singolarmente con una femmina di tipo selvatico per ~1 giorno. Quindi, rimuovere il maschio per la caratterizzazione molecolare della mutazione da PCR e sequenziamento, e lasciare che la femmina parassita un ospite. Continuare lo schema di incrocio solo con la prole di un maschio mutante confermato (Figura 2B). Se l'obiettivo è il knockdown da parte di RNAi di un gene candidato, eseguire il saggio funzionale desiderato (come letalità, sterilità o saggio di induzione della diapausa3,7 )direttamenteusando individui iniettati con dsRNA. Poiché RNAi è transitorio, non è possibile generare una colonia con il fenotipo desiderato (Figura 2C)3,7.

Figura 1: Cronologia per la microiniezione nasonia vitripennis pupale e adulta. (A) Le pupe bianche (in alto) e nere (in basso) sono raccolte, (B-C) allineate e incollate ad un vetrino per iniezione. (D) L'ago capillare viene preparato e aperto, facendolo scorrere su due vetrini sovrapposti. (E) L'ago è attaccato al Femtojet (in alto) o a un tubo aspiratore (in basso) per le iniezioni. (F) Le pupe iniettate sullo scivolo vengono trasferite in una piastra di Petri con un tessuto bagnato sul fondo per mantenere l'umidità. All'emergenza,le femmine (G)sono poste singolarmente in piccoli tubi di vetro e possono ovoposirsi sulla pupa di sarcofago. (H) Screening della prole per rilevare i mutanti. Clicca qui per visualizzare una versione più grande di questa figura.
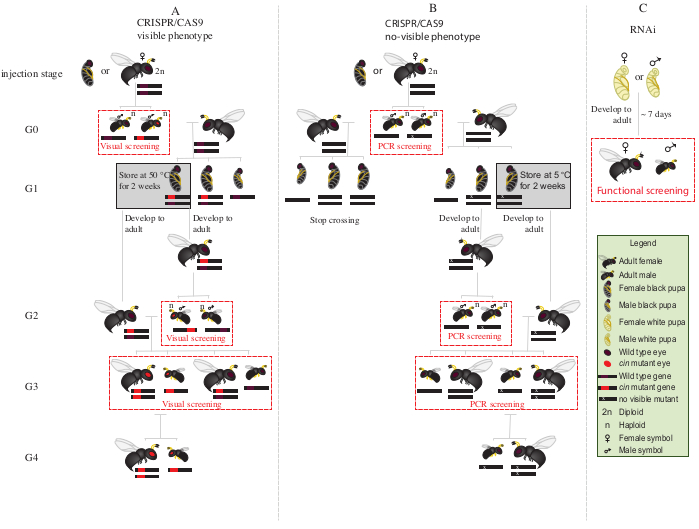
Figura 2: Schema di incrocio dopo iniezione. Rappresentazione schematica della procedura di crossing scheme nel caso di editing genico mediato da CRISPR/Cas9 di geni (A) che inducono un fenotipo visibile e (B) che non conferiscono fenotipo visibile. (C) Rappresentazione schematica della procedura di screening RNAi. Abbreviazioni: cin = cinabro; PCR = reazione a catena della polimerasi. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Questo documento presenta due semplici metodi per la microiniezione pupale e adulta, utilizzando un femtojet o un tubo aspiratore. Il primo metodo consente un'iniezione più precisa di liquido, che è importante per la consistenza RNAi, mentre il secondo consente l'iniezione di maggiori quantità di liquido in pupe nasonia o adulti.
I risultati rappresentativi presentati nella tabella 1 mostrano buoni t...
Discussione
Con il recente aumento dell'uso di Nasonia vitripennis come organismo modello per varie questioni biologiche2,3,7,17, è necessario sviluppare e ottimizzare metodi di iniezione per consentire un protocollo semplificato ed efficiente per l'analisi funzionale dei geni N. vitripennis. Gli attuali metodi che prevedono la microiniezione embrionale di reagenti per l'editing genico
Divulgazioni
JLR e DCR hanno presentato istanza di protezione brevettuale provvisoria sulla tecnologia remot control. O.S.A è uno dei fondatori di Agragene, Inc., ha una partecipazione azionaria e fa parte del Scientific Advisory Board della società. Tutti gli altri autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto in parte da fondi di avviamento UCSD diretti a O.S.A. e NSF/BIO 1645331 a J.L.R.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
Riferimenti
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon