É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Injeções de pupal e adultos para edição de genes RNAi e CRISPR em Nasonia vitripennis
Neste Artigo
Resumo
Aqui, descrevemos métodos para injeções pupais eficientes e adultas em Nasonia vitripennis como alternativas acessíveis à microinjeção de embriões, permitindo a análise funcional de genes de interesse usando RNA-silenciamento via interferência de RNA (RNAi) ou nocaute genético via edição de genoma CRISPR/Cas9.
Resumo
A vespa joia, Nasonia vitripennis,tornou-se um sistema modelo eficiente para estudar epigenética da determinação sexual haplo-diploide, biologia do cromossomo B, interações hospedeiras-simbiontes, especiação e síntese de veneno. Apesar da disponibilidade de várias ferramentas moleculares, incluindo CRISPR/Cas9, estudos genéticos funcionais ainda são limitados neste organismo. A maior limitação da aplicação da tecnologia CRISPR/Cas9 em N. vitripennis decorre dos desafios das microinjeções embrionárias. As injeções de embriões são particularmente difíceis neste organismo e, em geral, em muitas vespas parasitoides, devido ao pequeno tamanho de embrião e à exigência de uma pupa hospedeira para o desenvolvimento embrionário. Para enfrentar esses desafios, o parto complexo de ribonucleoproteína Cas9 em ovários femininos por injeção adulta, em vez de microinjeção embrionária, foi otimizado, resultando em edições germinas somáticas e herediáveis. Os procedimentos de injeção foram otimizados em pupas e vespas fêmeas usando controle remot (Transdução de ovário Mediado por Receptor de Carga) ou BAPC (Cápsulas de Peptídeos Anfífilos Ramificados). Esses métodos são mostrados como alternativas eficazes à injeção de embriões, permitindo mutações germinas específicas do local e hereiáveis.
Introdução
A edição de genes CRISPR/Cas9 é uma tecnologia poderosa para estudos genéticos funcionais, especialmente em muitos organismos modelo em ascensão, como a vespa-jóia, Nasonia vitripennis. A facilidade de criação e a disponibilidade de um genoma completo fazem da vespa joia um importante sistema experimental para elucidar os mecanismos moleculares de diferentes processos biológicos. Por exemplo, n. vitripennis tem sido recentemente usado para desvendar a base epigenética do sistema de determinação sexual haplodiploide1,2, a biologia dos cromossomos B3,4,5,6, e a base genética para a regulação circadiana e sazonal7,8. Algumas das características que tornam n. vitripennis favoráveis ao trabalho incluem tempo de geração curta (~2 semanas a 25 °C), altas taxas de reprodução, separação sexual fácil na fase pupal, e a capacidade de diapausa e armazenar cepas a 4 °C. O ciclo de vida começa com vespas fêmeas parasitando a pupa da mosca-do-sopro, Sarcófaga bullata. Através de seu ovipositor, as fêmeas colocam até 50 ovos no caso pupal da mosca-do-sopro. Os ovos se desenvolvem em larvas que se alimentam da pupa S. bullata, continuam a se desenvolver nos próximos dias, e depois filhotes, seguidos de eclosão adulta e surgimento do pupário hospedeiro9.
Ferramentas moleculares para a realização de estudos genéticos funcionais em N. vitripennis, como a interferência de RNA (RNAi)10 e CRISPR/Cas911,12, estão disponíveis, mas são limitadas, principalmente devido a dificuldades na realização de microinjeções embrionárias13. Como os ovos de vitripennis n. exigem um hospedeiro pupal para o desenvolvimento, a manipulação de ovos é muito desafiadora. Os embriões em estágio pré-blastoderm devem ser coletados do hospedeiro blowfly pupae, rapidamente microinjetados, e imediatamente transferidos de volta para o hospedeiro para o desenvolvimento13. Essas etapas requerem treinamento de precisão e especialização para evitar danificar os embriões microinjetados ou os hospedeiros pupal13. Além disso, os ovos são muito pequenos e frágeis, especialmente após microinjeções, com um citoplasma muito viscoso causando um entupimento contínuo da agulha injetora13. Essas características tornam as microinjeções embrionárias excepcionalmente desafiadoras, exigindo operadores altamente treinados e equipamentos especializados que estão ausentes na maioria dos laboratórios de N. vitripennis.
A otimização de métodos alternativos de injeção para a entrega de reagentes CRISPR contribuiria para a consolidação de N. vitripennis como organismo modelo. A manipulação de pupas e adultos é menos desafiadora do que manipular embriões e pode ser realizada com uma configuração básica de injeção. Aqui, dois protocolos são descritos para injeção de pupas e adultos: um envolvendo equipamentos especializados para injeções, e outro envolvendo o uso de um conjunto de tubos aspiradores equipados com uma agulha capilar de vidro. O uso de tubo aspirador é particularmente adequado para laboratórios que não têm acesso a equipamentos especializados para microinjeções de embriões. Injeções eficientes de diferentes estágios de desenvolvimento de N. vitripennis, incluindo pupas brancas ou pretas e vespas adultas, são demonstradas. Vespas na fase pupal branca são particularmente adequadas para experimentos de knockdown mediados pela RNAi. Embora o RNAi em Nasonia tenha sido descrito pela primeira vez por Lynch e Desplan em 200610,não há procedimento visual disponível para a forma como as injeções RNAi são realizadas. RNAi foi recentemente usado para descobrir o gene haploidizador do B-cromossomo PSR (Relação Sexual Paternal)3 e estudar o envolvimento do gene do relógio, período, em ritmos biológicos N. vitripennis 7.
Pupas pretas e vespas adultas podem ser usadas para induzir a edição de genes germânicos CRISPR/Cas9 usando protocolos de Controle de Ovário ReMOT (Transdução de Ovário Mediado por Receptor) e BAPC (Cápsulas de Peptídeos Anfífilos Ramificados). Estes dois métodos de entrega de ovários foram recentemente descritos como eficazes na Nasonia para a geração de mutações germinas no gene alvo, cinnabar7,12. Aqui, é fornecido um protocolo simplificado para injeções, incluindo um procedimento visual de uma metodologia passo a passo para injeções pupal e adultas que podem ser utilizadas para gerar estudos genéticos funcionais na Nasonia e provavelmente em outras vespas parasitoides, sem exigir equipamentos especializados e contornar microinjeções embrionárias.
Protocolo
1. Criação de Nasonia
- Configure ~20 fêmeas acasaladas singularmente em pequenos tubos de teste de vidro conectados com algodão.
NOTA: Para reduzir o espaço de criação, os tubos de 10 x 85 cm, de 4 mL são ótimos. As fêmeas são facilmente distinguidas dos machos por causa das asas maiores e da presença do ovipositor (Figura 1A). Protocolos detalhados para criação de N. vitripennis também podem ser encontrados em outrasliteraturas 13,14,15.- Adicione dois hospedeiros de S. bullata por tubo, e mantenha as vespas a 25 ± 1 °C e 30% de umidade relativa, com um ciclo claro-escuro de 12:12 por 2-3 dias.
NOTA: As vespas podem ser mantidas em temperatura mais baixa ou temperatura ambiente; no entanto, o desenvolvimento será desacelerado.
- Adicione dois hospedeiros de S. bullata por tubo, e mantenha as vespas a 25 ± 1 °C e 30% de umidade relativa, com um ciclo claro-escuro de 12:12 por 2-3 dias.
- Após 2-3 dias, com a ajuda de um pincel de ponta fina, remova suavemente as fêmeas para evitar a oviposição contínua e a assincronia no desenvolvimento da prole.
NOTA: As fêmeas removidas podem ser hospedadas ou armazenadas a 5 °C por até um mês.- Mantenha o hospedeiro parasita em 25 °C e 30% de umidade relativa, com um ciclo claro-escuro de 12:12 por 7 dias se o estágio de injeção desejado exigir pupas brancas; por 13 dias, se o estágio de desenvolvimento necessário for pupae preto; ou 14 dias para adultos jovens e recém-emergido.
NOTA: Pupas amarelas e pretas também podem ser armazenadas a 5 °C por até uma semana. Um armazenamento mais longo aumentará a frequência de diapausa em larvas para a próxima geração, dificultando a triagem pós-injeção e o estabelecimento de linhas mutantes. - Abra o puparium hospedeiro com uma agulha dissecando para recuperar n. vitripennis pupae e adultos na fase desejada(Figura 1A).
NOTA: Para injeções em uma determinada idade adulta ou para coletar fêmeas virgens, recomenda-se remover a pupa escura no dia 13 do hospedeiro, separar-se por sexo e coletar adultos após o surgimento.
- Mantenha o hospedeiro parasita em 25 °C e 30% de umidade relativa, com um ciclo claro-escuro de 12:12 por 7 dias se o estágio de injeção desejado exigir pupas brancas; por 13 dias, se o estágio de desenvolvimento necessário for pupae preto; ou 14 dias para adultos jovens e recém-emergido.
2. Alinhamento de pupas brancas e pretas
- Prepare um slide de vidro aplicando uma linha de cola escolar no centro. Espalhe a cola com uma agulha dissecando para obter uma camada grossa(Figura 1B),que será usada para alinhar a pupa. Deixe a cola secar por ~2 minutos antes de transferir a pupa.
NOTA: Não dou o excesso de cola, caso contrário, a pupa não estará adequadamente presa ao slide e escorregará durante as injeções. - Sob um microscópio dissecando, usando a agulha dissecando, aplique cola na parte de trás da cabeça da pupa.
- Coloque a pupa na camada de cola na lâmina com o abdômen virado para cima. Alinhe 20-30 pupae lado a lado no slide(Figura 1C).
NOTA: Evite tocar o abdômen com a cola e evite submergir a pupa na cola; caso contrário, os adultos não serão capazes de emergir. - Coloque o slide com a pupa em uma placa de Petri para deixar a cola secar por ~10 min. Antes de iniciar as injeções, teste a adesão da pupa à cola empurrando-as suavemente com a agulha dissecando. Se a maioria das pupas forem soltas, prepare um novo slide. Alternativamente, remova todas as pupas que estão soltas e prossiga para injetar aquelas que estão devidamente presas ao slide.
3. Preparação da agulha
- Coloque um tubo de vidro capilar em um puxador de agulhas e puxe agulhas seguindo as instruções do fabricante.
NOTA: Um puxador de agulha de filamento de platina P-1000 e capilares de vidro silicato de alumínio são usados nesta demonstração. O manual de operação deste instrumento (ver Tabela de Materiais) explica como carregar adequadamente tubos de vidro capilar e configurar programas neste instrumento. Use os seguintes parâmetros (Calor: 536; Puxão: 80; Vel: 100; Atraso: 70) em capilares de vidro silicato de alumínio para injetar pupas amarelas, pupas pretas e adultos.
Além disso, o puxador de agulhas P-2000 foi usado para preparar agulhas de quartzo seguindo os parâmetros (Calor: 805; Tração: 145; Vel: 50; Atraso: 145). O manual fornece instruções para o carregamento de tubos de quartzo capilar e a instalação de programas neste instrumento. Na ausência de um puxador, vidro capilar personalizável está disponível. - Carregue a agulha com 5 μL da mistura de injeção (preparada com antecedência seguindo protocolos anteriores para as injeções de de10 RNAi ou CRISPR/Cas912 (RNP) em N. vitripennis) utilizando pontas de pipeta de microcarregador.
NOTA: Durante a demonstração, a agulha é carregada com RNA de dois fios (dsRNA) combinado com corante vermelho (ver Tabela de Materiais) para injeção de pupae de estágio branco e com BAPC-Cas9-sgRNA para injeção de vespas pupas pretas e adultos. Estes reagentes terão como alvo o gene cinnabar. Vespas que são derrubadas/para fora com sucesso mostrarão olhos vermelhos em vez do tipo selvagem de olhos castanhos. - Abra a agulha, deslizando a ponta sobre uma superfície feita de dois slides sobrepostos(Figura 1D). Alternativamente, abra a ponta da agulha com um par de fórceps finos para criar uma borda afiada ou perfurando lentamente o tórax ou abdômen da vespa.
4. Injeção de pupal com femtojet
- Coloque o slide com a pupae alinhada sob um microscópio dissecando. Insira a agulha no tubo de injeção do femtojet e aperte a cabeça de aperto.
- Olhando para a agulha sob o microscópio, ligue o femtojet e configure parâmetros de injeção de Pc e Pi girando os botões rotativos.
NOTA: Recomenda-se um valor de Pc de 600 hPa para um fluxo contínuo do líquido. O valor do Pc depende da abertura da agulha. Para agulhas preparadas utilizando os parâmetros indicados no puxador de agulha P-1000, os valores do Pc entre 500 hPa e 700 hPa produzem um fluxo constante. Se forem necessários valores mais baixos de Pc, isso indica que a abertura pode ser muito grande e pode danificar os insetos, enquanto valores mais altos indicam que a agulha ainda está fechada, ou que a abertura é muito pequena. - Insira cuidadosamente a agulha entre os segmentos abdominais visíveis 2 e 3 com ângulo vertical de cerca de 30°(Figura 1E). Injete com um fluxo contínuo até que todo o abdômen fique rosa no caso de pupas em estágio branco, ou até que o abdômen aumente de tamanho no caso de pupas pretas. Pare de injetar quando estiver claro que o abdômen não pode tomar mais líquido, ou quando o líquido começa a fluir para fora do corpo. Mova-se cuidadosamente para a próxima pupa e repita esses passos.
NOTA: Evite tocar e danificar o ovipositor com a agulha durante a injeção. - Transfira o slide com a pupae injetada para uma placa de Petri contendo uma toalha de papel encharcada com água deionizada para manter a umidade. Cubra o prato com sua tampa e coloque-o a 25 °C até o surgimento devespas (Figura 1F).
5. Injeção de pupal com tubo aspirador
- Calcule a quantidade de mistura de injeção usando o fator: 4 solução injetada de pupae/1 μL.
NOTA: Uma injeção típica de 20-30 pupas requer ~ 5-8 μL de ribonucleoproteína (RNP) mistura complexa-saponina ou RNP com BAPC12. - Alinhe a pupa, conforme sugerido na seção 2, e coloque um slide com a pupae alinhada sob um microscópio dissecando(Figura 1E).
- Pegue uma das agulhas capilares e quebre a ponta entre dois slides de vidro, conforme indicado na etapa 3.4(Figura 1D). Certifique-se de que a ponta da agulha está aberta o suficiente para permitir que a solução de injeção saia soprando ar com a boca, mas não muito aberta para evitar perder líquido e danificar a pupae (Figura 1E).
NOTA: Este passo é crítico porque o usuário estará usando o ar da boca para empurrar a mistura de injeção para o hemolífio do inseto. É melhor praticar de modo a verificar que tipo de abertura de agulha é ideal para a viscosidade de uma determinada mistura de soluções. Cinco conjuntos de injeções de 20 pupas por conjunto podem ser suficientes para se acostumar com o sistema de injeção bucal. - Carregue uma agulha com a solução de ribonucleoproteína12 usando uma ponta de microcarregamento e insira a agulha no pacote do conector do conjunto do tubo aspirador.
NOTA: Durante a demonstração, a agulha é carregada com BAPC-Cas9-sgRNA visando o gene Nasonia cinnabar 12. - Insira cuidadosamente a agulha entre os segmentos abdominais visíveis 2 e 3 com ângulo vertical de cerca de 30°(Figura 1E). Injete com um fluxo contínuo até que todo o abdômen fique rosa no caso de pupas de estágio branco ou até que o abdômen aumente de tamanho no caso de pupas pretas. Pare de injetar quando estiver claro que o abdômen não pode tomar mais líquido ou quando o líquido começa a fluir para fora do corpo. Mova-se cuidadosamente para a próxima pupa e repita esses passos
NOTA: Evite tocar e danificar o ovipositor com a agulha durante a injeção. - Transfira o slide com a pupae injetada para uma placa de Petri contendo uma toalha de papel encharcada com água deionizada para manter a umidade. Cubra o prato com a tampa e coloque-o a 25 °C até o surgimento davespa (Figura 1F).
6. Injeção adulta com tubo aspirador
- Para preparação adulta, grupos separados de 20 fêmeas virgens em um pequeno tubo de ensaio limpo com um pincel fino. Coloque o tubo no gelo por 5 minutos até que as fêmeas sejam anestesiadas. Alternativamente, as fêmeas podem ser anestesiadas e injetadas usando CO2.
NOTA: O gelo é preferível como um anestésico, pois as vespas adultas são tolerantes ao frio e se recuperam facilmente após as injeções. As fêmeas podem tomar mais líquido injetado do que a pupa: 1 μL de solução pode ser usada para três fêmeas em vez de para quatro pupas. Prepare os volumes de acordo. - Prepare um balde de gelo, colocando um deslizamento de vidro em cima do gelo. Alinhe as fêmeas lado a lado na lâmina fria com os abdômens voltados para cima(Figura 1E) sob um escopo dissecando.
- Carregue uma agulha com a solução de ribonucleoproteína12 usando uma ponta de microcarregamento e insira a agulha no pacote do conector do conjunto do tubo aspirador. Apoie as fêmeas do lado oposto com agulhas dissecando sem cortes enquanto injeta lentamente no abdômen do outro lado. Evite tocar no ovipositor, isso danificará severamente esta estrutura reprodutiva crítica(Figura 1E).
NOTA: Qualquer orientação é aceitável, dependendo da preferência do operador. - Insira cuidadosamente a agulha entre os segmentos abdominais visíveis 2 e 3 com ângulo vertical de cerca de 30°(Figura 1E). Injete a solução no abdômen feminino, parando quando não houver mais líquido, ou quando o vazamento de solução excedente for observado. Mova-se cuidadosamente para a próxima vespa e repita esses passos
NOTA: Injete lentamente, deixando a agulha dentro do abdômen por cerca de 3 s antes de removê-la muito lentamente. Isso ajudará a ajustar a pressão líquida interna e evitar o vazamento da solução do local da injeção após a remoção da agulha. - Quando terminar, transfira suavemente fêmeas injetadas para um novo tubo com um hospedeiro usando um pincel. Deixe se recuperar à temperatura ambiente por aproximadamente 1h, confirmando a sobrevivência e, em seguida, devolva os tubos para a incubadora de criação.
NOTA: Durante a demonstração, a agulha é carregada com BAPC-Cas9-sgRNA visando o gene Nasonia cinnabar 12.
7. Cuidados pós-injeção e triagem mutante
- Após a eclosão adulta da pupae injetada, coloque vespas únicas em um tubo de vidro plugado com algodão e insira um hospedeiro S. bullata (Figura 1G). Em contraste, coloque fêmeas injetadas em tubos individuais com hospedeiros imediatamente após a injeção.
- Para experimentos de nocaute CRISPR/Cas9, permita que as fêmeas parasitizem os anfitriões por um dia, e substituam o anfitrião todos os dias por três dias consecutivos.
NOTA: Devido ao sistema de determinação sexual haplodiploide em N. vitripennis16,as fêmeas virgens produzirão ninhadas machos haploides, o que facilita a detecção de mutações. Para o knockdown via RNAi de genes específicos do sexo masculino, os indivíduos injetados podem ser singularmente acoplados com indivíduos do tipo selvagem e autorizados a parasitar hospedeiros. Use um host por dia e substitua os hosts com base na configuração experimental. - Coloque os anfitriões parasitas a 25 °C até o surgimento da prole masculina G0 (por ~13-14 dias).
- Sob um microscópio dissecando, tela G0 machos para os fenótipos mutantes. O gene cinnabar é responsável pela pigmentação dos olhos12: vespas com olhos castanhos são do tipo selvagem, e vespas com olhos vermelhos brilhantes ou variações entre olhos vermelhos e castanhos são mutantes(Figura 1H).
8. Cruzes pós-injeção e rearmamento
- Coloque todos os machos G0 mutantes com olhos vermelhos (o gene cinnabar12fenotipicamente interrompido) com fêmeas virgens do tipo selvagem por 1-2 dias(Figura 2A).
NOTA: Se o gene interrompido não conferir um fenótipo visível, a reação em cadeia de polimerase (PCR) seguida de sequenciamento do gene alvo é necessária para identificar os animais mutantes. Antes de obter o DNA de machos G0 para PCR, seria ideal acasalá-los com fêmeas virgens selvagens. Alternativamente, extrair DNA de uma perna de um macho G0 para identificar mutantes, e acasalar apenas aqueles com mutações verificadas. - Adicione dois hospedeiros de S. bullata por fêmea, e deixe ovipositar a 25 °C e 30% de umidade relativa com um ciclo claro-escuro de 12:12. Substitua os anfitriões a cada 2-3 dias.
- Armazenar hosts parasitas a 25 °C e 30% de umidade relativa, com um ciclo claro-escuro de 12:12 por ~10 dias.
- Após ~10 dias, abra o hospedeiro parasitado com uma agulha dissecando, e remova cada pupa N. vitripennis do hospedeiro.
- Com a ajuda de um pincel de ponta fina, selecione pupae fêmea (Figura 1A).
NOTA: As fêmeas são diploides e heterozigous, e assim a cor dos olhos será do tipo selvagem.
- Coloque 15-20 pupas fêmeas em tubos de vidro a 25 °C até o surgimento. Após o surgimento, adicione ~20 anfitriões de bullata s. e deixe as fêmeas virgens G1 parasitarem os anfitriões por 2-3 dias.
NOTA: Estas fêmeas produzirão 50% de machos mutantes G2.- Armazenar hosts parasitas a 25 °C e 30% de umidade relativa, com um ciclo claro-escuro de 12:12 até o G2 adulto masculino.
- Coloque o restante g1 pupae a 5 °C durante 8-10 dias . Após esse período, remova-os e coloque-os a 25 °C e 30% de umidade relativa, com um ciclo claro-escuro de 12:12 até o surgimento(Figura 2A).
- Após o surgimento dos machos G2 na etapa 8.3.1, tela para a presença de fenótipo mutante de olhos vermelhos. Com a ajuda de um pincel de ponta fina, separam machos de olhos vermelhos de machos selvagens.
NOTA: A presença de vespas de olhos vermelhos nesta geração (G2, Figura 2A) indica que a edição de genes ocorreu na linha germinal, e que a mutação é hereditária. - Coloque os machos de olhos vermelhos com as fêmeas G1 recém-emergidas na etapa 8.3.2 (Figura 2A),e deixe-os acasalar por 1-2 dias. Adicione 2 anfitriões de s. bullata por fêmea, e coloque-os a 25 °C e 30% de umidade relativa com um ciclo claro-escuro de 12:12 por 10-11 dias.
- Após 10-11 dias, abra o hospedeiro parasitado com uma agulha dissecando, e remova cada pupa N. vitripennis do hospedeiro(Figura 2A).
- Com a ajuda de um pincel de ponta fina, vespas de olhos vermelhos separadas (machos e fêmeas) do tipo selvagem(Figura 1H). Continue a criação de vespas de olhos vermelhos juntas em tubos de vidro, e não se misture com as vespas do tipo selvagem.
NOTA: Nesta fase (G3, Figura 2A), machos haploides e fêmeas diploides carregam e apresentam fenótipos para as mutações cinnabar. Se o gene afetado codificar um fenótipo invisível, cruze G0 macho singularmente com uma fêmea tipo selvagem por ~1 dia. Em seguida, remova o macho para caracterização molecular da mutação por PCR e sequenciamento, e deixe a fêmea parasitar um hospedeiro. Continue o esquema de travessia apenas com a prole de um macho mutante confirmado(Figura 2B). Se o objetivo for o knockdown por RNAi de um gene candidato, realize o ensaio funcional desejado (como letalidade, esterilidade ou ensaio de indução de diapausa3,7 ) utilizandodiretamenteindivíduos injetados com dsRNA. Como a RNAi é transitória, não é possível gerar uma colônia com o fenótipo desejado (Figura 2C)3,7.

Figura 1: Cronograma para microinjeção de nasonia vitripennis pupal e adulta. (A) Pupas brancas e femininas (superiores) e pretas (inferiores) são coletadas,(B-C) alinhadas e coladas a um slide de vidro para injeção. (D) A agulha capilar é preparada e aberta, deslizando-a em dois slides sobrepostos. (E) A agulha é anexada ao Femtojet (superior) ou a um tubo aspirador (inferior) para injeções. (F) As pupas injetadas no slide são transferidas para uma placa de Petri com um tecido molhado na parte inferior para manter a umidade. Após o surgimento, as fêmeas(G)são colocadas singularmente em pequenos tubos de vidro e permitidas a oviposit em Sarcophaga pupa. (H) Triagem da prole para detectar mutantes. Clique aqui para ver uma versão maior desta figura.
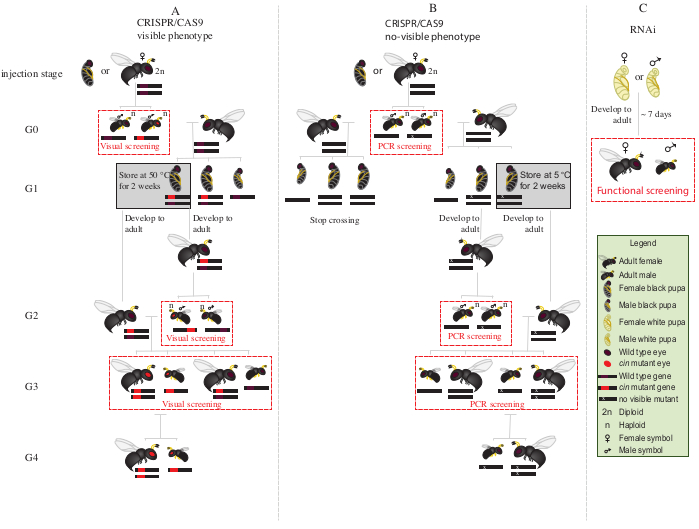
Figura 2: Esquema de travessia após a injeção. Representação esquemática do procedimento de esquema de cruzamento no caso da edição de genes mediados por CRISPR/Cas9 (A) que induzem um fenótipo visível e (B) que não conferem fenótipo visível. (C) Representação esquemática do procedimento de triagem RNAi. Abreviaturas: cin = cinnabar; PCR = reação em cadeia de polimerase. Clique aqui para ver uma versão maior desta figura.
Resultados
Este artigo apresenta dois métodos fáceis para microinjeção pupal e adulta, seja usando um femtojet ou um tubo aspirador. O primeiro método permite uma injeção mais precisa de líquido, que é importante para a consistência rnai, enquanto o segundo permite a injeção de quantidades maiores de líquido em nasonia pupae ou adultos.
Os resultados representativos apresentados na Tabela 1 mostram bo...
Discussão
Com o recente aumento do uso de nasonia vitripennis como organismo modelo para várias questões biológicas2,3,7,17, há a necessidade de desenvolver e otimizar métodos de injeção para permitir um protocolo simplificado e eficiente para a análise funcional dos genes N. vitripennis. Os métodos atuais envolvendo microinjeção embrionária de reagentes de edição de genes...
Divulgações
JLR e DCR solicitaram proteção provisória de patentes na tecnologia ReMOT Control. A O.S.A é fundadora da Agragene, Inc., tem participação acionária e atua no Conselho Consultivo Científico da empresa. Todos os outros autores não declaram interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado em parte por fundos de startup da UCSD direcionados à O.S.A. e à bolsa NSF/BIO 1645331 à J.L.R.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
Referências
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados