Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Puppen- und Erwachseneninjektionen zur RNAi- und CRISPR-Genbearbeitung bei Nasonia vitripennis
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir Methoden für effiziente Puppen- und Erwachseneninjektionen in Nasonia vitripennis als zugängliche Alternativen zur Embryo-Mikroinjektion, die eine funktionelle Analyse von Genen von Interesse entweder mit RNA-Silencing über RNA-Interferenz (RNAi) oder Gen-Knockout durch CRISPR/Cas9-Genom-Editing ermöglichen.
Zusammenfassung
Die Juwelenwespe Nasonia vitripennisist zu einem effizienten Modellsystem geworden, um die Epigenetik der haplo-diploiden Geschlechtsbestimmung, der B-Chromosom-Biologie, der Wirt-Symbionten-Interaktionen, der Artbildung und der Giftsynthese zu untersuchen. Trotz der Verfügbarkeit mehrerer molekularer Werkzeuge, einschließlich CRISPR/Cas9, sind funktionelle genetische Studien in diesem Organismus immer noch begrenzt. Die Haupteinschränkung bei der Anwendung der CRISPR/Cas9-Technologie bei N. vitripennis ergibt sich aus den Herausforderungen embryonaler Mikroinjektionen. Injektionen von Embryonen sind in diesem Organismus und im Allgemeinen bei vielen parasitoiden Wespen aufgrund der geringen Embryogröße und der Notwendigkeit einer Wirtspuppe für die Embryonalentwicklung besonders schwierig. Um diese Herausforderungen anzugehen, wurde die Abgabe des Cas9-Ribonukleoproteinkomplexes in die weiblichen Eierstöcke durch Injektion durch Erwachsene anstelle einer embryonalen Mikroinjektion optimiert, was sowohl zu somatischen als auch zu vererbbaren Keimbahnbearbeitungen führte. Die Injektionsverfahren wurden bei Puppen und weiblichen Wespen entweder mit ReMOT Control (Receptor-Mediated Ovary Transduction of Cargo) oder BAPC (Branched Amphiphilic Peptide Capsules) optimiert. Diese Methoden haben sich als wirksame Alternativen zur Embryoinjektion erwiesen und ermöglichen ortsspezifische und vererbbare Keimbahnmutationen.
Einleitung
CRISPR/Cas9 Gen-Editing ist eine leistungsfähige Technologie für funktionelle genetische Studien, insbesondere in vielen aufstrebenden Modellorganismen wie der Juwelenwespe, Nasonia vitripennis. Die einfache Aufzucht und die Verfügbarkeit eines vollständigen Genoms machen die Juwelenweipe zu einem wichtigen experimentellen System, um die molekularen Mechanismen verschiedener biologischer Prozesse aufklärt. Zum Beispiel wurde N. vitripennis kürzlich verwendet, um die epigenetische Grundlage des haplodiploiden Geschlechtsbestimmungssystems1,2, die Biologie der B-Chromosomen 3 ,4,5,6und die genetische Grundlage für die zirkadiane und saisonale Regulation7,8zu entschlüsseln. Einige der Merkmale, die N. vitripennis für die Arbeit nutzbar machen, sind kurze Generationszeit (~ 2 Wochen bei 25 ° C), hohe Reproduktionsraten, einfache Geschlechtstrennung im Puppenstadium und die Fähigkeit, Stämme bei 4 ° C zu diapausen und zu speichern. Der Lebenszyklus beginnt damit, dass weibliche Wespen die Puppen der Blasfly, Sarcophaga bullata,parasitieren. Durch ihren Ovipositor legen weibchen bis zu 50 Eier in den Puppenkasten der Blasfly. Eier entwickeln sich zu Larven, die sich von der S. bullata-Puppe ernähren, sich in den nächsten Tagen weiter entwickeln und sich dann verpuppen, gefolgt von einer erwachsenen Eklosion und dem Auftauchen aus dem Wirtspuparium9.
Molekulare Werkzeuge zur Durchführung funktioneller genetischer Studien in N. vitripennis, wie RNA-Interferenz (RNAi)10 und CRISPR / Cas911,12, sind verfügbar, sind aber begrenzt, vor allem aufgrund von Schwierigkeiten bei der Durchführung embryonaler Mikroinjektionen13. Da N. vitripennis-Eier für die Entwicklung einen Puppenwirt benötigen, ist die Eimanipulation sehr schwierig. Embryonen im Stadium vor dem Blastoderm müssen von den Wirtsblasfliegenpuppen entnommen, schnell mikroinjektiert und sofort zur Entwicklung zurück an den Wirt übertragen werden13. Diese Schritte erfordern Präzision und spezielles Training, um zu vermeiden, dass die mikroinjektierten Embryonen oder die Puppenwirte beschädigt werden13. Darüber hinaus sind die Eier sehr klein und zerbrechlich, insbesondere nach Mikroinjektionen, mit einem sehr viskosen Zytoplasma, das eine kontinuierliche Verstopfung der Injektionsnadel verursacht13. Diese Eigenschaften machen embryonale Mikroinjektionen außergewöhnlich herausfordernd und erfordern hochqualifizierte Bediener und spezielle Geräte, die in den meisten N. vitripennis-Labors fehlen.
Die Optimierung alternativer Injektionsmethoden zur Abgabe von CRISPR-Reagenzien würde zur Festigung von N. vitripennis als Modellorganismus beitragen. Die Manipulation von Puppen und Erwachsenen ist weniger herausfordernd als die Manipulation von Embryonen und kann mit einem grundlegenden Injektionsaufbau erreicht werden. Hier werden zwei Protokolle für die Injektion von Puppen und Erwachsenen beschrieben: eines mit spezialisierten Geräten für Injektionen und das andere mit der Verwendung einer Absaugrohranordnung, die mit einer Glaskapillarnadel ausgestattet ist. Die Verwendung eines Absaugrohrs eignet sich besonders für Laboratorien, die keinen Zugang zu speziellen Geräten für Embryo-Mikroinjektionen haben. Effiziente Injektionen verschiedener Entwicklungsstadien von N. vitripennis, einschließlich weißer oder schwarzer Puppen und erwachsener Wespen, werden nachgewiesen. Wespen im Stadium der weißen Puppen eignen sich besonders für RNAi-vermittelte Knockdown-Experimente. Obwohl RNAi in Nasonia erstmals 2006 von Lynch und Desplan beschrieben wurde10,gibt es kein visuelles Verfahren für die Durchführung von RNAi-Injektionen. RNAi wurde kürzlich verwendet, um das Haploidizer-Gen des B-Chromosoms PSR (Paternal Sex Ratio)3 zu entdecken und die Beteiligung des Uhrengens Periodean den biologischen Rhythmen von N. vitripennis zu untersuchen 7.
Schwarze Puppen und erwachsene Wespen können verwendet werden, um crispR / Cas9-Keimbahn-Gen-Editing mit ReMOT Control (Receptor-Mediated Ovary Transduction of Cargo) und BAPC (Branched Amphiphilic Peptide Capsules) Protokollen zu induzieren. Diese beiden Ovarialabgabemethoden wurden kürzlich als wirksam bei Nasonia beschrieben, um Keimbahnmutationen im Zielgen, Zinnober7,12,zu erzeugen. Hier wird ein vereinfachtes Protokoll für Injektionen bereitgestellt, einschließlich eines visuellen Verfahrens einer Schritt-für-Schritt-Methodik für Puppen- und Erwachseneninjektionen, die verwendet werden kann, um funktionelle genetische Studien in Nasonia und wahrscheinlich in anderen parasitoiden Wespen zu generieren, ohne dass spezielle Ausrüstung erforderlich ist und embryonale Mikroinjektionen umgangen werden.
Protokoll
1. Nasonia-Aufzucht
- Stellen Sie ~ 20 gepaarte Weibchen einzeln in kleinen Glasreagenzgläsern auf, die mit Baumwolle verstopft sind.
HINWEIS: Um den Aufzuchtraum zu reduzieren, sind 10 x 85 cm, 4 ml Rohre optimal. Weibchen sind aufgrund der größeren Flügel und des Vorhandenseins des Ovipositors leicht von Männchen zu unterscheiden (Abbildung 1A). Detaillierte Protokolle für die Aufzucht von N. vitripennis finden sich auch in der anderen Literatur13,14,15.- Fügen Sie zwei S. bullata-Wirte pro Tube hinzu und halten Sie die Wespen bei 25 ± 1 ° C und 30% relativer Luftfeuchtigkeit mit einem Hell-Dunkel-Zyklus von 12: 12 für 2-3 Tage.
HINWEIS: Wespen können bei niedrigerer Temperatur oder Raumtemperatur gehalten werden; die Entwicklung wird sich jedoch verlangsamen.
- Fügen Sie zwei S. bullata-Wirte pro Tube hinzu und halten Sie die Wespen bei 25 ± 1 ° C und 30% relativer Luftfeuchtigkeit mit einem Hell-Dunkel-Zyklus von 12: 12 für 2-3 Tage.
- Nach 2-3 Tagen mit Hilfe eines Pinsels mit feiner Spitze die Weibchen vorsichtig entfernen, um eine kontinuierliche Eiablage und Asynchronie in der Nachwuchsentwicklung zu vermeiden.
HINWEIS: Entfernte Weibchen können optional bis zu einem Monat lang bei 5 °C neu gehostet oder gelagert werden.- Halten Sie den parasitierten Wirt bei 25 ° C und 30% relativer Luftfeuchtigkeit, mit einem 12:12 Hell-Dunkel-Zyklus für 7 Tage, wenn die gewünschte Injektionsstufe weiße Puppen erfordert; für 13 Tage, wenn das erforderliche Entwicklungsstadium schwarze Puppen ist; oder 14 Tage für junge, neu entstandene Erwachsene.
HINWEIS: Gelbe und schwarze Puppen können auch bis zu einer Woche bei 5 °C gelagert werden. Eine längere Lagerung wird die Häufigkeit der Diapause in Larven für die nächste Generation erhöhen, was das Screening nach der Injektion und die Etablierung von Mutantenlinien erschwert. - Öffnen Sie das Wirtspuparium mit einer Sezierungsnadel, um N. vitripennis Puppen und Erwachsene im gewünschten Stadium zu bergen (Abbildung 1A).
HINWEIS: Für Injektionen in einem bestimmten Erwachsenenalter oder zum Sammeln von jungfräulichen Weibchen wird empfohlen, die dunklen Puppen am 13. Tag vom Wirt zu entfernen, nach Geschlecht zu trennen und Erwachsene nach dem Auftauchen zu sammeln.
- Halten Sie den parasitierten Wirt bei 25 ° C und 30% relativer Luftfeuchtigkeit, mit einem 12:12 Hell-Dunkel-Zyklus für 7 Tage, wenn die gewünschte Injektionsstufe weiße Puppen erfordert; für 13 Tage, wenn das erforderliche Entwicklungsstadium schwarze Puppen ist; oder 14 Tage für junge, neu entstandene Erwachsene.
2. Ausrichtung von weißen und schwarzen Puppen
- Bereiten Sie ein Glasobjektträger vor, indem Sie eine Linie Schulkleber in der Mitte auftragen. Verteilen Sie den Kleber mit einer Seziernadel, um eine dicke Schicht zu erhalten (Abbildung 1B), die zum Ausrichten der Puppen verwendet wird. Lassen Sie den Kleber ~2 min trocknen, bevor Sie die Puppen übertragen.
HINWEIS: Übertrinnen Sie den Kleber nicht, da die Puppen sonst nicht richtig am Schlitten befestigt werden und während der Injektionen rüberrutschen. - Unter einem Seziermikroskop mit der Seziernadel Kleber auf den Hinterkopf der Puppe auftragen.
- Befestigen Sie die Puppe mit dem Bauch nach oben an der Leimschicht auf dem Dia. Richten Sie 20-30 Puppen nebeneinander auf dem Schlitten aus (Abbildung 1C).
HINWEIS: Vermeiden Sie es, den Bauch mit dem Kleber zu berühren, und vermeiden Sie, die Puppen in den Kleber zu tauchen; Andernfalls können die Erwachsenen nicht auftauchen. - Legen Sie den Dia mit den Puppen in eine Petrischale, um den Kleber ~10 min trocknen zu lassen. Bevor Sie mit den Injektionen beginnen, testen Sie die Haftung der Puppen am Kleber, indem Sie sie vorsichtig mit der Seziernadel drücken. Wenn die meisten Puppen gelöst sind, bereiten Sie eine neue Rutsche vor. Alternativ können Sie alle Puppen entfernen, die locker sind, und fahren Sie fort, diejenigen zu injizieren, die ordnungsgemäß am Objektträger befestigt sind.
3. Nadelvorbereitung
- Laden Sie ein Kapillarglasrohr in einen Nadelzieher und ziehen Sie die Nadeln gemäß den Anweisungen des Herstellers.
HINWEIS: Ein P-1000 Platinfilament-Nadelzieher und Aluminiumsilikatglaskapillaren werden in dieser Demonstration verwendet. Die Bedienungsanleitung für dieses Gerät (siehe Materialtabelle)erklärt, wie Man Kapillarglasröhren richtig belädt und Programme auf diesem Gerät einrichtet. Verwenden Sie die folgenden Parameter (Wärme: 536; Zug: 80; Vel: 100; Verzögerung: 70) auf Aluminiumsilikatglaskapillaren, um gelbe Puppen, schwarze Puppen und Erwachsene zu injizieren.
Darüber hinaus wurde der Nadelzieher P-2000 zur Herstellung von Quarznadeln nach den Parametern (Heat: 805; Zug: 145; Vel: 50; Verspätung: 145). Das Handbuch enthält Anweisungen zum Laden von Kapillarquarzrohren und zum Einrichten von Programmen in diesem Gerät. In Ermangelung eines Abziehers ist anpassbares Kapillarglas erhältlich. - Laden Sie die Nadel mit 5 μL der Injektionsmischung (im Voraus nach früheren Protokollen für RNAi10 oder CRISPR/Cas9 Ribonukleoprotein12 (RNP) Injektionen in N. vitripennisvorbereitet) mit Mikrolader-Pipettenspitzen.
HINWEIS: Während der Demonstration wird die Nadel mit doppelsträngiger RNA (dsRNA) in Kombination mit rotem Farbstoff (siehe Materialtabelle)zur Injektion von weißen Puppen und mit BAPC-Cas9-sgRNA zur Injektion von Schwarzen Puppen wespen und Erwachsenen beladen. Diese Reagenzien zielen auf das Zinnober-Gen ab. Wespen, die erfolgreich niedergeschlagen / ausgeschaltet werden, zeigen rote Augen anstelle der wildtypbraunen Augen. - Öffnen Sie die Nadel, und schieben Sie die Spitze auf eine Oberfläche, die aus zwei überlappenden Objektträgern besteht (Abbildung 1D). Alternativ öffnen Sie die Nadelspitze mit einer feinen Zange, um eine scharfe Kante zu erzeugen, oder indem Sie langsam den Thorax oder Bauch der Wespe durchbohren.
4. Puppeninjektion mit Femtojet
- Legen Sie den Objektträger mit den ausgerichteten Puppen unter ein Seziermikroskop. Führen Sie die Nadel in das Injektionsrohr des Femtojets ein und ziehen Sie den Griffkopf fest.
- Wenn Sie die Nadel unter dem Mikroskop betrachten, schalten Sie den Femtojet ein und richten Sie die Pc- und Pi-Injektionsparameter ein, indem Sie die Drehknöpfe drehen.
HINWEIS: Für einen kontinuierlichen Fluss der Flüssigkeit wird ein Pc-Wert von 600 hPa empfohlen. Der Pc-Wert hängt von der Öffnung der Nadel ab. Bei Nadeln, die mit den angegebenen Parametern im Nadelzieher P-1000 hergestellt werden, erzeugen Pc-Werte zwischen 500 hPa und 700 hPa einen konstanten Durchfluss. Wenn niedrigere Pc-Werte erforderlich sind, deutet dies darauf hin, dass die Öffnung zu groß sein und die Insekten schädigen könnte, während höhere Werte darauf hinweisen, dass die Nadel noch geschlossen ist oder dass die Öffnung zu klein ist. - Führen Sie die Nadel vorsichtig zwischen die 2 und 3 sichtbaren Bauchsegmente mit einem vertikalen Winkel von ca. 30° ein (Abbildung 1E). Injizieren Sie mit einem kontinuierlichen Fluss, bis der gesamte Bauch bei Puppen im weißen Stadium rosa wird oder bis der Bauch bei schwarzen Puppen an Größe zunimmt. Stoppen Sie die Injektion, wenn klar ist, dass der Bauch keine Flüssigkeit mehr aufnehmen kann oder wenn die Flüssigkeit aus dem Körper zu fließen beginnt. Gehen Sie vorsichtig zur nächsten Puppe und wiederholen Sie diese Schritte.
HINWEIS: Vermeiden Sie es, den Ovipositor während der Injektion mit der Nadel zu berühren und zu beschädigen. - Übertragen Sie den Objektträger mit den injizierten Puppen in eine Petrischale, die ein mit entionisiertem Wasser getränktes Papiertuch enthält, um die Feuchtigkeit aufrechtzuerhalten. Decken Sie die Schüssel mit dem Deckel ab und stellen Sie sie bei 25 °C, bis die Verschwendung austritt (Abbildung 1F).
5. Puppeninjektion mit Absaugschlauch
- Berechnen Sie die Menge der Injektionsmischung mit dem Faktor: 4 Puppen injiziert / 1 μL Lösung.
HINWEIS: Eine typische Injektion von 20-30 Puppen erfordert ~ 5-8 μL Ribonukleoprotein (RNP) Komplex-Saponin-Mischung oder RNP mit BAPC12. - Richten Sie die Puppen wie in Abschnitt 2 vorgeschlagen aus und legen Sie einen Objektträger mit den ausgerichteten Puppen unter ein Seziermikroskop (Abbildung 1E).
- Nehmen Sie eine der Kapillarnadeln und brechen Sie die Spitze zwischen zwei Glasobjektträgern, wie in Schritt 3.4 (Abbildung 1D) dargestellt. Stellen Sie sicher, dass die Nadelspitze offen genug ist, damit die Injektionslösung durch Blasen von Luft mit dem Mund ausgehen kann, aber nicht zu offen, um Flüssigkeit zu verlieren und die Puppen zu beschädigen (Abbildung 1E).
HINWEIS: Dieser Schritt ist kritisch, da der Benutzer Luft aus dem Mund verwendet, um die Injektionsmischung in die Insekten-Hämolymphe zu drücken. Es ist besser, so zu üben, dass festgestellt wird, welche Art von Nadelöffnung für die Viskosität einer bestimmten Lösungsmischung optimal ist. Fünf Injektionssätze von 20 Puppen pro Satz können ausreichen, um sich an das Mundinjektionssystem zu gewöhnen. - Laden Sie eine Nadel mit der Ribonukleoproteinlösung12 unter Verwendung einer Mikroladespitze und führen Sie die Nadel in das Anschlusspaket der Absaugrohrbaugruppe ein.
HINWEIS: Während der Demonstration wird die Nadel mit BAPC-Cas9-sgRNA beladen, die auf das Nasonia cinnabar Gen12abzielt. - Führen Sie die Nadel vorsichtig zwischen die 2 und 3 sichtbaren Bauchsegmente mit einem vertikalen Winkel von ca. 30° ein (Abbildung 1E). Injizieren Sie mit einem kontinuierlichen Fluss, bis der gesamte Bauch bei Puppen im weißen Stadium rosa wird oder bis der Bauch bei schwarzen Puppen an Größe zunimmt. Stoppen Sie die Injektion, wenn klar ist, dass der Bauch keine Flüssigkeit mehr aufnehmen kann oder wenn die Flüssigkeit aus dem Körper zu fließen beginnt. Gehen Sie vorsichtig zur nächsten Puppe und wiederholen Sie diese Schritte
HINWEIS: Vermeiden Sie es, den Ovipositor während der Injektion mit der Nadel zu berühren und zu beschädigen. - Übertragen Sie den Objektträger mit den injizierten Puppen in eine Petrischale, die ein mit entionisiertem Wasser getränktes Papiertuch enthält, um die Feuchtigkeit aufrechtzuerhalten. Decken Sie die Schüssel mit dem Deckel ab und stellen Sie sie bei 25 °C auf, bis eine Verschwendung austritt (Abbildung 1F).
6. Injektion für Erwachsene mit Absaugerrohr
- Für die Zubereitung für Erwachsene trennen Sie Gruppen von 20 jungfräulichen Weibchen in einem sauberen kleinen Reagenzglas mit einem feinen Pinsel. Legen Sie das Röhrchen für 5 Minuten auf Eis, bis die Weibchen betäubt sind. Alternativ können Weibchen betäubt und mit CO2injiziert werden.
HINWEIS: Eis ist als Anästhetikum vorzuziehen, da erwachsene Wespen kältetolerant sind und sich nach den Injektionen leicht erholen. Weibchen können mehr injizierte Flüssigkeit aufnehmen als die Puppen: 1 μL Lösung kann für drei Weibchen anstelle von vier Puppen verwendet werden. Bereiten Sie die Volumina entsprechend vor. - Bereiten Sie einen Eiskübel vor und legen Sie ein Glasobjektträger auf das Eis. Richten Sie die Weibchen seite an Seite auf dem kalten Objektträger mit nach oben gerichteten Abdomen aus (Abbildung 1E) unter einem Sezierungsfernrohr.
- Laden Sie eine Nadel mit der Ribonukleoproteinlösung12 unter Verwendung einer Mikroladespitze und führen Sie die Nadel in das Anschlusspaket der Absaugrohrbaugruppe ein. Unterstützen Sie die Weibchen von der gegenüberliegenden Seite mit abgestumpften Seziernadeln, während Sie von der anderen Seite langsam in den Bauch injizieren. Vermeiden Sie es, den Ovipositor zu berühren, da dies diese kritische Fortpflanzungsstruktur stark schädigt (Abbildung 1E).
HINWEIS: Je nach Bedienerpräferenz ist jede Ausrichtung akzeptabel. - Führen Sie die Nadel vorsichtig zwischen die 2 und 3 sichtbaren Bauchsegmente mit einem vertikalen Winkel von ca. 30° ein (Abbildung 1E). Injizieren Sie die Lösung in den weiblichen Bauch und stoppen Sie, wenn keine Flüssigkeit mehr eindringen kann oder wenn das Austreten von überschüssiger Lösung beobachtet wird. Gehen Sie vorsichtig zur nächsten Waspe und wiederholen Sie diese Schritte
HINWEIS: Injizieren Sie langsam und lassen Sie die Nadel etwa 3 s im Bauch, bevor Sie sie sehr langsam entfernen. Dies hilft, den internen Flüssigkeitsdruck anzupassen und zu vermeiden, dass nach der Nadelentfernung Lösung aus der Injektionsstelle austritt. - Wenn Sie fertig sind, übertragen Sie einzelne injizierte Weibchen vorsichtig mit einem Wirt mit einem Pinsel in eine neue Röhre. Lassen Sie sich bei Raumtemperatur für ca. 1 h erholen, um das Überleben zu bestätigen, und geben Sie die Schläuche dann in den Aufzuchtinkubator zurück.
HINWEIS: Während der Demonstration wird die Nadel mit BAPC-Cas9-sgRNA beladen, die auf das Nasonia cinnabar Gen12abzielt.
7. Nachinjektionspflege und Mutantenscreening
- Nach der Eklosion durch Erwachsene von den injizierten Puppen legen Sie einzelne Wespen in ein mit Baumwolle verstopftes Glasrohr und führen einen S. bullata-Wirt ein (Abbildung 1G). Im Gegensatz dazu legen Sie injizierte Weibchen unmittelbar nach der Injektion in einzelne Röhrchen mit Wirten.
- Erlauben Sie den Weibchen für CRISPR / Cas9-Knockout-Experimente, die Wirte für einen Tag zu parasitieren und den Wirt jeden Tag an drei aufeinanderfolgenden Tagen zu ersetzen.
HINWEIS: Aufgrund des haplodiploiden Geschlechtsbestimmungssystems in N. vitripennis16produzieren jungfräuliche Weibchen haploide männliche Bruten, was den Nachweis von Mutationen erleichtert. Für den Knockdown über RNAi von männlichen spezifischen Genen können die injizierten Individuen singulär mit Wildtyp-Individuen gepaart werden und Wirte parasitieren. Verwenden Sie einen Host pro Tag und ersetzen Sie die Hosts basierend auf dem experimentellen Aufbau. - Platzieren Sie die parasitierten Wirte bei 25 °C bis zum Auftauchen der männlichen G0-Nachkommen (für ~13-14 Tage).
- Unter einem Seziermikroskop werden G0-Männchen auf die mutierten Phänotypen untersucht. Das Zinnober-Gen ist für die Augenpigmentierung verantwortlich12:Wespen mit braunen Augen sind Wildtyp, und Wespen mit leuchtend roten Augen oder Variationen zwischen roten und braunen Augen sind Mutanten (Abbildung 1H).
8. Kreuzungen nach der Injektion und Aufzucht
- Platzieren Sie alle mutierten G0-Männchen mit roten Augen (das phänotypisch gestörte Cinnabar 12-Gen)für 1-2 Tage mit jungfräulichen Wildtyp-Weibchen(Abbildung 2A).
HINWEIS: Wenn das gestörte Gen keinen sichtbaren Phänotyp verleiht, ist eine Polymerase-Kettenreaktion (PCR) gefolgt von einer Sequenzierung des Zielgens erforderlich, um die mutierten Tiere zu identifizieren. Bevor die DNA von G0-Männchen für die PCR erhalten wird, wäre es ideal, sie mit jungfräulichen Wildtyp-Weibchen zu paaren. Alternativ können Sie DNA aus einem Bein eines G0-Männchens extrahieren, um Mutanten zu identifizieren, und nur diejenigen mit verifizierten Mutationen paaren. - Fügen Sie zwei S. bullata-Wirte pro Weibchen hinzu und lassen Sie es bei 25 °C und 30% relativer Luftfeuchtigkeit mit einem Hell-Dunkel-Zyklus von 12:12 eiabreichen. Ersetzen Sie die Hosts alle 2-3 Tage.
- Lagern Sie parasitierte Wirte bei 25 ° C und 30% relativer Luftfeuchtigkeit mit einem Hell-Dunkel-Zyklus von 12:12 für ~ 10 Tage.
- Nach ~ 10 Tagen den parasitierten Wirt mit einer sezierenden Nadel aufbrechen und jede N. vitripennis-Puppe vom Wirt entfernen.
- Wählen Sie mit Hilfe eines Pinsels mit feiner Spitze weibliche Puppen aus (Abbildung 1A).
HINWEIS: Weibchen sind diploid und heterozygot, und daher ist die Augenfarbe Wildtyp.
- 15-20 weibliche Puppen bis zum Auftauchen in Glasröhren bei 25 °C geben. Nach dem Auftauchen ~ 20 S. bullata-Wirte hinzufügen und die jungfräulichen G1-Weibchen die Wirte für 2-3 Tage parasitieren lassen.
HINWEIS: Diese Weibchen produzieren 50% G2-mutierte Männchen.- Lagern Sie parasitierte Wirte bei 25 ° C und 30% relativer Luftfeuchtigkeit mit einem Hell-Dunkel-Zyklus von 12:12 bis zum Auftauchen des männlichen G2-Erwachsenen.
- Die restlichen G1 Puppen für 8-10 Tage bei 5 °C platzieren. Nach dieser Zeit entfernen Sie sie und legen Sie sie bei 25 °C und 30% relativer Luftfeuchtigkeit mit einem Hell-Dunkel-Zyklus von 12:12 bis zum Auftreten (Abbildung 2A).
- Nach dem Auftauchen der G2-Männchen in Schritt 8.3.1, Screen auf das Vorhandensein eines rotäugigen mutierten Phänotyps. Trennen Sie mit Hilfe eines Pinsels mit feiner Spitze rotäugige Männchen von Wildtyp-Männchen.
HINWEIS: Das Vorhandensein von Rotaugenweispen in dieser Generation (G2, Abbildung 2A) deutet darauf hin, dass die Genbearbeitung in der Keimbahn stattgefunden hat und dass die Mutation erblich ist. - Platzieren Sie rotäugige Männchen mit den in Schritt 8.3.2 neu aufgetauchten G1-Weibchen (Abbildung 2A) und lassen Sie sie 1-2 Tage paaren. Fügen Sie 2 S. bullata-Wirte pro Weibchen hinzu und legen Sie sie bei 25 ° C und 30% relativer Luftfeuchtigkeit mit einem Hell-Dunkel-Zyklus von 12:12 für 10-11 Tage.
- Nach 10-11 Tagen den parasitierten Wirt mit einer sezierten Nadel aufbrechen und jede N. vitripennis-Puppe vom Wirt entfernen (Abbildung 2A).
- Trennen Sie mit Hilfe eines Pinsels mit feiner Spitze rotäugige Wespen (Männchen und Weibchen) vom Wildtyp (Abbildung 1H). Setzen Sie die Aufzucht von rotäugigen Wespen zusammen in Glasröhren fort und mischen Sie sich nicht mit den Wildtypwespen.
HINWEIS: In diesem Stadium (G3, Abbildung 2A)tragen und zeigen haploide Männchen und diploide Weibchen Phänotypen für die Zinnobermutationen. Wenn das betroffene Gen für einen unsichtbaren Phänotyp kodiert, kreuzen Sie das G0-Männchen für ~ 1 Tag mit einem Wildtyp-Weibchen. Entfernen Sie dann das Männchen zur molekularen Charakterisierung der Mutation durch PCR und Sequenzierung und lassen Sie das Weibchen einen Wirt parasitieren. Setzen Sie das Kreuzungsschema nur mit den Nachkommen eines bestätigten mutierten Männchens fort (Abbildung 2B). Wenn das Ziel der Knockdown eines Kandidatengens durch RNAi ist, führen Sie den gewünschten funktionellen Assay (z. B. Letalität, Sterilität oder Diapauseninduktionsassay3,7)direkt mit Personen durch, denen dsRNA injiziert wurde. Da RNAi transient ist, ist es nicht möglich, eine Kolonie mit dem gewünschten Phänotyp (Abbildung 2C)3,7zu erzeugen.

Abbildung 1: Zeitleiste für Puppen und erwachsene Nasonia vitripennis Mikroinjektion. (A) Männliche und weibliche weiße (oben) und schwarze (unten) Puppen werden gesammelt, (B-C) ausgerichtet und zur Injektion auf einen Glasträger geklebt. (D) Die Kapillarnadel wird vorbereitet und geöffnet, wobei sie auf zwei überlappenden Objektträgern geschoben wird. (E) Die Nadel wird entweder am Femtojet (oben) oder an einem Absaugrohr (unten) für Injektionen befestigt. (F) Die injizierten Puppen auf dem Objektträger werden in eine Petrischale mit einem feuchten Gewebe auf dem Boden übertragen, um feuchtigkeitsspauend zu halten. Beim Auftauchen werden (G) Weibchen einzeln in kleine Glasröhren gelegt und erlaubt, auf Sarkophagenpuppe zu oviposit. (H) Screening der Nachkommen zum Nachweis von Mutanten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
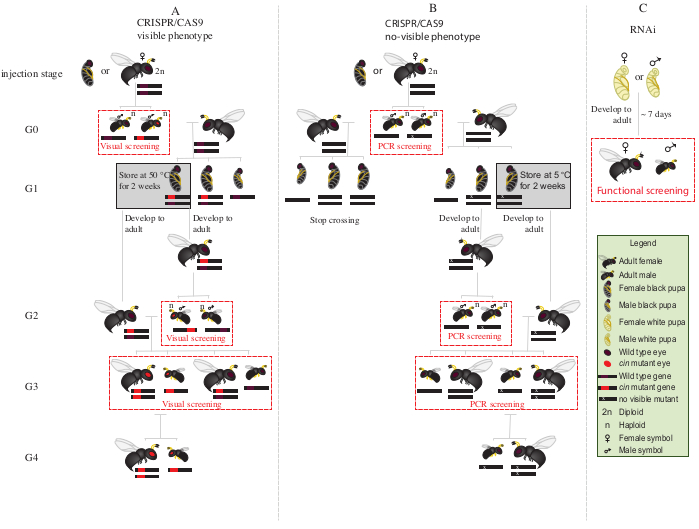
Abbildung 2: Kreuzungsschema nach Injektion. Schematische Darstellung des Kreuzungsschemaverfahrens bei CRISPR/Cas9-vermittelter Genbearbeitung von Genen (A), die einen sichtbaren Phänotyp induzieren und (B) die keinen sichtbaren Phänotyp verleihen. (C) Schematische Darstellung des RNAi-Screening-Verfahrens. Abkürzungen: cin = cinnabar; PCR = Polymerase-Kettenreaktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Dieser Artikel stellt zwei einfache Methoden für die Puppen- und Erwachsenenmikroinjektion vor, entweder mit einem Femtojet oder einem Absaugrohr. Die erste Methode ermöglicht eine präzisere Injektion von Flüssigkeit, die für die RNAi-Konsistenz wichtig ist, während die zweite methode die Injektion größerer Flüssigkeitsmengen in Nasonia-Puppen oder Erwachsene ermöglicht.
Repräsentative Ergebnisse in T...
Diskussion
Mit der kürzlich verstärkten Verwendung von Nasonia vitripennis als Modellorganismus für verschiedene biologische Fragen2,3,7,17besteht die Notwendigkeit, Injektionsmethoden zu entwickeln und zu optimieren, um ein vereinfachtes und effizientes Protokoll für die funktionelle Analyse von N. vitripennis-Genen zu ermöglichen. Die derzeitigen Methoden zur embryonalen Mikroinje...
Offenlegungen
JLR und DCR haben vorläufigen Patentschutz für die ReMOT Control-Technologie angemeldet. O.S.A ist ein Gründer von Agragene, Inc., hat eine Beteiligung und ist Mitglied des wissenschaftlichen Beirats des Unternehmens. Alle anderen Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde teilweise durch UCSD-Startup-Fonds unterstützt, die an O.S.A. und NSF / BIO-Zuschüsse 1645331 an J.L.R. gerichtet waren.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
Referenzen
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten