このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ナソニアビトリペニスにおけるRNAiおよびCRISPR遺伝子編集のためのプパルおよび成人注射
要約
ここでは、 ナソニアビトリペンシス での効率的なプパルおよび成人注射を胚微小注射の代替手段として説明し、RNA干渉(RNAi)またはCRISPR/Cas9ゲノム編集によるRNAサイレンシングまたは遺伝子ノックアウトのいずれかを使用して目的の遺伝子の機能解析を可能にする。
要約
ジュエルスズメ バチ、ナソーニアビトリペンニスは、ハプロ-ジプロイド性決定、B染色体生物学、宿主共生相互作用、種分化、および毒合成のエピジェネティクスを研究するための効率的なモデルシステムとなっています。CRISPR/Cas9を含むいくつかの分子ツールが利用可能であるにもかかわらず、機能的遺伝学的研究はこの生物において依然として限られている。 N.ビトリペニス にCRISPR/Cas9技術を適用する主な制限は、胚性マイクロインジェクションの課題に起因する。胚の注射は、この生物では特に困難であり、一般的には多くの寄生虫スズメバチでは、小さな胚の大きさと胚発生のための宿主の子犬の要件のために困難である。これらの課題に対処するために、胚性マイクロインジェクションではなく、成人注射による女性卵巣へのCas9リボヌクレオプロテイン複合体の送達が最適化され、体細胞性および遺伝性生殖細胞系列の両方の編集が得られた。注射手順は、ReMOTコントロール(受容体媒介性貨物の卵巣伝達)またはBAPC(分岐性両親媒性ペプチドカプセル)のいずれかを使用して、子犬および雌のスズメバチで最適化されました。これらの方法は、胚注射に有効な代替手段であることが示されており、部位特異的および遺伝性生殖細胞系列突然変異を可能にする。
概要
CRISPR/Cas9遺伝子編集は、特にジュエルスズメバチ、ナソニアビトリペンシスなどの多くの上昇モデル生物において、機能的な遺伝学的研究のための強力な技術です。完全なゲノムの入手性と飼育の容易性により、さまざまな生物学的プロセスの分子機構を解明する重要な実験システムとして、宝石のスズイを作ります。例えば、N.ビトリペンシスは最近、ハプロディプロイド性決定系1、2、B染色体3、4、5、6の生物学、概日および季節的な調節7、8の遺伝的基盤のエピジェネティックな基礎を解明するために使用されている。N.ビトリペンニスを使いこなせる機能には、短い世代の時間(25°Cで約2週間)、再生率が高く、パパルステージでの容易な性分離、および4°Cで緊張をジアポーズして保存する機能などがあります。 ライフサイクルは、ブロウフライ、サルコパガ・ブッラタの子犬を寄生する雌のスズメバチから始まります。彼らのオビポジターを介して、メスはブローフライのプパルケースに最大50個の卵を産む。卵は、S.ブラタの子犬を食べる幼虫に発達し、次の数日間にわたって発達し続け、次いで、宿主の子犬9からの成人の飛散および出現を続ける。
N.ビトリペンシスにおいて機能遺伝学的研究を行う分子ツールは、RNA干渉(RNAi)10およびCRISPR/Cas9 11、12など、利用可能であるが、限定的であるが、主に胚性マイクロインジェクション13を行う上で困難なためである。N.ビトリペンニスの卵は開発のためにプパルホストを必要とするので、卵操作は非常に困難です。プレブラトデドムステージ胚は、宿主のブローフライの子犬から採取し、迅速にマイクロインジェクションし、すぐに開発13のために宿主に戻さなければならない。これらのステップは、マイクロ注入胚またはプパルホスト13を損傷することを避けるために、精度と専門的な訓練を必要とします。また、卵は非常に小さく、壊れやすい、特にマイクロインジェクションの後、非常に粘性の細胞質が注射針13の連続的な詰まりを引き起こす。これらの機能は、胚性マイクロインジェクションを非常に困難にし、ほとんどのN.ビトリペニス研究所に存在しない高度な訓練を受けたオペレータと特殊な機器を必要とします。
CRISPR試薬の送達のための代替注入方法の最適化は、モデル生物としてのN.ビトリペンシスの統合に寄与するであろう。子犬と大人の操作は、胚を操作するよりも難しくなく、基本的な注射のセットアップで達成することができます。ここでは、2つのプロトコルは、子犬と成人の注射のために記述されている:注射のための特殊な機器を含む1つと、ガラス毛細血管針を装着したアスピレーターチューブアセンブリの使用を含む他。アスピレーターチューブの使用は、胚マイクロインジェクションのための特殊な機器へのアクセスを持たない実験室に特に適しています。白または黒の子犬および成人のスズメバチを含むN.ビトリペンシスの異なる発達段階の効率的な注射が実証されている。白いプパルの段階でのスズメバチはRNAi媒介性のノックダウン実験に特に適している。ナソーニアのRNAiは2006年10年にリンチとデスプランによって最初に説明されましたが、RNAi注射がどのように行われるかについて利用可能な視覚的な手順はありません。RNAiは最近、B染色体PSR(父性比)3のハプロイダイザー遺伝子を発見し、N.ヴィトリペンシス生物学的リズムにおけるクロック遺伝子の関与を研究するために用いた。
黒い子犬および成体のスズメバチは、ReMOT制御(貨物の受容体媒介性卵巣転移)およびBAPC(分岐性両親媒性ペプチドカプセル)プロトコルを使用してCRISPR/Cas9生殖細胞系列遺伝子編集を誘導するために使用することができる。これら2つの卵巣送達方法は、標的遺伝子において生殖細胞系列変異を発生させるナソニアにおいて有効であると最近説明されている、シナバー7、12。ここでは、ナソニアおよび他の寄生虫スズメバチで機能的遺伝学研究を生成するために利用できるパパルおよび成人注射のステップバイステップ方法論の視覚的手順を含む注射のための単純化されたプロトコルが提供され、特殊な機器を必要とせず、胚微小注射をバイパスする。
プロトコル
1. ナッソニア飼育
- 綿を差し込んだ小さなガラス試験管に、〜20人の合致女性を単独で設置します。
メモ:リアリングスペースを減らすには、10 x 85 cm、4 mLチューブが最適です。女性は、翼が大きく、オビポジターが存在するため、男性と区別されやすい(図1A)。N. ビトリペンシスを飼育するための詳細なプロトコルは、他の文献13、14、15にも見られます。- チューブごとに2つの S.ブラタホストを 追加し、2〜3日間12:12明暗サイクルで、25±1°Cと30%の相対湿度でスズメバチを維持します。
注:スズメバチは、より低い温度または室温で維持することができます。しかし、開発は遅くなります。
- チューブごとに2つの S.ブラタホストを 追加し、2〜3日間12:12明暗サイクルで、25±1°Cと30%の相対湿度でスズメバチを維持します。
- 2-3日後、細かい先端のペンキブラシの助けを借りて、子孫の発達における連続的な卵位と非同期を避けるために、女性をそっと取り除きます。
注:取り除かれた女性は、必要に応じて、5°Cで最大1ヶ月間再ホストまたは保存することができます。- 希望の注入段階が白い子犬を必要とする場合、7日間の12:12明暗サイクルで、25°Cと30%の相対湿度で寄生した宿主を維持します。必要な発達段階が黒い子犬である場合は13日間。若い、新たに出現した成人のための14日。
注意:黄色と黒の子犬も5°Cで1週間まで保存することができます。より長い貯蔵は、次世代の幼虫のジアポーズの頻度を増加させ、注射後スクリーニングおよび突然変異線の確立をより困難にする。 - 宿主の子犬を解剖針で開き、所望の段階でN.ビトリペニスの子犬と成人を回復する(図1A)。
注:特定の成人年齢での注射や処女女性を収集するために、13日目に暗い子犬をホストから取り除き、セックス別に分離し、出現後に成人を収集することをお勧めします。
- 希望の注入段階が白い子犬を必要とする場合、7日間の12:12明暗サイクルで、25°Cと30%の相対湿度で寄生した宿主を維持します。必要な発達段階が黒い子犬である場合は13日間。若い、新たに出現した成人のための14日。
2. 白と黒の子犬のアライメント
- 中央に学校の接着剤のラインを適用することにより、ガラスのスライドを準備します。接着剤を解剖針で広げて、子犬の位置合わせに使用される厚い層(図1B)を得ます。子犬を移す前に、接着剤を〜2分間乾燥させます。
注:接着剤を過度に乾燥させないでください、そうでなければ、子犬はスライドに適切に取り付けられておらず、注射中に滑り落ちます。 - 解剖顕微鏡の下で、解剖針を使用して、子犬の頭部の後ろに接着剤を塗布する。
- 子犬をスライド上の接着剤層に取り付け、腹部を上に向けます。スライド上で20~30個の子犬を並べて揃えます(図1C)。
注:接着剤で腹部に触れないようにし、接着剤に子犬を浸さないようにしてください。さもなければ、大人は現れないだろう。 - ペトリ皿に子犬と一緒にスライドを置き、接着剤を約10分間乾燥させます。注射を開始する前に、解剖針で優しく押して、接着剤に子犬の付着をテストします。子犬のほとんどが緩んでいる場合は、新しいスライドを準備します。あるいは、緩んでいるすべての子犬を取り除き、スライドに適切に取り付けられているものを注入するに進みます。
3. 針の準備
- 毛細管ガラス管を針プラーに1本積み込み、メーカーの指示に従って針を引っ張ります。
注:P-1000プラチナフィラメントニードルプーラーとアルミニウムケイ酸ガラス毛細血管がこのデモで使用されています。本機器の取扱説明書( 材料表を参照)では、キャピラリーガラスチューブを正しくロードし、この機器にプログラムを設定する方法を説明しています。次のパラメータを使用します(Heat: 536;プル: 80;ヴェル: 100;遅延:70)黄色の子犬、黒い子犬、および成人を注入するアルミニウムケイ酸ガラス毛細血管上。
さらに、P-2000ニードルプーラーは、パラメータに従って石英針を調製するために使用されました(Heat:805;プル: 145;ヴェル: 50;遅延: 145)。本書では、キャピラリー石英管のロードとこの機器のプログラムのセットアップの手順を提供します。引き手がない場合は、カスタマイズ可能なキャピラリーガラスが利用可能です。 - マイクロローダーピペットチップを使用して、注射混合物の5 μL(RNAi10またはCRISPR/Cas9リボヌクレオプロテイン12(RNP)注射のための前のプロトコルに従って事前に調製された)をマイクロローダーピペットチップを使用して針をロードします。
注:デモンストレーションの間、針は白いステージの子犬の注射のための赤い染料( 材料表を参照)と黒い子犬のスズメバチおよび大人の注入のためのBAPC-Cas9-sgRNAと組み合わせた二本鎖RNA(dsRNA)を装った。これらの試薬は、 シナバー 遺伝子を標的とする。正常にノックダウン/アウトされたスズメバチは、野生のタイプの茶色の目の代わりに赤い目を表示します。 - 針を開き、2枚の重なり合うスライドから作られた表面に先端をスライドさせます(図1D)。あるいは、細かい鉗子のペアで針の先端を開いて鋭いエッジを作り出すか、またはスズメバチの胸郭または腹部をゆっくりと突き刺す。
4. フェムトジェットによるプパル注射
- 平行な子犬とスライドを解剖顕微鏡の下に置きます。フェムトジェットのインジェクションチューブに針を差し込み、グリップヘッドを締めます。
- 顕微鏡下の針を見て、フェムトジェットをオンにし、回転ノブを回転させることによってPcおよびPi注入パラメータを設定します。
注:液体の連続的な流れのために600 hPaのPC値が推薦される。Pc 値は針の開口部によって異なります。P-1000ニードルプーラーで示されたパラメータを使用して調製された針の場合、Pc値は500 hPaと700 hPaの間で一定の流れを生成する。Pc の値が低い場合は、開口部が大きすぎて昆虫に損傷を与える可能性があることを示しますが、値が大きいほど、針がまだ閉じているか、開口部が小さすぎることを示します。 - 約30°の垂直角度で2と3の目に見える腹部セグメントの間に針を慎重に挿入します(図1E)。白い段階の子犬の場合は腹部全体がピンク色になるまで、または黒い子犬の場合は腹部のサイズが大きくなるまで、連続的な流れを注入する。腹部がこれ以上液体を取ることができないことが明らかになった場合、または液体が体外に流れ始めたときに注入を停止します。次の子犬に慎重に移動し、これらの手順を繰り返します。
注:注射中に針でオビポジターに触れたり損傷を与えたりしないでください。 - 注入した子犬とスライドを、水分を維持するために脱イオン水を浸したペーパータオルを含むペトリ皿に移します。皿を蓋で覆い、スズミが出現するまで25°Cに置きます(図1F)。
5. 吸引管を用いたプパル注射
- 因子を使用して注入ミックスの量を計算する:4 pupae注入/1 μL溶液。
注:20-30の子犬の典型的な注射は、5〜8 μLのリボヌクレオタンパク質(RNP)複合体サポニンミックスまたはBAPC12とのRNPを必要とします。 - セクション2で示唆されているように、子犬を整列させ、1つのスライドを解剖顕微鏡の下に整列した子犬と一緒に置きます(図1E)。
- ステップ3.4(図1D)で示すように、毛細血管針の1つを取り、2つのガラススライドの間の先端を破る。注射液が口で空気を吹き飛ばして外に出るのに十分な針先が開いているが、液体を失って子犬を傷つけることを避けるために開きすぎないことを確認してください(図1E)。
注:このステップは、ユーザーが昆虫のヘモリンフに注入混合物を押し込むために口からの空気を使用するので、重要です。特定の溶液の混合の粘度に最適な針の絞りの種類を確認するために練習することをお勧めします。1セットあたり20匹の子犬の5セットの注射は、口の注射システムに慣れるのに十分かもしれません。 - マイクロローディングチップを用いてリボヌクレオプロテイン溶液12 を用いて1本の針をロードし、その針をアスピレーターチューブアセンブリのコネクタパックに挿入する。
注:デモンストレーションの間、針には ナソーニアシンナバー ル遺伝子12を標的とするBAPC-Cas9-sgRNAがロードされます。 - 約30°の垂直角度で2と3の目に見える腹部セグメントの間に針を慎重に挿入します(図1E)。白い段階の子犬の場合は腹部全体がピンク色になるまで、または黒い子犬の場合は腹部のサイズが大きくなるまで、連続的な流れを注入する。腹部がこれ以上液体を取ることができないことが明らかになった場合、または液体が体外に流れ始めたときに注入を停止します。次の子犬に慎重に移動し、これらの手順を繰り返します
注:注射中に針でオビポジターに触れたり損傷を与えたりしないでください。 - 注入した子犬とスライドを、水分を維持するために脱イオン水を浸したペーパータオルを含むペトリ皿に移します。皿を蓋で覆い、スズミが出現するまで25°Cに置きます(図1F)。
6. アスピレーターチューブによる成人注射
- 大人の準備のために、細かい絵筆ときれいな小さな試験管で20人の処女の女性の別々のグループ。メスが麻酔されるまで5分間氷の上にチューブを置きます。あるいは、女性は、CO2を使用して麻酔を行い、注入することができる。
注:成人のスズメバチは冷たい耐性を持ち、注射後に容易に回復するので、氷は麻酔薬として好ましい。メスは、子犬よりも多くの注入された液体を取ることができます:1 μLの溶液は、4匹の子犬の代わりに3人の女性に使用できます。それに応じてボリュームを準備します。 - 氷の上に1つのガラススライドを置いて、アイスバケツを準備します。冷たいスライドの上に女性を並べて、腹部を上に向けて(図1E)、解剖スコープの下に合わせます。
- マイクロローディングチップを用いてリボヌクレオプロテイン溶液12を用いて1本の針をロードし、その針をアスピレーターチューブアセンブリのコネクタパックに挿入する。反対側から腹部にゆっくりと注入しながら、鈍い解剖針で反対側から女性をサポートします。この重要な生殖構造に大きなダメージを与えるオビポジターに触れないようにしてください(図1E)。
注: どちらの方向も、オペレータの設定に応じて許容されます。 - 約30°の垂直角度で2と3の目に見える腹部セグメントの間に針を慎重に挿入します(図1E)。女性の腹部に溶液を注入し、液体が入ることができなくなったり、余剰溶液の漏れが観察された場合に停止する。次のスズリに慎重に移動し、これらの手順を繰り返します
注:ゆっくりと注射し、針を腹部の中に約3s放置してから、ゆっくりと取り除きます。これは内部液体圧力を調節し、注射部位からの液漏れを避けるのに役立つ針の除去. - 完成したら、ペイントブラシを使用して1つのホストで新しいチューブに注入された単一の女性を穏やかに移します。室温で約1時間回復し、生存を確認し、チューブを飼育インキュベーターに戻します。
注:デモンストレーションの間、針には ナソーニアシンナバー ル遺伝子12を標的とするBAPC-Cas9-sgRNAがロードされます。
7. 射出後ケアと変異体スクリーニング
- 注射された子犬からの成人の分離の後、綿で差し込まれたガラス管に単一のスズメバチを入れ、1つの S.ブラタ ホストを挿入する(図1G)。対照的に、注射直後に宿主を持つ個々のチューブに注入された女性を置く。
- CRISPR/Cas9ノックアウト実験では、女性が1日ホストを寄生させ、毎日3日間連続してホストを交換することができます。
注 :N.ビトリペニス16のハプロディプロイド性決定システムのために、処女女性は突然変異の検出を容易にするハプロイド男性のブロードを生成します。男性特異的遺伝子のRNAiを介したノックダウンの場合、注射された個体は野生型の個体と単独で交配され、宿主を寄生させることができる。1 日に 1 つのホストを使用し、実験用のセットアップに基づいてホストを置き換えます。 - 寄生した宿主を25°Cに置き、G0雄の子孫の出現まで(〜13〜14日間)
- 解剖顕微鏡の下で、変異したフェノタイプのためのスクリーニングG0の男性。このシンナバー遺伝子は眼色素沈着12を担う:茶色の目を持つスズメバチは野生型であり、赤目や赤と茶色の目の間のバリエーションが変異体であるスズメバチである(図1H)。
8. 射出後クロスと飼育
- すべての変異G0雄を赤目(表現型破壊シナバー12遺伝子)を野生型の処女メスと1〜2日間配置する(図2A)。
注:破壊された遺伝子が目に見える表現型を与えない場合、ポリメラーゼ連鎖反応(PCR)の後に、変異動物を同定するために標的遺伝子のシーケンシングが必要である。PCR用のG0雄からDNAを得る前に、野生のタイプの処女メスと交尾するのが理想的であろう。あるいは、G0雄の脚からDNAを抽出して突然変異体を同定し、検証された突然変異を有するもののみを交尾させる。 - 女性1人につき2つの S.ブラタ ホストを追加し、12:12明暗サイクルで25°Cと30%の相対湿度でオビポジットを可能にします。ホストを 2 ~3 日ごとに交換します。
- 寄生したホストを25°Cと相対湿度30%で保存し、12:12の明暗サイクルで10日間保存します。
- 〜10日後、穿刺針で寄生宿主を開き、宿主から各 N.ビトリペンシス の子犬を取り除いた。
- 細かい先端の絵筆の助けを借りて、女性の子犬を選択します(図1A)。
注:メスは二色とヘテロ接合であり、したがって、目の色は野生のタイプになります。
- 15~20匹の雌の子犬をガラス管に25°Cで入れ、出現するまで置きます。出現後、〜20 S.ブラタ ホストを追加し、処女G1女性は2-3日間ホストを寄生させる。
注:これらの女性は50%G2変異体の男性を生産します。- 寄生したホストを25°Cと相対湿度30%で保存し、G2男性成人が出現するまで12:12の明暗サイクルを行います。
- 残りのG1の子犬を5°Cで8-10日間置きます。この期間の後、それらを取り除き、25°Cと30%の相対湿度に置き、12:12明暗サイクルで出現するまで(図2A)。
- ステップ8.3.1でG2雄の出現後、赤目変異型表現型の存在をスクリーンする。細かい先端の絵筆の助けを借りて、野生のタイプの男性から赤目の男性を分離します。
注: この世代に赤目のスズメバチが存在する(G2, 図2A)は、遺伝子編集が生殖細胞系列で起こったこと、そして突然変異が遺伝性であることを示しています。 - G1メスと赤目の男性を配置し、ステップ8.3.2(図2A)で新たに出現し、1〜2日間交尾させます。女性1人につき2 S.ブラタ ホストを追加し、10〜11日間12:12の明暗サイクルで25°Cと30%の相対湿度に置きます。
- 10~11日後、穿刺された宿主を解剖針で開き、宿主から各N.ビトリペンシスの子犬を取り除いた(図2A)。
- 細かい先端の絵筆の助けを借りて、赤目のスズメバチ(男性とメス)を野生のタイプから分離します(図1H)。ガラス管で一緒に赤目のスズメバチの飼育を続け、野生のスズメバチと混ぜないでください。
注:この段階(G3、図2A)では、ハプロイドの男性とジプロイドメスは、シナバー突然変異の表型を運び、示します。もし影響を受けた遺伝子が目に見えない表現型のためにコードするならば、G0雄を1匹の野生型メスと単独で交差させ、〜1日を過ごす。次いで、PCRおよびシーケンシングによる突然変異の分子特性評価のために雄を除去し、雌が宿主を寄生させる。確認された変異型男性の子孫のみで交差方式を継続する(図2B)。候補遺伝子のRNAiによるノックダウンが目標である場合、dsRNAを注入した個体を直接使用して、所望の機能アッセイ(致死性、滅菌、またはジアポーズ誘導アッセイ3,7など)を行う。RNAiは一過性であるため、所望の表現型(図2C)3、7でコロニーを生成することはできない。

図1:プパルと成人のナソーニアビトリペニスマイクロインジェクションのタイムライン(A)オスとメスの白(上)と黒(下)の子犬が集まり、(B-C)が整列し、注入のためにガラススライドに接着される。(D)毛細血管針を用意して開き、2枚の重なり合うスライド上でスライドさせる。(E)針は、フェムトジェット(上)または注射用のアスピレーターチューブ(下)のいずれかに取り付けられています。(F)スライド上に注入された子犬は、湿度を保つために底部に湿ったティッシュを持つペトリ皿に移される。出現すると、(G)メスは小さなガラス管に単独で配置され、サルコパの子犬にオビポジットを許可される。(H)変異体を検出する子孫のスクリーニング。この図の大きなバージョンを表示するには、ここをクリックしてください。
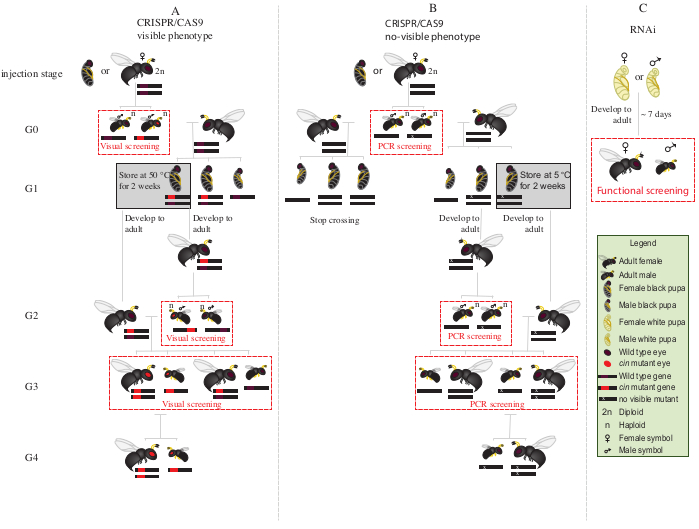
図2:射出後の交差方式 CRISPR/Cas9媒介遺伝子の遺伝子編集の場合における交差スキーム手順の模式表現(A)は、可視表現型を誘導し、(B)可視表現型を付与しない。(C) RNAiスクリーニング手順の概略表現。略語:シン=シナバー;PCR = ポリメラーゼ連鎖反応。この図の大きなバージョンを表示するには、ここをクリックしてください。
結果
この論文では、フェムトジェットまたはアスピレーターチューブを使用して、プパルと成人マイクロインジェクションの2つの簡単な方法を紹介します。第1の方法は、RNAiの一貫性のために重要である液体のより正確な注入を可能にするが、2番目の方法は 、ナソニア の子犬または成人に大量の液体を注入することを可能にする。
ディスカッション
最近、さまざまな生物学的な質問2、3、7、17のモデル生物としてのナッソニア・ビトリペンシスの使用が増加したことで、N.ビトリペンシス遺伝子の機能解析のための単純化された効率的なプロトコルを可能にする注入方法を開発し、最適化する必要があります。遺伝子編集試薬の胚...
開示事項
JLR及びDCRは、リモット制御技術に関する暫定特許保護を申請している。O.S.Aはアグラジーン社の創設者であり、株式権を持ち、同社のサイエンティフィック・アドバイザリー・ボードを務めています。他のすべての著者は、競合する利益を宣言しません。
謝辞
この作業の一部は、O.S.A.とNSF/BIO助成金1645331 J.L.Rに向けられたUCSDスタートアップファンドによって支えられた。
資料
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm Stackable Petri Dishes, Polystyrene, Mono, Sterile | Sigma | 960-97693-083 | |
| Aluminosilicate glass capillary tubing 1 mm(outside diameter) x 0.58 mm (inner diameter) | Sutter Instruments | BF100-58-10 | Can also use Borosilicate or Quartz |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma | A5177-5EA | |
| BAPC | phoreus biotech | BAPtofect-25 0.5 mg Kit | |
| Cas9 Protein with NLS | PNABio | CP01 | |
| Dissecting needle | VWR | 10806-330 | |
| DNase/RNase-Free distilled Water | Invitrogen | 10977-015 | |
| Femtojet Express programmable microinjector | Eppendorf | ||
| Femtotips Microloader tips | Fisher Scientific | E5242956003 | |
| Fine-tip paintbrush | ZEM | 2595 | |
| Flesh fly pupae, Sarcophaga bullata | Ward's Science | 470180-392 | |
| Food colorant dye | |||
| Glass Test Tubes | Fisher Scientific | 982010 | |
| Glue | Elmer's | washable, no toxic school glue | |
| Micropipette Puller | Sutter Instruments | P-1000 or P-2000 | |
| Microscope Slides | Fisherbrand | 12-550-A3 | |
| Stereo Microscope | Olympus | SZ51 |
参考文献
- Verhulst, E. C., Beukeboom, L. W., van de Zande, L. Maternal control of haplodiploid sex determination in the wasp Nasonia. Science. 328 (5978), 620-623 (2010).
- Verhulst, E. C., Lynch, J. A., Bopp, D., Beukeboom, L. W., van de Zande, L. A new component of the Nasonia sex determining cascade is maternally silenced and regulates transformer expression. PloS One. 8 (5), 63618 (2013).
- Dalla Benetta, E., et al. Genome elimination mediated by gene expression from a selfish chromosome. Science Advances. 6 (14), (2020).
- Aldrich, J. C., Leibholz, A., Cheema, M. S., Ausiό, J., Ferree, P. M. A "selfish" B chromosome induces genome elimination by disrupting the histone code in the jewel wasp Nasonia vitripennis. Scientific Reports. 7, 42551 (2017).
- Ferree, P. M., et al. Identification of genes uniquely expressed in the germ-line tissues of the jewel wasp Nasonnia vitripennis. G3. 3 (12), 2647-2653 (2015).
- Akbari, O. S., Antoshechkin, I., Hay, B. A., Ferree, P. M. Transcriptome profiling of Nasonia vitripennis testis reveals novel transcripts expressed from the selfish B chromosome, paternal sex ratio. G3. 3 (9), 1597-1605 (2013).
- Dalla Benetta, E., Beukeboom, L. W., van de Zande, L. Adaptive differences in circadian clock gene expression patterns and photoperiodic diapause induction in Nasonia vitripennis. The American Naturalist. 193 (6), 881-896 (2019).
- Paolucci, S., et al. Latitudinal variation in circadian rhythmicity in Nasonia vitripennis. Behavioral Sciences. 9 (11), (2019).
- Werren, J. H., Loehlin, D. W. The parasitoid wasp Nasonia: an emerging model system with haploid male genetics. Cold Spring Harbor Protocols. 2009 (10), (2009).
- Lynch, J. A., Desplan, C. A method for parental RNA interference in the wasp Nasonia vitripennis. Nature Protocols. 1 (1), 486-494 (2006).
- Li, M., et al. Generation of heritable germline mutations in the jewel wasp Nasonia vitripennis using CRISPR/Cas9. Scientific Reports. 7 (1), 901 (2017).
- Chaverra-Rodriguez, D., et al. Germline mutagenesis of Nasonia vitripennis through ovarian delivery of CRISPR-Cas9 ribonucleoprotein. Insect Molecular Biology. , (2020).
- Li, M., Bui, M., Akbari, O. S. Embryo microinjection and transplantation technique for Nasonia vitripennis genome manipulation. Journal of Visualized Experiments. (130), (2017).
- Werren, J. H., Loehlin, D. W. Rearing Sarcophaga bullata fly hosts for Nasonia (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Werren, J. H., Loehlin, D. W. Strain maintenance of Nasonia vitripennis (Parasitoid Wasp). Cold Spring Harbor Protocols. 2009 (10), (2009).
- Beukeboom, L. W., van de Zande, L. Genetics of sex determination in the haplodiploid wasp Nasonia vitripennis (Hymenoptera: Chalcidoidea). Journal of Genetics. 89 (3), 333-339 (2010).
- Leung, K., van de Zande, L., Beukeboom, L. W. Life-history traits of the Whiting polyploid line of the parasitoid. Entomologia experimentalis et applicata. 167 (7), 655-669 (2019).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95 (7), 1017-1026 (1998).
- Yang, J., Zhao-jun, H. A. N. Efficiency of different methods for dsrna delivery in cotton bollworm (Helicoverpa armigera). Journal of Integrative Agriculture. 13 (1), 115-123 (2014).
- Brown, S., Holtzman, S., Kaufman, T., Denell, R. Characterization of the Tribolium Deformed ortholog and its ability to directly regulate Deformed target genes in the rescue of a Drosophila Deformed null mutant. Development Genes and Evolution. 209 (7), 389-398 (1999).
- Hughes, C. L., Kaufman, T. C. RNAi analysis of Deformed, proboscipedia and Sex combs reduced in the milkweed bug Oncopeltus fasciatus: novel roles for Hox genes in the hemipteran head. Development. 127 (17), 3683-3694 (2000).
- Dzitoyeva, S., Dimitrijevic, N., Manev, H. Intra-abdominal injection of double-stranded RNA into anesthetized adult Drosophila triggers RNA interference in the central nervous system. Molecular Psychiatry. 6 (6), 665-670 (2001).
- Chaverra-Rodriguez, D., et al. Targeted delivery of CRISPR-Cas9 ribonucleoprotein into arthropod ovaries for heritable germline gene editing. Nature Communications. 9 (1), 3008 (2018).
- Macias, V. M., et al. Cas9-mediated gene-editing in the malaria mosquito anopheles stephensi by ReMOT control. G3. 10 (4), 1353-1360 (2020).
- Heu, C. C., McCullough, F. M., Luan, J., Rasgon, J. L. CRISPR/Cas9-based genome editing in the silverleaf whitefly (Bemisia tabaci). CRISPR Journal. 3 (2), 89-96 (2020).
- Shirai, Y., Daimon, T. Mutations in cardinal are responsible for the red-1 and peach eye color mutants of the red flour beetle Tribolium castaneum. Biochemical and Biophysical Research Communications. 529 (2), 372-378 (2020).
- Hunter, W. B., Gonzalez, M. T., Tomich, J. BAPC-assisted CRISPR/Cas9 system: targeted delivery into adult ovaries for heritable germline gene editing (Arthropoda: Hemiptera). bioRxiv. , 478743 (2018).
- Chaverra Rodriguez, D., Bui, M., Li, M., Raban, R., Akbari, O. Developing genetic tools to control ACP. Citrus Research Board Citrograph Magazine. 11 (1), 64-68 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved