A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن التغيرات الطفيفة في وظائف القلب باستخدام تخطيط صدى القلب الإجهاد الدوبوتامين عبر الصدر في الفئران
In This Article
Summary
يشكل الخلل الوظيفي في البطين الأيسر المسار المشترك النهائي لمجموعة من اضطرابات القلب. نحن نقدم هنا بروتوكولا مفصلا لنهج تخطيط صدى القلب بإجهاد الدوبوتامين عبر الصدر لتقييم شامل لوظيفة البطين الأيسر لنماذج الفئران لأمراض القلب بالإضافة إلى التنميط الظاهري للقلب.
Abstract
يمهد الخلل الوظيفي في البطين الأيسر (LV) المسار النهائي للعديد من اضطرابات القلب. مع تخطيط صدى القلب الإجهادي الدوبوتامين عالي التردد عبر الصدر غير الغازية في البشر ، أصبح من الممكن اتباع نهج تحقيق اختزالي للكشف عن التغيرات الطفيفة في وظائف القلب. هنا ، نقدم بروتوكولا لاستخدام هذه التقنية في الفئران لتسهيل التحليل الموسع لبنية الجهد المنخفض ووظيفته في علم وظائف الأعضاء وعلم الأمراض مما يتيح ملاحظة التغيرات في نماذج أمراض القلب المخبأة في القلوب غير المجهدة. يمكن إجراء هذا الفحص في نفس ويسمح بالقياسات القاعدية والدوائية الناجمة عن الإجهاد. نحدد معايير مفصلة للتخدير المناسب ، وتحليل الجهد المنخفض القائم على التصوير ، والنظر في التباين داخل المراقبين وبينهم ، والحصول على استجابة إيجابية للتقلص العضلي يمكن تحقيقها في الفئران بعد حقن الدوبوتامين داخل الصفاق في ظل ظروف فسيولوجية قريبة. لتلخيص خصائص علم وظائف الأعضاء البشري والمرض في نماذج الصغيرة ، نسلط الضوء على المزالق الحرجة في التقييم ، على سبيل المثال ، تأثير Bowditch الواضح في الفئران. لتحقيق الأهداف الانتقالية بشكل أكبر ، نقارن التأثيرات الناجمة عن الإجهاد في البشر والفئران. عند استخدامها في الدراسات الانتقالية ، يجب الانتباه إلى الاختلافات الفسيولوجية بين الفئران والإنسان. تملي الدقة التجريبية أنه لا يمكن استخدام بعض المعلمات التي تم تقييمها في المرضى إلا بحذر بسبب القيود المفروضة على الدقة المكانية والزمانية في نماذج الفئران.
Introduction
السمة المميزة للعديد من أمراض القلب لدى الإنسان هي ضعف وظيفي انقباضي و / أو انبساطي في البطين الأيسر (LV). للكشف عن التشوهات الهيكلية ، وتشخيص وإدارة قصور القلب الانقباضي وكذلك تقييم الوظيفة الانبساطي لدى المرضى الذين يعانون من أعراض قصور القلب ، يتم استخدام تخطيط صدى القلب كطريقة تقييم أساسية.
نظرا لأن الأعراض غير محددة وقد لا يعاني أكثر من ثلث المرضى الذين يعانون من المتلازمة السريرية لفشل القلب من قصور القلب الفعلي ، فمن المهم العثور على ارتباط موضوعي لتخطيط صدى القلب للعرض السريريللمريض 1. علاوة على ذلك ، قد تحدث بعض الأعراض الغامضة في حالة الراحة أو الساكنة في ظل ظروف النشاط أو الإجهاد. في المرضى الذين يعانون من مرض الشريان التاجي ، يمكن أن تؤدي التغييرات الطفيفة بالفعل في التروية التاجية إلى تشوهات في حركة الجدار الإقليمي. ومع ذلك ، لا يمكن تقييم هذه التغييرات الطفيفة باستخدام تخطيط صدى القلب التقليدي حيث يمكن إخفاء التغيرات في أمراض القلب في القلوب غير المجهدة. لاكتساب فهم أعمق لعلم أمراض القلب الفيزيائية للقلب ، يوفر تخطيط صدى القلب الإجهادي تقييما ديناميكيا لبنية عضلة القلب ووظيفتها في ظل ظروف التمرين أو الإجهاد الدوائي الناجم عن ذلك ، مما يسمح بمطابقة الأعراض مع النتائج القلبية2. أيضا ، في الصغيرة ، تمثل هذه الطريقة أداة غير جراحية موثوقة في الجسم الحي3،4،5. تماشيا مع البشر ، يمكن إحداث تفاعل الإجهاد لعضلة القلب عن طريق العوامل الدوائية في الفئران والجرذان. الدوبوتامين هو دواء يستخدم بشكل متكرر ويتم إجراء تخطيط صدى القلب للإجهاد الدوبوتامين على نطاق واسع في البشر6،7 ولكن في بعض الأحيان يستخدم فقط في نماذج الصغيرة لتقييم رد فعل الإجهاد القلبي8،9،10،11. الدوبوتامين هو كاتيكولامين اصطناعي له تأثير ناهض في الغالب β1 مما يؤدي إلى تقلص عضلي إيجابي وتغير زمني للقلب. لتحقيق الترجمة الصحيحة من الإنسان إلى الفأر ، يجب مراعاة التكنولوجيا والإطار المفاهيمي لتخطيط صدى القلب ، والقيود التقنية المتعلقة بالحجم الصغير ومعدل ضربات القلب السريع في الفأر. معدل ضربات القلب المستهدف للإنسان في تخطيط صدى القلب بإجهاد الدوبوتامين هو [(220 عاما) × 0.85] مما يؤدي إلى زيادة متوسط معدل ضربات القلب بحوالي 150 ± 10٪ في المتطوعين الأصحاء12،13. بالنسبة للفئران ، هذه الصيغة مفقودة. يوصف الكسر القذفي (EF) بأنه يزداد عن طريق تخطيط صدى القلب الإجهادي لدى البشر بنسبة 5-20٪ 12،14. يتم الإبلاغ عن EF في الفئران ، اعتمادا على معدل ضربات القلب ، بين 58 ± 11٪ (< 450 نبضة في الدقيقة) و 71 ± 11٪ (≥ 450 نبضة في الدقيقة) ويتغير بنسبة 20٪ تقريبا مع ارتفاع معدلات ضرباتالقلب 4. الآلية الرئيسية في الفئران لزيادة النتاج القلبي هي زيادة معدل ضربات القلب. المسؤول جزئيا عن هذه الآلية هو تأثير Bowditch أو ظاهرة الدرج ، وهي استجابة قلبية إيجابية معتمدة على الكالسيوم بوساطة الكالسيوم ، والتي تكون أكثر وضوحا في الفئران منها في البشر15،16. بالإضافة إلى ذلك ، يكمن تخطيط صدى القلب (الإجهاد) وراء التباين داخل المراقبين وبينهم. لذلك ، لا غنى عن إجراء موحد للغاية17،18.
نقدم هنا الإجراء التفصيلي لتخطيط صدى القلب بإجهاد الدوبوتامين للحصول على صور موحدة لكشف التغيرات الطفيفة في وظائف القلب في الفئران في نماذج الصحة والمرض. تشمل المكونات الرئيسية التخدير الكافي والمراقبة الكافية لمعدل ضربات القلب والمزالق المحتملة في التصوير الناجم عن الإجهاد في الفئران. المعلمات الرئيسية هي تقييم الوظيفة الانقباضية والانبساطي بما في ذلك النظر في LVEF. نظرا لأن الفئران تقاوم الخلل الوظيفي القلبي الناجم عن الحملاللاحق 17 ، فقد يضيف هذا البروتوكول معلومات قيمة للاستخدام في نماذج أمراض صمامات القلب أيضا.
Protocol
تم تنفيذ جميع الأساليب والإجراءات وفقا والامتثال لجميع اللوائح ذات الصلة ("الاتفاقية الأوروبية لحماية الفقارية المستخدمة للأغراض التجريبية والعلمية الأخرى" (التوجيه 2010/63 / EU) وكانت رعاية وفقا للمبادئ التوجيهية المؤسسية. تم تحليل البيانات من البشر وفقا لجميع المبادئ التوجيهية المؤسسية والوطنية والدولية لرعاية الإنسان وتمت الموافقة عليها من قبل لجنة الأخلاقيات المحلية (20-9218-BO). تم إجراء جميع التجارب على ذكر C57BL / 6JRj في سن 12 أسبوعا.
1. تحضير المواد والمعدات
ملاحظة: يوضح الشكل 1 مثالا على مكان عمل الموجات فوق الصوتية للحيوانات الصغيرة.
- تأكد من العمل في بيئة صامتة يتم التحكم فيها مع ضوء قابل للتعتيم.
- قم بتسخين جل الموجات فوق الصوتية مسبقا ، على سبيل المثال ، باستخدام جهاز تسخين الجل. اترك الجل يسخن إلى 37 درجة مئوية. قد يستغرق هذا بعض الوقت.
- نظف جميع الأدوات بما في ذلك المنصة بمنديل مطهر.
- قم بتشغيل المنصة وتسخينها مسبقا إلى 37 درجة مئوية.
- قم بتشغيل جهاز الموجات فوق الصوتية. أدخل معرف ومعرف البروتوكول بالإضافة إلى المعلومات الأخرى ذات الصلة. استخدم محول طاقة بالموجات فوق الصوتية عالي التردد مع إرسال مركزي يبلغ 30 ميجاهرتز للفئران التي يبلغ وزنها حوالي 30 جراما من وزن الجسم.
- تأكد من العمل مع نظام استنفاد الغاز النشط.
ملاحظة: إذا كنت تستخدم مرشح فحم نشط لامتصاص الأيزوفلوران في تدفق الزفير ، فتأكد من التحقق من الوزن واستبدال الفلتر بمجرد الوصول إلى الحد الأقصى للزيادة في الوزن المشار إليه. - إذا لزم الأمر ، املأ المرذاذ بكمية كافية من الأيزوفلوران.
تنبيه: لا تستنشق التخدير المتطاير. - قم بإعداد محلول عمل الدوبوتامين بحجم 2.5 ميكروغرام / ميكرولتر إما عن طريق تخفيف محلول حقن جاهز للاستخدام أو عن طريق إذابة مسحوق هيدروكلوريد الدوبوتامين في محلول ملحي بنسبة 0.9٪ وفقا لتعليمات الشركة المصنعة. يكون المحلول مستقرا لمدة 24 ساعة على الأقل عند تخزينه في درجة حرارة الغرفة.

الشكل 1: مكان عمل الموجات فوق الصوتية للقلب للحيوانات الصغيرة. لا غنى عن الإعداد المريح لتخطيط صدى القلب لإجهاد الصغيرة حيث يجب أن تظل أوقات الفحص قصيرة. يتكون مكان العمل من جهاز الموجات فوق الصوتية ، ونظام تخدير للحيوانات الصغيرة مع إمدادات الأكسجين وعادم الغاز النشط ، ومنصة تخطيط صدى القلب الساخنة مع تخطيط القلب المدمج وقدرات الحركة عبر أجهزة المعالجة الدقيقة كجزء من نظام سكة حديد متكامل بالإضافة إلى وحدة مراقبة فسيولوجية. يعتبر جهاز تسخين الجل لتسخين هلام الموجات فوق الصوتية والمصباح الحراري من المساعدات المفيدة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تحضير الفأر للتصوير وتحريض التخدير
- املأ غرفة الحث ب 3٪ -4٪ v / v isoflurane في خليط غاز غاز غني بالأكسجين (مع 1 لتر / دقيقة 100٪ O2).
- وزن الماوس. التقط الماوس برفق من الذيل وانقله إلى غرفة الحث. تأكد من تخدير في غضون ثوان قليلة من خلال مراقبة حركات عن كثب.
- إذا لزم الأمر ، قم بتغيير تدفق الغاز إلى مخروط الأنف المتصل بنظام التخدير (1.0-1.5٪ حجمي إيزوفلوران مع 1 لتر / دقيقة 100٪ O2 للحفاظ على تخدير مستقر). قم بإزالة الماوس من غرفة الحث وضعه بعناية على المنصة المسخنة مسبقا. تأكد من أن الكفوف تقع على مستشعرات تخطيط القلب المدمجة في المنصة.
- لمنع جفاف الصلبة ، ضع جل المرهم على كلتا العينين.
ملاحظة: ستستغرق قياسات الإجهاد وقتها. - ضع كمية صغيرة جدا من كريم القطب الكهربائي على مستشعرات تخطيط القلب. قم بتأمين برفق بشريط لاصق على الأطراف الأربعة. استخدم جزءا صغيرا من الشريط اللاصق لتأمين موضع رأس في مخروط الأنف. يستخدم مخطط كهربية القلب لتسجيل معدل ضربات القلب أثناء الحصول على الصورة. اضبط نظام التصوير الفسيولوجي للحصول على إشارة تخطيط كهربية القلب مستقرة وواضحة.
ملاحظة: قد يؤدي الكثير من كريم القطب الكهربائي إلى سوء جودة إشارة تخطيط القلب. - لحماية من الإجهاد أثناء الإجراء ، تحقق من العمق الكافي للتخدير عن طريق الحفاظ على نطاق معدل ضربات القلب عند 400-450 نبضة في الدقيقة. يتم الحصول على معدل ضربات القلب عن طريق تخطيط القلب. من المقبول اختلاف 50 نبضة في الدقيقة داخل النطاق.
ملاحظة: قد تشير حركات إلى مستوى ضيق جدا من التخدير. يجب ألا يؤدي التخدير إلى اكتئاب القلب في الفأر. يمكن تعديل التخدير للحصول على معدل ضربات القلب المستهدف المذكور أعلاه. - باستخدام التشحيم ، أدخل مقياس حرارة المستقيم برفق للمراقبة المستمرة لدرجة حرارة الجسم. حافظ على درجة الحرارة في النطاق الفسيولوجي (عادة بين 36.5 درجة مئوية و 37.5 درجة مئوية حسب سلالة الماوس والإعداد التجريبي). في مختبر الموجات فوق الصوتية للقلب الحيواني غير الخاضع للرقابة البيئية ، يمكن النظر في استخدام إضاءة الأشعة تحت الحمراء.
- استخدم كريم إزالة الشعر الكيميائي لإزالة شعر الجسم من الصدر. استخدم منشفة ورقية مبللة ونظيفة لمسح الصدر. تأكد من إزالة جميع مكونات الكريم المتبقية (الشكل 2 أ).
ملاحظة: يمكن استخدام المقص الكهربائي قبل تطبيق إزالة الشعر أيضا. جاهز الآن للتصوير. نظرا لأنه من الأهمية بمكان إبقاء وقت التصوير قصيرا ، يجب أن يستغرق التحضير الكامل قبل التصوير أقل من 3 دقائق.
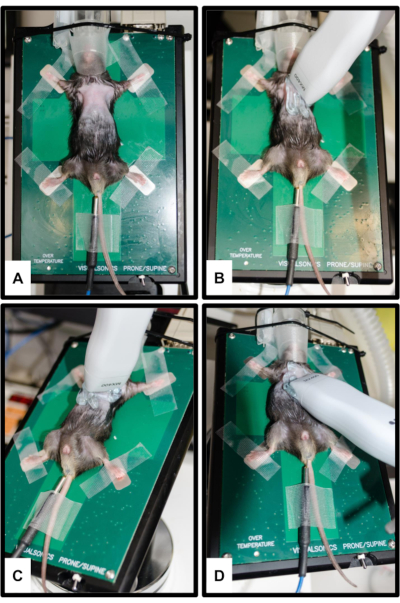
الشكل 2: وضع ومحول الطاقة. (أ) يتم توصيل الماوس بالمنصة الساخنة مع تثبيت جميع الأطراف الأربعة على أقطاب تخطيط القلب الفضية. يتم إدخال مقياس حرارة المستقيم لقياس درجة حرارة الجسم. يتم إدخال الخطم برفق في مخروط الأنف لنظام التخدير. (ب) اتجاه المسبار لرؤية المحور الطويل شبه القصي (PSLAX)؛ انظر الخطوة 3.2. (ج) اتجاه المسبار لرؤية المحور القصير شبه القصي (PSSAX)؛ انظر الخطوة 3.3. (د) اتجاه المسبار لعرض الغرف القمية الأربع (4CH) ؛ انظر الخطوة 3.4. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تصوير القلب والأوعية الدموية الأساسي
ملاحظة: يمكن الحصول على الصور باستخدام موضعين أساسيين لمحول الطاقة (نافذة الموجات فوق الصوتية المجاورة للقص والقمي) (الشكل 2) وثلاث طرق على الأقل للموجات فوق الصوتية (الوضع B (الحق) ، وضع M (otion) ووضع دوبلر (دوبلر ملون ودوبلر بالموجات النبضية (PW) (الشكل 3 ، الشكل 4 ، الشكل 5). للحصول على أساسيات التصوير ، يرجى الرجوع إلى المقالات المنشورةسابقا 16 ، 18. من الأهمية بمكان الحصول على صور واضحة للمقارنة مع صور الإجهاد المكتسبة لاحقا.
- ضع جل الموجات فوق الصوتية المسخن مسبقا بدون فقاعات على الصدر.
ملاحظة: سيؤدي جل الموجات فوق الصوتية غير المسخن إلى فقدان سريع لدرجة حرارة الجسم مما سيؤثر على معدل ضربات القلب. - أداء عرض المحور الطويل القصي (PSLAX).
ملاحظة: يتم تنفيذ PSLAX لتصور الجهد المنخفض في محوره الطويل. مع هذا ، على سبيل المثال ، يمكن الحصول على أبعاد جذر الأبهر وأبعاد الشريان الأورطي القريب بالإضافة إلى طول الجهد المنخفض.- مع توجيه الرأس بعيدا عن المحقق ، قم بإمالة الطاولة حوالي 10-20 درجة إلى اليسار و 5-10 درجات إلى الأمام لإحضار القلب إلى الأمام قدر الإمكان. ضع محول الطاقة بشكل متماشي مع المحور الطويل للقلب مع الإشارة إلى الكتف الأيمن للحيوان (الشكل 2 ب).
- استخدم المعالجات الدقيقة لضبط العرض الأمثل. استخدم عناصر التحكم في لوحة التحكم في الصورة لتحسين الصورة. احصل على صورة واحدة على الأقل في الوضع 2D B وصورة واحدة في الوضع M في مستوى البطين الأوسط.
- احصل على أي صور إضافية إذا لزم الأمر للسؤال المحدد. احصل على ما لا يقل عن 100 إطار وما لا يقل عن 3 (-6) دورات قلبية كاملة.
- قم بإجراء عرض المحور القصير القصي (PSSAX).
ملاحظة: يتم تنفيذ PSSAX لتصور الجهد المنخفض في محوره القصير. من وجهة النظر هذه ، على سبيل المثال ، يمكن حساب الحجم الانقباضي النهائي للبطين الأيسر (LVESV) وحجم البطين الأيسر الانبساطي (LVEDV) وحجم السكتة الدماغية (SV) والنتاج القلبي (CO).- قم بتدوير محول الطاقة 90 درجة في اتجاه عقارب الساعة دون تغيير الزوايا (تشير العلامة الآن إلى الكتف الأيسر للحيوان) (الشكل 2 ج). احصل على صورة واحدة على الأقل في الوضع B في المنظر القاعدي والبطيني الأوسط (مستوى العضلات الحليمي) والقمي.
- لتحديد العرض الأساسي والأكثر قمي ، قم بالتمرير على طول المحور الطويل إلى أبعد النقاط ، حيث لا تزال الدورة القلبية الكاملة لغرفة الجهد المنخفض مرئية. التقط صورا على مستوى البطين الأوسط تقريبا في وضع متوسط على مستوى العضلات الحليمية
- احصل على صورة واحدة على الأقل في الوضع M في عرض البطين الأوسط.
ملاحظة: توفر بعض أجهزة الموجات فوق الصوتية إعدادات مسبقة لوجهات النظر المختلفة ؛ يوصى بالتحقق من الإعداد المسبق المناسب قبل الحصول على الصور.
- أداء قمي أربع غرف (4CH) عرض.
ملاحظة: 4CH مهم لأنه يمكن استخدامه بشكل أساسي لتقييم الصمام التاجي باستخدام دوبلر PW.- قم بإمالة المنصة التي يكون فيها في وضع Trendelenburg المعدل مع وضع الرأس لأسفل. قم بزاوية محول الطاقة باتجاه رأس الفأر ، بحيث تكون العلامة متجهة نحو الجانب الأيسر للحيوان (الشكل 2 د).
- احصل على صورة واحدة على الأقل في الوضع B بالإضافة إلى صورة دوبلر ملونة وصورة دوبلر PW للصمام التاجي والصمام ثلاثي الشرف. اعتمادا على السؤال التجريبي ، قم بتطبيق دوبلر الأنسجة في عرض 4CH.
ملاحظة: أسهل طريقة للوصول إلى موضع 4CH القمي هي إمالة الطاولة من عرض PSAX وزاوية محول الطاقة. احرص على عدم الضغط الشديد على الصدر لأن هذا قد يتداخل مع القياسات ، على سبيل المثال وظيفة الانبساطي.
4. تصوير الإجهاد الدوبوتامين
ملاحظة: بمجرد الوصول إلى معدل ضربات القلب المستهدف ، يجب الحصول على طرق عرض موحدة طالما أن معدل ضربات القلب المستهدف مستقر. يتطلب هذا عادة أكثر من مفتاح واحد بين PSLAX و PSSAX. نظرا لأن التبديل بين PSLAX و PSSAX لا يتطلب سوى تدوير 90 درجة ، يمكن تصوير طرق العرض بسهولة.
- قم بإجراء اختبار إجهاد الدوبوتامين في نفس مع الحفاظ على نفس التخدير لضمان إمكانية المقارنة. تأكد من أن معدل ضربات القلب المبدئي يظل مستقرا في حدود 400-450 نبضة في الدقيقة. سجل قراءات تخطيط القلب واحفظها مع الصور المكتسبة عليها. تأكد من أن إشارة تخطيط القلب واضحة. خلاف ذلك ، حاول إعادة لصق جميع الأطراف الأربعة حتى يتم عرض إشارة تخطيط القلب واضحة.
- مرة أخرى ، قم بإجراء عرض PSLAX (صور الوضع B والوضع M). احفظ الصور كصورة "أساسية". تأكد من حفظ معدل ضربات القلب الأولي ووضعه في اعتبارك أيضا.
- املأ المحقنة مسبقا وحقن 5 ميكروغرام / غرام من وزن الجسم الدوبوتامين داخل الصفاق باستخدام إبرة 27 جم وحقنة 1 مل. راقب عن كثب معدل ضربات القلب. سجل صور تخطيط صدى القلب حتى يتم الوصول إلى معدل ضربات القلب المستهدف واستخدم زيادة معدل ضربات القلب لتحليلها لاحقا. يتم الوصول إلى زيادة كبيرة في معدل ضربات القلب الناجمة عن الدوبوتامين بعد زيادة بنسبة 15-30٪ بعد حوالي دقيقة واحدة ، اعتمادا على جرعة الدوبوتامين.
ملاحظة: استخدم دائما إبر الحقن المعقمة ذات الاستخدام الواحد لكل للوقاية من العدوى. قد تختلف قابلية الدوبوتامين والحمل الأقصى (الفرعي) باختلاف سلالة الفأر وقد تعتمد على الإعداد التجريبي ويجب تحديدها في التجارب المسبقة. يوصى بتعديل جرعة الدوبوتامين على الإعداد التجريبي.
تنبيه: اتبع الإرشادات المؤسسية لاستخدام المواد المعدية الحادة والمحتملة. تخلص دائما من الإبرة في حاوية نفايات طبية معتمدة! - بمجرد الوصول إلى معدل ضربات القلب المستهدف والبقاء مستقرا لمدة 30 ثانية تقريبا ، احصل على صور PSLAX B-mode و M-mode كما هو موضح في الخطوة 3.
- مرة أخرى، قم بتدوير محول الطاقة في اتجاه عقارب الساعة للحصول على عرض PSSAX كما هو موضح في الخطوة 3. هنا ، احصل على صور الوضع B للمستوى القاعدي والبطيني الأوسط (مستوى العضلات الحليمي) والمستوى القمي وصور الوضع M للمستوى البطيني الأوسط (مستوى العضلات الحليمي). طمأنة, أن معدل ضربات القلب المستهدف لا يزال مستقرا. خلاف ذلك ، ارجع إلى وضع PSLAX وابدأ التصوير مرة أخرى.
ملاحظة: نظرا لأن معدل ضربات القلب سينخفض بدون ضخ مستمر للدوبوتامين12 (غير مغطى في هذه المقالة) ، يجب الحصول على الصور في غضون دقيقتين. تعد صور PSLAX و PSSAX ضرورية لمعظم القياسات ذات الصلة الناجمة عن الإجهاد (انظر قسم "النتائج التمثيلية"). - الآن ، قم بإجراء عرض قمي 4CH مرة أخرى (كما هو موضح في الخطوة 3.4.). باستخدام دوبلر PW ، قم بقياس أنماط التدفق ذات الأهمية (كما هو موضح في الخطوة 3.4.2). في ظل ظروف غير مجهدة ، يتم قياس موجتين مميزتين باستخدام دوبلر PW ، إحداهما تمثل الحشو السلبي للبطين (الموجة E (arly)) والأخرى تمثل الحشو النشط بعد الانقباض الأذيني (الموجة A (التجريبية)). مع زيادة معدل ضربات القلب ، تميل هذه الموجات إلى الاندماج وقد لا تكون قابلة للقياس بشكل مميز تحت الإجهاد الناجم عن الدوبوتامين.
5. الخطوات النهائية
- بعد حوالي 5 دقائق عندما يبدأ معدل ضربات القلب في الانخفاض مرة أخرى ، تأكد من التقاط جميع طرق العرض.
- قم بإزالة جل الموجات فوق الصوتية برفق من الصدر باستخدام منشفة ورقية مبللة ونظيفة. قم بإزالة تثبيت الشريط بعناية. انتبه بشكل خاص للشريط الذي يثبت رأس لتجنب سحب الشعيرات.
- أوقف التخدير. إذا كنت تستخدم عادم غاز نشط ، فتأكد من الاستمرار في استنفاد الغاز. ضع على منشفة ورقية في قفص ساخن منفصل خلال فترة الاستيقاظ. راقب عن كثب. يجب ألا تترك دون رقابة حتى تستعيد وعيا كافيا للحفاظ على الاستلقاء القصي. بمجرد الاستيقاظ والتعافي التام ، انقل إلى قفصه.
ملاحظة: نظرا للطابع غير النهائي لهذه التقنية ، يجوز للحيوان البقاء ضمن التجربة وفقا لجميع اللوائح ذات الصلة.
6. التقييم دون اتصال بالإنترنت
- انقل بيانات الصورة إلى برنامج التحليل غير المتصل بالإنترنت في محطة عمل لإجراء تقييم مفصل لوظيفة القلب. انتبه بشكل خاص للفرق بين وظيفة القلب غير المجهدة والمجهدة. يجب دائما تسجيل معدل ضربات القلب وتقديمه.
ملاحظة: نظرا لأن تحليل البرامج يختلف بين البرامج المختلفة، فإنه لا يغطيه هذا البروتوكول. يرجى الرجوع إلى تعليمات الشركة المصنعة.
النتائج
تظهر صورة تخطيط صدى القلب الفسيولوجية غير المجهدة التي تم الحصول عليها في PSLAX في الشكل 3. في الانبساط ، تظهر جدران البطين بشكل موحد (الشكل 3 أ) وتتكاثف إلى درجة معينة (الشكل 3 ب ، ج). يؤدي حقن 5 ميكروغ?...
Discussion
يستخدم التقييم الناجم عن الإجهاد لوظيفة القلب على نطاق واسع في البشر في بيئة سريرية باستخدام اختبار التمرين أو اختبار الإجهاد الدوائي6،7. نظرا لأن تخطيط صدى القلب بعد التمرين الفوري للفئران محدود للغاية بسبب الحاجة إلى التخدير ، فمن المح?...
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يقر المؤلفون بمصادر التمويل التالية: مؤسسة الأبحاث الألمانية (UMEA Junior Clinician Scientist ، Stephan Settelmeier; RA 969 / 12-1 ، تينوش رساف. HE 6317 / 2-1 ، Ulrike Hendgen-Cotta) ، Else-Kroener-Fresenius-Stiftung (2014_A216 ، Tienush Rassaf).
Materials
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
References
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110 (2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219 (2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447 (2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618 (2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110 (2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738 (2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629 (2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621 (2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646 (2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7 (2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved