Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Revelando cambios sutiles en la función cardíaca mediante ecocardiografía transtorácica de estrés con dobutamina en ratones
En este artículo
Resumen
La disfunción ventricular izquierda constituye la última vía común para una serie de trastornos cardíacos. Aquí proporcionamos un protocolo detallado del enfoque de ecocardiografía de esfuerzo transtorácico con dobutamina para la evaluación integral de la función ventricular izquierda de modelos murinos de enfermedad cardíaca, así como el fenotipado cardíaco.
Resumen
La disfunción del ventrículo izquierdo (VI) allana el camino final para una multitud de trastornos cardíacos. Con la ecocardiografía de esfuerzo transtorácica no invasiva de alta frecuencia con dobutamina en humanos, se ha hecho posible un enfoque de investigación reduccionista para desenmascarar los cambios sutiles en la función cardíaca. Aquí, proporcionamos un protocolo para el uso de esta técnica en ratones para facilitar un análisis ampliado de la arquitectura y la función del VI en fisiología y patología, permitiendo la observación de alteraciones en modelos de enfermedad cardíaca oculta en corazones no estresados. Esta investigación se puede realizar en un mismo animal y permite realizar mediciones tanto basales como farmacológicas inducidas por estrés. Describimos criterios detallados para la anestesia adecuada, el análisis del VI basado en imágenes, la consideración de la variabilidad intra e interobservador y la obtención de una respuesta inotrópica positiva que se puede lograr en ratones después de la inyección intraperitoneal de dobutamina en condiciones fisiológicas cercanas. Para recapitular las características de la fisiología y la enfermedad humanas en modelos de animales pequeños, destacamos los escollos críticos en la evaluación, por ejemplo, un pronunciado efecto Bowditch en ratones. Para cumplir aún más con los objetivos traslacionales, comparamos los efectos inducidos por el estrés en humanos y ratones. Cuando se utiliza en estudios traslacionales, se debe prestar atención a las diferencias fisiológicas entre ratones y humanos. El rigor experimental dicta que algunos parámetros evaluados en pacientes solo pueden usarse con precaución debido a las restricciones en la resolución espacial y temporal en modelos de ratón.
Introducción
La característica distintiva de muchas enfermedades cardíacas en humanos es un deterioro funcional sistólico y/o diastólico del ventrículo izquierdo (VI). Para la detección de anomalías estructurales, el diagnóstico y el tratamiento de la insuficiencia cardíaca sistólica, así como la evaluación de la función diastólica en pacientes con síntomas de insuficiencia cardíaca, la ecocardiografía se utiliza como una modalidad de evaluación fundamental.
Dado que los síntomas son inespecíficos y que más de un tercio de los pacientes con el síndrome clínico de insuficiencia cardíaca pueden no padecer la insuficiencia cardíaca real, es importante encontrar un correlato ecocardiográfico objetivo para la presentación clínica del paciente1. Además, algunos síntomas que son ocultos en el estado de reposo o estático pueden ocurrir en condiciones de actividad o estrés. En los pacientes con enfermedad de las arterias coronarias, los cambios ya menores en la perfusión coronaria pueden provocar anomalías en el movimiento de la pared regional. Sin embargo, estos cambios sutiles no se pueden evaluar mediante la ecocardiografía convencional, ya que las alteraciones de la enfermedad cardíaca pueden ocultarse en los corazones no estresados. Para obtener una comprensión más profunda de la fisiopatología cardíaca, la ecocardiografía de esfuerzo proporciona una evaluación dinámica de la estructura y función miocárdica en condiciones de ejercicio o estrés inducido farmacológico, lo que permite hacer coincidir los síntomas con los hallazgos cardíacos2. Además, en pequeños animales, este método representa una herramienta in-vivo confiable y no invasiva 3,4,5. Al igual que en los humanos, la reacción de estrés del miocardio puede inducirse a través de agentes farmacológicos en ratones y ratas. La dobutamina es un fármaco de uso frecuente y la ecocardiografía de estrés con dobutamina se realiza ampliamente en humanos 6,7 pero solo a veces se utiliza en modelos de animales pequeños para evaluar la reacción de estrés cardíaco 8,9,10,11. La dobutamina es una catecolamina sintética con un efecto predominantemente β1-agonístico que da lugar a una inotropía y cronotropía positivas del corazón. Para lograr una traducción correcta de humano a ratón, la tecnología y el marco conceptual de la ecocardiografía, se deben tener en cuenta las limitaciones técnicas relacionadas, por ejemplo, con el pequeño tamaño y la frecuencia cardíaca rápida en el ratón. La frecuencia cardíaca objetivo humana en la ecocardiografía de esfuerzo con dobutamina es [(220-edad) x 0,85], lo que resulta en un aumento promedio de la frecuencia cardíaca de aproximadamente 150 ± 10% en voluntarios sanos12,13. En el caso de los ratones, falta una fórmula de este tipo. Se ha descrito que la fracción de eyección (FE) se incrementa mediante ecocardiografía de esfuerzo en humanos en un 5-20%12,14. La FE en ratones, dependiendo de la frecuencia cardíaca, se reporta entre 58 ± 11% (< 450 lpm) y 71 ± 11% (≥ 450 lpm) y cambia en casi un 20% con frecuencias cardíacas más altas4. El principal mecanismo en ratones para aumentar el gasto cardíaco es un aumento de la frecuencia cardíaca. Parcialmente responsable de este mecanismo es el efecto Bowditch o fenómeno de escalera, una respuesta cardíaca inotrópica positiva mediada por calcio dependiente de la frecuencia, que es más pronunciada en ratones que en humanos 15,16. Además, la ecocardiografía (de esfuerzo) subyace a la variabilidad intra e interobservador. Por lo tanto, es indispensable un procedimiento altamente estandarizado17,18.
Aquí presentamos el procedimiento detallado de la ecocardiografía de estrés con dobutamina para adquirir imágenes estandarizadas para desentrañar cambios sutiles en la función cardíaca en ratones en modelos de salud y enfermedad. Los componentes clave incluyen una anestesia adecuada, un monitoreo adecuado de la frecuencia cardíaca y posibles dificultades en las imágenes inducidas por el estrés en ratones. Los parámetros clave son la evaluación de la función sistólica y diastólica, incluida la consideración de la FEVI. Debido a que los ratones son resistentes a la disfunción cardíaca inducida por la poscarga17, este protocolo puede agregar información valiosa para su uso también en modelos de enfermedad cardíaca valvular.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los métodos y procedimientos se llevaron a cabo de acuerdo con todas las regulaciones pertinentes ('Convenio Europeo para la Protección de los Animales Vertebrados Utilizados para Experimentación y otros Fines Científicos' (Directiva 2010/63/UE) y el cuidado de los animales se realizó de acuerdo con las directrices institucionales. Los datos de los sujetos humanos se analizaron de acuerdo con todas las directrices institucionales, nacionales e internacionales para el bienestar humano y fueron aprobados por el Comité de Ética Local (20-9218-BO). Todos los experimentos se han realizado con machos C57BL/6JRj a la edad de 12 semanas.
1. Preparación de materiales y equipos
NOTA: La Figura 1 muestra un ejemplo de un lugar de trabajo de ultrasonido para animales pequeños.
- Asegúrese de operar en un entorno controlado silencioso con luz regulable.
- Precaliente el gel de ultrasonidos, por ejemplo, con un calentador de gel. Deje que el gel se caliente a 37 °C. Esto puede llevar un tiempo.
- Limpie todos los instrumentos, incluida la plataforma, con una toallita desinfectante.
- Encienda y precaliente la plataforma a 37 °C.
- Encienda la máquina de ultrasonido. Introduzca el ID del animal y el ID del protocolo, así como otra información relevante. Utilice un transductor de ultrasonido de alta frecuencia con una transmisión central de 30 MHz para ratones con un peso corporal de aproximadamente 30 g.
- Asegúrese de trabajar con un sistema de escape de gas activo.
NOTA: Si utiliza un filtro de carbón activado para adsorber el isoflurano en el flujo exhalado, asegúrese de verificar el peso y reemplazar el filtro una vez que se alcance el aumento de peso máximo indicado. - Si es necesario, llene el vaporizador con la cantidad adecuada de isoflurano.
PRECAUCIÓN: No inhale anestésicos volátiles. - Prepare una solución de trabajo de dobutamina de 2,5 μg/μL, ya sea diluyendo una solución inyectable lista para usar o disolviendo polvo de clorhidrato de dobutamina en solución salina al 0,9%, de acuerdo con las instrucciones del fabricante. La solución es estable al menos durante 24 horas cuando se almacena a temperatura ambiente.

Figura 1: Lugar de trabajo de ecografía cardíaca en animales pequeños. Un entorno ergonómico es indispensable para la ecocardiografía de esfuerzo en animales pequeños, ya que los tiempos de examen deben ser cortos. El lugar de trabajo consta de una máquina de ultrasonidos, un sistema de anestesia para pequeños animales con suministro de oxígeno y escape de gas activo, una plataforma de ecocardiografía calefactada con ECG integrado y capacidades de movimiento a través de micromanipuladores como parte de un sistema de rieles integrado, así como una unidad de monitoreo fisiológico. Un calentador de gel para calentar el gel de ultrasonido y una lámpara de calor son ayudas útiles. Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación del ratón para la obtención de imágenes y la inducción de la anestesia
- Llene la cámara de inducción con isoflurano al 3%-4% v/v en una mezcla de gases enriquecidos con oxígeno (con 1 L/min 100% O2).
- Pesa el ratón. Levante suavemente el ratón por la cola y transfiéralo a la cámara de inducción. Asegúrese de que el animal esté sedado en unos segundos observando de cerca los movimientos del animal.
- Si es necesario, cambie el flujo de gas al cono de la nariz conectado al sistema de anestesia (1,0-1,5 vol% de isoflurano con 1 L/min 100 %O2 para mantener una sedación estable). Retire el ratón de la cámara de inducción y colóquelo con cuidado en la plataforma precalentada. Asegúrese de que las patas estén sobre los sensores de ECG integrados en la plataforma.
- Para evitar que se seque la esclerótica, aplique gel de ungüento en ambos ojos.
NOTA: Las mediciones de tensión tomarán su tiempo. - Aplique una cantidad muy pequeña de crema de electrodos a los sensores de ECG. Asegure suavemente al animal con cinta adhesiva en las cuatro extremidades. Use una pequeña parte de cinta adhesiva para asegurar la posición de la cabeza del animal en el cono de la nariz. El ECG se utiliza para registrar la frecuencia cardíaca durante la adquisición de imágenes. Ajuste el sistema de imágenes fisiológicas para obtener una señal de ECG estable y clara.
NOTA: Demasiada crema de electrodos puede resultar en una mala calidad de la señal de ECG. - Para proteger al animal del estrés durante el procedimiento, verifique la profundidad adecuada de la sedación manteniendo el rango de frecuencia cardíaca en 400-450 lpm. La frecuencia cardíaca se obtiene mediante el ECG. Una variación de 50 bpm dentro del rango es aceptable.
NOTA: Los movimientos del animal pueden indicar un nivel demasiado estrecho de sedación. La anestesia no debe provocar cardiodepresión del ratón. La sedación se puede ajustar para obtener la frecuencia cardíaca objetivo mencionada anteriormente. - Usando lubricación, inserte suavemente un termómetro rectal para un monitoreo continuo de la temperatura corporal. Mantenga la temperatura en el rango fisiológico (normalmente entre 36,5 °C y 37,5 °C, dependiendo de la cepa del ratón y de la configuración experimental). En un laboratorio de ultrasonido cardíaco animal no controlado ambientalmente, se puede considerar el uso de iluminación infrarroja.
- Use crema depilatoria química para eliminar el vello corporal del pecho. Use una toalla de papel limpia y húmeda para limpiar el pecho. Asegúrese de eliminar todos los componentes restantes de la crema (Figura 2A).
NOTA: También se puede usar una maquinilla eléctrica antes de la aplicación depilatoria. El animal ya está preparado para la toma de imágenes. Dado que es fundamental mantener el tiempo de obtención de imágenes corto, toda la preparación antes de la obtención de imágenes debe durar menos de 3 minutos.
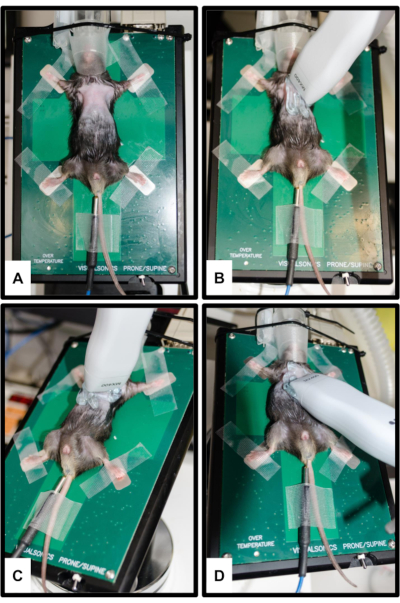
Figura 2: Posicionamiento del animal y del transductor. (A) El ratón está unido a la plataforma calentada con las cuatro extremidades fijadas en los electrodos de ECG plateados. Se inserta un termómetro rectal para medir la temperatura corporal. El hocico se inserta suavemente en el cono de la nariz del sistema de anestesia. (B) Orientación de la sonda para la vista del eje largo paraesternal (PSLAX); Consulte el paso 3.2. (C) Orientación de la sonda para la vista del eje corto paraesternal (PSSAX); Consulte el paso 3.3. (D) Orientación de la sonda para la vista apical de cuatro cámaras (4CH); Consulte el paso 3.4. Haga clic aquí para ver una versión más grande de esta figura.
3. Imágenes cardiovasculares básicas
NOTA: Las imágenes se pueden adquirir utilizando dos posiciones básicas del transductor (ventana de ultrasonido paraesternal y apical) (Figura 2) y al menos tres modalidades de ultrasonido (modo B(rectitud), modo M(otion) y modo Doppler (Doppler color y Doppler de onda pulsada (PW)) (Figura 3, Figura 4, Figura 5). Para conocer los conceptos básicos de imagen, consulte los artículospublicados anteriormente 16,18. Es fundamental obtener imágenes claras para la comparación con las imágenes de estrés adquiridas posteriormente.
- Aplique gel de ultrasonido precalentado sin burbujas en el pecho.
NOTA: El gel de ultrasonido no calentado provocará una rápida pérdida de temperatura corporal que afectará la frecuencia cardíaca. - Realizar la vista paraesternal de eje largo (PSLAX).
NOTA: PSLAX se realiza para visualizar el VI en su eje longitudinal. Con esto, por ejemplo, se pueden obtener las dimensiones de la raíz aórtica y la dimensión de la aorta proximal, así como la longitud del VI.- Con la cabeza alejada del investigador, incline la mesa aproximadamente 10-20° hacia la izquierda y 5-10° hacia el frente para llevar el corazón lo más adelante posible. Coloque el transductor paraesternalmente en línea con el eje largo del corazón con el marcador (muesca) apuntando hacia el hombro derecho del animal (Figura 2B).
- Utilice micromanipuladores para ajustar la vista óptima. Utilice los controles del panel de control de imagen para optimizar la imagen. Adquiera al menos una imagen 2D en modo B y una imagen en modo M a nivel ventricular medio.
- Adquiera imágenes adicionales si es necesario para la pregunta específica. Adquirir al menos 100 fotogramas y al menos 3(-6) ciclos cardíacos completos.
- Realizar la vista de eje corto paraesternal (PSSAX).
NOTA: El PSSAX se realiza para visualizar el VI en su eje corto. Desde este punto de vista, por ejemplo, se pueden calcular el volumen telesistólico del ventrículo izquierdo (VISVI), el volumen telediastólico del ventrículo izquierdo (VVIDI), el volumen sistólico (VS) y el gasto cardíaco (CO).- Gire el transductor 90° en el sentido de las agujas del reloj sin cambiar la angulación (el marcador ahora apunta hacia el hombro izquierdo del animal) (Figura 2C). Adquiera al menos una imagen en modo B en la vista basal, ventricular media (nivel de los músculos papilares) y apical.
- Para definir la vista más basal y la más apical, desplácese a lo largo del eje largo hasta los puntos más distantes, donde el ciclo cardíaco completo de la cámara del VI aún es visible. Tomar imágenes a nivel del ventrículo medio aproximadamente en una posición intermedia a nivel de los músculos papilares.
- Adquiera al menos una imagen en modo M en la vista ventricular media.
NOTA: Algunas máquinas de ultrasonido proporcionan ajustes preestablecidos para las diferentes vistas; Se recomienda comprobar el ajuste preestablecido adecuado antes de adquirir imágenes.
- Realice una vista apical de cuatro cámaras (4 canales).
NOTA: La 4CH es importante porque se puede utilizar principalmente para evaluar la válvula mitral mediante el Doppler PW.- Incline la plataforma en la que se encuentra el animal en una posición Trendelenburg modificada con la cabeza hacia abajo. Incline el transductor hacia la cabeza del ratón, con el marcador orientado hacia el lado izquierdo del animal (Figura 2D).
- Adquiera al menos una imagen en modo B, así como una imagen Doppler en color y una imagen Doppler PW de la válvula mitral y tricúspide. Dependiendo de la pregunta experimental, aplique Doppler tisular en la vista de 4 canales.
NOTA: La forma más fácil de alcanzar la posición apical de 4 canales es inclinar la mesa desde la vista PSAX y angular el transductor. Tenga cuidado de no aplicar demasiada presión sobre el tórax, ya que esto puede interferir con las mediciones, por ejemplo, de la función diastólica.
4. Imágenes de estrés con dobutamina
NOTA: Una vez que se alcanza la frecuencia cardíaca objetivo, se deben adquirir vistas estandarizadas siempre que la frecuencia cardíaca objetivo sea estable. Por lo general, esto requiere más de un cambio entre PSLAX y PSSAX. Debido a que el cambio entre PSLAX y PSSAX solo requiere una rotación de 90°, las vistas se pueden visualizar fácilmente.
- Realizar pruebas de esfuerzo con dobutamina en un mismo animal que mantenga la misma anestesia para garantizar la comparabilidad. Asegúrese de que la frecuencia cardíaca inicial permanezca estable en el rango de 400-450 lpm. Registre las lecturas de ECG y guárdelas junto con y sobre las imágenes adquiridas. Asegúrese de que la señal del ECG sea clara. De lo contrario, intente volver a colocar la cinta adhesiva en las cuatro extremidades hasta que se muestre una señal de ECG clara.
- De nuevo, realice la vista PSLAX (imágenes en modo B y modo M). Guarde las imágenes como imagen de "línea base". Asegúrese de guardar y tener en cuenta también la frecuencia cardíaca inicial.
- Llene previamente la jeringa e inyecte 5 μg/g de dobutamina de peso corporal por vía intraperitoneal con una aguja de 27 g y una jeringa de 1 mL. Vigila de cerca la frecuencia cardíaca. Registre imágenes ecocardiográficas hasta alcanzar la frecuencia cardíaca objetivo y utilice el aumento de la frecuencia cardíaca para su posterior análisis. Un aumento significativo y sostenible de la frecuencia cardíaca inducido por la dobutamina se alcanza después de un aumento del 15-30% después de aproximadamente 1 minuto, dependiendo de la dosis de dobutamina.
NOTA: Utilice siempre agujas de inyección estériles de un solo uso para cada animal para prevenir infecciones. La susceptibilidad a la dobutamina y la carga (sub)máxima pueden variar con la cepa de ratón y pueden depender de la configuración experimental y deben definirse en experimentos previos. Se recomienda ajustar la dosis de dobutamina a la configuración experimental.
PRECAUCIÓN: Siga las pautas institucionales para el uso de artículos punzantes y potencialmente infecciosos. ¡Deseche siempre la aguja en un contenedor de desechos médicos aprobado! - Una vez que se alcanza la frecuencia cardíaca objetivo y permanece estable durante aproximadamente 30 s, adquiera imágenes PSLAX en modo B y modo M como se describe en el paso 3.
- Nuevamente, gire el transductor en el sentido de las agujas del reloj para obtener la vista PSSAX como se describe en el paso 3. Aquí, adquiera imágenes en modo B del nivel basal, ventricular medio (nivel de los músculos papilares) y apical e imágenes en modo M del nivel ventricular medio (nivel de los músculos papilares). Tranquilízate de que la frecuencia cardíaca objetivo permanezca estable. De lo contrario, vuelva a la posición PSLAX y vuelva a iniciar la obtención de imágenes.
NOTA: Como la frecuencia cardíaca disminuirá sin una infusión continua de dobutamina12 (no tratada en este artículo), las imágenes deben adquirirse en dos minutos. Las imágenes PSLAX y PSSAX son esenciales para la mayoría de las mediciones relevantes inducidas por el estrés (consulte la sección "Resultados representativos"). - Ahora, vuelva a realizar la vista apical de 4 canales (como se explica en el paso 3.4.). Usando el Doppler PW, mida los patrones de flujo de interés (como se explica en el paso 3.4.2.). En condiciones no estresadas, se miden dos ondas características utilizando el Doppler PW, una que representa el llenado pasivo del ventrículo (onda E(arly)) y otra que representa el llenado activo después de la contracción auricular (onda A(trial)). Con el aumento de la frecuencia cardíaca, estas ondas tienden a fusionarse y pueden no ser medibles distintivamente bajo el estrés inducido por la dobutamina.
5. Pasos finales
- Después de aproximadamente 5 minutos, cuando la frecuencia cardíaca comenzará a disminuir nuevamente, asegúrese de que se capturen todas las vistas.
- Retire suavemente el gel de ultrasonido del tórax con una toalla de papel limpia y húmeda. Retire con cuidado la fijación de la cinta. Presta especial atención a la cinta que fija la cabeza del animal para evitar arrancarle los bigotes.
- Apague la anestesia. Si usa un escape de gas activo, asegúrese de continuar con el escape de gas. Coloque al animal sobre una toalla de papel en una jaula caliente separada durante el período de despertar. Observa al animal de cerca. No debe dejarse desatendido hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal. Una vez despierto y completamente recuperado, transfiera al animal a su jaula.
NOTA: Debido al carácter no definitivo de esta técnica, el animal puede permanecer dentro del experimento de acuerdo con todas las regulaciones pertinentes.
6. Evaluación fuera de línea
- Transfiera los datos de la imagen al software de análisis fuera de línea en una estación de trabajo para realizar una evaluación detallada de la función cardíaca. Preste especial atención a la diferencia entre la función cardíaca no estresada y estresada. La frecuencia cardíaca siempre debe estar registrada y presentada.
NOTA: Debido a que el análisis de software varía entre diferentes software, no está cubierto en este protocolo. Consulte las instrucciones del fabricante.
Access restricted. Please log in or start a trial to view this content.
Resultados
En la Figura 3 se muestra una imagen ecocardiográfica fisiológica sin estrés adquirida en PSLAX. En la diástole, las paredes del ventrículo aparecen uniformemente (Figura 3A) y se engrosan hasta cierto punto (Figura 3B, C). La inyección de 5 μg/g de dobutamina i.p. en el peso corporal conduce a un aumento significativo de la frecuencia cardía...
Access restricted. Please log in or start a trial to view this content.
Discusión
La evaluación de la función cardíaca inducida por el estrés es ampliamente utilizada en humanos en un entorno clínico mediante pruebas de esfuerzo o pruebas de esfuerzo farmacológico 6,7. Debido a que la ecocardiografía inmediata después del ejercicio en ratones es muy limitada debido a la necesidad de sedación, es probable que la ecocardiografía de esfuerzo inducida por dobutamina sea el método más traslacional para ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores mencionan las siguientes fuentes de financiación: Fundación Alemana de Investigación (UMEA Junior Clinician Scientist, Stephan Settelmeier; LR 969/12-1, Tienush Rassaf; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
Referencias
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110(2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219(2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447(2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618(2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110(2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738(2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629(2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, suppl_D 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621(2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, Suppl 1 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646(2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7(2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados