需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用经胸多巴酚丁胺负荷超声心动图揭示小鼠心脏功能的细微变化
摘要
左心室功能障碍是许多心脏疾病的最终共同途径。我们在这里提供了经胸多巴酚丁胺负荷超声心动图方法的详细方案,用于综合评估小鼠心脏病模型的左心室功能以及心脏表型。
摘要
左心室 (LV) 功能障碍为多种心脏疾病铺平了最终途径。随着人类无创高频经胸多巴酚丁胺负荷超声心动图,一种揭示心脏功能细微变化的还原主义调查方法已成为可能。在这里,我们提供了一种在小鼠中使用该技术的方案,以促进对生理学和病理学中 LV 结构和功能的扩展分析,从而能够观察隐藏在无压力心脏中的心脏病模型的改变。这项调查可以在同一只动物中进行,并允许进行基础和药理学应激诱导的测量。我们概述了适当麻醉、基于成像的 LV 分析、考虑观察者内部和观察者间变异性以及在接近生理条件下腹膜内注射多巴酚丁胺后小鼠可以获得的阳性正性肌力反应的详细标准。为了概括小动物模型中人类生理学和疾病的特征,我们强调了评估中的关键陷阱,例如,小鼠中明显的 Bowditch 效应。为了进一步满足转化目标,我们比较了压力诱导的人类和小鼠效应。当用于转化研究时,必须注意小鼠和人类之间的生理差异。实验的严谨性表明,由于小鼠模型的空间和时间分辨率的限制,在患者中评估的一些参数只能谨慎使用。
引言
人类许多心脏病的标志是左心室 (LV) 的收缩期和/或舒张期功能障碍。对于结构异常的检测、收缩性心力衰竭的诊断和管理以及心力衰竭症状患者的舒张功能评估,超声心动图被用作基本评估方式。
由于症状不具有特异性,并且超过 1/3 的心力衰竭临床综合征患者可能没有实际的心力衰竭,因此为患者的临床表现找到客观的超声心动图相关性非常重要1。此外,一些在静息或静止状态下隐匿的症状可能在活动或压力条件下出现。在冠状动脉疾病患者中,冠状动脉灌注的微小变化可导致局部室壁运动异常。然而,这些细微的变化不能用传统的超声心动图来评估,因为心脏病的变化可能隐藏在无压力的心脏中。为了更深入地了解心脏生理病理学,负荷超声心动图提供了在运动或药物诱导的负荷条件下心肌结构和功能的动态评估,允许将症状与心脏检查结果相匹配2。此外,在小动物中,这种方法代表了一种非侵入性的可靠体内工具 3,4,5。与人类一致,心肌的应激反应可以通过药物诱导小鼠和大鼠。多巴酚丁胺是一种常用的药物,多巴酚丁胺负荷超声心动图广泛用于人类 6,7,但有时仅用于小动物模型以评估心脏应激反应 8,9,10,11。多巴酚丁胺是一种合成的儿茶酚胺,主要具有 β1-激动作用,导致心脏的正性肌力和变时性。为了实现从人类到小鼠的正确翻译,超声心动图的技术和概念框架,必须考虑与小鼠的小尺寸和快速心率相关的技术限制。多巴酚丁胺负荷超声心动图中的人体目标心率为 [(220 岁) x 0.85],导致健康志愿者的平均心率增加约 150 ± 10%12,13。对于小鼠来说,缺少这样的公式。据描述,人体负荷超声心动图使射血分数 (EF) 增加了 5-20%12,14。根据心率,小鼠的 EF 在 58 ± 11%(< 450 次/分)和 71 ± 11%(≥ 450 次/分)之间,心率升高时变化近 20%4。小鼠增加心输出量的主要机制是心率增加。造成这种机制的部分原因是鲍迪奇效应或楼梯现象,这是一种频率依赖性钙介导的正性肌力心脏反应,在小鼠中比在人类中更明显15,16。此外,(负荷)超声心动图是观察者内部和观察者间变异性的基础。因此,高度标准化的程序是必不可少的17,18。
在这里,我们介绍了多巴酚丁胺负荷超声心动图的详细程序,以获取标准化图像,以揭示健康和疾病模型中小鼠心脏功能的细微变化。关键组成部分包括充分的麻醉、充分的心率监测和小鼠压力诱导成像中可能存在的陷阱。关键参数是收缩和舒张功能的评估,包括对 LVEF 的考虑。由于小鼠对后负荷诱导的心功能障碍17 具有抵抗力,因此该方案也可能为瓣膜性心脏病模型添加有价值的信息。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有方法和程序均按照所有相关法规(“欧洲保护用于实验和其他科学目的的脊椎动物公约”(指令 2010/63/EU))执行,动物护理符合机构指南。根据所有机构、国家和国际人类福利指南对人类受试者的数据进行了分析,并获得了当地伦理委员会 (20-9218-BO) 的批准。所有实验均在 12 周龄时用雄性 C57BL/6JRj 进行。
1. 准备材料和设备
注: 图 1 显示了一个小动物超声工作场所的示例。
- 确保在具有可调光灯光的安静受控环境中作。
- 预热超声凝胶,例如,使用凝胶加热器。让凝胶升温至 37 °C。 这可能需要一段时间。
- 用消毒湿巾清洁所有仪器,包括平台。
- 打开平台并将平台预热至 37 °C。
- 打开超声波机。输入动物 ID 和实验方案 ID 以及其他相关信息。对于体重约为 30 g 的小鼠,使用中心发射频率为 30 MHz 的高频超声换能器。
- 确保使用主动气体排气系统。
注意:如果使用活性炭过滤器吸附呼出流中的异氟醚,请务必检查重量并在达到指示的最大重量增加后更换过滤器。 - 如有必要,在蒸发器中加入适量的异氟醚。
注意: 不要吸入挥发性麻醉剂。 - 根据制造商的说明,通过稀释即用型注射液或将盐酸多巴酚丁胺粉末溶解在 0.9% 盐水中,制备 2.5 μg/μL 的多巴酚丁胺工作溶液。在室温下储存时,溶液可稳定至少 24 小时。

图 1:小动物心脏超声工作场所。符合人体工程学的设置对于小动物负荷超声心动图来说是必不可少的,因为检查时间必须保持较短。工作场所包括一台超声机、一个带氧气供应和主动气体排放的小动物麻醉系统、一个加热超声心动图平台,该平台通过嵌入式心电图和通过显微作器作为集成轨道系统的一部分的运动功能,以及一个生理监测单元。用于加热超声凝胶的凝胶加热器和加热灯是有用的辅助工具。请单击此处查看此图的较大版本。
2. 准备用于成像和麻醉诱导的小鼠
- 在富氧气体混合物(1 L/min 100% O2)中加入 3%-4% v/v 异氟醚填充感应室。
- 称量鼠标。轻轻地捡起鼠标的尾巴并将其转移到感应室。通过密切观察动物的动作,确保动物在几秒钟内服用镇静剂。
- 如有必要,改变流向连接到麻醉系统的鼻锥的气流(1.0-1.5 vol% isoflurane 和 1 L/min 100 % O2 以保持稳定的镇静)。从感应室中取出鼠标,小心地将其放在预热的平台上。确保爪子位于嵌入平台中的 ECG 传感器上。
- 为防止巩膜干燥,请在双眼涂抹软膏凝胶。
注意:应力测量需要时间。 - 将非常少量的电极霜涂抹在 ECG 传感器上。用胶带轻轻地固定动物的所有四个肢体。使用一小部分胶带将动物的头部位置固定在鼻锥中。ECG 用于记录图像采集过程中的心率。调整生理成像系统以获得稳定清晰的心电图信号。
注意: 电极霜过多可能会导致心电图信号质量不佳。 - 为了保护动物在手术过程中免受压力,请将心率范围保持在 400-450 bpm ,以检查镇静的足够深度。心率是通过心电图获得的。在该范围内 50 bpm 的变化是可以接受的。
注意:动物的运动可能表明镇静水平太窄。麻醉不得导致小鼠心脏抑制。可以调整镇静剂以获得上述目标心率。 - 使用润滑剂,轻轻插入直肠温度计,以持续监测体温。将温度保持在生理范围内(通常在 36.5 °C 和 37.5 °C 之间,具体取决于小鼠品系和实验设置)。在非环境控制的动物心脏超声实验室中,可以考虑使用红外照明。
- 使用化学脱毛膏去除胸部的体毛。使用干净的湿纸巾擦拭干净胸部。确保去除所有剩余的奶油成分(图 2A)。
注意:电动剪刀也可以在脱毛应用之前使用。动物现在已准备好进行成像。由于保持较短的成像时间至关重要,因此成像前的整个准备工作应少于 3 分钟。
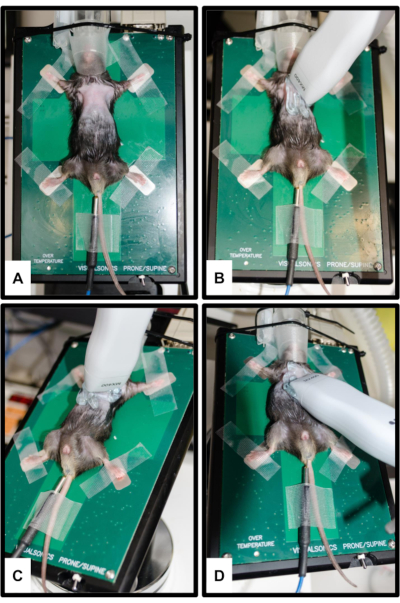
图 2:动物和换能器定位。(A) 将鼠标连接到加热平台上,所有四个肢体都固定在银色 ECG 电极上。插入直肠温度计用于测量体温。将鼻子轻轻插入麻醉系统的鼻锥。(B) 胸骨旁长轴视图 (PSLAX) 的探头方向;请参阅步骤 3.2。(C) 胸骨旁短轴视图 (PSSAX) 的探针方向;参见步骤 3.3。(D) 顶端四腔视图 (4CH) 的探针方向;参见步骤 3.4。请单击此处查看此图的较大版本。
3. 基础心血管影像学检查
注意:可以使用两个基本换能器位置(胸骨旁和心尖超声窗口)(图 2)和至少三种超声模式(B(正确)模式、M(otion)模式和多普勒模式(彩色多普勒和脉冲波 (PW) 多普勒)获取图像(图 3、图 4、图 5)。有关成像的基础知识,请参阅以前发表的文章 16,18。获得清晰的图像以便与后来获取的应力图像进行比较至关重要。
- 将预热的无气泡超声凝胶涂抹在胸部。
注意:未加热的超声凝胶会导致体温快速下降,从而影响心率。 - 进行胸骨旁长轴 (PSLAX) 视图检查。
注意:执行 PSLAX 是为了在其长轴上可视化 LV。这样,例如,可以获得主动脉根部尺寸和近端主动脉尺寸以及 LV 长度。- 将头部背对研究者,将桌子向左倾斜约 10-20°,向前倾斜约 5-10°,以使心脏尽可能向前。将换能器与心脏的长轴平行放置,标记(缺口)指向动物的右肩(图 2B)。
- 使用显微纵器调整最佳视图。使用图像控制面板控件优化图像。在心室中水平获取至少一张 2D B 型图片和一张 M 型图片。
- 如果需要特定问题,请获取任何其他图像。获取至少 100 帧和至少 3(-6) 个完整的心动周期。
- 执行胸骨旁短轴 (PSSAX) 视图。
注意:执行 PSSAX 以可视化其短轴上的 LV。从这个角度,例如,可以计算左心室收缩末期容积 (LVESV)、左心室舒张末期容积 (LVEDV)、每搏输出量 (SV) 和心输出量 (CO)。- 将换能器顺时针旋转 90°,不改变角度(标记现在指向动物的左肩)(图 2C)。在基底、心室中段 (肌水平) 和根尖视图中获取至少一个 B 型图像。
- 要定义最基底和最顶端的视图,请沿长轴滚动到最远的点,在那里 LV 腔室的完整心动周期仍然可见。在脑室中段水平拍摄图像,大约在肌水平的中间位置。
- 在心室中视图获取至少一个 M 型图像。
注意:一些超声机为不同的视图提供预设;建议在采集图像之前检查是否适当的预设。
- 执行根尖四腔 (4CH) 视图。
注意:4CH 很重要,因为它主要用于使用 PW 多普勒评估二尖瓣。- 倾斜平台,使动物处于改良的特伦德伦伯卧位,头朝下。将换能器朝向小鼠头部倾斜,标记朝向动物的左侧(图 2D)。
- 获取至少一个 B 型图像以及二尖瓣和三尖瓣的彩色多普勒和 PW 多普勒图像。根据实验问题,在 4CH 视图中应用组织多普勒。
注:达到根尖 4CH 位置的最简单方法是从 PSAX 视图倾斜工作台并调整换能器的角度。小心不要对胸部施加太大的压力,因为这可能会干扰舒张功能等测量。
4. 多巴酚丁胺应力成像
注意:一旦达到目标心率,只要目标心率稳定,就应该获取标准化视图。这通常需要在 PSLAX 和 PSSAX 之间进行多次切换。因为在 PSLAX 和 PSSAX 之间切换只需要旋转 90°,所以可以很容易地对视图进行成像。
- 在保持相同麻醉的同一只动物中进行多巴酚丁胺负荷测试,以确保可比性。确保起始心率在 400-450 bpm 范围内保持稳定。记录 ECG 读数并将其与采集的图像一起保存。确保 ECG 信号清晰。否则,请尝试重新贴上所有四个肢体,直到显示清晰的心电图信号。
- 再次执行 PSLAX 视图(B 模式和 M 模式图像)。将图像另存为 “baseline” 图像。请务必保存并记住初始心率。
- 预填充注射器,并使用 27 G 针头和 1 mL 注射器腹膜内注射 5 μg/g 体重的多巴酚丁胺。密切观察心率。记录超声心动图图像,直到达到目标心率,并使用增加的心率进行以后分析。根据多巴酚丁胺剂量,约1分钟后增加15-30%后,达到可持续的显著多巴酚丁胺诱导的心率增加。
注意:始终为每只动物使用一次性无菌注射针头,以防止感染。多巴酚丁胺敏感性和(次)最大负荷可能随小鼠品系而变化,并且可能取决于实验设置,应在实验前定义。建议根据实验设置调整多巴酚丁胺剂量。
注意: 遵循使用尖锐和潜在传染性物品的机构指南。始终将针头丢弃到经批准的医疗废物容器中! - 一旦达到目标心率并保持稳定约 30 秒,按照步骤 3 中的说明获取 PSLAX B 模式和 M 模式图像。
- 再次顺时针旋转传感器以获得 PSSAX 视图,如步骤 3 中所述。在这里,获取基底、中心室(肌水平)和根尖水平的 B 型图像以及中心室(肌水平)水平的 M 型图像。请放心,目标心率保持稳定。否则,请切换回 PSLAX 位置并再次开始成像。
注意:由于如果不持续输注多巴酚丁胺12 (本文未涵盖),心率会下降,因此应在两分钟内获取图像。PSLAX 和 PSSAX 图像对于大多数相关的应力诱导测量至关重要(参见“代表性结果”部分)。 - 现在,再次执行根尖 4CH 视图(如步骤 3.4 中所述)。使用 PW 多普勒,测量感兴趣的血流模式(如步骤 3.4.2 中所述)。在无应力条件下,使用 PW 多普勒测量两个特征波,一个代表心室的被动充盈 (E(arly) 波),另一个代表心房收缩后的主动充盈 (A(trial) 波)。随着心率的增加,这些波往往会融合,并且在多巴酚丁胺诱导的压力下可能无法明显测量。
5. 最后的步骤
- 大约 5 分钟后,当心率再次开始下降时,请确保捕获所有视图。
- 使用干净的湿纸巾轻轻地从胸部取出超声凝胶。小心地取下胶带固定。请特别注意固定动物头部的胶带,以免拉出胡须。
- 关闭麻醉。如果使用主动排气装置,请确保继续排气。在唤醒期间,将动物放在单独的加热笼子中的纸巾上。仔细观察动物。在它恢复足够的意识以维持胸骨卧位之前,不得无人看管。一旦醒来并完全恢复,将动物转移到笼子里。
注意:由于该技术的非最终特征,动物可以根据所有相关规定留在实验范围内。
6. 离线评估
- 将图像数据传输到工作站上的离线分析软件,以对心脏功能进行详细评估。特别注意无压力和压力心脏功能之间的区别。应始终记录并显示心率。
注意:由于软件分析因不同软件而异,因此本协议未涵盖。请参阅制造商的说明。
Access restricted. Please log in or start a trial to view this content.
结果
在 PSLAX 中获得的生理无应力超声心动图图像如图 3 所示。在舒张期,心室壁出现均匀(图 3A)并在一定程度上增厚(图 3B、C)。腹腔注射 5 μg/g 体重的多巴酚丁胺导致心率(正向变时作用)12 和 LVEF(正性肌力作用)显着增加(图 3<...
Access restricted. Please log in or start a trial to view this content.
讨论
压力诱导的心脏功能评估在人类临床环境中广泛使用运动测试或药物压力测试6,7。由于需要镇静,小鼠运动后立即超声心动图非常有限,因此多巴酚丁胺诱导的负荷超声心动图可能是评估负荷诱导的心脏生理病理学的最具转化性的方法。在最终方法中使用实时压力体积分析可以获得有关心脏功能的可靠信息23?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可披露的。
致谢
作者感谢以下资金来源:德国研究基金会(UMEA 初级临床医生科学家 Stephan Settelmeier;RA 969/12-1,蒂努什·拉萨夫;HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
参考文献
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110(2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219(2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447(2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618(2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110(2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738(2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629(2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, suppl_D 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621(2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, Suppl 1 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646(2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7(2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。