È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Rivelazione di sottili cambiamenti nella funzione cardiaca utilizzando l'ecocardiografia da stress transtoracica con dobutamina nei topi
In questo articolo
Riepilogo
La disfunzione ventricolare sinistra costituisce l'ultima via comune per una serie di disturbi cardiaci. Forniamo qui un protocollo dettagliato di approccio transtoracico all'ecocardiografia da stress con dobutamina per una valutazione completa della funzione ventricolare sinistra di modelli murini di malattia cardiaca e della fenotipizzazione cardiaca.
Abstract
La disfunzione ventricolare sinistra (LV) apre la strada finale a una moltitudine di disturbi cardiaci. Con l'ecocardiografia transtoracica da stress con dobutamina ad alta frequenza non invasiva nell'uomo, è diventato possibile un approccio di indagine riduzionista per smascherare sottili cambiamenti nella funzione cardiaca. Qui, forniamo un protocollo per l'utilizzo di questa tecnica nei topi per facilitare l'analisi estesa dell'architettura e della funzione del ventricolo sinistro in fisiologia e patologia, consentendo l'osservazione di alterazioni in modelli di malattia cardiaca nascosti in cuori non stressati. Questa indagine può essere eseguita in uno stesso animale e consente misurazioni sia basali che farmacologicamente indotte dallo stress. Delineiamo criteri dettagliati per un'anestesia appropriata, l'analisi LV basata sull'imaging, la considerazione della variabilità intra e interosservatore e l'ottenimento di una risposta inotropa positiva che può essere raggiunta nei topi dopo l'iniezione intraperitoneale di dobutamina in condizioni quasi fisiologiche. Per ricapitolare le caratteristiche della fisiologia umana e della malattia nei modelli di piccoli animali, evidenziamo le insidie critiche nella valutazione, ad esempio un pronunciato effetto Bowditch nei topi. Per raggiungere ulteriormente gli obiettivi traslazionali, confrontiamo gli effetti indotti dallo stress nell'uomo e nei topi. Quando viene utilizzato negli studi traslazionali, è necessario prestare attenzione alle differenze fisiologiche tra topi e uomo. Il rigore sperimentale impone che alcuni parametri valutati nei pazienti possano essere utilizzati solo con cautela a causa delle restrizioni nella risoluzione spaziale e temporale nei modelli murini.
Introduzione
Il segno distintivo di molte malattie cardiache nell'uomo è una compromissione funzionale sistolica e/o diastolica del ventricolo sinistro (LV). Per l'individuazione di anomalie strutturali, la diagnosi e la gestione dell'insufficienza cardiaca sistolica, nonché la valutazione della funzione diastolica nei pazienti con sintomi di insufficienza cardiaca, l'ecocardiografia viene utilizzata come modalità di valutazione fondamentale.
Poiché i sintomi sono aspecifici e più di un terzo dei pazienti con la sindrome clinica da scommesso cardiaco può non soffrire dell'insufficienza cardiaca vera e propria, è importante trovare un correlato ecocardiografico oggettivo per la presentazione clinica del paziente1. Inoltre, alcuni sintomi occulti nello stato di riposo o statico possono verificarsi in condizioni di attività o stress. Nei pazienti con malattia coronarica, cambiamenti già minori nella perfusione coronarica possono portare ad anomalie del movimento della parete regionale. Tuttavia, questi sottili cambiamenti non possono essere valutati utilizzando l'ecocardiografia convenzionale poiché le alterazioni della malattia cardiaca possono essere nascoste nei cuori non stressati. Per ottenere una comprensione più approfondita della fisiopatologia cardiaca, l'ecocardiografia da sforzo fornisce una valutazione dinamica della struttura e della funzione miocardica in condizioni di esercizio o stress farmacologico, consentendo di abbinare i sintomi con i reperti cardiaci2. Inoltre, nei piccoli animali, questo metodo rappresenta uno strumento in-vivo affidabile e non invasivo 3,4,5. In linea con l'uomo, la reazione allo stress del miocardio può essere indotta tramite agenti farmacologici nei topi e nei ratti. La dobutamina è un farmaco di uso frequente e l'ecocardiografia da stress con dobutamina è ampiamente eseguita nell'uomo 6,7, ma solo a volte utilizzata in piccoli modelli animali per valutare la reazione cardiaca allo stress 8,9,10,11. La dobutamina è una catecolamina sintetica con un effetto prevalentemente β1-agonistico che determina inotropia positiva e cronotropia del cuore. Per ottenere una corretta traduzione dall'uomo al topo, alla tecnologia e al quadro concettuale dell'ecocardiografia, devono essere prese in considerazione le limitazioni tecniche relative, ad esempio, alle piccole dimensioni e alla frequenza cardiaca rapida nel topo. La frequenza cardiaca target umana nell'ecocardiografia da stress con dobutamina è [(220-età) x 0,85] con un conseguente aumento medio della frequenza cardiaca di circa il 150 ± 10% in volontari sani12,13. Per i topi, manca una formula del genere. Si dice che la frazione di eiezione (EF) sia aumentata dall'ecocardiografia da sforzo nell'uomo del 5-20%12,14. La FE nei topi, a seconda della frequenza cardiaca, è riportata tra il 58 ± l'11% (< 450 bpm) e il 71 ± l'11% (≥ 450 bpm) e cambia di quasi il 20% con frequenze cardiache più elevate4. Il meccanismo principale nei topi per aumentare la gittata cardiaca è un aumento della frequenza cardiaca. Parte responsabile di questo meccanismo è l'effetto Bowditch o fenomeno della scala, una risposta cardiaca positiva-inotropa mediata dal calcio dipendente dalla frequenza, che è più pronunciata nei topi che nell'uomo 15,16. Inoltre, l'ecocardiografia (da stress) è alla base della variabilità intra e interosservatore. Pertanto, una procedura altamente standardizzata è indispensabile17,18.
Qui presentiamo la procedura dettagliata dell'ecocardiografia da stress con dobutamina per acquisire immagini standardizzate per svelare sottili cambiamenti nella funzione cardiaca nei topi in modelli di salute e malattia. I componenti chiave includono un'adeguata anestesia, un adeguato monitoraggio della frequenza cardiaca e possibili insidie nell'imaging indotto dallo stress nei topi. I parametri chiave sono la valutazione della funzione sistolica e diastolica, compresa la considerazione della LVEF. Poiché i topi sono resistenti alla disfunzione cardiaca indotta dal postcarico17, questo protocollo può aggiungere informazioni preziose per l'uso anche in modelli di cardiopatia valvolare.
Protocollo
Tutti i metodi e le procedure sono stati eseguiti in conformità e nel rispetto di tutte le normative pertinenti ("Convenzione europea per la protezione degli animali vertebrati utilizzati a fini sperimentali e altri scopi scientifici" (Direttiva 2010/63/UE) e la cura degli animali è stata conforme alle linee guida istituzionali. I dati provenienti da soggetti umani sono stati analizzati in conformità con tutte le linee guida istituzionali, nazionali e internazionali per il benessere umano e sono stati approvati dal Comitato Etico Locale (20-9218-BO). Tutti gli esperimenti sono stati eseguiti con maschio C57BL/6JRj all'età di 12 settimane.
1. Preparazione dei materiali e delle attrezzature
NOTA: La Figura 1 mostra un esempio di postazione di lavoro ecografica per piccoli animali.
- Assicurati di operare in un ambiente silenzioso e controllato con luce dimmerabile.
- Preriscaldare il gel per ultrasuoni, ad esempio utilizzando uno scaldagel. Lasciare riscaldare il gel a 37 °C. L'operazione potrebbe richiedere del tempo.
- Pulire tutti gli strumenti, compresa la piattaforma, con una salvietta disinfettante.
- Accendere e preriscaldare la piattaforma a 37 °C.
- Accendi l'ecografo. Inserisci l'ID dell'animale e l'ID del protocollo, nonché altre informazioni pertinenti. Utilizzare un trasduttore a ultrasuoni ad alta frequenza con una trasmissione centrale di 30 MHz per topi con circa 30 g di peso corporeo.
- Assicurati di lavorare con un sistema di esaurimento del gas attivo.
NOTA: Se si utilizza un filtro a carboni attivi per assorbire l'isoflurano nel flusso espirato, assicurarsi di controllare il peso e sostituire il filtro una volta raggiunto l'aumento di peso massimo indicato. - Se necessario, riempire il vaporizzatore con la quantità adeguata di isoflurano.
ATTENZIONE: Non inalare anestetici volatili. - Preparare una soluzione di lavoro a base di dobutamina di 2,5 μg/μl mediante diluizione di una soluzione iniettabile pronta all'uso o sciogliendo la polvere di dobutamina cloridrato in soluzione fisiologica allo 0,9% secondo le istruzioni del produttore. La soluzione è stabile per almeno 24 ore se conservata a temperatura ambiente.

Figura 1: Postazione di lavoro per ecografia cardiaca per piccoli animali. Un'impostazione ergonomica è indispensabile per l'ecocardiografia da sforzo di piccoli animali, poiché i tempi di esame devono rimanere brevi. La postazione di lavoro è composta da una macchina a ultrasuoni, un sistema di anestesia per piccoli animali con alimentazione di ossigeno e scarico attivo del gas, una piattaforma di ecocardiografia riscaldata con ECG incorporato e capacità di movimento tramite micromanipolatori come parte di un sistema ferroviario integrato e un'unità di monitoraggio fisiologico. Uno scaldagel per riscaldare il gel per ultrasuoni e una lampada termica sono aiuti utili. Clicca qui per visualizzare una versione più grande di questa figura.
2. Preparazione del topo per l'imaging e l'induzione dell'anestesia
- Riempire la camera di induzione con isoflurano al 3%-4% v/v in una miscela di gas arricchita di ossigeno (con 1 L/min 100% O2).
- Pesa il mouse. Prendi delicatamente il mouse per la coda e trasferiscilo nella camera di induzione. Assicurarsi che l'animale sia sedato entro pochi secondi osservando attentamente i movimenti dell'animale.
- Se necessario, modificare il flusso di gas al cono nasale collegato al sistema di anestesia (1,0-1,5 vol% di isoflurano con 1 L/min 100% O2 per mantenere una sedazione stabile). Rimuovere il mouse dalla camera di induzione e posizionarlo con cura sulla piattaforma preriscaldata. Assicurarsi che le zampe si trovino sui sensori ECG incorporati nella piattaforma.
- Per prevenire l'essiccazione della sclera, applicare un gel unguento su entrambi gli occhi.
NOTA: Le misurazioni dello stress richiederanno il loro tempo. - Applicare una piccolissima quantità di crema per elettrodi sui sensori ECG. Fissare delicatamente l'animale con del nastro adesivo su tutti e quattro gli arti. Usa una piccola parte di nastro adesivo per fissare la posizione della testa dell'animale nel cono del naso. L'ECG viene utilizzato per registrare la frequenza cardiaca durante l'acquisizione dell'immagine. Regolare il sistema di imaging fisiologico per un segnale ECG stabile e chiaro.
NOTA: Una quantità eccessiva di crema per elettrodi può causare una cattiva qualità del segnale ECG. - Per proteggere l'animale dallo stress durante la procedura, controllare l'adeguata profondità della sedazione mantenendo l'intervallo di frequenza cardiaca a 400-450 bpm. La frequenza cardiaca è ottenuta dall'ECG. È accettabile una variazione di 50 bpm all'interno dell'intervallo.
NOTA: I movimenti dell'animale possono indicare un livello di sedazione troppo stretto. L'anestesia non deve portare a cardiodepressione del topo. La sedazione può essere regolata per ottenere la frequenza cardiaca target sopra menzionata. - Utilizzando la lubrificazione, inserire delicatamente un termometro rettale per il monitoraggio continuo della temperatura corporea. Mantenere la temperatura nell'intervallo fisiologico (normalmente tra 36,5 °C e 37,5 °C a seconda del ceppo del topo e della configurazione sperimentale). In un laboratorio di ecografia cardiaca animale non controllato dal punto di vista ambientale, può essere preso in considerazione l'uso dell'illuminazione a infrarossi.
- Usa una crema depilatoria chimica per rimuovere i peli del corpo dal petto. Usa un tovagliolo di carta umido pulito per pulire il torace. Assicurarsi di rimuovere tutti i componenti rimanenti della crema (Figura 2A).
NOTA: È possibile utilizzare un tagliacapelli elettrico anche prima dell'applicazione depilatoria. L'animale è ora preparato per l'imaging. Poiché è fondamentale mantenere il tempo di imaging breve, l'intera preparazione prima dell'imaging dovrebbe richiedere meno di 3 minuti.
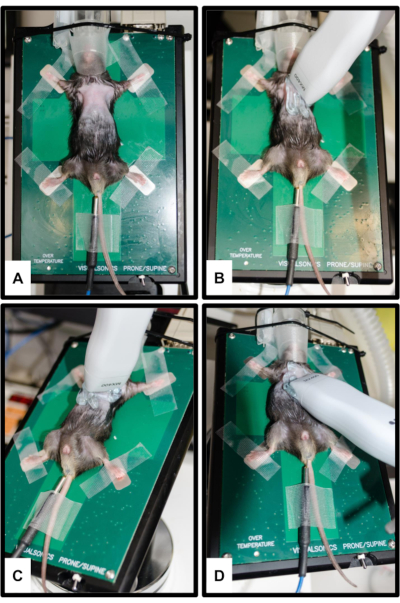
Figura 2: Posizionamento dell'animale e del trasduttore. (A) Il topo è fissato alla piattaforma riscaldata con tutti e quattro gli arti fissati sugli elettrodi ECG d'argento. Per la misurazione della temperatura corporea è inserito un termometro rettale. Il muso viene inserito delicatamente nel cono nasale del sistema di anestesia. (B) Orientamento della sonda per la vista parasternale dell'asse lungo (PSLAX); Vedere il passaggio 3.2. (C) Orientamento della sonda per la vista parasternale dell'asse corto (PSSAX); Vedere il passaggio 3.3. (D) Orientamento della sonda per la vista apicale a quattro camere (4CH); Vedere il passaggio 3.4. Clicca qui per visualizzare una versione più grande di questa figura.
3. Imaging cardiovascolare di base
NOTA: Le immagini possono essere acquisite utilizzando due posizioni di base del trasduttore (finestra ecografica parasternale e apicale) (Figura 2) e almeno tre modalità ecografiche (modalità B(destra), modalità M(ozione) e modalità Doppler (color doppler e doppler a onde pulsate (PW)) (Figura 3, Figura 4, Figura 5). Per le basi dell'imaging, fare riferimento agli articoli16,18 pubblicati in precedenza. È fondamentale ottenere immagini chiare per il confronto con le immagini di stress acquisite successivamente.
- Applicare il gel per ultrasuoni preriscaldato senza bolle sul petto.
NOTA: Il gel per ultrasuoni non riscaldato provocherà una rapida perdita di temperatura corporea che influenzerà la frequenza cardiaca. - Eseguire la visualizzazione dell'asse lungo parasternale (PSLAX).
NOTA: Il PSLAX viene eseguito per visualizzare il LV nel suo asse lungo. Con questo, ad esempio, è possibile ottenere le dimensioni della radice aortica e la dimensione dell'aorta prossimale, nonché la lunghezza del ventricolo sinistro.- Con la testa rivolta lontano dallo sperimentatore, inclinare il tavolo di circa 10-20° a sinistra e di 5-10° in avanti per portare il cuore il più avanti possibile. Posizionare il trasduttore parasternalmente in linea con l'asse lungo del cuore con il marcatore (tacca) rivolto verso la spalla destra dell'animale (Figura 2B).
- Utilizzare i micromanipolatori per regolare la visuale ottimale. Utilizzare i controlli del pannello di controllo dell'immagine per ottimizzare l'immagine. Acquisire almeno un'immagine 2D in modalità B e un'immagine in modalità M a livello medioventricolare.
- Acquisisci eventuali immagini aggiuntive se necessario per la domanda specifica. Acquisisci almeno 100 fotogrammi e almeno 3 (-6) cicli cardiaci completi.
- Eseguire la visualizzazione dell'asse corto parasternale (PSSAX).
NOTA: Il PSSAX viene eseguito per visualizzare il LV nel suo asse corto. Da questa prospettiva, ad esempio, è possibile calcolare il volume telesistolico del ventricolo sinistro (LVESV), il volume telediastolico del ventricolo sinistro (LVEDV), la gittata sistolica (SV) e la gittata cardiaca (CO).- Ruotare il trasduttore di 90° in senso orario senza modificare l'angolazione (l'indicatore ora punta verso la spalla sinistra dell'animale) (Figura 2C). Acquisire almeno un'immagine B-mode nella vista basale, medioventricolare (livello dei muscoli papillari) e apicale.
- Per definire la vista più basale e quella più apicale, scorrere lungo l'asse lungo fino ai punti più distanti, dove è ancora visibile l'intero ciclo cardiaco della camera ventricolare. Scattare immagini a livello medioventricolare approssimativamente in una posizione intermedia a livello dei muscoli papillari.
- Acquisire almeno un'immagine M-mode nella vista del ventricolo medio.
NOTA: Alcuni ecografi forniscono preimpostazioni per le diverse visualizzazioni; Si consiglia di verificare la preimpostazione adeguata prima di acquisire le immagini.
- Eseguire la vista apicale a quattro camere (4CH).
NOTA: 4CH è importante perché può essere utilizzato principalmente per valutare la valvola mitrale utilizzando il PW doppler.- Inclinare la piattaforma in modo che l'animale si trovi in una posizione di Trendelenburg modificata con la testa abbassata. Inclinare il trasduttore verso la testa del mouse, il marcatore rivolto verso il lato sinistro dell'animale (Figura 2D).
- Acquisire almeno un'immagine B-mode, nonché un'immagine color doppler e PW doppler della valvola mitrale e tricuspide. A seconda della domanda sperimentale, applicare il doppler tissutale nella vista 4CH.
NOTA: Il modo più semplice per raggiungere la posizione apicale 4CH è inclinare il tavolo dalla vista PSAX e angolare il trasduttore. Fare attenzione a non esercitare troppa pressione sul torace in quanto ciò potrebbe interferire con le misurazioni, ad esempio, della funzione diastolica.
4. Imaging dello stress da dobutamina
NOTA: Una volta raggiunta la frequenza cardiaca target, è necessario acquisire visualizzazioni standardizzate purché la frequenza cardiaca target sia stabile. Ciò richiede in genere più di un passaggio tra PSLAX e PSSAX. Poiché il passaggio tra PSLAX e PSSAX richiede solo una rotazione di 90°, le viste possono essere facilmente visualizzate.
- Eseguire il test da sforzo della dobutamina in uno stesso animale mantenendo la stessa anestesia per garantire la comparabilità. Assicurarsi che la frequenza cardiaca iniziale rimanga stabile nell'intervallo 400-450 bpm. Registra le letture ECG e salvale insieme e sulle immagini acquisite. Assicurati che il segnale ECG sia chiaro. In caso contrario, provare a fissare nuovamente tutti e quattro gli arti fino a quando non viene visualizzato un chiaro segnale ECG.
- Anche in questo caso, eseguire la vista PSLAX (immagini in modalità B e M). Salva le immagini come immagine "di base". Assicurati di risparmiare e tieni a mente anche la frequenza cardiaca iniziale.
- Preriempi la siringa e inietta 5 μg/g di dobutamina per via intraperitoneale utilizzando un ago da 27 G e una siringa da 1 mL. Osserva attentamente la frequenza cardiaca. Registrare le immagini ecocardiografiche fino al raggiungimento della frequenza cardiaca target e utilizzare l'aumento della frequenza cardiaca per un'analisi successiva. Un aumento significativo sostenibile della frequenza cardiaca indotto dalla dobutamina si raggiunge dopo un aumento del 15-30% dopo circa 1 minuto, a seconda della dose di dobutamina.
NOTA: Utilizzare sempre aghi per iniezione sterili monouso per ogni animale per prevenire infezioni. La suscettibilità alla dobutamina e il carico (sub)massimale possono variare con il ceppo di topo e possono dipendere dalla configurazione sperimentale e devono essere definiti nei pre-esperimenti. Si raccomanda di adattare la dose di dobutamina alla configurazione sperimentale.
ATTENZIONE: Seguire le linee guida istituzionali per l'uso di oggetti taglienti e potenzialmente infettivi. Smaltire sempre l'ago in un contenitore per rifiuti sanitari approvato! - Una volta raggiunta la frequenza cardiaca target che rimane stabile per circa 30 s, acquisire le immagini PSLAX B-mode e M-mode come descritto al punto 3.
- Anche in questo caso, ruotare il trasduttore in senso orario per ottenere la vista PSSAX come descritto al punto 3. Qui, acquisisci immagini in modalità B del livello basale, medioventricolare (livello dei muscoli papillari) e apicale e immagini in modalità M del livello medioventricolare (livello dei muscoli papillari). Rassicurare che la frequenza cardiaca target rimanga stabile. In caso contrario, tornare alla posizione PSLAX e ricominciare l'imaging.
NOTA: Poiché la frequenza cardiaca diminuirà senza l'infusione continua di dobutamina12 (non trattata in questo articolo), le immagini dovrebbero essere acquisite entro due minuti. Le immagini PSLAX e PSSAX sono essenziali per la maggior parte delle misurazioni indotte dallo stress rilevanti (vedere la sezione "Risultati rappresentativi"). - Ora, eseguire nuovamente la visualizzazione apicale 4CH (come spiegato nel passaggio 3.4.). Utilizzando il doppler PW, misurare i modelli di flusso di interesse (come spiegato nel passaggio 3.4.2.). In condizioni non stressate, due onde caratteristiche vengono misurate utilizzando il PW doppler, una che rappresenta il riempimento passivo del ventricolo (onda E(arly)) e una che rappresenta il riempimento attivo dopo la contrazione atriale (onda A(trial)). Con l'aumentare della frequenza cardiaca, queste onde tendono a fondersi e potrebbero non essere misurabili in modo distintivo sotto stress indotto da dobutamina.
5. Passaggi finali
- Dopo circa 5 minuti, quando la frequenza cardiaca ricomincerà a diminuire, assicurarsi che tutte le viste siano state catturate.
- Rimuovere delicatamente il gel per ultrasuoni dal torace utilizzando un tovagliolo di carta umido pulito. Rimuovere con cautela il fissaggio del nastro. Prestare particolare attenzione al nastro che fissa la testa dell'animale per evitare di strappare i baffi.
- Spegnere l'anestesia. Se si utilizza uno scarico del gas attivo, assicurarsi di continuare lo scarico del gas. Metti l'animale su un tovagliolo di carta in una gabbia riscaldata separata durante il periodo di risveglio. Osserva attentamente l'animale. Non deve essere lasciato incustodito fino a quando non ha riacquistato sufficiente coscienza per mantenere la decubito sternale. Una volta sveglio e completamente recuperato, trasferisci l'animale nella sua gabbia.
NOTA: A causa del carattere non definitivo di questa tecnica, l'animale può rimanere all'interno dell'esperimento in conformità con tutte le normative pertinenti.
6. Valutazione offline
- Trasferire i dati dell'immagine al software di analisi offline su una stazione di lavoro per eseguire una valutazione dettagliata della funzione cardiaca. Presta particolare attenzione alla differenza tra funzione cardiaca non stressata e stressata. La frequenza cardiaca deve essere sempre registrata e presentata.
NOTA: poiché l'analisi del software varia tra i diversi software, non è coperta da questo protocollo. Fare riferimento alle istruzioni del produttore.
Risultati
Un'immagine ecocardiografica fisiologica non stressata acquisita in PSLAX è mostrata nella Figura 3. Nella diastole, le pareti del ventricolo appaiono uniformemente (Figura 3A) e si ispessiscono in una certa misura (Figura 3B, C). L'iniezione di 5 μg/g di peso corporeo di dobutamina i.p. porta a un aumento significativo della frequenza cardiaca (ef...
Discussione
La valutazione della funzione cardiaca indotta dallo stress è ampiamente utilizzata nell'uomo in ambito clinico utilizzando test da sforzo o test da sforzo farmacologico 6,7. Poiché l'ecocardiografia post-esercizio immediata dei topi è molto limitata a causa della necessità di sedazione, è probabile che l'ecocardiografia da stress indotta da dobutamina sia il metodo più traslazionale per valutare la fisiopatologia cardiaca ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono le seguenti fonti di finanziamento: Fondazione tedesca per la ricerca (UMEA Junior Clinician Scientist, Stephan Settelmeier; RA 969/12-1, Tienush Rassaf; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Materiali
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
Riferimenti
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110 (2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219 (2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447 (2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618 (2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110 (2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738 (2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629 (2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621 (2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646 (2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7 (2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon