Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Aufdeckung subtiler Veränderungen der Herzfunktion mittels transthorakaler Dobutamin-Stress-Echokardiographie bei Mäusen
In diesem Artikel
Zusammenfassung
Die linksventrikuläre Dysfunktion stellt den letzten gemeinsamen Weg für eine Vielzahl von Herzerkrankungen dar. Wir stellen hier ein detailliertes Protokoll des transthorakalen Dobutamin-Stress-Echokardiographie-Ansatzes zur umfassenden Bewertung der linksventrikulären Funktion von Mausmodellen für Herzerkrankungen sowie der kardialen Phänotypisierung zur Verfügung.
Zusammenfassung
Die linksventrikuläre (LV) Dysfunktion ebnet den letzten Weg für eine Vielzahl von Herzerkrankungen. Mit der nicht-invasiven hochfrequenten transthorakalen Dobutamin-Stress-Echokardiographie beim Menschen ist ein reduktionistischer Untersuchungsansatz zur Demaskierung subtiler Veränderungen der Herzfunktion möglich geworden. Hier stellen wir ein Protokoll für die Anwendung dieser Technik bei Mäusen zur Verfügung, um eine erweiterte Analyse der LV-Architektur und -Funktion in Physiologie und Pathologie zu ermöglichen und die Beobachtung von Veränderungen in Modellen von Herzerkrankungen zu ermöglichen, die in unbelasteten Herzen verborgen sind. Diese Untersuchung kann an ein und demselben Tier durchgeführt werden und ermöglicht sowohl basale als auch pharmakologisch stressinduzierte Messungen. Wir skizzieren detaillierte Kriterien für eine angemessene Anästhesie, eine bildgebende LV-Analyse, die Berücksichtigung der Intra- und Interobserver-Variabilität und das Erzielen eines positiven inotropen Ansprechens, das bei Mäusen nach intraperitonealer Injektion von Dobutamin unter nahezu physiologischen Bedingungen erreicht werden kann. Um die Charakteristika der menschlichen Physiologie und Krankheit in Kleintiermodellen zu rekapitulieren, beleuchten wir kritische Fallstricke bei der Bewertung, z.B. einen ausgeprägten Bowditch-Effekt bei Mäusen. Um die translationalen Ziele weiter zu erreichen, vergleichen wir stressinduzierte Effekte bei Menschen und Mäusen. Bei der Anwendung in translationalen Studien müssen physiologische Unterschiede zwischen Maus und Mensch beachtet werden. Die experimentelle Strenge diktiert, dass einige Parameter, die an Patienten untersucht wurden, aufgrund von Einschränkungen in der räumlichen und zeitlichen Auflösung in Mausmodellen nur mit Vorsicht verwendet werden können.
Einleitung
Kennzeichen vieler kardialer Erkrankungen beim Menschen ist eine systolische und/oder diastolische Funktionsbeeinträchtigung des linken Ventrikels (LV). Zur Erkennung struktureller Anomalien, zur Diagnose und zum Management der systolischen Herzinsuffizienz sowie zur Beurteilung der diastolischen Funktion bei Patienten mit Symptomen einer Herzinsuffizienz wird die Echokardiographie als grundlegende Untersuchungsmodalität eingesetzt.
Da die Symptome unspezifisch sind und mehr als ein Drittel der Patienten mit dem klinischen Syndrom der Herzinsuffizienz möglicherweise nicht an der eigentlichen Herzinsuffizienz leiden, ist es wichtig, ein objektives echokardiographisches Korrelat für das klinische Erscheinungsbild des Patienten zu finden1. Darüber hinaus können einige Symptome, die im ruhenden oder statischen Zustand okkult sind, unter Bedingungen von Aktivität oder Stress auftreten. Bei Patienten mit koronarer Herzkrankheit können bereits geringfügige Veränderungen der koronaren Perfusion zu regionalen Anomalien der Wandbewegung führen. Diese subtilen Veränderungen können jedoch nicht mit der konventionellen Echokardiographie beurteilt werden, da Veränderungen von Herzerkrankungen in unbelasteten Herzen verborgen sein können. Um ein tieferes Verständnis der kardialen Physiopathologie zu erlangen, bietet die Stressechokardiographie eine dynamische Bewertung der Myokardstruktur und -funktion unter Bedingungen von körperlicher Belastung oder pharmakologisch induziertem Stress, die einen Abgleich der Symptome mit kardialen Befunden ermöglicht2. Auch bei Kleintieren stellt diese Methode ein nicht-invasives, zuverlässiges in-vivo-Werkzeugdar 3,4,5. Analog zum Menschen kann die Stressreaktion des Myokards bei Mäusen und Ratten über pharmakologische Wirkstoffe induziert werden. Dobutamin ist ein häufig verwendetes Medikament, und die Dobutamin-Stress-Echokardiographie wird häufig beim Menschen durchgeführt 6,7, aber nur manchmal in Kleintiermodellen zur Beurteilung der kardialen Stressreaktion eingesetzt 8,9,10,11. Dobutamin ist ein synthetisches Katecholamin mit einer überwiegend β1-agonistischen Wirkung, die zu einer positiven Inotropie und Chronotropie des Herzens führt. Um eine korrekte Übersetzung von Mensch zu Maus zu erreichen, müssen die Technologie und der konzeptionelle Rahmen der Echokardiographie technische Einschränkungen in Bezug auf z.B. die geringe Größe und die schnelle Herzfrequenz in der Maus berücksichtigt werden. Die Zielherzfrequenz des Menschen in der Dobutamin-Stress-Echokardiographie beträgt [(220 Jahre) x 0,85], was zu einem durchschnittlichen Anstieg der Herzfrequenz um etwa 150 ± 10% bei gesunden Probanden führt12,13. Für Mäuse fehlt eine solche Formel. Es wird beschrieben, dass die Ejektionsfraktion (EF) durch Stressechokardiographie beim Menschen um 5-20% erhöht ist12,14. Die EF bei Mäusen wird je nach Herzfrequenz zwischen 58 ± 11 % (< 450 Schläge pro Minute) und 71 ± 11 % (≥ 450 Schläge pro Minute) angegeben und ändert sich mit höherer Herzfrequenz um fast 20 %4. Der Hauptmechanismus bei Mäusen zur Erhöhung des Herzzeitvolumens ist eine Erhöhung der Herzfrequenz. Teilweise verantwortlich für diesen Mechanismus ist der Bowditch-Effekt oder das Treppenphänomen, eine frequenzabhängige Kalzium-vermittelte positive-inotrope kardiale Reaktion, die bei Mäusen stärker ausgeprägt ist als beim Menschen 15,16. Darüber hinaus unterliegt die (Stress-)Echokardiographie der intra- und interobservern Variabilität. Daher ist ein hochgradig standardisiertes Vorgehen unabdingbar17,18.
Hier stellen wir das detaillierte Verfahren der Dobutamin-Stress-Echokardiographie vor, um standardisierte Bilder zu erhalten, um subtile Veränderungen der Herzfunktion bei Mäusen in Modellen von Gesundheit und Krankheit zu entschlüsseln. Zu den Schlüsselkomponenten gehören eine angemessene Anästhesie, eine angemessene Herzfrequenzüberwachung und mögliche Fallstricke bei der stressinduzierten Bildgebung bei Mäusen. Wesentliche Parameter sind die Beurteilung der systolischen und diastolischen Funktion einschließlich der Berücksichtigung der LVEF. Da Mäuse resistent gegen Nachlast-induzierte Herzfunktionsstörungen sind17, kann dieses Protokoll auch wertvolle Informationen für die Verwendung in Modellen der Herzklappenerkrankung liefern.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Methoden und Verfahren wurden in Übereinstimmung mit allen einschlägigen Vorschriften ("Europäisches Übereinkommen zum Schutz von Wirbeltieren für Versuche und andere wissenschaftliche Zwecke" (Richtlinie 2010/63/EU)) durchgeführt, und die Tierpflege erfolgte in Übereinstimmung mit den institutionellen Richtlinien. Die Daten von Probanden wurden in Übereinstimmung mit allen institutionellen, nationalen und internationalen Richtlinien für das Wohlergehen des Menschen analysiert und von der lokalen Ethikkommission (20-9218-BO) genehmigt. Alle Experimente wurden mit männlichem C57BL/6JRj im Alter von 12 Wochen durchgeführt.
1. Vorbereitung von Materialien und Geräten
HINWEIS: Abbildung 1 zeigt ein Beispiel für einen Ultraschallarbeitsplatz für Kleintiere.
- Stellen Sie sicher, dass Sie in einer leisen, kontrollierten Umgebung mit dimmbarem Licht arbeiten.
- Erhitzen Sie das Ultraschallgel vor, z. B. mit einem Gelwärmer. Lassen Sie das Gel auf 37 °C erwärmen. Dies kann eine Weile dauern.
- Reinigen Sie alle Instrumente einschließlich der Plattform mit einem Desinfektionstuch.
- Schalten Sie die Plattform ein und heizen Sie sie auf 37 °C vor.
- Schalten Sie das Ultraschallgerät ein. Geben Sie die Tier-ID und die Protokoll-ID sowie weitere relevante Informationen ein. Verwenden Sie einen Hochfrequenz-Ultraschallwandler mit einer Mittenübertragung von 30 MHz für Mäuse mit einem Körpergewicht von ca. 30 g.
- Stellen Sie sicher, dass Sie mit einem aktiven Gasabsaugsystem arbeiten.
HINWEIS: Wenn Sie einen Aktivkohlefilter zur Adsorption des Isoflurans im ausgeatmeten Strom verwenden, überprüfen Sie unbedingt das Gewicht und tauschen Sie den Filter aus, sobald die angegebene maximale Gewichtszunahme erreicht ist. - Füllen Sie den Verdampfer bei Bedarf mit der ausreichenden Menge Isofluran.
ACHTUNG: Inhalieren Sie keine flüchtigen Anästhetika. - Eine Dobutamin-Arbeitslösung von 2,5 μg/μl entweder durch Verdünnung einer gebrauchsfertigen Injektionslösung oder durch Auflösen von Dobutaminhydrochloridpulver in 0,9 % Kochsalzlösung gemäß den Anweisungen des Herstellers herstellen. Die Lösung ist bei Lagerung bei Raumtemperatur mindestens 24 Stunden haltbar.

Abbildung 1: Herzultraschall-Arbeitsplatz für Kleintiere. Eine ergonomische Einstellung ist für die Kleintier-Stress-Echokardiographie unabdingbar, da die Untersuchungszeiten kurz bleiben müssen. Der Arbeitsplatz besteht aus einem Ultraschallgerät, einer Kleintieranästhesieanlage mit Sauerstoffzufuhr und aktiver Gasabsaugung, einer beheizten Echokardiographie-Plattform mit eingebettetem EKG und Bewegungsmöglichkeiten über Mikromanipulatoren als Teil eines integrierten Schienensystems sowie einer physiologischen Überwachungseinheit. Ein Gelwärmer zum Erwärmen von Ultraschallgel und eine Wärmelampe sind nützliche Hilfsmittel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Vorbereitung der Maus für die Bildgebung und Einleitung der Anästhesie
- Die Induktionskammer wird mit 3%-4 % v/v Isofluran in einem sauerstoffangereicherten Gasgemisch (mit 1 L/min 100 % O2) gefüllt.
- Wiegen Sie die Maus. Nehmen Sie die Maus vorsichtig am Schwanz und bringen Sie sie in die Induktionskammer. Stellen Sie sicher, dass das Tier innerhalb weniger Sekunden sediert wird, indem Sie die Bewegungen des Tieres genau beobachten.
- Falls erforderlich, ändern Sie den Gasfluss zum Nasenkonus, der mit dem Anästhesiesystem verbunden ist (1,0-1,5 Vol.-% Isofluran mit 1 L/min 100 % O2 , um eine stabile Sedierung aufrechtzuerhalten). Nehmen Sie die Maus aus der Induktionskammer und legen Sie sie vorsichtig auf die vorgeheizte Plattform. Achten Sie darauf, dass die Pfoten auf den in die Plattform eingelassenen EKG-Sensoren liegen.
- Um ein Austrocknen der Sklera zu verhindern, tragen Sie das Salbengel auf beide Augen auf.
HINWEIS: Belastungsmessungen nehmen ihre Zeit in Anspruch. - Tragen Sie eine sehr kleine Menge Elektrodencreme auf die EKG-Sensoren auf. Befestigen Sie das Tier vorsichtig mit Klebeband an allen vier Gliedmaßen. Verwenden Sie ein kleines Stück Klebeband, um die Kopfposition des Tieres im Nasenkonus zu fixieren. Das EKG wird verwendet, um die Herzfrequenz während der Bildaufnahme aufzuzeichnen. Stellen Sie das physiologische Bildgebungssystem für ein stabiles und klares EKG-Signal ein.
HINWEIS: Zu viel Elektrodencreme kann zu einer schlechten EKG-Signalqualität führen. - Um das Tier während des Eingriffs vor Stress zu schützen, überprüfen Sie die angemessene Sedierungstiefe, indem Sie den Herzfrequenzbereich bei 400-450 Schlägen pro Minute halten. Die Herzfrequenz wird durch das EKG ermittelt. Eine Abweichung von 50 bpm innerhalb des Bereichs ist akzeptabel.
HINWEIS: Bewegungen des Tieres können auf einen zu geringen Sedierungsgrad hinweisen. Die Narkose darf nicht zu einer Kardio-Depression der Maus führen. Die Sedierung kann angepasst werden, um die oben erwähnte Zielherzfrequenz zu erreichen. - Führen Sie unter Verwendung von Gleitmittel vorsichtig ein Rektalthermometer ein, um die Körpertemperatur kontinuierlich zu überwachen. Halten Sie die Temperatur im physiologischen Bereich (normalerweise zwischen 36,5 °C und 37,5 °C, abhängig von der Mausbelastung und dem Versuchsaufbau). In einem nicht umweltkontrollierten Herzultraschalllabor für Tiere kann die Verwendung von Infrarotlicht in Betracht gezogen werden.
- Verwenden Sie eine chemische Enthaarungscreme, um die Körperbehaarung von der Brust zu entfernen. Verwende ein sauberes, feuchtes Papiertuch, um die Brust abzuwischen. Achten Sie darauf, alle restlichen Bestandteile der Creme zu entfernen (Abbildung 2A).
HINWEIS: Eine elektrische Schermaschine kann auch vor der Enthaarungsanwendung verwendet werden. Das Tier wird nun für die Bildgebung vorbereitet. Da es wichtig ist, die Bildgebungszeit kurz zu halten, sollte die gesamte Vorbereitung vor der Bildgebung weniger als 3 Minuten dauern.
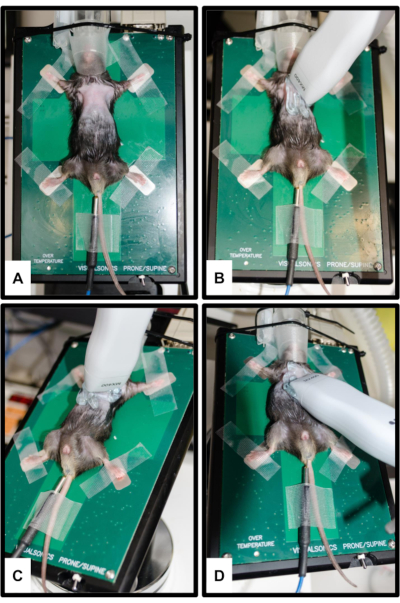
Abbildung 2: Positionierung von Tier und Schallkopf. (A) Die Maus ist an der beheizten Plattform befestigt, wobei alle vier Gliedmaßen an den silbernen EKG-Elektroden befestigt sind. Zur Messung der Körpertemperatur wird ein rektales Thermometer eingesetzt. Die Schnauze wird sanft an den Nasenkegel des Anästhesiesystems herangeführt. (B) Sondenausrichtung für parasternale Langachsenansicht (PSLAX); Siehe Schritt 3.2. (C) Sondenausrichtung für parasternale Kurzachsenansicht (PSSAX); Siehe Schritt 3.3. (D) Sondenausrichtung für apikale Vierkammeransicht (4CH); Siehe Schritt 3.4. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Grundlegende kardiovaskuläre Bildgebung
HINWEIS: Bilder können mit zwei grundlegenden Schallkopfpositionen (parasternales und apikales Ultraschallfenster) (Abbildung 2) und mindestens drei Ultraschallmodalitäten (B(rightness)-Modus, M(otion)-Modus und Doppler-Modus (Farbdoppler und gepulster Wellen (PW)-Doppler) aufgenommen werden (Abbildung 3, Abbildung 4, Abbildung 5). Für die Grundlagen der Bildgebung verweisen wir auf die zuvor veröffentlichten Artikel16,18. Es ist wichtig, klare Bilder für den Vergleich mit später aufgenommenen Belastungsbildern zu erhalten.
- Tragen Sie das vorgewärmte Ultraschallgel blasenfrei auf die Brust auf.
HINWEIS: Nicht erhitztes Ultraschallgel führt zu einem schnellen Verlust der Körpertemperatur, der sich auf die Herzfrequenz auswirkt. - Führen Sie die PSLAX-Ansicht (Parasternal Long Axis) durch.
HINWEIS: PSLAX wird durchgeführt, um das LV in seiner Längsachse zu visualisieren. Damit können z.B. die Aortenwurzeldimensionen und die proximale Aortendimension sowie die LV-Länge ermittelt werden.- Neigen Sie den Tisch mit dem Kopf vom Untersucher abgewandt um ca. 10-20° nach links und 5-10° nach vorne, um das Herz so weit wie möglich nach vorne zu bringen. Platzieren Sie den Schallkopf parasternal in einer Linie mit der Längsachse des Herzens, wobei der Marker (Kerbe) auf die rechte Schulter des Tieres zeigt (Abbildung 2B).
- Verwenden Sie Mikromanipulatoren, um die optimale Ansicht einzustellen. Verwenden Sie die Steuerelemente des Bildbedienfelds, um das Bild zu optimieren. Nehmen Sie mindestens ein 2D-Bild im B-Modus und ein Bild im M-Modus auf mittelventrikulärer Ebene auf.
- Erfassen Sie zusätzliche Bilder, wenn dies für die jeweilige Frage erforderlich ist. Erfassen Sie mindestens 100 Bilder und mindestens 3(-6) vollständige Herzzyklen.
- Führen Sie die PSSAX-Ansicht (Parasternal Short Axis) durch.
HINWEIS: PSSAX wird durchgeführt, um das LV in seiner kurzen Achse zu visualisieren. Aus dieser Sicht können z.B. das linksventrikuläre endsystolische Volumen (LVESV), das linksventrikuläre enddiastolische Volumen (LVEDV), das Schlagvolumen (SV) und das Herzzeitvolumen (CO) berechnet werden.- Drehen Sie den Schallkopf um 90° im Uhrzeigersinn, ohne die Winkelung zu verändern (Markierung zeigt jetzt auf die linke Schulter des Tieres) (Abbildung 2C). Nehmen Sie mindestens ein B-Mode-Bild in der basalen, mittelventrikulären (Höhe der Papillarmuskulatur) und apikalen Ansicht auf.
- Um die basalste und die apikalste Ansicht zu definieren, scrollen Sie entlang der Längsachse zu den am weitesten entfernten Punkten, an denen der gesamte Herzzyklus der LV-Kammer noch sichtbar ist. Nehmen Sie Bilder auf mittelventrikulärer Ebene etwa in einer Zwischenposition auf Höhe der Papillenmuskulatur auf.
- Nehmen Sie mindestens ein Bild im M-Modus in der mittelventrikulären Ansicht auf.
HINWEIS: Einige Ultraschallgeräte bieten Voreinstellungen für die verschiedenen Ansichten; Es wird empfohlen, vor der Aufnahme von Bildern nach der richtigen Voreinstellung zu suchen.
- Führen Sie eine apikale Vierkammeransicht (4CH) durch.
HINWEIS: 4CH ist wichtig, da es hauptsächlich zur Beurteilung der Mitralklappe mit PW-Doppler verwendet werden kann.- Kippen Sie die Plattform so, dass sich das Tier in einer modifizierten Trendelenburg-Position mit dem Kopf nach unten befindet. Richten Sie den Schallkopf in Richtung des Mauskopfes aus, wobei der Marker zur linken Seite des Tieres zeigt (Abbildung 2D).
- Nehmen Sie mindestens ein B-Mode-Bild sowie ein Farbdoppler- und PW-Dopplerbild der Mitral- und Trikuspidalklappe auf. Je nach experimenteller Fragestellung den Gewebedoppler in der 4CH-Ansicht anwenden.
HINWEIS: Der einfachste Weg, die apikale 4CH-Position zu erreichen, besteht darin, den Tisch aus der PSAX-Ansicht zu neigen und den Schallkopf zu winkeln. Achten Sie darauf, nicht zu viel Druck auf den Brustkorb auszuüben, da dies die Messung z.B. der diastolischen Funktion beeinträchtigen kann.
4. Dobutamin-Stress-Bildgebung
HINWEIS: Sobald die Zielherzfrequenz erreicht ist, sollten standardisierte Ansichten erfasst werden, solange die Zielherzfrequenz stabil ist. Dies erfordert in der Regel mehr als einen Wechsel zwischen PSLAX und PSSAX. Da der Wechsel zwischen PSLAX und PSSAX nur eine 90°-Drehung erfordert, können die Ansichten einfach abgebildet werden.
- Durchführung von Dobutamin-Stresstests an ein und demselben Tier unter Beibehaltung der gleichen Anästhesie, um die Vergleichbarkeit zu gewährleisten. Stellen Sie sicher, dass die Startherzfrequenz stabil im Bereich von 400-450 Schlägen pro Minute bleibt. Zeichnen Sie die EKG-Messwerte auf und speichern Sie sie zusammen mit und auf den aufgenommenen Bildern. Stellen Sie sicher, dass das EKG-Signal klar ist. Versuchen Sie andernfalls, alle vier Gliedmaßen erneut zu kleben, bis ein klares EKG-Signal angezeigt wird.
- Führen Sie erneut die PSLAX-Ansicht aus (Bilder im B-Modus und im M-Modus). Speichern Sie die Bilder als "Baseline"-Bild. Achten Sie darauf, auch die anfängliche Herzfrequenz zu speichern und im Auge zu behalten.
- Füllen Sie die Spritze vor und injizieren Sie 5 μg/g Dobutamin intraperitoneal mit einer 27 g Nadel und 1 ml Spritze. Achten Sie genau auf die Herzfrequenz. Nehmen Sie echokardiographische Bilder auf, bis die Zielherzfrequenz erreicht ist, und verwenden Sie den Anstieg der Herzfrequenz für eine spätere Analyse. Eine nachhaltig signifikante Dobutamin-induzierte Herzfrequenzerhöhung wird nach einer Erhöhung von 15-30% nach ca. 1 min, abhängig von der Dobutamin-Dosis, erreicht.
HINWEIS: Verwenden Sie für jedes Tier immer sterile Einweg-Injektionsnadeln, um Infektionen zu vermeiden. Die Dobutamin-Empfindlichkeit und die (sub)maximale Belastung können mit der Mausbelastung variieren und können vom Versuchsaufbau abhängen und sollten in Vorversuchen definiert werden. Es wird empfohlen, die Dobutamindosis an den Versuchsaufbau anzupassen.
VORSICHT: Befolgen Sie die institutionellen Richtlinien für die Verwendung von scharfen und potenziell infektiösen Gegenständen. Entsorgen Sie die Nadel immer in einem zugelassenen Behälter für medizinische Abfälle! - Sobald die Zielherzfrequenz erreicht ist und für ca. 30 s stabil bleibt, nehmen Sie PSLAX B-Modus- und M-Modus-Bilder auf, wie in Schritt 3 beschrieben.
- Drehen Sie den Wandler erneut im Uhrzeigersinn, um die PSSAX-Ansicht zu erhalten, wie in Schritt 3 beschrieben. Hier erhalten Sie B-Mode-Bilder der basalen, mittelventrikulären (Ebene der Papillarmuskulatur) und apikaler Ebene sowie M-Mode-Bilder der Ebene der Mittelventrikulären (Ebene der Papillarmuskulatur). Stellen Sie sicher, dass die Zielherzfrequenz stabil bleibt. Andernfalls wechseln Sie zurück in die PSLAX-Position und starten Sie die Bildgebung erneut.
HINWEIS: Da die Herzfrequenz ohne kontinuierliche Infusion von Dobutamin12 (in diesem Artikel nicht behandelt) sinkt, sollten die Bilder innerhalb von zwei Minuten aufgenommen werden. PSLAX- und PSSAX-Bilder sind für die meisten relevanten stressinduzierten Messungen unerlässlich (siehe Abschnitt "Repräsentative Ergebnisse"). - Führen Sie nun erneut die apikale 4CH-Ansicht durch (wie in Schritt 3.4 erklärt). Messen Sie mit dem PW-Doppler die interessierenden Strömungsmuster (wie in Schritt 3.4.2 erläutert). Unter unbelasteten Bedingungen werden zwei charakteristische Wellen mit dem PW-Doppler gemessen, eine für die passive Füllung des Ventrikels (E(arly)-Welle) und eine für die aktive Füllung nach Vorhofkontraktion (A(trial)-Welle). Mit steigender Herzfrequenz neigen diese Wellen dazu, zu verschmelzen und sind unter Dobutamin-induziertem Stress möglicherweise nicht eindeutig messbar.
5. Letzte Schritte
- Nach ca. 5 Minuten, wenn die Herzfrequenz wieder zu sinken beginnt, stellen Sie sicher, dass alle Ansichten erfasst werden.
- Entfernen Sie das Ultraschallgel vorsichtig mit einem sauberen, feuchten Papiertuch von der Brust. Entfernen Sie vorsichtig die Klebebandfixierung. Achten Sie besonders auf das Klebeband, mit dem der Kopf des Tieres fixiert ist, um ein Herausziehen der Schnurrhaare zu vermeiden.
- Schalten Sie die Anästhesie aus. Wenn Sie einen aktiven Gasauspuff verwenden, stellen Sie sicher, dass die Gasabsaugung fortgesetzt wird. Legen Sie das Tier während der Weckphase auf ein Papiertuch in einen abgetrennten beheizten Käfig. Beobachte das Tier genau. Er darf nicht unbeaufsichtigt gelassen werden, bis er wieder genügend Bewusstsein erlangt hat, um die Brustbeinlage aufrecht zu erhalten. Sobald das Tier wach und vollständig genesen ist, bringen Sie es in seinen Käfig.
HINWEIS: Aufgrund des nicht endgültigen Charakters dieser Technik kann das Tier in Übereinstimmung mit allen einschlägigen Vorschriften innerhalb des Versuchs bleiben.
6. Offline-Auswertung
- Übertragen Sie die Bilddaten an die Offline-Analysesoftware auf einem Arbeitsplatz, um eine detaillierte Auswertung der Herzfunktion durchzuführen. Achten Sie besonders auf den Unterschied zwischen unbelasteter und belasteter Herzfunktion. Die Herzfrequenz sollte immer aufgezeichnet und dargestellt werden.
HINWEIS: Da die Softwareanalyse zwischen verschiedenen Softwares unterschiedlich ist, wird sie in diesem Protokoll nicht behandelt. Bitte beachten Sie die Angaben des Herstellers.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Ein physiologisches, unbelastetes echokardiographisches Bild, das in PSLAX aufgenommen wurde, ist in Abbildung 3 dargestellt. Bei der Diastole erscheinen die Ventrikelwände gleichmäßig (Abbildung 3A) und verdicken sich bis zu einem gewissen Grad (Abbildung 3B,C). Die Injektion von 5 μg/g Dobutamin i.p. führt zu einer signifikanten Erhöhung der ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die stressinduzierte Bewertung der Herzfunktion wird beim Menschen häufig im klinischen Umfeld unter Verwendung von Belastungstests oder pharmakologischen Stresstestseingesetzt 6,7. Da die unmittelbare Echokardiographie von Mäusen nach dem Training aufgrund der Notwendigkeit einer Sedierung sehr begrenzt ist, ist die Dobutamin-induzierte Stress-Echokardiographie wahrscheinlich die translationalste Methode zur Beurteilung der st...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren nennen folgende Förderquellen: Deutsche Forschungsgemeinschaft (UMEA Junior Clinician Scientist, Stephan Settelmeier; RA 969/12-1, Tienush Rassaf; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
Referenzen
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110(2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219(2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447(2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618(2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110(2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738(2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629(2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, suppl_D 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621(2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, Suppl 1 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646(2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7(2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten