A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חשיפת שינויים עדינים בתפקוד הלב באמצעות אקו לב מתח דובוטמין דרך בית החזה בעכברים
In This Article
Summary
תפקוד לקוי של החדר השמאלי מהווה את המסלול המשותף האחרון לשורה של הפרעות לב. אנו מספקים כאן פרוטוקול מפורט של גישת אקו לב במאמץ דובוטמין טרנס-חזה להערכה מקיפה של תפקוד החדר השמאלי של מודלים עכבריים של מחלות לב כמו גם פנוטיפ לבבי.
Abstract
תפקוד לקוי של החדר השמאלי (LV) סולל את המסלול הסופי למספר רב של הפרעות לב. עם אקו לב מתח טרנס-חזה לא פולשני בתדר גבוה בבני אדם, התאפשרה גישת חקירה רדוקציוניסטית לחשיפת שינויים עדינים בתפקוד הלב. כאן, אנו מספקים פרוטוקול לשימוש בטכניקה זו בעכברים כדי להקל על ניתוח מורחב של ארכיטקטורת LV ותפקוד בפיזיולוגיה ופתולוגיה המאפשר התבוננות בשינויים במודלים של מחלות לב החבויות בלבבות לא לחוצים. חקירה זו יכולה להתבצע באותה חיה ומאפשרת מדידות בסיסיות ותרופתיות הנגרמות על ידי מתח. אנו מתארים קריטריונים מפורטים להרדמה מתאימה, ניתוח LV מבוסס הדמיה, התחשבות בשונות תוך-צופית ובין-צופית, והשגת תגובת אינוטרופ חיובית שניתן להשיג בעכברים לאחר הזרקה תוך-צפקית של דובוטמין בתנאים פיזיולוגיים קרובים. כדי לסכם את המאפיינים של הפיזיולוגיה והמחלה האנושית במודלים של בעלי חיים קטנים, אנו מדגישים מלכודות קריטיות בהערכה, למשל, אפקט בודיץ' בולט בעכברים. כדי לעמוד עוד יותר ביעדי התרגום, אנו משווים השפעות הנגרמות על ידי מתח בבני אדם ועכברים. בשימוש במחקרים תרגומיים, יש לשים לב להבדלים פיזיולוגיים בין עכברים לבני אדם. קפדנות ניסויית מכתיבה כי ניתן להשתמש בפרמטרים מסוימים המוערכים בחולים רק בזהירות עקב מגבלות ברזולוציה מרחבית וזמנית במודלים של עכברים.
Introduction
סימן ההיכר של מחלות לב רבות בבני אדם הוא ליקוי תפקודי סיסטולי ו/או דיאסטולי של החדר השמאלי (LV). לאיתור חריגות מבניות, אבחון וניהול אי ספיקת לב סיסטולית וכן הערכת תפקוד דיאסטולי בחולים עם תסמינים של אי ספיקת לב, אקו לב משמש כשיטת הערכה בסיסית.
מכיוון שהתסמינים אינם ספציפיים ויותר משליש מהחולים עם התסמונת הקלינית של אי ספיקת לב עשויים שלא לסבול מאי ספיקת לב בפועל, חשוב למצוא מתאם אקו לב אובייקטיבי להופעה הקלינית של המטופל1. יתר על כן, חלק מהתסמינים הנסתרים במצב מנוחה או סטטי עשויים להופיע בתנאים של פעילות או לחץ. בחולים עם מחלת עורקים כליליים, שינויים קלים כבר בזלוף הכלילי יכולים להוביל לחריגות בתנועת הדופן האזורית. עם זאת, לא ניתן להעריך את השינויים העדינים הללו באמצעות אקו לב קונבנציונאלי מכיוון ששינויים במחלות לב יכולים להיות מוסתרים בלבבות לא לחוצים. כדי להשיג הבנה מעמיקה יותר של הפיזיופתולוגיה של הלב, אקו לב במאמץ מספק הערכה דינמית של מבנה ותפקוד שריר הלב בתנאים של פעילות גופנית או מתח תרופתי, המאפשר התאמת תסמינים לממצאים לבביים2. כמו כן, בבעלי חיים קטנים, שיטה זו מייצגת כלי in-vivo אמין לא פולשני 3,4,5. בדומה לבני אדם, ניתן לגרום לתגובת לחץ של שריר הלב באמצעות חומרים פרמקולוגיים בעכברים וחולדות. דובוטמין היא תרופה בשימוש תכוף ואקו לב במאמץ דובוטמין מבוצע באופן נרחב בבני אדם 6,7 אך משמש רק לפעמים במודלים של בעלי חיים קטנים כדי להעריך את תגובת הלחץ הלבבי 8,9,10,11. דובוטמין הוא קטכולאמין סינתטי בעל השפעה אגוניסטית β1 וכתוצאה מכך אינוטרופיה חיובית וכרונוטרופיה של הלב. כדי להשיג תרגום נכון מאדם לעכבר, יש לקחת בחשבון את הטכנולוגיה והמסגרת המושגית של אקו לב, מגבלות טכניות הקשורות למשל, הגודל הקטן והדופק המהיר בעכבר. דופק היעד האנושי באקו-לב במאמץ דובוטמין הוא [(220-age) x 0.85] וכתוצאה מכך עלייה ממוצעת בקצב הלב של כ-150 ±-10% במתנדבים בריאים12,13. עבור עכברים, נוסחה כזו חסרה. מקטע הפליטה (EF) מתואר כמוגבר על ידי אקו לב במאמץ בבני אדם ב-5-20%12,14. ה-EF בעכברים מדווח, בהתאם לקצב הלב, בין 58 ±-11% (<-450 פעימות לדקה) ל-71 ±-11% (≥-450 פעימות לדקה) ומשתנה בכמעט 20% עם קצב לב גבוה יותר4. המנגנון העיקרי בעכברים להגברת תפוקת הלב הוא עלייה בקצב הלב. אחראית חלקית למנגנון זה היא תופעת בודיץ' או גרם המדרגות, תגובה לבבית חיובית-אינוטרופית תלוית תדר בתיווך סידן, הבולטת יותר בעכברים מאשר בבני אדם15,16. בנוסף, אקו לב (מאמץ) עומד בבסיס השונות התוך-צופית והבין-צופית. לכן, הליך סטנדרטי ביותר הוא הכרחי17,18.
כאן אנו מציגים את ההליך המפורט של אקו לב במאמץ דובוטמין כדי לרכוש תמונות סטנדרטיות כדי לחשוף שינויים עדינים בתפקוד הלב בעכברים במודלים של בריאות וחולי. מרכיבי המפתח כוללים הרדמה נאותה, ניטור דופק הולם ומלכודות אפשריות בהדמיה הנגרמת על ידי מתח בעכברים. פרמטרים מרכזיים הם הערכת התפקוד הסיסטולי והדיאסטולי כולל התחשבות ב-LVEF. מכיוון שעכברים עמידים להפרעות בתפקוד הלב הנגרמות על ידי עומס17, פרוטוקול זה עשוי להוסיף מידע רב ערך לשימוש גם במודלים של מחלות לב מסתמיות.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל השיטות והנהלים בוצעו בהתאם ועמדו בכל התקנות הרלוונטיות ('האמנה האירופית להגנה על בעלי חוליות המשמשים למטרות ניסיוניות ומדעיות אחרות' (הנחיה 2010/63/EU) והטיפול בבעלי חיים היה בהתאם להנחיות המוסדיות. הנתונים מבני אדם נותחו בהתאם לכל ההנחיות המוסדיות, הלאומיות והבינלאומיות לרווחת האדם ואושרו על ידי ועדת האתיקה המקומית (20-9218-BO). כל הניסויים בוצעו עם C57BL/6JRj זכר בגיל 12 שבועות.
1. הכנת חומרים וציוד
הערה: איור 1 מציג דוגמה למקום עבודה של אולטרסאונד של חיות קטנות.
- הקפד לפעול בסביבה מבוקרת שקטה עם אור הניתן לעמעום.
- מחממים מראש את ג'ל האולטרסאונד, למשל באמצעות מחמם ג'ל. הניחו לג'ל להתחמם ל-37 מעלות צלזיוס. זה עשוי לקחת זמן מה.
- נקה את כל המכשירים כולל הפלטפורמה עם מגבון חיטוי.
- הפעל וחמם מראש את הפלטפורמה ל -37 מעלות צלזיוס.
- הפעל את מכונת האולטרסאונד. הזן את מזהה החיה ומזהה הפרוטוקול וכן מידע רלוונטי אחר. השתמש במתמר אולטרסאונד בתדר גבוה עם שידור מרכזי של 30 מגה-הרץ לעכברים עם משקל גוף של כ-30 גרם.
- הקפד לעבוד עם מערכת פליטת גז פעילה.
הערה: אם משתמשים במסנן פחם פעיל לספיגת האיזופלורן בזרימה הננשפת, הקפד לבדוק את המשקל ולהחליף את המסנן לאחר הגעה לעלייה המקסימלית המצוינת במשקל. - במידת הצורך, מלאו את הוופורייזר בכמות מספקת של איזופלורן.
זהירות: אין לשאוף חומרי הרדמה נדיפים. - הכן תמיסת עבודה של דובוטמין של 2.5 מיקרוגרם/מיקרוליטר על ידי דילול תמיסת הזרקה מוכנה לשימוש או על ידי המסת אבקת דובוטמין הידרוכלוריד במי מלח 0.9% לפי הוראות היצרן. התמיסה יציבה לפחות למשך 24 שעות כאשר היא מאוחסנת בטמפרטורת החדר.

איור 1: מקום עבודה אולטרסאונד לב של בעלי חיים קטנים. הגדרה ארגונומית היא הכרחית עבור אקו לב במאמץ של בעלי חיים קטנים מכיוון שזמני הבדיקה חייבים להישאר קצרים. מקום העבודה מורכב ממכונת אולטרסאונד, מערכת הרדמה לבעלי חיים קטנים עם אספקת חמצן ופליטת גז פעילה, פלטפורמת אקו לב מחוממת עם יכולות א.ק.ג ותנועה משובצות באמצעות מיקרומניפולטורים כחלק ממערכת מסילות משולבת וכן יחידת ניטור פיזיולוגית. מחמם ג'ל לחימום ג'ל אולטרסאונד ומנורת חום הם עזרים שימושיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. הכנת העכבר להדמיה וזירוז הרדמה
- מלאו את תא האינדוקציה באיזופלורן של 3%-4% v/v בתערובת גז מועשרת בחמצן (עם 1 ליטר/דקה 100% O2).
- שקלו את העכבר. הרם בעדינות את העכבר בזנב והעביר אותו לתא האינדוקציה. ודא שהחיה מורדמת תוך מספר שניות על ידי התבוננות מקרוב בתנועות החיה.
- במידת הצורך, שנה את זרימת הגז לקונוס האף המחובר למערכת ההרדמה (1.0-1.5% נפח איזופלורן עם 1 ליטר/דקה 100% O2 כדי לשמור על טשטוש יציב). הסר את העכבר מתא האינדוקציה והנח אותו בזהירות על הפלטפורמה המחוממת מראש. ודא שהכפות מונחות על חיישני האק"ג המוטבעים בפלטפורמה.
- כדי למנוע ייבוש של הסקלרה, יש למרוח ג'ל משחה על שתי העיניים.
הערה: מדידות מתח ייקחו את הזמן שלהן. - מרחו כמות קטנה מאוד של קרם אלקטרודות על חיישני האק"ג. אבטח בעדינות את החיה עם סרט דבק על כל ארבעת הגפיים. השתמש בחלק קטן של סרט דבק כדי לאבטח את מיקום ראש החיה בקונוס האף. האק"ג משמש לרישום הדופק במהלך רכישת תמונה. התאם את מערכת ההדמיה הפיזיולוגית לקבלת אות א.ק.ג יציב וברור.
הערה: יותר מדי קרם אלקטרודות עלול לגרום לאיכות אות א.ק.ג גרועה. - כדי להגן על החיה מפני לחץ במהלך ההליך, בדוק את עומק ההרגעה המתאים על ידי שמירה על טווח הדופק על 400-450 פעימות לדקה. קצב הלב מתקבל על ידי האק"ג. וריאציה של 50 סל"ד בתוך הטווח מקובלת.
הערה: תנועות החיה עשויות להצביע על רמת טשטוש צרה מדי. אסור שההרדמה תוביל לדיכאון לב של העכבר. ניתן לכוונן את ההרגעה כדי להשיג את דופק היעד שהוזכר לעיל. - בעזרת שימון, הכנס בעדינות מדחום רקטלי לניטור רציף של טמפרטורת הגוף. שמור על הטמפרטורה בטווח הפיזיולוגי (בדרך כלל בין 36.5 מעלות צלזיוס ל-37.5 מעלות צלזיוס בהתאם למתח העכבר ולהגדרת הניסוי). במעבדת אולטרסאונד לב של בעלי חיים שאינה מבוקרת סביבתית, ניתן לשקול שימוש בתאורת אינפרא אדום.
- השתמש בקרם אפילציה כימי כדי להסיר את שיער הגוף מהחזה. השתמש במגבת נייר לחה נקייה כדי לנגב את החזה. הקפד להסיר את כל רכיבי הקרם הנותרים (איור 2A).
הערה: ניתן להשתמש בקוצץ חשמלי גם לפני מריחת האפילציה. החיה מוכנה כעת להדמיה. מכיוון שקריטי לשמור על זמן הדמיה קצר, כל ההכנה לפני ההדמיה אמורה להימשך פחות מ-3 דקות.
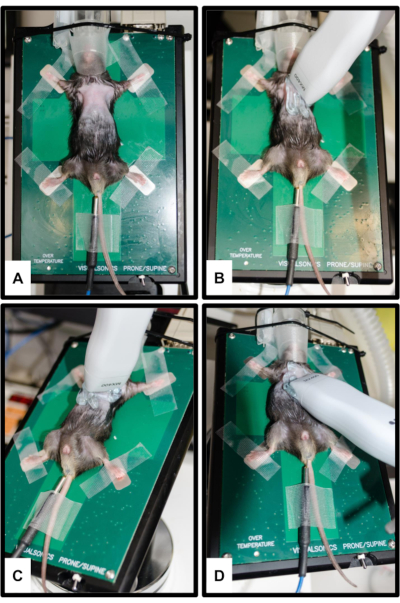
איור 2: מיקום בעלי חיים ומתמרים. (A) העכבר מחובר לפלטפורמה המחוממת כאשר כל ארבעת הגפיים מקובעות על אלקטרודות האק"ג הכסופות. מוכנס מדחום רקטלי למדידת טמפרטורת הגוף. החוטם מוחדר בעדינות לקונוס האף של מערכת ההרדמה. (B) כיוון בדיקה לתצוגת ציר ארוך parasternal (PSLAX); ראה שלב 3.2. (C) כיוון בדיקה לתצוגת ציר קצר פרה-סטרנלי (PSSAX); ראה שלב 3.3. (ד) כיוון בדיקה לארבעה חדרים אפיקליים view (4CH); ראה שלב 3.4. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
3. הדמיה קרדיווסקולרית בסיסית
הערה: ניתן לרכוש תמונות באמצעות שני מיקומי מתמר בסיסיים (חלון אולטרסאונד פרה-סטרנלי ואפיקלי) (איור 2) ולפחות שלושה אופני אולטרסאונד (B(rightness)-mode, M(otion)-mode ו-Doppler-mode (דופלר צבעוני וגל דופק (PW) (איור 3, איור 4, איור 5). ליסודות ההדמיה אנא עיין במאמרים שפורסמו בעבר16,18. זה קריטי להשיג תמונות ברורות להשוואה עם תמונות מתח שנרכשו מאוחר יותר.
- מרחו ג'ל אולטרסאונד שחומם מראש ללא בועות על החזה.
הערה: ג'ל אולטרסאונד לא מחומם יגרום לאובדן מהיר של טמפרטורת הגוף אשר ישפיע על קצב הלב. - בצע תצוגת ציר ארוך parasternal (PSLAX).
הערה: PSLAX מבוצע כדי לדמיין את ה-LV בציר הארוך שלו. עם זה, למשל, ניתן לקבל את מידות שורש אבי העורקים וממד אבי העורקים הפרוקסימלי וכן את אורך ה-LV.- כשהראש פונה הרחק מהחוקר, הטו את השולחן כ-10-20 מעלות שמאלה ו-5-10 מעלות קדימה כדי להביא את הלב קדימה ככל האפשר. מקמו את המתמר באופן פרה-סטרני בקו אחד עם הציר הארוך של הלב, כאשר הסמן (החריץ) מצביע לכיוון הכתף הימנית של החיה (איור 2B).
- השתמש במיקרומניפולטורים כדי להתאים את התצוגה האופטימלית. השתמש בפקדים בלוח הבקרה של התמונה כדי למטב את התמונה. רכוש לפחות תמונה דו-ממדית אחת במצב B ותמונה אחת במצב M ברמת החדר האמצעי.
- רכוש תמונות נוספות במידת הצורך לשאלה הספציפית. רכוש לפחות 100 פריימים ולפחות 3 (-6) מחזורי לב מלאים.
- בצע תצוגת ציר קצר parasternal (PSSAX).
הערה: PSSAX מבוצע כדי להמחיש את ה-LV בציר הקצר שלו. מנקודת מבט זו, למשל, ניתן לחשב נפח סיסטולי קצה חדר שמאלי (LVESV), נפח קצה דיאסטולי שמאלי (LVEDV), נפח שבץ (SV) ותפוקת לב (CO).- סובבו את המתמר ב-90 מעלות בכיוון השעון מבלי לשנות את הזווית (הסמן מצביע כעת לכיוון הכתף השמאלית של החיה) (איור 2C). רכוש לפחות תמונה אחת במצב B בתצוגה הבסיסית, האמצעית (רמת השרירים הפפילריים) והאפיקלי.
- כדי להגדיר את המבט הבסיסי ביותר והאפיקלי ביותר, גלול לאורך הציר הארוך לנקודות הרחוקות ביותר, שם מחזור הלב המלא של תא ה-LV עדיין נראה לעין. צלם תמונות ברמת החדר האמצעי בערך בתנוחת ביניים ברמת השרירים הפפילריים.
- רכוש לפחות תמונה אחת במצב M בתצוגת החדר האמצעי.
הערה: חלק ממכשירי האולטרסאונד מספקים הגדרות קבועות מראש עבור התצוגות השונות; מומלץ לבדוק את הקביעה המוגדרת מראש המתאימה לפני רכישת תמונות.
- בצע תצוגה אפיקלית של ארבעה חדרים (4CH).
הערה: 4CH חשוב מכיוון שניתן להשתמש בו בעיקר להערכת המסתם המיטרלי באמצעות דופלר PW.- הטה את הפלטפורמה שהחיה נמצאת בתנוחת טרנדלנבורג שונה עם הראש כלפי מטה. זווית את המתמר לכיוון ראש העכבר, כאשר הסמן פונה לכיוון הצד השמאלי של החיה (איור 2D).
- רכוש לפחות תמונה אחת במצב B וכן דופלר צבעוני ותמונת דופלר PW של המסתם המיטרלי והתלת-שפתי. בהתאם לשאלת הניסוי, החל דופלר רקמות בתצוגת 4CH.
הערה: הדרך הקלה ביותר להגיע למצב אפיקלי 4CH היא להטות את השולחן מתצוגת PSAX ולזווית את המתמר. היזהר לא להפעיל לחץ רב מדי על בית החזה מכיוון שהדבר עלול להפריע למדידות למשל של תפקוד דיאסטולי.
4. הדמיית מתח דובוטמין
הערה: לאחר הגעה לדופק היעד, יש להשיג תצוגות סטנדרטיות כל עוד דופק היעד יציב. זה בדרך כלל דורש יותר ממתג אחד בין PSLAX ל-PSSAX. מכיוון שהמעבר בין PSLAX ל-PSSAX דורש סיבוב של 90 מעלות בלבד, ניתן לצלם את התצוגות בקלות.
- בצע בדיקת מאמץ דובוטמין באותה חיה תוך שמירה על אותה הרדמה כדי להבטיח השוואה. ודא שהדופק ההתחלתי נשאר יציב בטווח של 400-450 פעימות לדקה. הקלט את קריאות האק"ג ושמור אותו יחד עם ועל התמונות שנרכשו. ודא שאות האק"ג ברור. אחרת, נסה להדביק מחדש את כל ארבעת הגפיים עד להצגת אות א.ק.ג ברור.
- שוב, בצע תצוגת PSLAX (תמונות במצב B ומצב M). שמור את התמונות כתמונה "בסיסית". הקפד, לשמור ולזכור גם את הדופק הראשוני.
- מלאו מראש את המזרק והזריקו 5 מיקרוגרם/גרם משקל גוף דובוטמין תוך צפקית באמצעות מחט 27 גרם ומזרק 1 מ"ל. עקוב מקרוב אחר הדופק. הקלט תמונות אקו לב עד להגעה לדופק היעד והשתמש בעליית הדופק לניתוח מאוחר יותר. עלייה משמעותית בת קיימא בקצב הלב הנגרמת על ידי דובוטמין מושגת לאחר עלייה של 15-30% לאחר כדקה, תלוי במינון הדובוטמין.
הערה: השתמש תמיד במחטי הזרקה סטריליות לשימוש חד פעמי לכל בעל חיים כדי למנוע זיהומים. הרגישות לדובוטמין והעומס (התת-מקסימלי) עשויים להשתנות בהתאם לזן העכבר ועשויים להיות תלויים במערך הניסוי ויש להגדיר אותם בניסויים מוקדמים. מומלץ להתאים את מינון הדובוטמין למערך הניסוי.
זהירות: פעל לפי ההנחיות המוסדיות לשימוש בפריטים זיהומיים חדים ופוטנציאליים. השלך תמיד את המחט למיכל פסולת רפואית מאושר! - לאחר הגעה לדופק היעד ונשאר יציב למשך כ-30 שניות, רכוש תמונות PSLAX B-mode ו-M-mode כמתואר בשלב 3.
- שוב, סובב את המתמר בכיוון השעון כדי לקבל תצוגת PSSAX כמתואר בשלב 3. כאן, רכשו תמונות במצב B של רמת השרירים הבסיסיים, האמצעיים (רמת השרירים הפפילריים) והרמה האפיקלית ותמונות מצב M של רמת האמצע החדר (רמת השרירים הפפילריים). הרגיע, כי דופק היעד נשאר יציב. אחרת, חזור למצב PSLAX והתחל שוב לצלם.
הערה: מכיוון שקצב הלב יירד ללא עירוי רציף של דובוטמין12 (לא מכוסה במאמר זה), יש לרכוש את התמונות תוך שתי דקות. תמונות PSLAX ו-PSSAX חיוניות לרוב המדידות הרלוונטיות הנגרמות על ידי מתח (ראה סעיף "תוצאות מייצגות"). - כעת, בצע שוב תצוגת 4CH אפיקלית (כפי שהוסבר בשלב 3.4). באמצעות דופלר PW, מדוד את דפוסי הזרימה המעניינים (כפי שהוסבר בשלב 3.4.2). בתנאים לא מלחיצים, שני גלים אופייניים נמדדים באמצעות דופלר PW, אחד מייצג את המילוי הפסיבי של החדר (גל E(arly)) ואחד מייצג את המילוי הפעיל לאחר התכווצות פרוזדורים (גל A(ניסוי)). עם עלייה בקצב הלב, גלים אלה נוטים להתמזג וייתכן שלא ניתן למדוד אותם באופן מובהק תחת לחץ הנגרם על ידי דובוטמין.
5. צעדים אחרונים
- לאחר כ-5 דקות כאשר הדופק יתחיל לרדת שוב, ודא שכל הצפיות נלכדו.
- הסר בעדינות את ג'ל האולטרסאונד מהחזה בעזרת מגבת נייר לחה נקייה. הסר בזהירות את קיבוע הקלטת. שימו לב במיוחד לסרט המקבע את ראש החיה כדי להימנע משילוף השפם.
- כבה את ההרדמה. אם אתה משתמש בפליטת גז פעילה, הקפד להמשיך את פליטת הגז. הניחו את החיה על מגבת נייר בכלוב מחומם מופרד בתקופת ההשכמה. התבונן בבעל החיים מקרוב. אסור להשאיר אותו ללא השגחה עד שהוא חוזר להכרה מספקת כדי לשמור על שכיבה על החזה. לאחר שהתעורר והתאושש לחלוטין, העבירו את החיה לכלוב שלה.
הערה: בשל האופי הלא סופי של טכניקה זו, בעל החיים רשאי להישאר בתוך הניסוי בהתאם לכל התקנות הרלוונטיות.
6. הערכה לא מקוונת
- העבר את נתוני התמונה לתוכנת הניתוח הלא מקוונת בתחנת עבודה כדי לבצע הערכה מפורטת של תפקוד הלב. שימו לב במיוחד להבדל בין תפקוד לב לא לחוץ ללחוץ. יש לרשום ולהציג את הדופק תמיד.
הערה: מאחר שניתוח תוכנה משתנה בין תוכנות שונות, הוא אינו מכוסה בפרוטוקול זה. אנא עיין בהוראות היצרן.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תמונה אקו לב פיזיולוגית לא לחוצה שנרכשה ב-PSLAX מוצגת באיור 3. בדיאסטולה, דפנות החדרים מופיעות באופן אחיד (איור 3A) ומתעבות במידה מסוימת (איור 3B,C). הזרקה של 5 מיקרוגרם/גרם משקל גוף dobutamine i.p. מובילה לעלי?...
Access restricted. Please log in or start a trial to view this content.
Discussion
הערכה הנגרמת על ידי מתח של תפקוד הלב נמצאת בשימוש נרחב בבני אדם בסביבה קלינית באמצעות בדיקות מאמץ או בדיקות מאמץ פרמקולוגיות 6,7. מכיוון שאקו לב מיידי לאחר פעילות גופנית של עכברים מוגבל מאוד בשל הצורך בהרגעה, אקו לב במאמץ המושרה על ידי דובו?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מכירים במקורות המימון הבאים: קרן המחקר הגרמנית (מדען קלינאי זוטר של UMEA, סטפן סטלמאייר; RA 969/12-1, טיינוש ראסאף; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
References
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110(2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219(2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447(2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618(2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110(2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738(2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629(2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, suppl_D 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621(2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, Suppl 1 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646(2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7(2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved