Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выявление незначительных изменений в функции сердца с помощью трансторакальной стресс-эхокардиографии с добутамином у мышей
В этой статье
Резюме
Дисфункция левого желудочка представляет собой последний общий путь для множества сердечных заболеваний. Здесь мы представляем подробный протокол трансторакальной стресс-эхокардиографии с добутамином для комплексной оценки функции левого желудочка у мышей с моделями сердечных заболеваний, а также для фенотипирования сердца.
Аннотация
Дисфункция левого желудочка (ЛЖ) прокладывает окончательный путь для множества сердечных заболеваний. С помощью неинвазивной высокочастотной трансторакальной стресс-эхокардиографии с добутамином у людей стал возможен редукционистский исследовательский подход для выявления тонких изменений в сердечной функции. В данной работе мы предоставляем протокол использования этого метода на мышах, чтобы облегчить расширенный анализ архитектуры и функции ЛЖ в физиологии и патологии, что позволяет наблюдать за изменениями в моделях сердечных заболеваний, скрытых в сердцах без стресса. Это исследование может быть выполнено на одном и том же животном и позволяет проводить как базальные, так и фармакологически стресс-индуцированные измерения. Мы подробно описываем критерии для надлежащей анестезии, анализа ЛЖ на основе визуализации, учета внутри- и межнаблюдательной вариабельности, а также получения положительного инотропного ответа, который может быть достигнут у мышей после внутрибрюшинного введения добутамина в условиях, близких к физиологическим. Чтобы резюмировать характеристики физиологии и болезней человека на моделях мелких животных, мы выделяем критические подводные камни в оценке, например, выраженный эффект Боудича у мышей. Для дальнейшего достижения трансляционных целей мы сравниваем эффекты, вызванные стрессом, у людей и мышей. При использовании в трансляционных исследованиях необходимо обращать внимание на физиологические различия между мышами и человеком. Экспериментальная строгость диктует, что некоторые параметры, оцененные у пациентов, можно использовать только с осторожностью из-за ограничений пространственного и временного разрешения в мышиных моделях.
Введение
Отличительной чертой многих сердечных заболеваний у человека является систолическое и/или диастолическое функциональное нарушение левого желудочка (ЛЖ). Для выявления структурных аномалий, диагностики и лечения систолической сердечной недостаточности, а также оценки диастолической функции у пациентов с симптомами сердечной недостаточности эхокардиография используется в качестве основного метода оценки.
Поскольку симптомы неспецифичны и более трети пациентов с клиническим синдромом сердечной недостаточности могут не страдать от самой сердечной недостаточности, важно найти объективный эхокардиографический коррелят для клинической картины пациента. Кроме того, некоторые симптомы, которые являются оккультными в состоянии покоя или статике, могут возникать в условиях активности или стресса. У пациентов с ишемической болезнью сердца уже незначительные изменения коронарной перфузии могут привести к аномалиям движения регионарной стенки. Тем не менее, эти тонкие изменения не могут быть оценены с помощью обычной эхокардиографии, поскольку изменения сердечного заболевания могут быть скрыты в сердцах без стресса. Для более глубокого понимания кардиологической физиопатологии стресс-эхокардиография обеспечивает динамическую оценку структуры и функции миокарда в условиях физической нагрузки или фармакологического стресса, что позволяет сопоставить симптомыс кардиологическими данными. Также у мелких животных этот метод представляет собой неинвазивное надежное средство in-vivo 3,4,5. Как и у человека, стрессовая реакция миокарда может быть вызвана фармакологическими агентами у мышей и крыс. Добутамин является часто используемым препаратом, и стресс-эхокардиография с добутамином широко применяется у людей 6,7, но только иногда используется на моделях мелких животных для оценки сердечной стрессовой реакции 8,9,10,11. Добутамин представляет собой синтетический катехоламин с преимущественно β1-агонистическим эффектом, приводящим к положительной инотропии и хронотропии сердца. Для достижения правильного перевода с человека на мышь, технологию и концептуальную основу эхокардиографии необходимо учитывать технические ограничения, связанные, например, с маленьким размером и учащенным сердцебиением у мыши. Целевая частота сердечных сокращений человека при стресс-эхокардиографии с добутамином составляет [(возраст 220 лет) x 0,85], что приводит к увеличению средней частоты сердечных сокращений примерно на 150 ± 10% у здоровых добровольцев12,13. Для мышей такая формула отсутствует. Показано, что фракция выброса (ФВ) увеличивается при проведении стресс-эхокардиографии у человека на 5-20%12,14. ФВ у мышей, в зависимости от частоты сердечных сокращений, составляет от 58 ± 11% (< 450 уд/мин) до 71 ± 11% (≥ 450 уд/мин) и изменяется почти на 20% при более высокой частоте сердечныхсокращений. Основным механизмом у мышей по увеличению сердечного выброса является увеличение частоты сердечных сокращений. Частично ответственным за этот механизм является эффект Боудича или феномен лестницы, частотно-зависимый кальций-инотропный сердечный ответ, который более выражен у мышей, чем у людей15,16. Кроме того, (стрессовая) эхокардиография лежит в основе внутри- и межнаблюдательной вариабельности. Поэтому необходима высокостандартизированная процедура17,18.
Здесь мы представляем подробную процедуру стресс-эхокардиографии добутамина для получения стандартизированных изображений для выявления тонких изменений в сердечной функции у мышей в моделях здоровья и болезни. Ключевыми компонентами являются адекватная анестезия, адекватный мониторинг сердечного ритма и возможные подводные камни в стресс-индуцированной визуализации у мышей. Ключевыми параметрами являются оценка систолической и диастолической функции, в том числе с учетом ФВЛЖ. Поскольку мыши устойчивы к сердечной дисфункции, вызванной последующей нагрузкой17, этот протокол может добавить ценную информацию для использования в моделях клапанных пороков сердца.
Access restricted. Please log in or start a trial to view this content.
протокол
Все методы и процедуры выполнялись в соответствии со всеми соответствующими нормами («Европейская конвенция о защите позвоночных животных, используемых в экспериментальных и других научных целях» (Директива 2010/63/ЕС), а уход за животными осуществлялся в соответствии с институциональными руководящими принципами. Данные от людей были проанализированы в соответствии со всеми институциональными, национальными и международными рекомендациями по благополучию человека и были одобрены Местным комитетом по этике (20-9218-BO). Все эксперименты проводились с самцами C57BL/6JRj в возрасте 12 недель.
1. Подготовка материалов и оборудования
ПРИМЕЧАНИЕ: На рисунке 1 показан пример рабочего места для ультразвукового управления мелкими животными.
- Убедитесь, что вы работаете в тихой контролируемой среде с регулируемым светом.
- Предварительно нагрейте гель для ультразвука, например, с помощью подогревателя геля. Дайте гелю нагреться до 37 °C. Это может занять некоторое время.
- Очистите все инструменты, включая платформу, дезинфицирующей салфеткой.
- Включите и предварительно нагрейте платформу до 37 °C.
- Включите ультразвуковой аппарат. Введите идентификатор животного и идентификатор протокола, а также другую необходимую информацию. Используйте высокочастотный ультразвуковой преобразователь с центральной частотой передачи 30 МГц для мышей с массой тела около 30 г.
- Убедитесь, что вы работаете с активной системой отвода газов.
ПРИМЕЧАНИЕ: При использовании фильтра с активированным углем для адсорбции изофлурана в выдыхаемом потоке, обязательно проверьте вес и замените фильтр при достижении указанного максимального увеличения веса. - При необходимости заполните вапорайзер достаточным количеством изофлурана.
ВНИМАНИЕ: Не вдыхайте летучие анестетики. - Приготовьте рабочий раствор добутамина в концентрации 2,5 мкг/мкл либо путем разведения готового к применению раствора для инъекций, либо путем растворения порошка добутамина гидрохлорида в 0,9% физиологическом растворе в соответствии с инструкцией производителя. Раствор стабилен не менее 24 ч при хранении при комнатной температуре.

Рисунок 1: Рабочее место для ультразвукового исследования сердца мелких животных. Эргономичная настройка незаменима при стресс-эхокардиографии мелких животных, так как время обследования должно оставаться коротким. Рабочее место состоит из ультразвукового аппарата, наркозной системы для мелких животных с подачей кислорода и активным отводом газа, подогреваемой эхокардиографической платформы со встроенной ЭКГ и возможностями движения с помощью микроманипуляторов в составе интегрированной рельсовой системы, а также блока физиологического мониторинга. Полезными вспомогательными средствами являются подогреватель геля к теплому гелю для ультразвука и тепловая лампа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Подготовка мыши к визуализации и индукции анестезии
- Заполните индукционную камеру 3%-4% v/v изофлурана в газовой смеси, обогащенной кислородом (с концентрацией 1 л/мин 100%O2).
- Взвесьте мышь. Аккуратно возьмите мышь за хвост и перенесите ее в индукционную камеру. Убедитесь, что животное усыплено в течение нескольких секунд, внимательно наблюдая за движениями животного.
- При необходимости изменить подачу газа к носовому конусу, подключенному к анестезиологической системе (1,0-1,5 об.% изофлурана с 1 л/мин 100 %О2 для поддержания стабильной седации). Извлеките мышь из индукционной камеры и осторожно поместите ее на предварительно нагретую платформу. Убедитесь, что лапы лежат на датчиках ЭКГ, встроенных в платформу.
- Чтобы предотвратить высыхание склеры, нанесите мазевой гель на оба глаза.
ПРИМЕЧАНИЕ: Измерение напряжений займет много времени. - Нанесите очень небольшое количество электродного крема на датчики ЭКГ. Аккуратно закрепите животное скотчем на всех четырех конечностях. Используйте небольшую часть клейкой ленты, чтобы зафиксировать положение головы животного в носовом конусе. ЭКГ используется для записи частоты сердечных сокращений во время получения изображения. Настройте систему физиологической визуализации для получения стабильного и четкого сигнала ЭКГ.
ПРИМЕЧАНИЕ: Слишком большое количество электродного крема может привести к ухудшению качества сигнала ЭКГ. - Чтобы защитить животное от стресса во время процедуры, проверьте достаточную глубину седации, поддерживая диапазон частоты сердечных сокращений на уровне 400-450 уд/мин. Частота сердечных сокращений определяется с помощью ЭКГ. Допустимо отклонение в 50 уд/мин в пределах диапазона.
ПРИМЕЧАНИЕ: Движения животного могут указывать на слишком узкий уровень седативного эффекта. Анестезия не должна приводить к кардиоугнетению мыши. Седация может быть скорректирована для получения вышеупомянутой целевой частоты сердечных сокращений. - С помощью смазки аккуратно введите ректальный термометр для непрерывного контроля температуры тела. Поддерживайте температуру в физиологическом диапазоне (обычно от 36,5 °C до 37,5 °C в зависимости от штамма мыши и экспериментальной установки). В лаборатории ультразвукового исследования сердца животных без контроля окружающей среды можно рассмотреть возможность использования инфракрасного освещения.
- Используйте химический крем для депиляции, чтобы удалить волосы на теле с груди. Используйте чистое влажное бумажное полотенце, чтобы протереть грудь. Обязательно удалите все оставшиеся компоненты крема (рисунок 2А).
ПРИМЕЧАНИЕ: Электрическую машинку для стрижки можно использовать и перед депиляцией. Теперь животное подготовлено к визуализации. Поскольку очень важно сократить время визуализации, вся подготовка перед визуализацией должна занимать менее 3 минут.
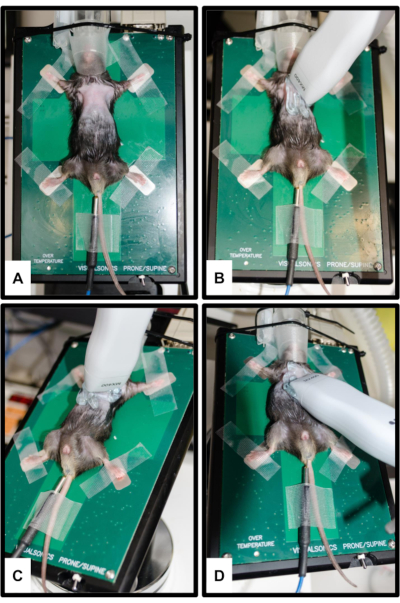
Рисунок 2: Положение животного и датчика. (A) Мышь прикреплена к нагреваемой платформе всеми четырьмя конечностями, закрепленными на серебряных электродах ЭКГ. Для измерения температуры тела вставляется ректальный термометр. Рыло аккуратно вводится в носовой конус наркозной системы. (B) Ориентация зонда для парастернального обзора по длинной оси (PSLAX); Смотрите шаг 3.2. (C) ориентация зонда для парастернального обзора короткой оси (PSSAX); Смотрите шаг 3.3. (D) Ориентация зонда для апикального четырехкамерного обзора (4CH); Смотрите шаг 3.4. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Базовая визуализация сердечно-сосудистой системы
ПРИМЕЧАНИЕ: Изображения могут быть получены с использованием двух основных положений преобразователя (парастернальное и апикальное ультразвуковое окно) (Рисунок 2) и, по крайней мере, трех ультразвуковых модальностей (режим B(правильность), режим M(otion) и режим Допплера (цветной допплер и допплер импульсной волны (PW)) (Рисунок 3, Рисунок 4, Рисунок 5). Для ознакомления с основами визуализации обратитесь к ранее опубликованным статьям16,18. Очень важно получить четкие изображения для сравнения с более поздними полученными изображениями напряжений.
- Нанесите предварительно подогретый ультразвуковой гель без пузырьков на грудь.
ПРИМЕЧАНИЕ: Ненагреваемый ультразвуковой гель приведет к быстрой потере температуры тела, что повлияет на частоту сердечных сокращений. - Выполните представление по длинному краю света в парастернале (PSLAX).
ПРИМЕЧАНИЕ: PSLAX выполняется для визуализации LV в ее длинной оси. С его помощью, например, можно получить размеры корня аорты и проксимального отдела аорты, а также длину ЛЖ.- Повернув голову в сторону от исследователя, наклоните стол примерно на 10-20° влево и на 5-10° вперед, чтобы отодвинуть сердце как можно дальше. Расположите датчик пассинально на одной линии с длинной осью сердца маркером (выемкой), направленным в сторону правого плеча животного (рис. 2B).
- Используйте микроманипуляторы для настройки оптимального обзора. Используйте элементы управления на панели управления изображением для оптимизации изображения. Получите по крайней мере одно изображение в 2D B-режиме и одно изображение в M-режиме на уровне среднего желудочка.
- Приобретите любые дополнительные изображения, если это необходимо для конкретного вопроса. Получите не менее 100 кадров и не менее 3(-6) полных сердечных циклов.
- Выполните парастернальный вид по короткой оси (PSSAX).
ПРИМЕЧАНИЕ: PSSAX выполняется для визуализации LV по его короткой оси. С этой точки зрения, например, можно рассчитать конечный систолический объем левого желудочка (LVESV), конечный диастолический объем левого желудочка (LVEDV), ударный объем (SV) и сердечный выброс (CO).- Поверните датчик на 90° по часовой стрелке, не изменяя угол наклона (маркер теперь указывает на левое плечо животного) (Рисунок 2C). Получите по крайней мере одно изображение в B-режиме в базальном, среднежелудочковом (уровне папиллярных мышц) и апикальном обзоре.
- Чтобы определить самый базальный и самый апикальный вид, прокрутите вдоль длинной оси к наиболее удаленным точкам, где еще виден полный сердечный цикл камеры ЛЖ. Делайте снимки на среднежелудочковом уровне примерно в промежуточном положении на уровне папиллярных мышц.
- Получите по крайней мере одно изображение в М-режиме в среднежелудочковой проекции.
ПРИМЕЧАНИЕ: Некоторые ультразвуковые аппараты предоставляют предустановки для различных видов; Рекомендуется проверить наличие адекватной предустановки перед получением изображений.
- Выполнение апикального четырехкамерного (4CH) вида.
ПРИМЕЧАНИЕ: 4CH важен, потому что его можно в первую очередь использовать для оценки митрального клапана с помощью допплерографии PW.- Наклоните платформу, чтобы животное находилось в модифицированном по Тренделенбургу положении головой вниз. Наклоните преобразователь к голове мыши так, чтобы маркер был направлен к левому боку животного (Рисунок 2D).
- Получите по крайней мере одно изображение в режиме B, а также цветное допплеровское и допплеровское изображение митрального и трикуспидального клапанов. В зависимости от экспериментального вопроса, нанесите тканевый допплер в виде 4CH.
ПРИМЕЧАНИЕ: Самый простой способ достичь апикального положения 4CH - это наклонить стол с точки зрения PSAX и наклонить датчик. Будьте осторожны, не оказывайте слишком большого давления на грудную клетку, так как это может помешать измерениям, например, диастолической функции.
4. Визуализация стресса с добутамином
ПРИМЕЧАНИЕ: Как только целевая частота сердечных сокращений достигнута, следует получить стандартизированные изображения, если целевая частота сердечных сокращений стабильна. Обычно для этого требуется более одного переключения между PSLAX и PSSAX. Поскольку для переключения между PSLAX и PSSAX требуется всего лишь поворот на 90°, виды можно легко визуализировать.
- Проведите стресс-тестирование добутамина на одном и том же животном под одной и той же анестезией для обеспечения сопоставимости. Следите за тем, чтобы начальная частота сердечных сокращений оставалась стабильной в диапазоне 400-450 уд/мин. Запишите показания ЭКГ и сохраните их вместе с полученными изображениями и на них. Убедитесь, что сигнал ЭКГ четкий. В противном случае попытайтесь повторно наложить тейп на все четыре конечности до тех пор, пока не отобразится четкий сигнал ЭКГ.
- Снова выполните просмотр PSLAX (изображения в B-режиме и M-режиме). Сохраните изображения в качестве "базового" изображения. Обязательно сохраняйте и учитывайте также начальную частоту сердечных сокращений.
- Предварительно наполните шприц и введите 5 мкг/г добутамина внутрибрюшинно с помощью иглы 27 г и шприца объемом 1 мл. Внимательно следите за частотой сердечных сокращений. Записывайте эхокардиографические изображения до тех пор, пока не будет достигнута целевая частота сердечных сокращений, и используйте увеличение частоты сердечных сокращений для последующего анализа. Устойчивое значительное увеличение частоты сердечных сокращений, вызванное добутамином, достигается после увеличения на 15-30% примерно через 1 мин, в зависимости от дозы добутамина.
ПРИМЕЧАНИЕ: Всегда используйте одноразовые стерильные иглы для инъекций для каждого животного, чтобы предотвратить инфекции. Чувствительность к добутамину и (суб)максимальная нагрузка могут варьироваться в зависимости от штамма мыши и могут зависеть от экспериментальной установки и должны быть определены в предварительных экспериментах. Рекомендуется корректировать дозу добутамина в соответствии с экспериментальной установкой.
ВНИМАНИЕ: Следуйте рекомендациям учреждения по использованию острых и потенциально инфекционных предметов. Всегда выбрасывайте иглу в одобренный контейнер для медицинских отходов! - Как только целевая частота сердечных сокращений будет достигнута и останется стабильной в течение примерно 30 с, получите изображения PSLAX в B-режиме и M-режиме, как описано в шаге 3.
- Снова поверните преобразователь по часовой стрелке, чтобы получить изображение PSSAX, как описано в шаге 3. Здесь получите B-режимные изображения базального, среднежелудочкового (уровень папиллярных мышц) и апикального уровня, а также M-модные изображения среднежелудочкового (уровень папиллярных мышц). Будьте уверены, что целевой пульс остается стабильным. В противном случае вернитесь в положение PSLAX и начните визуализацию заново.
ПРИМЕЧАНИЕ: Поскольку частота сердечных сокращений снижается без непрерывной инфузии добутамина12 (не рассматривается в этой статье), изображения должны быть получены в течение двух минут. Изображения PSLAX и PSSAX необходимы для большинства соответствующих измерений, вызванных напряжением (см. раздел «Репрезентативные результаты»). - Теперь снова выполните апикальный вид 4CH (как описано в шаге 3.4.). С помощью допплера PW измерьте интересующие вас схемы потока (как описано в шаге 3.4.2.). В ненапряженных условиях с помощью допплера PW измеряются две характеристические волны, одна из которых представляет пассивное наполнение желудочка (волна E), а другая — активное наполнение после сокращения предсердий (волна A(trial)). С увеличением частоты сердечных сокращений эти волны имеют тенденцию сливаться и могут не поддаваться четкому измерению при стрессе, вызванном добутамином.
5. Заключительные шаги
- Примерно через 5 минут, когда частота сердечных сокращений снова начнет снижаться, убедитесь, что все виды сняты.
- Аккуратно удалите гель для ультразвука с груди с помощью чистого влажного бумажного полотенца. Аккуратно снимите фиксацию ленты. Особое внимание уделите ленте, фиксирующей голову животного, чтобы избежать выдергивания усов.
- Выключите анестезию. Если вы используете активный выхлоп газа, обязательно продолжайте откачивать газ. Поместите животное на бумажное полотенце в отдельную отапливаемую клетку в период пробуждения. Внимательно наблюдайте за животным. Его нельзя оставлять без присмотра до тех пор, пока он не придет в сознание, достаточное для поддержания лежачего положения на грудине. Когда животное проснутся и полностью придет в себя, пересадите его в клетку.
ПРИМЕЧАНИЕ: Из-за неокончательного характера этой методики, животное может оставаться в рамках эксперимента в соответствии со всеми соответствующими правилами.
6. Оценка в автономном режиме
- Передайте данные изображения в программное обеспечение для автономного анализа на рабочей станции для выполнения детальной оценки сердечной функции. Обратите особое внимание на разницу между ненапряженной и напряженной функцией сердца. Частота сердечных сокращений всегда должна быть записана и представлена.
ПРИМЕЧАНИЕ: Поскольку анализ программного обеспечения различается в зависимости от программного обеспечения, он не рассматривается в данном протоколе. Пожалуйста, обратитесь к инструкциям производителя.
Access restricted. Please log in or start a trial to view this content.
Результаты
Физиологическое ненапряженное эхокардиографическое изображение, полученное при PSLAX, показано на рисунке 3. При диастоле стенки желудочков выглядят равномерно (рисунок 3А) и утолщаются до определенной степени (
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Стресс-индуцированная оценка сердечной функции широко используется у людей в клинических условиях с использованием нагрузочного тестирования или фармакологического нагрузочного тестирования 6,7. Поскольку эхокардиография мышей сра?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы отмечают следующие источники финансирования: Немецкое научно-исследовательское общество (младший ученый-клиницист UMEA Штефан Сеттельмайер; RA 969/12-1, Тиенуш Рассаф; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
Ссылки
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110(2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219(2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447(2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618(2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110(2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738(2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629(2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, suppl_D 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621(2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, Suppl 1 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646(2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7(2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены