É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Revelando alterações sutis na função cardíaca usando ecocardiografia transtorácica de estresse com dobutamina em camundongos
Neste Artigo
Resumo
A disfunção ventricular esquerda constitui a via comum final para uma série de distúrbios cardíacos. Fornecemos aqui um protocolo detalhado de abordagem de ecocardiografia transtorácica de estresse com dobutamina para avaliação abrangente da função ventricular esquerda de modelos de camundongos de doença cardíaca, bem como fenotipagem cardíaca.
Resumo
A disfunção ventricular esquerda (VE) abre o caminho final para uma infinidade de distúrbios cardíacos. Com a ecocardiografia transtorácica não invasiva de alta frequência com dobutamina em humanos, tornou-se possível uma abordagem de investigação reducionista para desmascarar alterações sutis na função cardíaca. Aqui, fornecemos um protocolo para o uso dessa técnica em camundongos para facilitar a análise expandida da arquitetura e função do VE em fisiologia e patologia, permitindo a observação de alterações em modelos de doenças cardíacas ocultas em corações não estressados. Esta investigação pode ser realizada em um mesmo animal e permite medições basais e farmacologicamente induzidas por estresse. Descrevemos critérios detalhados para anestesia apropriada, análise de VE baseada em imagem, consideração da variabilidade intra e interobservador e obtenção de resposta inotrópica positiva que pode ser alcançada em camundongos após injeção intraperitoneal de dobutamina em condições fisiológicas próximas. Para recapitular as características da fisiologia humana e da doença em modelos de pequenos animais, destacamos armadilhas críticas na avaliação, por exemplo, um efeito Bowditch pronunciado em camundongos. Para atender ainda mais aos objetivos translacionais, comparamos os efeitos induzidos pelo estresse em humanos e camundongos. Quando usado em estudos translacionais, deve-se prestar atenção às diferenças fisiológicas entre camundongos e humanos. O rigor experimental determina que alguns parâmetros avaliados em pacientes só podem ser usados com cautela devido a restrições na resolução espacial e temporal em modelos de camundongos.
Introdução
A marca registrada de muitas doenças cardíacas em humanos é um comprometimento funcional sistólico e/ou diastólico do ventrículo esquerdo (VE). Para a detecção de anormalidades estruturais, o diagnóstico e o manejo da insuficiência cardíaca sistólica, bem como a avaliação da função diastólica em pacientes com sintomas de insuficiência cardíaca, a ecocardiografia é usada como uma modalidade de avaliação fundamental.
Como os sintomas são inespecíficos e mais de um terço dos pacientes com a síndrome clínica da insuficiência cardíaca podem não sofrer da insuficiência cardíaca real, é importante encontrar um correlato ecocardiográfico objetivo para a apresentação clínica do paciente1. Além disso, alguns sintomas ocultos no estado de repouso ou estático podem ocorrer em condições de atividade ou estresse. Em pacientes com doença arterial coronariana, pequenas alterações na perfusão coronariana já podem levar a anormalidades regionais da contratilidade da parede. No entanto, essas alterações sutis não podem ser avaliadas usando a ecocardiografia convencional, pois as alterações da doença cardíaca podem estar ocultas em corações não estressados. Para obter uma compreensão mais profunda da fisiopatologia cardíaca, a ecocardiografia de estresse fornece uma avaliação dinâmica da estrutura e função miocárdica sob condições de exercício ou estresse induzido farmacológico, permitindo combinar sintomas com achados cardíacos2. Além disso, em pequenos animais, esse método representa uma ferramenta in vivo confiável e não invasiva 3,4,5. Em consonância com os humanos, a reação ao estresse do miocárdio pode ser induzida por meio de agentes farmacológicos em camundongos e ratos. A dobutamina é uma droga frequentemente usada e a ecocardiografia de estresse com dobutamina é amplamente realizada em humanos 6,7, mas apenas ocasionalmente usada em modelos de pequenos animais para avaliar a reação ao estresse cardíaco 8,9,10,11. A dobutamina é uma catecolamina sintética com efeito predominantemente β1-agonístico, resultando em inotropia e cronotropia positivas do coração. Para obter uma tradução correta de humano para camundongo, a tecnologia e a estrutura conceitual da ecocardiografia, limitações técnicas relacionadas, por exemplo, ao tamanho pequeno e à frequência cardíaca rápida no camundongo devem ser consideradas. A frequência cardíaca alvo humana na ecocardiografia de estresse com dobutamina é [(220-idade) x 0,85], resultando em um aumento médio da frequência cardíaca de cerca de 150 ± 10% em voluntários saudáveis 12,13. Para camundongos, essa fórmula está faltando. Descreve-se que a fração de ejeção (FE) é aumentada pela ecocardiografia de estresse em humanos em 5-20%12,14. A FE em camundongos é, dependendo da frequência cardíaca, relatada entre 58 ± 11% (< 450 bpm) e 71 ± 11% (≥ 450 bpm) e muda em quase 20% com frequências cardíacas mais altas4. O principal mecanismo em camundongos para aumentar o débito cardíaco é o aumento da frequência cardíaca. Em parte responsável por esse mecanismo é o efeito Bowditch ou fenômeno da escada, uma resposta cardíaca positiva-inotrópica mediada por cálcio dependente da frequência, que é mais pronunciada em camundongos do que em humanos15,16. Além disso, a ecocardiografia (de estresse) está subjacente à variabilidade intra e interobservador. Portanto, um procedimento altamente padronizado é indispensável17,18.
Aqui apresentamos o procedimento detalhado da ecocardiografia de estresse com dobutamina para adquirir imagens padronizadas para desvendar mudanças sutis na função cardíaca em camundongos em modelos de saúde e doença. Os principais componentes incluem anestesia adequada, monitoramento adequado da frequência cardíaca e possíveis armadilhas na imagem induzida por estresse em camundongos. Os principais parâmetros são a avaliação da função sistólica e diastólica, incluindo a consideração da FEVE. Como os camundongos são resistentes à disfunção cardíaca induzida por pós-carga17, esse protocolo pode adicionar informações valiosas para o uso também em modelos de valvopatia.
Protocolo
Todos os métodos e procedimentos foram realizados de acordo e em conformidade com todos os regulamentos relevantes ('Convenção Europeia para a Proteção dos Animais Vertebrados Usados para Fins Experimentais e outros Fins Científicos' (Diretiva 2010/63/UE) e os cuidados com os animais estavam de acordo com as diretrizes institucionais. Os dados de seres humanos foram analisados de acordo com todas as diretrizes institucionais, nacionais e internacionais para o bem-estar humano e foram aprovados pelo Comitê de Ética Local (20-9218-BO). Todos os experimentos foram realizados com machos C57BL/6JRj com 12 semanas de idade.
1. Preparação de materiais e equipamentos
NOTA: A Figura 1 mostra um exemplo de um local de trabalho de ultrassom de pequenos animais.
- Certifique-se de operar em um ambiente controlado silencioso com luz regulável.
- Pré-aqueça o gel de ultrassom, por exemplo, usando um aquecedor de gel. Deixe o gel aquecer a 37 °C. Isso pode demorar um pouco.
- Limpe todos os instrumentos, incluindo a plataforma, com um pano desinfetante.
- Ligue e pré-aqueça a plataforma a 37 °C.
- Ligue a máquina de ultrassom. Insira o ID do animal e o ID do protocolo, bem como outras informações relevantes. Use um transdutor de ultrassom de alta frequência com transmissão central de 30 MHz para camundongos com aproximadamente 30 g de peso corporal.
- Certifique-se de trabalhar com um sistema ativo de exaustão de gás.
NOTA: Se estiver usando um filtro de carvão ativado para adsorver o isoflurano no fluxo exalado, certifique-se de verificar o peso e substituir o filtro assim que o aumento de peso máximo indicado for atingido. - Se necessário, encha o vaporizador com a quantidade adequada de isoflurano.
CUIDADO: Não inale anestésicos voláteis. - Prepare uma solução de trabalho de dobutamina de 2,5 μg/μL por diluição de uma solução de injeção pronta para uso ou dissolvendo o pó de cloridrato de dobutamina em solução salina a 0,9% de acordo com as instruções do fabricante. A solução é estável pelo menos durante 24 h quando conservada à temperatura ambiente.

Figura 1: Local de trabalho de ultrassom cardíaco de pequenos animais. Um ambiente ergonômico é indispensável para a ecocardiografia de estresse de pequenos animais, pois os tempos de exame devem permanecer curtos. O local de trabalho consiste em uma máquina de ultrassom, um sistema de anestesia para pequenos animais com suprimento de oxigênio e exaustão ativa de gás, uma plataforma de ecocardiografia aquecida com ECG incorporado e recursos de movimento por meio de micromanipuladores como parte de um sistema ferroviário integrado, bem como uma unidade de monitoramento fisiológico. Um gel mais quente para aquecer o gel de ultrassom e uma lâmpada de calor são ajudas úteis. Clique aqui para ver uma versão maior desta figura.
2. Preparação do camundongo para imagem e indução anestésica
- Encha a câmara de indução com 3%-4% v/v de isoflurano em uma mistura de gases enriquecida com oxigênio (com 1 L/min 100% O2).
- Pese o mouse. Pegue suavemente o mouse pela cauda e transfira-o para a câmara de indução. Certifique-se de que o animal seja sedado em alguns segundos, observando de perto os movimentos do animal.
- Se necessário, altere o fluxo de gás para o cone nasal conectado ao sistema de anestesia (1,0-1,5 vol% de isoflurano com 1 L/min 100% O2 para manter uma sedação estável). Remova o mouse da câmara de indução e coloque-o cuidadosamente na plataforma pré-aquecida. Certifique-se de que as patas estejam nos sensores de ECG embutidos na plataforma.
- Para evitar o ressecamento da esclera, aplique pomada em gel em ambos os olhos.
NOTA: As medições de tensão levarão seu tempo. - Aplique uma quantidade muito pequena de creme de eletrodo nos sensores de ECG. Prenda suavemente o animal com fita adesiva nos quatro membros. Use uma pequena parte da fita adesiva para proteger a posição da cabeça do animal no cone do nariz. O ECG é usado para registrar a frequência cardíaca durante a aquisição da imagem. Ajuste o sistema de imagem fisiológica para um sinal de ECG estável e claro.
NOTA: Muito creme de eletrodo pode resultar em má qualidade do sinal de ECG. - Para proteger o animal do estresse durante o procedimento, verifique a profundidade adequada da sedação, mantendo a faixa de frequência cardíaca em 400-450 bpm. A frequência cardíaca é obtida pelo ECG. Uma variação de 50 bpm dentro da faixa é aceitável.
NOTA: Os movimentos do animal podem indicar um nível de sedação muito estreito. A anestesia não deve levar à cardio-depressão do camundongo. A sedação pode ser ajustada para obter a frequência cardíaca alvo mencionada acima. - Usando lubrificação, insira suavemente um termômetro retal para monitoramento contínuo da temperatura corporal. Manter a temperatura na faixa fisiológica (normalmente entre 36,5 °C e 37,5 °C, dependendo da cepa do camundongo e da configuração experimental). Em um laboratório de ultrassom cardíaco animal não controlado ambientalmente, o uso de iluminação infravermelha pode ser considerado.
- Use creme depilatório químico para remover os pelos do corpo do peito. Use uma toalha de papel limpa e úmida para limpar o peito. Certifique-se de remover todos os componentes restantes do creme (Figura 2A).
NOTA: Um aparador elétrico também pode ser usado antes da aplicação depilatória. O animal agora está preparado para imagens. Como é fundamental manter o tempo de imagem curto, toda a preparação antes da imagem deve levar menos de 3 min.
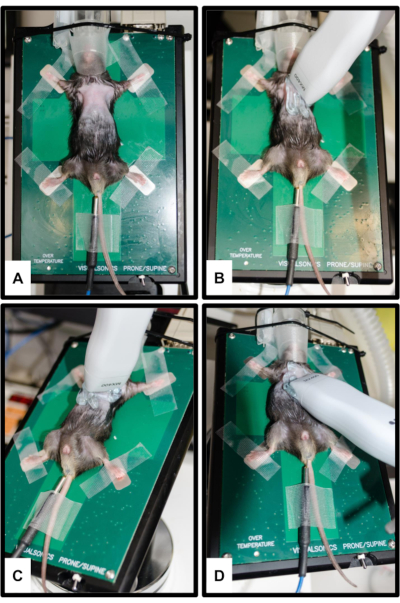
Figura 2: Posicionamento do animal e do transdutor. (A) O mouse é conectado à plataforma aquecida com todos os quatro membros fixados nos eletrodos de ECG de prata. Um termômetro retal é inserido para medição da temperatura corporal. O focinho é inserido suavemente no cone do nariz do sistema de anestesia. (B) Orientação da sonda para visão paraesternal de eixo longo (PSLAX); Consulte a etapa 3.2. (C) Orientação da sonda para visão de eixo curto paraesternal (PSSAX); Consulte a etapa 3.3. (D) Orientação da sonda para visão apical de quatro câmaras (4CH); Consulte a etapa 3.4. Clique aqui para ver uma versão maior desta figura.
3. Imagem cardiovascular básica
NOTA: As imagens podem ser adquiridas usando duas posições básicas do transdutor (janela de ultrassom paraesternal e apical) (Figura 2) e pelo menos três modalidades de ultrassom (modo B (correção), modo M (oção) e modo Doppler (doppler colorido e doppler de onda pulsada (PW)) (Figura 3, Figura 4, Figura 5). Para noções básicas de imagem, consulte os artigospublicados anteriormente 16,18. É fundamental obter imagens nítidas para a comparação com imagens de estresse adquiridas posteriormente.
- Aplique gel de ultrassom pré-aquecido sem bolhas no peito.
NOTA: O gel de ultrassom não aquecido resultará em rápida perda de temperatura corporal, o que afetará a frequência cardíaca. - Execute a visão do eixo longo paraesternal (PSLAX).
NOTA: O PSLAX é realizado para visualizar o VE em seu eixo longo. Com isso, por exemplo, as dimensões da raiz da aorta e a dimensão proximal da aorta, bem como o comprimento do VE, podem ser obtidas.- Com a cabeça voltada para longe do investigador, incline a mesa aproximadamente 10-20° para a esquerda e 5-10° para a frente para trazer o coração o mais anterior possível. Coloque o transdutor paraesternalmente alinhado com o eixo longo do coração com o marcador (entalhe) apontando para o ombro direito do animal (Figura 2B).
- Use micromanipuladores para ajustar a visualização ideal. Use os controles do painel de controle de imagem para otimizar a imagem. Adquira pelo menos uma imagem 2D no modo B e uma imagem no modo M no nível do ventrículo médio.
- Adquira quaisquer imagens adicionais, se necessário, para a pergunta específica. Adquira pelo menos 100 quadros e pelo menos 3 (-6) ciclos cardíacos completos.
- Execute a visão do eixo curto paraesternal (PSSAX).
NOTA: O PSSAX é realizado para visualizar o VE em seu eixo curto. A partir dessa visão, por exemplo, o volume sistólico final do ventrículo esquerdo (VSVEVE), o volume diastólico final do ventrículo esquerdo (VDVEVE), o volume sistólico (VS) e o débito cardíaco (DC) podem ser calculados.- Gire o transdutor 90° no sentido horário sem alterar a angulação (marcador agora apontando para o ombro esquerdo do animal) (Figura 2C). Adquira pelo menos uma imagem do modo B na visão basal, ventricular média (nível dos músculos papilares) e apical.
- Para definir a visão mais basal e a mais apical, role ao longo do eixo longo até os pontos mais distantes, onde o ciclo cardíaco completo da câmara do VE ainda é visível. Tire imagens no nível do ventrículo médio aproximadamente em uma posição intermediária ao nível dos músculos papilares.
- Adquira pelo menos uma imagem no modo M na visão do meio ventricular.
NOTA: Algumas máquinas de ultrassom fornecem predefinições para as diferentes visualizações; Recomenda-se verificar a predefinição adequada antes de adquirir imagens.
- Execute a visualização apical de quatro câmaras (4CH).
NOTA: O 4CH é importante porque pode ser usado principalmente para avaliar a válvula mitral usando o PW doppler.- Incline a plataforma para que o animal esteja em uma posição de Trendelenburg modificada com a cabeça baixa. Incline o transdutor em direção à cabeça do camundongo, o marcador voltado para o lado esquerdo do animal (Figura 2D).
- Adquira pelo menos uma imagem do modo B, bem como uma imagem doppler colorida e doppler PW da válvula mitral e tricúspide. Dependendo da questão experimental, aplique o doppler tecidual na visão 4CH.
NOTA: A maneira mais fácil de alcançar a posição apical 4CH é inclinar a mesa a partir do PSAX view e angular o transdutor. Tenha cuidado para não aplicar muita pressão no tórax, pois isso pode interferir nas medições, por exemplo, da função diastólica.
4. Imagem de estresse com dobutamina
NOTA: Assim que a frequência cardíaca alvo for atingida, as visualizações padronizadas devem ser adquiridas, desde que a frequência cardíaca alvo esteja estável. Isso normalmente requer mais de uma alternância entre PSLAX e PSSAX. Como a alternância entre PSLAX e PSSAX requer apenas uma rotação de 90°, as visualizações podem ser visualizadas facilmente.
- Realize testes de estresse de dobutamina em um mesmo animal mantendo a mesma anestesia para garantir a comparabilidade. Certifique-se de que a frequência cardíaca inicial permaneça estável na faixa de 400-450 bpm. Registre as leituras de ECG e salve-as junto com e sobre as imagens adquiridas. Certifique-se de que o sinal de ECG esteja claro. Caso contrário, tente recolocar fita adesiva em todos os quatro membros até que um sinal claro de ECG seja exibido.
- Novamente, execute a visualização PSLAX (imagens no modo B e no modo M). Salve as imagens como imagem de "linha de base". Certifique-se de salvar e ter em mente a frequência cardíaca inicial também.
- Encha previamente a seringa e injete 5 μg/g de peso corporal de dobutamina por via intraperitoneal utilizando uma agulha de 27 G e uma seringa de 1 ml. Observe atentamente a frequência cardíaca. Registre imagens ecocardiográficas até que a frequência cardíaca alvo seja atingida e use o aumento da frequência cardíaca para análise posterior. Um aumento significativo sustentável da frequência cardíaca induzida pela dobutamina é alcançado após um aumento de 15-30% após cerca de 1 min, dependendo da dose de dobutamina.
NOTA: Sempre use agulhas de injeção estéreis de uso único para todos os animais para evitar infecções. A suscetibilidade à dobutamina e a carga (sub)máxima podem variar com a estirpe do ratinho e podem depender da configuração experimental e devem ser definidas em pré-experiências. Recomenda-se ajustar a dose de dobutamina à configuração experimental.
CUIDADO: Siga as diretrizes institucionais para o uso de itens cortantes e potencialmente infecciosos. Sempre descarte a agulha em um recipiente de lixo médico aprovado! - Quando a frequência cardíaca alvo for atingida e permanecer estável por aproximadamente 30 s, adquira imagens PSLAX no modo B e no modo M conforme descrito na etapa 3.
- Novamente, gire o transdutor no sentido horário para obter PSSAX view conforme descrito na etapa 3. Aqui, adquira imagens do modo B do nível basal, médio (nível dos músculos papilares) e apical e imagens do modo M do nível médio (nível dos músculos papilares). Tranquilize, que a frequência cardíaca alvo permanece estável. Caso contrário, volte para a posição PSLAX e inicie a geração de imagens novamente.
NOTA: Como a frequência cardíaca cairá sem infusão contínua de dobutamina12 (não abordada neste artigo), as imagens devem ser adquiridas em dois minutos. As imagens PSLAX e PSSAX são essenciais para a maioria das medições relevantes induzidas por estresse (consulte a seção "Resultados representativos"). - Agora, execute a visualização apical de 4CH novamente (conforme explicado na etapa 3.4.). Usando o PW doppler, meça os padrões de fluxo de interesse (conforme explicado na etapa 3.4.2.). Em condições não tensionadas, duas ondas características são medidas usando o doppler PW, uma representando o enchimento passivo do ventrículo (onda E(arly)) e outra representando o enchimento ativo após a contração atrial (onda A(trial)). Com o aumento da frequência cardíaca, essas ondas tendem a se fundir e podem não ser mensuráveis distintamente sob estresse induzido por dobutamina.
5. Passos finais
- Após aproximadamente 5 minutos, quando a frequência cardíaca começar a diminuir novamente, certifique-se de que todas as visualizações sejam capturadas.
- Remova suavemente o gel de ultrassom do peito usando uma toalha de papel limpa e úmida. Remova cuidadosamente a fixação da fita. Preste atenção especial à fita adesiva que fixa a cabeça do animal para evitar arrancar os bigodes.
- Desligue a anestesia. Se estiver usando um escapamento de gás ativo, certifique-se de continuar a exaustão de gás. Coloque o animal em uma toalha de papel em uma gaiola aquecida separada durante o período de despertar. Observe o animal de perto. Não deve ser deixado sem vigilância até que tenha recuperado a consciência suficiente para manter a decúbito esternal. Uma vez acordado e totalmente recuperado, transfira o animal para sua gaiola.
NOTA: Devido ao caráter não final desta técnica, o animal pode permanecer dentro do experimento de acordo com todos os regulamentos relevantes.
6. Avaliação offline
- Transfira os dados da imagem para o software de análise off-line em uma estação de trabalho para realizar uma avaliação detalhada da função cardíaca. Preste atenção especial à diferença entre a função cardíaca não estressada e estressada. A frequência cardíaca deve sempre ser registrada e apresentada.
NOTA: Como a análise de software varia entre diferentes softwares, ela não é abordada neste protocolo. Consulte as instruções do fabricante.
Resultados
Uma imagem ecocardiográfica fisiológica não tensionada adquirida no PSLAX é mostrada na Figura 3. Na diástole, as paredes do ventrículo aparecem uniformemente (Figura 3A) e engrossam até certo ponto (Figura 3B, C). A injeção de 5 μg/g de dobutamina i.p. em peso corporal leva a um aumento significativo da freqüência cardíaca (efeito crono...
Discussão
A avaliação da função cardíaca induzida por estresse é amplamente utilizada em humanos em um ambiente clínico usando teste ergométrico ou teste de estresse farmacológico 6,7. Como a ecocardiografia pós-exercício imediata de camundongos é muito limitada devido à necessidade de sedação, a ecocardiografia de estresse induzida por dobutamina provavelmente é o método mais translacional para avaliar a fisiopatologia ca...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores reconhecem as seguintes fontes de financiamento: Fundação Alemã de Pesquisa (UMEA Junior Clinician Scientist, Stephan Settelmeier; RA 969 / 12-1, Tienush Rassaf; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Materiais
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
Referências
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110 (2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219 (2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447 (2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618 (2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110 (2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738 (2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629 (2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621 (2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646 (2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7 (2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados