JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스에서 경흉부 도부타민 스트레스 심초음파를 사용하여 심장 기능의 미묘한 변화를 밝히기
요약
좌심실 기능 장애는 여러 심장 질환의 최종 공통 경로를 구성합니다. 여기에서는 심장 질환 마우스 모델의 좌심실 기능과 심장 표현형을 종합적으로 평가하기 위해 경흉부 도부타민 스트레스 심초음파 접근법에 대한 자세한 프로토콜을 제공합니다.
초록
좌심실(LV) 기능 장애는 다양한 심장 질환의 최종 경로를 열어줍니다. 인간의 비침습적 고주파 경흉부 도부타민 스트레스 심초음파를 통해 심장 기능의 미묘한 변화를 밝히기 위한 환원주의적 조사 접근 방식이 가능해졌습니다. 여기에서는 생리학 및 병리학에서 좌심실 구조 및 기능에 대한 확장된 분석을 용이하게 하기 위해 마우스에서 이 기술을 사용하기 위한 프로토콜을 제공하여 스트레스를 받지 않은 심장에 숨겨진 심장 질환 모델의 변화를 관찰할 수 있도록 합니다. 이 조사는 하나의 동일한 동물에서 수행할 수 있으며 기저 및 약리학적으로 스트레스 유발 측정을 모두 수행할 수 있습니다. 적절한 마취, 영상 기반 LV 분석, 관찰자 내 및 관찰자 간 변동성 고려, 가까운 생리학적 조건에서 도부타민의 복강 내 주사 후 마우스에서 얻을 수 있는 양성 수축 반응 획득에 대한 자세한 기준을 간략하게 설명합니다. 소동물 모델에서 인간의 생리학과 질병의 특성을 다시 요약하기 위해, 우리는 평가의 중요한 함정, 예를 들어 쥐에서 뚜렷한 보우디치 효과(Bowditch effect)를 강조합니다. 번역 목표를 더욱 달성하기 위해 인간과 생쥐의 스트레스 유발 효과를 비교합니다. 중개 연구에 사용할 때는 생쥐와 인간의 생리학적 차이에 주의를 기울여야 합니다. 실험적 엄격함으로 인해 환자에서 평가된 일부 매개변수는 마우스 모델의 공간 및 시간 해상도의 제한으로 인해 주의해서만 사용할 수 있습니다.
서문
인간에게 나타나는 많은 심장 질환의 특징은 좌심실(LV)의 수축기 및/또는 이완기 기능 장애입니다. 심부전 증상이 있는 환자의 이완기 기능 평가뿐만 아니라 수축기 심부전의 구조적 이상 감지, 진단 및 관리를 위해 심장초음파가 기본 평가 방식으로 사용됩니다.
증상이 비특이적이고 임상적 심부전 증후군 환자의 1/3 이상이 실제 심부전을 앓고 있지 않을 수 있기 때문에 환자의 임상적 양상에 대한 객관적인 심초음파학적 상관관계를 찾는 것이 중요하다1. 더욱이, 휴지 상태나 정지 상태에서의 신비로운 일부 증상은 활동이나 스트레스 상태에서 발생할 수 있다. 관상동맥 질환이 있는 환자의 경우, 이미 관상동맥 관류의 경미한 변화만으로도 국소 벽 운동 이상이 발생할 수 있습니다. 그러나 이러한 미묘한 변화는 스트레스를 받지 않은 심장에 심장 질환의 변화가 숨겨져 있을 수 있기 때문에 기존의 심장초음파검사로는 평가할 수 없습니다. 심장 생리병리학에 대한 더 깊은 이해를 얻기 위해 스트레스 심장초음파검사는 운동 또는 약리학적 유발 스트레스 조건에서 심근 구조 및 기능에 대한 동적 평가를 제공하여 증상을 심장 소견과 일치시킬 수 있도록 합니다2. 또한, 작은 동물에서, 이 방법은 비침습적이고 신뢰할 수 있는 생체 내 도구(in-vivo tool)를 나타낸다 3,4,5. 인간과 마찬가지로 심근의 스트레스 반응은 생쥐와 쥐의 약리학적 제제를 통해 유도될 수 있습니다. 도부타민은 자주 사용되는 약물이며 도부타민 스트레스 심장 초음파 검사는 인간에서 널리 수행되지만 6,7 심장 스트레스 반응을 평가하기 위해 소동물 모델에서만 가끔 사용됩니다 8,9,10,11. 도부타민은 주로 β1 작용 효과를 가진 합성 카테콜아민으로 심장의 양성 수축성 및 크로노트로피를 초래합니다. 사람에서 마우스로의 정확한 번역을 달성하기 위해서는 심초음파의 기술 및 개념적 프레임워크, 예를 들어 마우스의 작은 크기와 빠른 심박수와 관련된 기술적 한계를 고려해야 합니다. 도부타민 스트레스 심초음파에서 인간 목표 심박수는 [(220-age) x 0.85]이며, 건강한 지원자에서 평균 심박수가 약 150 ± 10% 증가한다12,13. 쥐의 경우 이러한 공식이 없습니다. 박출률(EF)은 인간의 스트레스 심초음파에 의해 5-20% 증가하는 것으로 설명됩니다12,14. 생쥐의 EF는 심박수에 따라 58 ± 11%(< 450bpm)에서 71± 11%(≥ 450bpm) 사이에서 보고되며 심박수가 높을수록 거의 20% 변화합니다4. 심박출량을 증가시키는 생쥐의 주요 메커니즘은 심박수의 증가입니다. 이 메커니즘에 부분적으로 책임이 있는 것은 Bowditch 효과 또는 계단 현상, 빈도 의존적 칼슘 매개 양성 수축성 심장 반응으로, 인간보다 생쥐에서 더 두드러집니다15,16. 또한, (스트레스) 심장초음파는 관찰자 내 및 관찰자 간 변동성의 기초가 됩니다. 따라서 고도로 표준화된 절차가 필수적입니다17,18.
여기에서는 건강 및 질병 모델에서 마우스의 심장 기능의 미묘한 변화를 풀기 위해 표준화된 이미지를 획득하기 위한 도부타민 스트레스 심초음파의 자세한 절차를 제시합니다. 주요 구성 요소에는 적절한 마취, 적절한 심박수 모니터링 및 생쥐의 스트레스 유발 이미징에서 발생할 수 있는 함정이 포함됩니다. 주요 매개변수는 LVEF에 대한 고려를 포함한 수축기 및 이완기 기능의 평가입니다. 마우스는 후부하로 인한 심장 기능 장애에 내성이 있기 때문에17, 이 프로토콜은 심장 판막 질환 모델에도 사용할 수 있는 귀중한 정보를 추가할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 방법과 절차는 모든 관련 규정('실험 및 기타 과학적 목적으로 사용되는 척추 동물 보호를 위한 유럽 협약'(지침 2010/63/EU))에 따라 수행되었으며 동물 관리는 기관 지침에 따라 수행되었습니다. 인간 피험자의 데이터는 인간 복지를 위한 모든 제도적, 국가적, 국제적 지침에 따라 분석되었으며 지역 윤리 위원회(20-9218-BO)의 승인을 받았습니다. 모든 실험은 12주 령의 수컷 C57BL/6JRj를 대상으로 수행되었습니다.
1. 재료 및 장비 준비
참고: 그림 1 은 소동물 초음파 작업장의 예를 보여줍니다.
- 밝기를 조절할 수 있는 조명이 있는 조용하고 통제된 환경에서 작동하는지 확인하십시오.
- 초음파 젤을 예열합니다(예: 젤 워머를 사용). 젤을 37 °C로 예열합니다. 시간이 걸릴 수 있습니다.
- 플랫폼을 포함한 모든 기구를 소독용 물티슈로 청소하십시오.
- 전원을 켜고 플랫폼을 37°C로 예열합니다.
- 초음파 기계를 켭니다. 동물 ID 및 프로토콜 ID 및 기타 관련 정보를 입력합니다. 체중이 약 30g인 마우스의 경우 중심 전송이 30MHz인 고주파 초음파 변환기를 사용합니다.
- 활성 가스 배기 시스템으로 작업해야 합니다.
알림: 내쉬는 흐름에서 이소플루란을 흡착하기 위해 활성탄 필터를 사용하는 경우 무게를 확인하고 표시된 최대 무게 증가에 도달하면 필터를 교체하십시오. - 필요한 경우 기화기에 적절한 양의 이소플루란을 채웁니다.
주의 : 휘발성 마취제를 흡입하지 마십시오. - 즉시 사용 가능한 주사 용액을 희석하거나 제조업체의 지침에 따라 도부타민 염산염 분말을 0.9% 식염수에 용해하여 2.5μg/μL의 도부타민 작업 용액을 준비합니다. 용액은 실온에서 보관할 때 최소 24시간 동안 안정적입니다.

그림 1: 소동물 심장 초음파 작업장. 인체공학적 환경은 검사 시간이 짧아야 하기 때문에 소동물 스트레스 심초음파검사에 필수적입니다. 작업장은 초음파 기계, 산소 공급 및 활성 가스 배출 기능이 있는 소동물 마취 시스템, ECG가 내장된 가열식 심장 초음파 플랫폼, 통합 철도 시스템의 일부인 미세 조작기를 통한 이동 기능 및 생리학적 모니터링 장치로 구성됩니다. 젤 워머에서 데우는 초음파 젤과 열 램프는 유용한 보조 도구입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 마취의 화상 진찰 그리고 감응작용을 위한 쥐의 준비
- 산소가 풍부한 가스 혼합물에서 유도 챔버를 3%-4% v/v 이소플루란으로 채웁니다(1L/min 100% O2).
- 마우스의 무게를 잰다. 마우스의 꼬리를 부드럽게 잡고 인덕션 챔버로 옮깁니다. 동물의 움직임을 면밀히 관찰하여 몇 초 이내에 동물이 진정되었는지 확인하십시오.
- 필요한 경우 마취 시스템에 연결된 콧방울로 가스 흐름을 변경합니다(안정적인 진정을 유지하기 위해 1L/min 100% O2 와 1.0-1.5 vol% 이소플루란). 인덕션 챔버에서 마우스를 제거하고 예열된 플랫폼에 조심스럽게 놓습니다. 플랫폼에 내장된 ECG 센서에 발이 있는지 확인합니다.
- 공막의 건조를 방지하려면 양쪽 눈에 연고 젤을 바르십시오.
알림: 응력 측정에는 시간이 걸립니다. - ECG 센서에 아주 적은 양의 전극 크림을 바르십시오. 접착 테이프로 동물의 네 팔다리를 부드럽게 고정합니다. 접착 테이프의 작은 부분을 사용하여 노즈 콘에서 동물의 머리 위치를 고정합니다. ECG는 이미지 획득 중 심박수를 기록하는 데 사용됩니다. 안정적이고 선명한 ECG 신호를 위해 생리학적 이미징 시스템을 조정합니다.
알림: 전극 크림을 너무 많이 사용하면 ECG 신호 품질이 나빠질 수 있습니다. - 시술 중 동물을 스트레스로부터 보호하려면 심박수 범위를 400-450bpm으로 유지하여 적절한 진정 깊이를 확인하십시오. 심박수는 ECG에 의해 얻어집니다. 범위 내에서 50bpm의 변동이 허용됩니다.
참고: 동물의 움직임은 진정 수준이 너무 좁다는 것을 나타낼 수 있습니다. 마취가 마우스의 심장 우울증으로 이어져서는 안 됩니다. 진정제는 위에서 언급한 목표 심박수를 얻기 위해 조정될 수 있습니다. - 윤활제를 사용하여 직장 체온계를 부드럽게 삽입하여 체온을 지속적으로 모니터링합니다. 온도를 생리학적 범위(마우스 변형 및 실험 설정에 따라 일반적으로 36.5°C에서 37.5°C 사이)로 유지하십시오. 환경적으로 통제되지 않는 동물 심장 초음파 실험실에서는 적외선 조명의 사용을 고려할 수 있습니다.
- 화학 제모 크림을 사용하여 가슴에서 체모를 제거합니다. 깨끗하고 젖은 종이 타월을 사용하여 가슴을 깨끗이 닦습니다. 남아 있는 모든 크림 성분을 제거해야 합니다(그림 2A).
알림: 전기 클리퍼는 제모 전에도 사용할 수 있습니다. 이제 동물은 이미징을 할 준비가 되었습니다. 이미징 시간을 짧게 유지하는 것이 중요하므로 이미징 전 전체 준비는 3분 미만이 소요되어야 합니다.
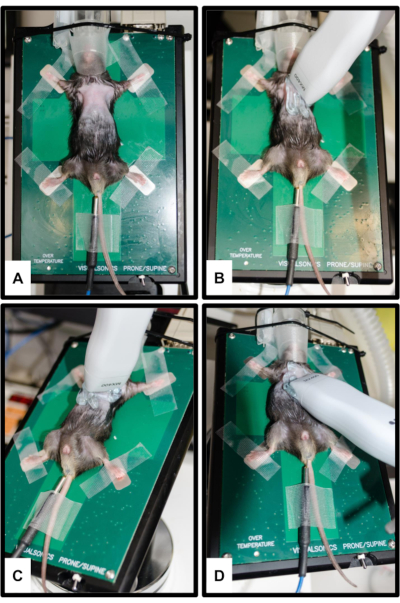
그림 2: 동물 및 변환기 위치.(A) 마우스는 4개의 팔다리가 모두 은색 ECG 전극에 고정된 상태로 가열된 플랫폼에 부착됩니다. 체온 측정을 위해 직장 체온계가 삽입됩니다. 주둥이는 마취 시스템의 콧방울에 부드럽게 삽입됩니다. (B) 흉골 주위 장축 보기(PSLAX)를 위한 프로브 방향; 3.2단계를 참조하십시오. (C) 흉골 주위 단축 보기(PSSAX)를 위한 프로브 방향; 3.3단계를 참조하십시오. (D) 정점 4 챔버 뷰 (4CH)에 대한 프로브 방향; 3.4단계를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 기본 심혈관 영상
참고: 두 개의 기본 변환기 위치(주위 흉골 및 정점 초음파 창)(그림 2)와 최소 세 가지 초음파 양식(B(올바름) 모드, M(otion) 모드 및 도플러 모드(컬러 도플러 및 펄스파(PW) 도플러))를 사용하여 이미지를 획득할 수 있습니다(그림 3, 그림 4, 그림 5). 이미징의 기초는 이전에 발표된 논문16,18을 참조하십시오. 나중에 획득한 응력 이미지와 비교하기 위해 선명한 이미지를 얻는 것이 중요합니다.
- 예열된 초음파 젤을 거품이 나지 않게 가슴에 바릅니다.
알림: 가열되지 않은 초음파 젤은 심박수에 영향을 미치는 급격한 체온 손실을 초래합니다. - 흉골 주위 장축(PSLAX) 보기를 수행합니다.
참고: PSLAX는 장축에서 LV를 시각화하기 위해 수행됩니다. 이를 통해, 예를 들어, 대동맥근 치수와 근위 대동맥 치수, LV 길이를 얻을 수 있습니다.- 머리가 조사관과 반대쪽을 향하게 하고 테이블을 왼쪽으로 약 10-20°, 앞쪽으로 5-10° 기울여 심장을 가능한 한 앞쪽으로 가져옵니다. 동물의 오른쪽 어깨를 가리키는 마커(노치)가 있는 심장의 긴 축과 일직선으로 변환기를 parasternally 배치합니다(그림 2B).
- 마이크로 매니퓰레이터를 사용하여 최적의 보기를 조정합니다. 이미지 제어판 컨트롤을 사용하여 이미지를 최적화합니다. 심실 수준에서 하나 이상의 2D B 모드 사진과 하나의 M 모드 사진을 획득합니다.
- 특정 질문에 필요한 경우 추가 이미지를 획득합니다. 최소 100개의 프레임과 최소 3(-6)개의 전체 심장 주기를 획득합니다.
- PSSAX(parasternal short axis) 보기를 수행합니다.
참고: PSSAX는 짧은 축에서 LV를 시각화하기 위해 수행됩니다. 이러한 관점에서, 예를 들어, 좌심실 수축기 말단 용적량(LVESV), 좌심실 이완기 말단 용적량(LVEDV), 뇌졸중 용적(SV) 및 심박출량(CO)을 계산할 수 있습니다.- 각도를 변경하지 않고 변환기를 시계 방향으로 90° 회전합니다(이제 마커가 동물의 왼쪽 어깨를 가리킴)(그림 2C). 기저부, 중뇌실(유두근 수준) 및 정점 보기에서 하나 이상의 B-모드 이미지를 획득합니다.
- 가장 기저부(basal)와 가장 정점(most-apical) 보기를 정의하려면 장축을 따라 LV 챔버의 전체 심장 주기가 여전히 보이는 가장 먼 지점까지 스크롤합니다. 유두 근육 수준의 중간 위치에서 중심실 수준에서 이미지를 촬영합니다.
- 중심실 보기에서 하나 이상의 M-모드 이미지를 획득합니다.
알림: 일부 초음파 기계는 다양한 view; 이미지를 획득하기 전에 적절한 사전 설정을 확인하는 것이 좋습니다.
- 정점 4챔버(4CH) 보기를 수행합니다.
참고: 4CH는 주로 PW 도플러를 사용하여 승모판막을 평가하는 데 사용할 수 있기 때문에 중요합니다.- 동물이 머리를 아래로 향하게 한 상태에서 수정된 트렌델렌부르크 위치에 있는 플랫폼을 기울입니다. 변환기를 마우스의 머리 쪽으로 각도를 맞추고 마커는 동물의 왼쪽을 향하게 합니다(그림 2D).
- 하나 이상의 B-모드 이미지와 승모판 및 삼첨판 판막의 컬러 도플러 및 PW 도플러 이미지를 획득합니다. 실험 질문에 따라 4CH 뷰에서 조직 도플러를 적용합니다.
참고: 정점 4CH 위치에 도달하는 가장 쉬운 방법은 PSAX 보기에서 테이블을 기울이고 변환기를 각도를 조정하는 것입니다. 흉부에 너무 많은 압력을 가하면 이완기 기능 측정과 같은 측정을 방해할 수 있으므로 주의해야 합니다.
4. 도부타민 스트레스 이미징
알림: 목표 심박수에 도달하면 목표 심박수가 안정적인 한 표준화된 보기를 획득해야 합니다. 이를 위해서는 일반적으로 PSLAX와 PSSAX 간에 두 개 이상의 스위치가 필요합니다. PSLAX와 PSSAX 간의 전환은 90° 회전만 필요하기 때문에 뷰를 쉽게 이미지화할 수 있습니다.
- 비교 가능성을 보장하기 위해 동일한 마취를 유지하는 동일한 동물에서 도부타민 스트레스 테스트를 수행합니다. 시작 심박수가 400-450bpm 범위에서 안정적으로 유지되는지 확인하십시오. ECG 판독값을 기록하고 획득한 이미지와 함께 저장합니다. ECG 신호가 깨끗한지 확인하십시오. 그렇지 않으면 명확한 ECG 신호가 표시될 때까지 네 팔다리를 모두 테이프로 다시 감으십시오.
- 다시 PSLAX 보기(B 모드 및 M 모드 이미지)를 수행합니다. 이미지를 "기준선" 이미지로 저장합니다. 초기 심박수도 저장하고 염두에 두십시오.
- 주사기를 미리 채우고 27G 바늘과 1mL 주사기를 사용하여 5μg/g의 체중 도부타민을 복강내로 주입합니다. 심박수를 면밀히 관찰하십시오. 목표 심박수에 도달할 때까지 심초음파 이미지를 기록하고 나중에 분석할 수 있도록 심박수 증가를 사용합니다. 도부타민 용량에 따라 약 1분 후 15-30% 증가한 후 지속 가능한 상당한 도부타민 유도 심박수 증가에 도달합니다.
알림: 감염을 방지하기 위해 모든 동물에게 항상 일회용 멸균 주삿바늘을 사용하십시오. 도부타민 민감도 및 (이하)최대 부하는 마우스 균주에 따라 달라질 수 있으며 실험 설정에 따라 달라질 수 있으며 사전 실험에서 정의해야 합니다. 도부타민 투여량을 실험 설정에 맞게 조정하는 것이 좋습니다.
주의: 날카롭고 잠재적인 감염 물질의 사용에 대한 기관 지침을 따르십시오. 바늘은 항상 승인된 의료 폐기물 용기에 폐기하십시오! - 목표 심박수에 도달하고 약 30초 동안 안정적으로 유지되면 3단계에서 설명한 대로 PSLAX B 모드 및 M 모드 이미지를 획득합니다.
- 다시 변환기를 시계 방향으로 회전하여 3단계에서 설명한 대로 PSSAX 보기를 얻습니다. 여기에서 기저부, 중심실(유두근 수준) 및 정점 수준의 B 모드 이미지와 중심실(유두 근육 수준) 수준의 M 모드 이미지를 획득합니다. 목표 심박수가 안정적으로 유지되는지 확인합니다. 그렇지 않으면 PSLAX 위치로 다시 전환하고 이미징을 다시 시작하십시오.
참고: 도부타민12 (이 기사에서 다루지 않음)를 지속적으로 주입하지 않으면 심박수가 떨어지므로 이미지는 2분 이내에 획득해야 합니다. PSLAX 및 PSSAX 이미지는 대부분의 관련 응력 유발 측정에 필수적입니다("대표 결과" 섹션 참조). - 이제 정점 4CH 보기를 다시 수행합니다(3.4단계에서 설명한 대로). PW 도플러를 사용하여 관심 있는 흐름 패턴을 측정합니다(3.4.2단계에서 설명). 스트레스가 없는 조건에서 PW 도플러를 사용하여 두 개의 특징적인 파동을 측정하는데, 하나는 심실의 수동 충전(E(arly)파)를 나타내고 다른 하나는 심방 수축 후 활성 충전(A(trial)파)을 나타냅니다. 심박수가 증가함에 따라 이러한 파동은 융합되는 경향이 있으며 도부타민으로 인한 스트레스 하에서는 뚜렷하게 측정되지 않을 수 있습니다.
5. 마지막 단계
- 약 5분 후 심박수가 다시 감소하기 시작하면 모든 보기가 캡처되었는지 확인합니다.
- 깨끗하고 젖은 종이 타월을 사용하여 가슴에서 초음파 젤을 부드럽게 제거합니다. 테이프 고정 장치를 조심스럽게 제거하십시오. 수염이 뽑히지 않도록 동물의 머리를 고정하는 테이프에 특히 주의하십시오.
- 마취를 끕니다. 활성 가스 배기 가스를 사용하는 경우 가스 배출을 계속해야 합니다. 기상 시간 동안 분리된 가열된 케이지에 종이 타월 위에 동물을 놓습니다. 동물을 자세히 관찰하십시오. 흉골 누운 자세를 유지할 수 있을 만큼 충분한 의식을 회복할 때까지 방치해서는 안 됩니다. 깨어나 완전히 회복되면 동물을 우리로 옮깁니다.
참고: 이 기술의 최종적이지 않은 특성으로 인해 동물은 모든 관련 규정에 따라 실험 내에 머물 수 있습니다.
6. 오프라인 평가
- 이미지 데이터를 작업 스테이션의 오프라인 분석 소프트웨어로 전송하여 심장 기능에 대한 자세한 평가를 수행합니다. 스트레스를 받지 않은 심장 기능과 스트레스를 받은 심장 기능의 차이에 특히 주의하십시오. 심박수는 항상 기록되고 표시되어야 합니다.
참고: 소프트웨어 분석은 소프트웨어마다 다르기 때문에 이 프로토콜에서 다루지 않습니다. 제조업체의 지침을 참조하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
PSLAX에서 획득한 생리학적 무스트레스 심초음파영상이 그림 3에 나와 있습니다. 이완기에서는 심실 벽이 균일하게 나타나고(그림 3A) 어느 정도 두꺼워집니다(그림 3B, C). 체중 5μg/g의 도부타민 i.p.를 주사하면 심박수(positive chronotropic effect)12 및 LVEF(po...
Access restricted. Please log in or start a trial to view this content.
토론
스트레스에 의한 심장 기능 평가는 운동 검사 또는 약리학적 스트레스 검사를 사용하는 임상 환경에서 인간에게 널리 사용됩니다 6,7. 생쥐의 운동 직후 심초음파검사는 진정제의 필요성으로 인해 매우 제한적이기 때문에 도부타민 유발 스트레스 심초음파검사는 스트레스 유발 심장 생리병리를 평가하는 가장 효과적인 방법이...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 내용이 없습니다.
감사의 말
저자는 다음과 같은 자금 출처를 인정합니다 : 독일 연구 재단 (UMEA Junior Clinician Scientist, Stephan Settelmeier; RA 969/12-1, 티에누시 라사프; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
참고문헌
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110(2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219(2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447(2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618(2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110(2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738(2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629(2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, suppl_D 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621(2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, Suppl 1 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646(2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7(2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유