Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Révéler des changements subtils de la fonction cardiaque à l’aide de l’échocardiographie transthoracique de stress à la dobutamine chez la souris
Dans cet article
Résumé
La dysfonction ventriculaire gauche constitue la dernière voie commune à une foule de troubles cardiaques. Nous fournissons ici un protocole détaillé de l’approche d’échocardiographie transthoracique de stress à la dobutamine pour une évaluation complète de la fonction ventriculaire gauche de modèles murins de maladies cardiaques ainsi que du phénotypage cardiaque.
Résumé
Le dysfonctionnement ventriculaire gauche (VG) ouvre la voie finale à une multitude de troubles cardiaques. Avec l’échocardiographie de stress transthoracique non invasive à haute fréquence à la dobutamine chez l’homme, une approche d’investigation réductionniste pour démasquer les changements subtils de la fonction cardiaque est devenue possible. Ici, nous fournissons un protocole pour l’utilisation de cette technique chez la souris afin de faciliter une analyse élargie de l’architecture et de la fonction du VG en physiologie et en pathologie permettant l’observation d’altérations dans des modèles de maladies cardiaques cachées dans des cœurs non stressés. Cette investigation peut être réalisée chez un seul et même animal et permet des mesures à la fois induites par le stress basal et pharmacologique. Nous décrivons des critères détaillés pour une anesthésie appropriée, une analyse VG basée sur l’imagerie, la prise en compte de la variabilité intra- et inter-observateur et l’obtention d’une réponse inotrope positive qui peut être obtenue chez la souris après une injection intrapéritonéale de dobutamine dans des conditions physiologiques proches. Pour récapituler les caractéristiques de la physiologie humaine et de la maladie dans les modèles de petits animaux, nous soulignons les pièges critiques de l’évaluation, par exemple, un effet Bowditch prononcé chez la souris. Pour répondre davantage aux objectifs translationnels, nous comparons les effets induits par le stress chez l’homme et la souris. Lorsqu’il est utilisé dans des études translationnelles, une attention particulière doit être portée aux différences physiologiques entre la souris et l’homme. La rigueur expérimentale dicte que certains paramètres évalués chez les patients ne peuvent être utilisés qu’avec prudence en raison des restrictions de résolution spatiale et temporelle dans les modèles murins.
Introduction
La caractéristique de nombreuses maladies cardiaques chez l’homme est une déficience fonctionnelle systolique et/ou diastolique du ventricule gauche (VG). Pour la détection d’anomalies structurelles, le diagnostic et la prise en charge de l’insuffisance cardiaque systolique ainsi que l’évaluation de la fonction diastolique chez les patients présentant des symptômes d’insuffisance cardiaque, l’échocardiographie est utilisée comme modalité d’évaluation fondamentale.
Étant donné que les symptômes ne sont pas spécifiques et que plus d’un tiers des patients atteints du syndrome clinique de l’insuffisance cardiaque peuvent ne pas souffrir de l’insuffisance cardiaque réelle, il est important de trouver un corrélat échocardiographique objectif pour la présentation clinique du patient1. De plus, certains symptômes occultes à l’état de repos ou statique peuvent survenir dans des conditions d’activité ou de stress. Chez les patients atteints d’une maladie coronarienne, des changements déjà mineurs dans la perfusion coronaire peuvent entraîner des anomalies régionales du mouvement de la paroi. Cependant, ces changements subtils ne peuvent pas être évalués à l’aide de l’échocardiographie conventionnelle, car les altérations des maladies cardiaques peuvent être cachées dans les cœurs non stressés. Pour mieux comprendre la physiopathologie cardiaque, l’échocardiographie de stress fournit une évaluation dynamique de la structure et de la fonction du myocarde dans des conditions d’exercice ou de stress induit par la pharmacologie, ce qui permet de faire correspondre les symptômes aux résultats cardiaques2. De plus, chez les petits animaux, cette méthode représente un outil in-vivo non invasifet fiable 3,4,5. Comme chez l’homme, la réaction de stress du myocarde peut être induite par des agents pharmacologiques chez la souris et le rat. La dobutamine est un médicament fréquemment utilisé et l’échocardiographie de stress à la dobutamine est largement réalisée chez l’homme 6,7, mais seulement parfois utilisée dans de petits modèles animaux pour évaluer la réaction au stress cardiaque 8,9,10,11. La dobutamine est une catécholamine synthétique avec un effet principalement β1-agoniste entraînant une inotropie et une chronotropie positives du cœur. Pour obtenir une traduction correcte de l’homme à la souris, la technologie et le cadre conceptuel de l’échocardiographie, les limitations techniques liées par exemple à la petite taille et à la fréquence cardiaque rapide de la souris doivent être prises en compte. La fréquence cardiaque cible humaine dans l’échocardiographie de stress à la dobutamine est de [(220-âge) x 0,85], ce qui entraîne une augmentation moyenne de la fréquence cardiaque d’environ 150 ± 10 % chez les volontaires en bonne santé12,13. Pour les souris, une telle formule fait défaut. La fraction d’éjection (FE) est décrite comme étant augmentée par l’échocardiographie de stress chez l’homme de 5 à 20 %12,14. La FE chez la souris est, en fonction de la fréquence cardiaque, rapportée entre 58 ± 11 % (< 450 bpm) et 71 ± 11 % (≥ 450 bpm) et change de près de 20 % avec des fréquences cardiaques plus élevées4. Le principal mécanisme chez la souris pour augmenter le débit cardiaque est une augmentation de la fréquence cardiaque. Ce mécanisme est en partie responsable de l’effet Bowditch ou phénomène d’escalier, une réponse cardiaque inotrope positive médiée par le calcium dépendant de la fréquence, qui est plus prononcée chez la souris que chez l’homme15,16. De plus, l’échocardiographie (de stress) est à l’origine de la variabilité intra et inter-observateur. Par conséquent, une procédure hautement normalisée est indispensable17,18.
Nous présentons ici la procédure détaillée de l’échocardiographie de stress à la dobutamine pour acquérir des images standardisées afin de démêler les changements subtils de la fonction cardiaque chez la souris dans des modèles de santé et de maladie. Les éléments clés comprennent une anesthésie adéquate, une surveillance adéquate de la fréquence cardiaque et les pièges possibles de l’imagerie induite par le stress chez la souris. Les paramètres clés sont l’évaluation de la fonction systolique et diastolique, y compris la prise en compte de la FEVG. Étant donné que les souris sont résistantes à la dysfonction cardiaque induite par la postcharge17, ce protocole peut ajouter des informations précieuses pour l’utilisation dans des modèles de cardiopathie valvulaire.
Protocole
Toutes les méthodes et procédures ont été mises en œuvre conformément à toutes les réglementations pertinentes (« Convention européenne pour la protection des animaux vertébrés utilisés à des fins expérimentales et à d’autres fins scientifiques » (Directive 2010/63/UE) et les soins aux animaux ont été effectués conformément aux directives institutionnelles. Les données provenant de sujets humains ont été analysées conformément à toutes les directives institutionnelles, nationales et internationales en matière de bien-être humain et ont été approuvées par le Comité d’éthique local (20-9218-BO). Toutes les expériences ont été réalisées avec des hommes C57BL/6JRj à l’âge de 12 semaines.
1. Préparation des matériaux et des équipements
REMARQUE : La figure 1 montre un exemple de lieu de travail pour l’échographie de petits animaux.
- Assurez-vous de fonctionner dans un environnement silencieux et contrôlé avec une lumière à intensité variable.
- Préchauffez le gel à ultrasons, par exemple à l’aide d’un chauffe-gel. Laissez le gel se réchauffer à 37 °C. Cela peut prendre un certain temps.
- Nettoyez tous les instruments, y compris la plate-forme, avec une lingette désinfectante.
- Allumez et préchauffez la plate-forme à 37 °C.
- Allumez l’échographe. Entrez l’identifiant de l’animal et l’identifiant du protocole ainsi que d’autres informations pertinentes. Utilisez un transducteur à ultrasons haute fréquence avec une transmission centrale de 30 MHz pour les souris pesant environ 30 g de poids corporel.
- Assurez-vous de travailler avec un système d’échappement des gaz actif.
REMARQUE : Si vous utilisez un filtre à charbon actif pour adsorber l’isoflurane dans le flux expiré, assurez-vous de vérifier le poids et de remplacer le filtre une fois que l’augmentation de poids maximale indiquée est atteinte. - Si nécessaire, remplissez le vaporisateur avec la quantité adéquate d’isoflurane.
ATTENTION : Ne pas inhaler d’anesthésiques volatils. - Préparer une solution de travail de dobutamine de 2,5 μg/μL soit en diluant une solution injectable prête à l’emploi, soit en dissolvant la poudre de chlorhydrate de dobutamine dans une solution saline à 0,9 % conformément aux instructions du fabricant. La solution est stable au moins pendant 24 h lorsqu’elle est conservée à température ambiante.

Figure 1 : Lieu de travail de l’échographie cardiaque chez les petits animaux. Un réglage ergonomique est indispensable pour l’échocardiographie d’effort chez les petits animaux, car les temps d’examen doivent rester courts. Le lieu de travail se compose d’un appareil à ultrasons, d’un système d’anesthésie pour petits animaux avec alimentation en oxygène et évacuation active des gaz, d’une plate-forme d’échocardiographie chauffée avec ECG intégré et de capacités de mouvement via des micromanipulateurs dans le cadre d’un système de rail intégré ainsi que d’une unité de surveillance physiologique. Un chauffe-gel pour réchauffer le gel à ultrasons et une lampe chauffante sont des aides utiles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation de la souris pour l’imagerie et l’induction de l’anesthésie
- Remplissez la chambre d’induction avec de l’isoflurane 3 %-4 % v/v dans un mélange gazeux enrichi en oxygène (avec 1 L/min 100 % O2).
- Pesez la souris. Saisissez doucement la souris par la queue et transférez-la dans la chambre d’induction. Assurez-vous que l’animal est sous sédatif en quelques secondes en observant de près ses mouvements.
- Si nécessaire, modifiez le débit de gaz vers le cône nasal relié au système d’anesthésie (1,0-1,5 % d’isoflurane en volume avec 1 L/min 100 % O2 pour maintenir une sédation stable). Retirez la souris de la chambre d’induction et placez-la soigneusement sur la plate-forme préchauffée. Assurez-vous que les pattes reposent sur les capteurs ECG intégrés à la plate-forme.
- Pour éviter le dessèchement de la sclérotique, appliquez un gel pommade sur les deux yeux.
REMARQUE : Les mesures de contrainte prendront leur temps. - Appliquez une très petite quantité de crème pour électrodes sur les capteurs ECG. Fixez doucement l’animal avec du ruban adhésif sur les quatre membres. Utilisez une petite partie de ruban adhésif pour fixer la position de la tête de l’animal dans le cône nasal. L’ECG est utilisé pour enregistrer la fréquence cardiaque pendant l’acquisition de l’image. Ajustez le système d’imagerie physiologique pour un signal ECG stable et clair.
REMARQUE : Trop de crème d’électrode peut entraîner une mauvaise qualité du signal ECG. - Pour protéger l’animal du stress pendant la procédure, vérifiez la profondeur adéquate de la sédation en maintenant la plage de fréquence cardiaque à 400-450 bpm. La fréquence cardiaque est obtenue par l’ECG. Une variation de 50 bpm dans la plage est acceptable.
REMARQUE : Les mouvements de l’animal peuvent indiquer un niveau de sédation trop étroit. L’anesthésie ne doit pas entraîner de cardio-dépression de la souris. La sédation peut être ajustée pour obtenir la fréquence cardiaque cible mentionnée ci-dessus. - À l’aide de la lubrification, insérez doucement un thermomètre rectal pour une surveillance continue de la température corporelle. Maintenez la température dans la plage physiologique (normalement entre 36,5 °C et 37,5 °C selon la souche de souris et la configuration expérimentale). Dans un laboratoire d’échographie cardiaque animale non contrôlé, l’utilisation d’un éclairage infrarouge peut être envisagée.
- Utilisez une crème dépilatoire chimique pour enlever les poils du corps de la poitrine. Utilisez une serviette en papier propre et humide pour essuyer la poitrine. Assurez-vous d’enlever tous les composants restants de la crème (Figure 2A).
REMARQUE : Une tondeuse électrique peut également être utilisée avant l’application dépilatoire. L’animal est maintenant prêt pour l’imagerie. Comme il est essentiel de réduire le temps d’imagerie, l’ensemble de la préparation avant l’imagerie devrait prendre moins de 3 minutes.
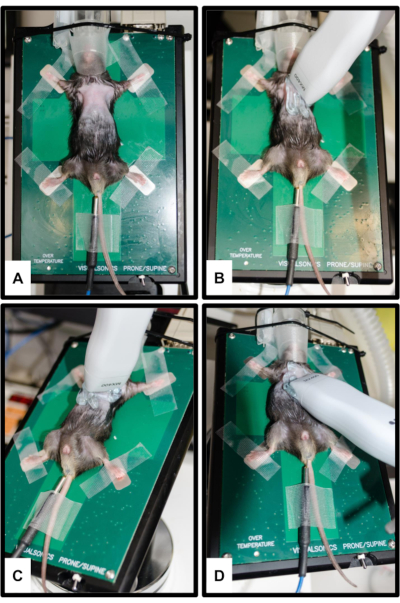
Figure 2 : Positionnement de l’animal et du transducteur. (A) La souris est attachée à la plate-forme chauffée avec les quatre membres fixés sur les électrodes ECG argentées. Un thermomètre rectal est inséré pour la mesure de la température corporelle. Le museau est doucement inséré dans le cône nasal du système d’anesthésie. (B) Orientation de la sonde pour la vue parasternale grand axe (PSLAX) ; Voir l’étape 3.2. (C) Orientation de la sonde pour la vue parasternale sur l’axe court (PSSAX) ; Voir l’étape 3.3. (D) Orientation de la sonde pour une vue apicale à quatre chambres (4CH) ; Voir l’étape 3.4. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Imagerie cardiovasculaire de base
REMARQUE : Les images peuvent être acquises à l’aide de deux positions de base de la sonde (fenêtre d’échographie parasternale et apicale) (Figure 2) et d’au moins trois modalités d’échographie (mode B (justesse), mode M (otion) et mode Doppler (doppler couleur et doppler à ondes pulsées (PW)) (Figure 3, Figure 4, Figure 5). Pour les bases de l’imagerie, veuillez vous référer aux articles16,18 précédemment publiés. Il est essentiel d’obtenir des images claires pour la comparaison avec les images de contraintes acquises ultérieurement.
- Appliquez du gel à ultrasons préchauffé sans bulles sur la poitrine.
REMARQUE : Le gel à ultrasons non chauffé entraînera une perte rapide de la température corporelle qui affectera la fréquence cardiaque. - Effectuer une vue parasternale grand axe (PSLAX).
REMARQUE : PSLAX est effectué pour visualiser le VG dans son axe long. Grâce à cela, par exemple, les dimensions de la racine aortique et de l’aorte proximale ainsi que la longueur du VG peuvent être obtenues.- Avec la tête tournée vers l’opposant, inclinez la table d’environ 10 à 20° vers la gauche et de 5 à 10 ° vers l’avant pour amener le cœur aussi en avant que possible. Placez le transducteur parasternalement dans l’axe long du cœur, le marqueur (encoche) pointant vers l’épaule droite de l’animal (figure 2B).
- Utilisez des micromanipulateurs pour ajuster la vue optimale. Utilisez les commandes du panneau de configuration de l’image pour optimiser l’image. Acquérir au moins une image 2D en mode B et une image en mode M au niveau médio-ventriculaire.
- Acquérez des images supplémentaires si nécessaire pour la question spécifique. Acquérir au moins 100 images et au moins 3(-6) cycles cardiaques complets.
- Effectuer une vue parasternale sur un axe court (PSSAX).
REMARQUE : PSSAX est effectué pour visualiser le LV dans son axe court. De ce point de vue, par exemple, le volume ventriculaire gauche en fin de systolique (LVESV), le volume ventriculaire gauche en fin de diastolic (LVEDV), le volume systolique (SV) et le débit cardiaque (CO) peuvent être calculés.- Tournez la sonde de 90° dans le sens des aiguilles d’une montre sans modifier l’angulation (le marqueur pointant maintenant vers l’épaule gauche de l’animal) (figure 2C). Acquérir au moins une image en mode B dans la vue basale, mi-ventriculaire (niveau des muscles papillaires) et apicale.
- Pour définir la vue la plus basale et la plus apicale, faites défiler le long de l’axe long jusqu’aux points les plus éloignés, où le cycle cardiaque complet de la chambre VG est encore visible. Prendre des images au niveau médio-ventriculaire approximativement en position intermédiaire au niveau des muscles papillaires.
- Acquérir au moins une image en mode M dans la vue médio-ventriculaire.
REMARQUE : Certains appareils à ultrasons fournissent des préréglages pour les différentes vues ; Il est recommandé de vérifier le préréglage adéquat avant d’acquérir des images.
- Effectuer une vue apicale à quatre chambres (4CH).
REMARQUE : 4CH est important car il peut être principalement utilisé pour évaluer la valve mitrale à l’aide du doppler PW.- Inclinez la plate-forme de manière à ce que l’animal se trouve dans une position de Trendelenburg modifiée avec la tête vers le bas. Inclinez le transducteur vers la tête de la souris, le marqueur vers le côté gauche de l’animal (figure 2D).
- Acquérir au moins une image en mode B ainsi qu’une image Doppler couleur et une image Doppler PW de la valve mitrale et tricuspide. En fonction de la question expérimentale, appliquez le Doppler tissulaire dans la vue 4CH.
REMARQUE : Le moyen le plus simple d’atteindre la position apicale 4CH est d’incliner la table à partir de la vue PSAX et d’anguler le transducteur. Veillez à ne pas appliquer trop de pression sur le thorax car cela pourrait interférer avec les mesures, par exemple de la fonction diastolique.
4. Imagerie du stress à la dobutamine
REMARQUE : Une fois la fréquence cardiaque cible atteinte, des vues standardisées doivent être acquises tant que la fréquence cardiaque cible est stable. Cela nécessite généralement plus d’un commutateur entre PSLAX et PSSAX. Étant donné que le basculement entre PSLAX et PSSAX ne nécessite qu’une rotation de 90°, les vues peuvent être facilement imagées.
- Effectuer des tests d’effort à la dobutamine chez un seul et même animal en maintenant la même anesthésie pour assurer la comparabilité. Assurez-vous que la fréquence cardiaque de démarrage reste stable dans la plage de 400-450 bpm. Enregistrez les lectures de l’ECG et enregistrez-les avec et sur les images acquises. Assurez-vous que le signal ECG est clair. Sinon, essayez de recoller les quatre membres jusqu’à ce qu’un signal ECG clair s’affiche.
- Encore une fois, effectuez la vue PSLAX (images en mode B et en mode M). Enregistrez les images en tant qu’image de base. Assurez-vous d’économiser et de garder à l’esprit la fréquence cardiaque initiale.
- Préremplissez la seringue et injectez 5 μg/g de dobutamine par voie intrapéritonéale à l’aide d’une aiguille de 27 g et d’une seringue de 1 ml. Surveillez de près la fréquence cardiaque. Enregistrez des images échocardiographiques jusqu’à ce que la fréquence cardiaque cible soit atteinte et utilisez l’augmentation de la fréquence cardiaque pour une analyse ultérieure. Une augmentation significative durable de la fréquence cardiaque induite par la dobutamine est atteinte après une augmentation de 15 à 30 % après environ 1 minute, en fonction de la dose de dobutamine.
REMARQUE : Utilisez toujours des aiguilles d’injection stériles à usage unique pour chaque animal afin de prévenir les infections. La sensibilité à la dobutamine et la charge (sous-)maximale peuvent varier avec la souche de souris et peuvent dépendre de la configuration expérimentale et doivent être définies dans les pré-expériences. Il est recommandé d’ajuster la dose de dobutamine à la configuration expérimentale.
ATTENTION : Suivez les directives de l’établissement pour l’utilisation d’articles tranchants et potentiellement infectieux. Jetez toujours l’aiguille dans un conteneur de déchets médicaux approuvé ! - Une fois que la fréquence cardiaque cible est atteinte et reste stable pendant environ 30 s, acquérez des images PSLAX en mode B et en mode M comme décrit à l’étape 3.
- Encore une fois, tournez la sonde dans le sens des aiguilles d’une montre pour obtenir une vue PSSAX comme décrit à l’étape 3. Ici, acquérez des images en mode B du niveau basal, médio-ventriculaire (niveau des muscles papillaires) et apical et des images en mode M du niveau médio-ventriculaire (niveau des muscles papillaires). Rassurez-vous, que la fréquence cardiaque cible reste stable. Sinon, revenez à la position PSLAX et recommencez l’imagerie.
REMARQUE : Comme la fréquence cardiaque chutera sans perfusion continue de dobutamine12 (non couverte dans cet article), les images doivent être acquises dans les deux minutes. Les images PSLAX et PSSAX sont essentielles pour la plupart des mesures induites par les contraintes pertinentes (voir la section « Résultats représentatifs »). - Maintenant, effectuez à nouveau la vue apicale 4CH (comme expliqué à l’étape 3.4.). À l’aide du doppler PW, mesurez les modèles d’écoulement d’intérêt (comme expliqué à l’étape 3.4.2.). Dans des conditions non sollicitées, deux ondes caractéristiques sont mesurées à l’aide du doppler PW, l’une représentant le remplissage passif du ventricule (onde E(arly)) et l’autre représentant le remplissage actif après contraction auriculaire (onde A(trial)). Avec l’augmentation de la fréquence cardiaque, ces ondes ont tendance à fusionner et peuvent ne pas être mesurables distinctement sous le stress induit par la dobutamine.
5. Dernières étapes
- Après environ 5 minutes, lorsque la fréquence cardiaque recommencera à diminuer, assurez-vous que toutes les vues sont capturées.
- Retirez délicatement le gel à ultrasons de la poitrine à l’aide d’une serviette en papier propre et humide. Retirez délicatement la fixation du ruban. Portez une attention particulière au ruban adhésif fixant la tête de l’animal pour éviter d’arracher les moustaches.
- Éteignez l’anesthésie. Si vous utilisez un échappement de gaz actif, assurez-vous de continuer l’épuisement des gaz. Placez l’animal sur une serviette en papier dans une cage chauffée séparée pendant la période de réveil. Observez attentivement l’animal. Il ne doit pas être laissé sans surveillance jusqu’à ce qu’il ait repris une conscience suffisante pour maintenir la déposition sternale. Une fois réveillé et complètement rétabli, transférez l’animal dans sa cage.
REMARQUE : En raison du caractère non final de cette technique, l’animal peut rester dans l’expérience conformément à toutes les réglementations pertinentes.
6. Évaluation hors ligne
- Transférez les données d’image vers le logiciel d’analyse hors ligne sur un poste de travail pour effectuer une évaluation détaillée de la fonction cardiaque. Portez une attention particulière à la différence entre la fonction cardiaque non stressée et la fonction cardiaque stressée. La fréquence cardiaque doit toujours être enregistrée et présentée.
REMARQUE : Étant donné que l’analyse logicielle varie d’un logiciel à l’autre, elle n’est pas couverte par ce protocole. Veuillez vous référer aux instructions du fabricant.
Résultats
Une image échocardiographique physiologique non stressée acquise dans PSLAX est illustrée à la figure 3. Dans la diastole, les parois du ventricule apparaissent uniformément (Figure 3A) et s’épaississent dans une certaine mesure (Figure 3B,C). L’injection de 5 μg/g de poids corporel de dobutamine i.p. entraîne une augmentation significati...
Discussion
L’évaluation de la fonction cardiaque induite par le stress est largement utilisée chez l’homme dans un cadre clinique à l’aide de tests d’effort ou de tests de stress pharmacologique 6,7. Étant donné que l’échocardiographie post-exercice immédiate chez les souris est très limitée en raison de la nécessité d’une sédation, l’échocardiographie de stress induite par la dobutamine est probablement la métho...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient les sources de financement suivantes : Fondation allemande pour la recherche (UMEA Junior clinician scientist, Stephan Settelmeier ; RA 969/12-1, Tienush Rassaf ; HE 6317/2-1, Ulrike Hendgen-Cotta), Else-Kroener-Fresenius-Stiftung (2014_A216, Tienush Rassaf).
matériels
| Name | Company | Catalog Number | Comments |
| Activated Charcoal Filter | UNO BV | 180000140 | http://www.unobv.com/Rest%20Gas%20Filters.html |
| Aquasonic 100 Ultrasound Transmission Gel | Parker Laboratories | 001-02 | https://www.parkerlabs.com/aquasonic-100.asp |
| Chemical Hair removal lotion | General Supply | - | |
| Cotton Swaps | General Supply | - | |
| ddH2O | General Supply | - | |
| Dobutamine | Carinopharm | 71685.00.00 | https://www.carinopharm.de/stammsortiment/#103 |
| Flowmeter for laboratory animal anesthesia | UNO BV | SF3 | http://www.unobv.com/Flowmeters.html |
| Gas Exhaust Unit | UNO BV | - | http://www.unobv.com/Gas%20Exhaust%20Unit.html |
| Heating Lamp | Philips | - | |
| Induction Box | UNO BV | - | http://www.unobv.com/Induction%20box.html |
| Medical Sharps Container | BD | 305626 | https://legacy.bd.com/europe/safety/de/products/sharps/ |
| MX400 ultrasound transducer (20-46 Mhz) | VisualSonics | MX400 | https://www.visualsonics.com/product/transducers/mx-series-transducers |
| Octenisept disinfectant | Schuelke | 173711 | https://www.schuelke.com/de-de/produkte/octenisept.php |
| Omnican F syringe with needle 1ml | B. Braun | 9161502S | https://www.bbraun.de/de/products/b60/omnican-f.html |
| Paper Towels | General Supply | - | |
| Signacreme Electrode Cream | Parker Laboratories | 017-05 | https://www.parkerlabs.com/Signacreme.asp |
| Standard Gauze Pads | BeeSana Meditrade | 4852728 | https://www.meditrade.de/de/wundversorgung/verbandstoffe/beesana-mullkompresse/ |
| Thermasonic Gel Warmer | Parker Laboratories | 82-03-20 CE | https://www.parkerlabs.com/thermasonic_apta_sbp.asp |
| Transpore Tape | 3M | 1527NP-0 | https://www.3mdeutschland.de/3M/de_DE/unternehmen-de/produkte/~/3M-Transpore-Fixierpflaster/ |
| Vaporizer Sigma Delta | UNO BV | - | http://www.unobv.com/Vaporizers.html |
| Vevo 3100 high-frequency preclinical ultrasound imaging system | VisualSonics | Vevo3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100 * required software package: Cardiovascular package; B-mode, M-mode, pulsed-wave doppler mode |
| Vevo Imaging Station with integrated rail system, heated platform and physiological monitoring unit | VisualSonics | - | https://www.visualsonics.com/product/accessories/imaging-stations |
| VevoLab Analysis Software | VisualSonics | Vers. 3.2.5 | https://www.visualsonics.com/product/software/vevo-lab *required software package: Vevo Strain, LV analysis |
Références
- Oh, J. Echocardiography in heart failure: Beyond diagnosis. European Journal of Echocardiography. 8 (1), 4-14 (2007).
- Lancellotti, P., et al. The clinical use of stress echocardiography in non-ischaemic heart disease: Recommendations from the european association of cardiovascular imaging and the american society of echocardiography. Journal of the American Society of Echocardiography. 30 (2), 101-138 (2017).
- Lindsey, M. L., Kassiri, Z., Virag, J. A. I., de Castro Bras, L. E., Scherrer-Crosbie, M. Guidelines for measuring cardiac physiology in mice. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 733-752 (2018).
- Zacchigna, S., et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC Working Group on myocardial function. Cardiovascular Research. , 110 (2020).
- Hendgen-Cotta, U. B., et al. A novel physiological role for cardiac myoglobin in lipid metabolism. Scientific Reports. 7, 43219 (2017).
- Al-Lamee, R. K., et al. Dobutamine stress echocardiography ischemia as a predictor of the placebo-controlled efficacy of percutaneous coronary intervention in stable coronary artery disease: The stress echocardiography-stratified analysis of ORBITA. Circulation. 140 (24), 1971-1980 (2019).
- Cadeddu Dessalvi, C., Deidda, M., Farci, S., Longu, G., Mercuro, G. Early ischemia identification employing 2D speckle tracking selective layers analysis during dobutamine stress echocardiography. Echocardiography. 36 (12), 2202-2208 (2019).
- Li, Z., et al. Reduced myocardial reserve in young x-linked muscular dystrophy mice diagnosed by two-dimensional strain analysis combined with stress echocardiography. Journal of the American Society of Echocardiography. 30 (8), 815-827 (2017).
- Puhl, S. L., Weeks, K. L., Ranieri, A., Avkiran, M. Assessing structural and functional responses of murine hearts to acute and sustained beta-adrenergic stimulation in vivo. Journal of Pharmacological and Toxicological Methods. 79, 60-71 (2016).
- Ferferieva, V., et al. Assessment of strain and strain rate by two-dimensional speckle tracking in mice: comparison with tissue Doppler echocardiography and conductance catheter measurements. European Heart Journal Cardiovascular Imaging. 14 (8), 765-773 (2013).
- Wiesmann, F., et al. Dobutamine-stress magnetic resonance microimaging in mice : acute changes of cardiac geometry and function in normal and failing murine hearts. Circulation Research. 88 (6), 563-569 (2001).
- Pellikka, P. A., et al. Guidelines for performance, interpretation, and application of stress echocardiography in ischemic heart disease: From the American Society of Echocardiography. Journal of the American Society of Echocardiography. 33 (1), 1-41 (2020).
- Ahonen, J., et al. Pharmacokinetic-pharmacodynamic relationship of dobutamine and heart rate, stroke volume and cardiac output in healthy volunteers. Clinical Drug Investigation. 28 (2), 121-127 (2008).
- Nath Das, R. Determinants of cardiac ejection fraction for the patients with dobutamine stress echocardiography. Epidemiology. 07 (03), (2017).
- Balcazar, D., et al. SERCA is critical to control the Bowditch effect in the heart. Scientific Reports. 8 (1), 12447 (2018).
- Zhang, B., Davis, J. P., Ziolo, M. T. Cardiac catheterization in mice to measure the pressure volume relationship: Investigating the Bowditch Effect. Journal of Visualized Experiments. (100), e52618 (2015).
- Casaclang-Verzosa, G., Enriquez-Sarano, M., Villaraga, H. R., Miller, J. D. Echocardiographic approaches and protocols for comprehensive phenotypic characterization of valvular heart disease in mice. Journal of Visualized Experiments. (120), e54110 (2017).
- Respress, J. L., Wehrens, X. H. Transthoracic echocardiography in mice. Journal of Visualized Experiments. (39), e1738 (2010).
- Rea, D., et al. Strain analysis in the assessment of a mouse model of cardiotoxicity due to chemotherapy: Sample for preclinical research. In Vivo. 30 (3), 279-290 (2016).
- Beyhoff, N., et al. Application of speckle-tracking echocardiography in an experimental model of isolated subendocardial damage. Journal of the American Society of Echocardiography. 30 (12), 1239-1250 (2017).
- Pappritz, K., et al. Speckle-tracking echocardiography combined with imaging mass spectrometry assesses region-dependent alterations. Scientific Reports. 10 (1), 3629 (2020).
- Krahwinkel, W., et al. Dobutamine stress echocardiography. European Heart Journal. 18, 9-15 (1997).
- Michel, L., et al. Real-time pressure-volume analysis of acute myocardial infarction in mice. Journal of Visualized Experiments. (137), e57621 (2018).
- Baumgartner, H., et al. ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Knuuti, J., et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Schoensiegel, F., et al. High throughput echocardiography in conscious mice: Training and primary screens. European Journal of Ultrasound. 32, 124-129 (2011).
- Gao, S., Ho, D., Vatner, D. E., Vatner, S. F. Echocardiography in Mice. Current Protocols in Mouse Biology. 1, 71-83 (2011).
- Scherrer-Crosbie, M., Thibault, H. B. Echocardiography in translational research: of mice and men. Journal of the American Society of Echocardiography. 21 (10), 1083-1092 (2008).
- Tanaka, N., et al. Transthoracic echocardiography in models of cardiac disease in the mouse. Circulation. 94 (5), 1109-1117 (1996).
- Roth, D. M., et al. Cardiac-directed adenylyl cyclase expression improves heart function in murine cardiomyopathy. Circulation. 99 (24), 3099-3102 (1999).
- Castle, P. E., et al. Anatomical location, sex, and age influence murine arterial circumferential cyclic strain before and during dobutamine infusion. Journal of Magnetic Resonance Imaging. 49 (1), 69-80 (2019).
- Ren, S., et al. Implantation of an isoproterenol mini-pump to induce heart failure in mice. Journal of Visualized Experiments. (152), e59646 (2019).
- Carillion, A., Biais, M., Riou, B., Amour, J. Comparison of Dobutamine with Isoproterenol in echocardiographic evaluation of cardiac β-adrenergic response in rats: 4AP8-9. European Journal of Anaesthesiology. 29, (2012).
- Lang, R. M., et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 16 (3), 233-270 (2015).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology-Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Pieske, B., et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). European Heart Journal. 40 (40), 3297-3317 (2019).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Rammos, C., et al. Impact of dietary nitrate on age-related diastolic dysfunction. European Journal of Heart Failure. 18 (6), 599-610 (2016).
- Koshizuka, R., et al. Longitudinal strain impairment as a marker of the progression of heart failure with preserved ejection fraction in a rat model. Journal of the American Society of Echocardiography. 26 (3), 316-323 (2013).
- Bunting, K. V., et al. A practical guide to assess the reproducibility of echocardiographic measurements. Journal of the American Society of Echocardiography. 32 (12), 1505-1515 (2019).
- Grune, J., et al. Accurate assessment of LV function using the first automated 2D-border detection algorithm for small animals - evaluation and application to models of LV dysfunction. Cardiovascular Ultrasound. 17 (1), 7 (2019).
- Lau, E. M. T., et al. Dobutamine stress echocardiography for the assessment of pressure-flow relationships of the pulmonary circulation. Chest. 146 (4), 959-966 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon