Method Article
جيل من يرقات حمار وحشي Xenografts وتحليل سلوك الورم
In This Article
Summary
هنا، ونحن نقدم بروتوكول خطوة بخطوة، مع نصائح لتوليد xenografts والمبادئ التوجيهية لتحليل سلوك الورم، وفلورية المناعة جبل كامل، وتكميم التصوير الكونفوكوكال.
Abstract
يتم استخدام يرقات حمار وحشي xenografts على نطاق واسع لأبحاث السرطان لإجراء دراسات حية وفي الوقت الحقيقي للسرطان البشري. إمكانية تصور سريع للاستجابة للعلاجات المضادة للسرطان (العلاج الكيميائي والعلاج الإشعاعي والبيولوجيات) ، وتولد الأوعية والانبثاث مع قرار خلية واحدة ، يضع نموذج xenograft حمار وحشي كخيار أعلى لتطوير الدراسات قبل السريرية.
يقدم مقايسة يرقات حمار وحشي xenograft العديد من المزايا التجريبية مقارنة بالنماذج الأخرى ، ولكن ربما يكون الأكثر لفتا للنظر هو تقليل حجم الحجم وبالتالي الوقت. يسمح هذا التخفيض في الحجم بتصوير الخلايا المفردة ، واستخدام عدد منخفض نسبيا من الخلايا البشرية (متوافقة مع الخزعات) ، وفحص الأدوية متوسطة وعالية الإنتاجية ، ولكن الأهم من ذلك أنه يمكن من تقليل كبير في وقت الفحص. كل هذه المزايا تجعل من الحمار الوحشي xenograft المقايسة جذابة للغاية لتطبيقات الطب الشخصية في المستقبل.
وقد وضعت العديد من بروتوكولات xenograft حمار وحشي مع تنوع واسع من الأورام البشرية; ومع ذلك ، لا يزال هناك نقص في بروتوكول عام وموحد لتوليد يرقات حمار وحشي بكفاءة. هنا نقدم بروتوكول خطوة بخطوة، مع نصائح لتوليد xenografts والمبادئ التوجيهية لتحليل سلوك الورم، وفلورية المناعة جبل كامل، وتكميم التصوير الكونفوكوكال.
Introduction
حمار وحشي (دانيو ريو) هو الظهور ككائن حي نموذج الفقاريات قوية لدراسة التنمية والمرض. حمار وحشي أسهم الوراثية المحفوظة للغاية (~ 70٪ علم الأوهام الوراثية و ~ 84٪ الجينات المرتبطة بالأمراض) والميزات الأساسية مورفولوجية الجهاز مع البشر1,2. هذا الحفظ يسمح باستخدام حمار وحشي لنموذج العديد من الأمراض البشرية، بما في ذلك السرطان3،4.
التعامل مع وصيانة حمار وحشي هو أسهل بكثير وأكثر فعالية من حيث التكلفة من الفئران نظرا لصغر حجمها، والخصوبة عالية على مدار السنة والإخصاب الخارجي3،5. لا تتطلب أجنة حمار وحشي تغذية حية خلال أول 5-7 أيام من حياتها وقد استخدمت كنموذج فعال للتنمية والعدوى والسرطان1و4و6و7. تفقس أجنة حمار وحشي في 48 ساعة بعد الإخصاب (hpf) وهي سباحة حرة مع تشكيل جميع الأعضاء ، والقلب النابض ونظام الدورة الدموية الوظيفية ، والكبد ، والدماغ ، ونخاع الكلى ، وما إلى ذلك1،3. أيضا ، في هذه المرحلة من التطور فقط المناعة الفطرية هي في اللعب ، والمناعة التكيفية لا تزال تتطور ، مما يسمح بالحرمان الفعال العام للخلايا البشرية دون الحاجة إلى استخدام المسوخ المنافض مناعة7،8. ومع ذلك، من المهم أن نلاحظ أن ليس كل الخلايا البشرية تغرن على قدمالمساواة 9 وأنه، على سبيل المثال، لخلايا سرطان الدم تبين أن الخلايا الفرجية (العدلات وال الضامة) تحتاج إلى أن تستنفد من أجل الحرمان الفعال10.
تسمح قابلية المسالك الوراثية لسمك الحمار الوحشي والشفافية البصرية في مراحله الجنينية المبكرة بالتصوير داخل الخلية الواحدة بدقة عالية وبالتالي ، لإنشاء أحدث تقنيات التصوير في مجالات متنوعة من البيولوجيا. وعلاوة على ذلك، في سياق السرطان، وهذه الميزات مفيدة للدراسات في الوقت الحقيقي من المراحل الأولى من التفاعلات بين الورم المضيف، مثل دراسة الأوعية والإمكانات النقيلي، فضلا عن التفاعلات مع الجهاز المناعي الفطري8،9،11،12،13.
على الرغم من أن في المقايسة xenograft قصيرة ليس هناك وقت ل "تطور" النقيلي- فمن الممكن لتحليل القدرة النقيلي للخلايا السرطانية (أي كفاءتها للذهاب من خلال خطوات النقيلي مثل الغزو, داخل, البقاء على قيد الحياة في الدورة الدموية, البذخ, والاستعمار, وبالتالي دراسة هذه العمليات في الجسم الحي وفي الوقت الحقيقي8,11,13,14).
خصائص دورة حياتها وضع حمار وحشي كنموذج فريد للطب الشخصي في السرطان. يمكن إجراء المقايسات في فترة زمنية أقصر والنتائج التي تم الحصول عليها في بضعة أسابيع7،8،9،11،12،15،16. الكرفس وجدوى هذه المقايسات توفر للأطباء والباحثين إمكانية الحصول على نتائج تحويلية يمكن أن تكون مفيدة لمرضى السرطان، الذين الوقت هو حاجة أساسية.
على الرغم من المحاولات المتزايدة لتوليد xenografts جنين حمار وحشي ناجحة، لا تزال هناك حاجة لتوحيد إجراءات الحقن، فضلا عن تقييم صلاحية الخلية وسلوك الورم بعد الحقن.
في هذا البروتوكول نقدم للباحثين دليلا تفصيليا وواضحا خطوة بخطوة لحقن خطوط الخلايا السرطانية البشرية في أجنة حمار وحشي وما يليها من تثبيت ، والتلطخ المناعي ، والتصوير ، وتحديد كمي لسلوك الخلايا السرطانية.
Protocol
تم التعامل مع نموذج سمك الحمار الوحشي(دانيو ريو)وصيانته وفقا للبروتوكولات القياسية للتشريعات الأوروبية لرعاية الحيوان والتوجيه 2010/63/EU (المفوضية الأوروبية، 2016) ومنصة شامباليمود للأسماك. وقد وافقت على جميع البروتوكولات لجنة شامباليمود الأخلاقية الحيوانية والمنظمات المؤسسية البرتغالية -ORBEA (Órgão de Bem-Estar e Ética Animal/AnimalLfare and Ethics Body) وDGAV (Direção Geral de Alimentação e Veterinária/المديرية العامة للأغذية والطب البيطري).
ملاحظة: قبل بدء التجربة الرئيسية، ممارسة مع سرطان القولون والمستقيم البشري (CRC) خط الخلية HCT116. هذا الخط الخلية من السهل إعداد (تكاثري للغاية)، وسهلة لحقن و engrafts بكفاءة عالية (حوالي 95-100٪). تبدأ مع الخلايا الزائدة (~ 12x106 خلايا، T-75 قارورة) والأسماك الزائدة (400 سمكة) حتى تصبح يتقن في هذه التقنية، لأن العديد من الخلايا والأسماك سوف تضيع أثناء التدريب. المجربون جاهزون بمجرد تحقيق نسبة 95٪ تقريبا في HCT116 xenografts. راجع الشكل 1 للحصول على تخطيطي للبروتوكول الكامل.
1. إعداد للحقن
- قبل أسبوعين من الحقن، قم بتوسيع الخلايا في الثقافة (انظر الجدول 1 للحصول على دليل مفصل للالتقاء الأمثل في المختبر لحقن عدة خطوط خلايا).
- قبل ثلاثة أيام من الحقن، عبر حمار وحشي من الخلفية المطلوبة.
2. 24 ساعة قبل الحقن
- تنظيف لوحات جنين حمار وحشي (تجاهل جميع الأجنة الميتة وغير المتقدمة) وتحديث E3 المتوسطة.
- في غرفة زراعة الخلايا، تجاهل وسيطة ثقافة الخلية من القوارير المخطط للحقن، واغسل مرة واحدة مع المالحة العازلة بالفوسفات (PBS) لإزالة الخلايا الميتة وإضافة وسيطة جديدة.
- إعداد أدوات لإجراء الحقن، مثل: الإبر microinjection، لوحات agarose ودبابيس الشعر لمحاذاة الأجنة للحقن (الشكل 2A-D،مفصلة أدناه).
- إبر الميكروبيكشن (الشكل 2A)
- استخدام الشعيرات الدموية الزجاج borosilicate (4 بوصات، OD 1.0 ملم، لا خيوط في سحب micropipette (الحرارة: ≈500؛ فيل: 10؛ فيل: 50؛ ديسمبر: 60؛ سحب: 100).
- إعداد لوحة (الشكل 2B)
- إعداد 2٪ agarose في H2O، تسخينه وصب طبقة واحدة من الآغاروز الذائب في غطاء طبق بيتري نظيفة. السماح لها بلمرة وبمساعدة مسطرة، وجعل ثلاثة إلى أربعة خطوط الآجروز على التوالي لمحاذاة الأجنة.
- تجميع دبوس الشعر (الشكل 2C-D)
- ضع شعرة واحدة داخل أنبوب زجاجي الشعر الشعري تاركا حوالي 1 سنتيمتر من الشعر خارج الأنبوب.
- حليقة الطرف الخارجي من الشعر مع مساعدة من ملقط في أنبوب زجاجي الشعرية تشكيل حلقة من ~ 0.5 مم طول.
- ختم حافة أنبوب الشعرية مع قطرة من طلاء الأظافر. سيساعد هذا أيضا في إصلاح الحلقة في مكانها. دعه يجف. كرر الإجراء على الحافة الأخرى للأنبوب.
- قطع قطعة من الشريط الكهربائي (أكثر مقاومة، منيعة، وصلبة من الشريط لاصق العادية).
- ختم الشريط حول الشعرية لحمايته من كسر.
- إبر الميكروبيكشن (الشكل 2A)
3. يوم الحقن
- فصل الأجنة المفقسة عن البويضات غير المفقسة. إضافة 1x pronase (0.6 ملغم / مل، الجدول 3)إلى وسيط الجنين في هذه المرحلة يمكن أن تعزز الفقس. ضع الأجنة في الحاضنة (عند 28 درجة مئوية) حتى الحقن.
ملاحظة: لا تترك الأجنة في محلول البروناز لأكثر من ساعة واحدة، لأن الإنزيم سيعمل على الأجنة المفقسة مما يزيد من خطر الوفاة. التأكد من أن مرحلة نمو الأجنة هي تلك المقابلة ل 48 حصان(الشكل 3A، A') لتجنب خطر الوذمة والوفيات. - إعداد 1x Tricaine (من الأسهم 25x).
ملاحظة: يمكن العثور على وصفة مفصلة في الجدول 3 وفي شبكة معلومات Zebrafish - ZFIN صفحة ويب17.
4. وضع العلامات الخلية للحقن
ملاحظة: يمكن وضع علامات على الخلايا إما مباشرة في قارورة أو في أنبوب طرد مركزي صغير سعة 1.5 مل بعد انفصال أنزيمي. راجع مناقشة للحصول على مزيد من المعلومات.
- إزالة الخلايا ثقافة المتوسطة وغسل القارورة مرتين (2x) مع برنامج تلفزيوني 1X.
- تسمية الخلايا مع صبغة ليبوفيلي من الاختيار إما مباشرة في القارورة (2 مل حل / قارورة T75) أو في أنبوب الطرد الدقيق 1.5 مل بعد انفصال الأنزيمية. تجنب التعرض للخلايا الخفيفة والمحتضنة عند 37 درجة مئوية (انظر الجدول 1 والجدول 2 للاطلاع على الشروط/الحلول).
- إذا وضع العلامات في قارورة
- إزالة الصبغة، وغسل مع برنامج تلفزيوني 1x وفصل الخلايا مع EDTA وكشطة الخلية.
- نقل الخلايا إلى أنابيب الطرد المركزي الدقيق 1.5 مل. الطرد المركزي لمدة 5 دقائق في 300 × ز ثم انتقل إلى الخطوة 4.5.
- إذا وضع العلامات في أنبوب الطرد المركزي الدقيق 1.5 مل:
- الطرد المركزي 5 دقائق في 300 × ز لإزالة الصبغة والتخلص من supernatant. ريسوسبند في برنامج تلفزيوني 1x لغسل.
- الطرد المركزي 5 دقائق في 300 × ز ومن ثم انتقل إلى الخطوة 4.5.
- تجاهل supernatant وإعادة إنفاق بيليه مع خلية الثقافة المتوسطة (لبيليه 50 ميكرولتر إضافة ~ 150-200 ميكرولتر من المتوسطة).
- قياس صلاحية الخلية باستخدام غرفة نيوباور مع استبعاد تريبان الأزرق أو طريقة أخرى للاختيار.
- الطرد المركزي لمدة 4 دقائق في 300 × ز والتخلص من supernatant. إعادة ضغط الخلايا في وسيط الحقن.
ملاحظة: يمكن العثور على تركيز الخلية الموصى بها (بشكل عام من 0.25-0.5x106 خلايا / ميكرولتر) والمتوسطة في الجدول 1. - من هذه النقطة فصاعدا، والحفاظ على الخلايا على الجليد.
5. إجراء الحقن
- تخدير الأجنة في 1x Tricaine لمدة 5 دقائق.
- مع ماصة باستور بلاستيكية، نقل كمية صغيرة (~ 50) من الأجنة المخدرة إلى لوحة agarose ومحاذاتها بعناية مع مساعدة من حلقة دبوس الشعر. تأكد من الحفاظ على المسافة بين الأجنة ، وخاصة بين صفار واحد ورئيس واحد المقبل(الشكل 4A).
ملاحظة: يختلف عدد الأجنة التي يجب محاذاتها وفقا لمستوى خبرة الباحث الذي يقوم بالحقن. تبدأ مع عدد قليل (~ 10-20). للحصول على تخطيطي لتحديد المواقع الصحيح للأجنة في لوحة أجار / أغاروز انظر الشكل 4A. - تأكد من عدم جفاف الأجنة المنحازة في صفيحة الآجروز لمنع الوفيات ، عن طريق إضافة 1-3 قطرات بعناية من محلول Tricaine 1x إلى اللوحة.
- اضغط بخفة على أنبوب الطرد المركزي الدقيق لإعادة إنفاق الخلايا. قم بتحميل إبرة الحقن مع تعليق الخلية باستخدام طرف محمل صغير لتجنب فقاعات الهواء ، لأنها يمكن أن تعرض سلامة الأجنة للخطر.
- افتح صمام ضغط الهواء (40 psi)، و قم بإعداد المميكرونجينكتور و ضع إبرة الحقن المجهري بعناية في الحامل.
ملاحظة: استخدم إعدادات الميكروينكتور الموصى بها التالية: اضغط الضغط - تنفيس (3 psi)؛ إخراج الضغط - تنفيس؛ المدى - 100 مللي ثانية. - قطع إبرة microinjection قريبة من طرف مع ملقط دومون #5 أو ما شابه ذلك تحت مجسم.
ملاحظة: يجب أن يكون الطرف حادة ورقيقة بما يكفي للسماح للخلايا بالمرور دون انسداد وكذلك لتجنب إتلاف الأجنة وفقدان الخلايا. وهناك طرف إبرة microinjection سميكة إصابة الجنين وتعزيز تشكيل وذمة أو وفاة حمار وحشي. لا يستخدم الإكراميات لمعايرة الإبر. راجع مناقشة للحصول على شرح مفصل. - قبل حقن الأجنة، اختبر ضغط الحقن الدقيق بدءا من أقل ضغط إخراج حتى يتم تحقيق حجم مماثل لحجم عين جنين حمار وحشي في ~ 1-3.
ملاحظة: يوصى باستخدام مجسم مفلور كلما أمكن في بداية التدريب. وسيسمح ذلك بتحديد أسهل للخلايا الموسومة بالفلورسنت. - ثقب بعناية في منتصف صفار الجنين، وخفض زاوية الإبرة ودفع بحذر حتى غيض من الإبرة تصل إلى الفضاء perivitelline (PVS) (الشكل 4B-D).
- اضغط على دواسة microinjector وحقن الخلايا في PVS. استخدم عين الجنين كدليل. حاول حقن حجم من الخلايا مشابه لحجم عين الجنين وبقدر الإمكان من القلب لمنع وذمة القلب.
- إزالة الإبرة بعناية والانتقال إلى الجنين التالي.
- ضبط ضغط الميكروبيكتور إذا لزم الأمر.
ملاحظة: تميل الخلايا إلى بدء الانسداد، لذلك قد يزداد الضغط. إذا لزم الأمر، فمن الممكن لخفض الشعرية (لزيادة القطر) مع الحد من الضغط. - نقل الأجنة المحقونة إلى طبق بيتري نظيفة (الجدول 4) مع محلول تريكين 1x وتركها للراحة لمدة 5-10 دقائق. هذا سيعطي الوقت لإغلاق الجرح.
ملاحظة: لنقل الأجنة من لوحة أجار إلى طبق بيتري إضافة بضع قطرات من محلول تريكين 1x على رأس الأجنة وجمع بعناية لهم مع ماصة باستور البلاستيك. إسقاط الأجنة التي تم جمعها في طبق بيتري جديد مع محلول تريكين 1x. - إزالة الحل 1x Tricaine وإضافة جديدة E3 المتوسطة.
- احتضان xenografts في 34 درجة مئوية (درجة حرارة للخطر بين خطوط الخلايا البشرية البقاء على قيد الحياة وتطوير حمار وحشي8).
6. المقايسة النقيلية
- في ما يقرب من 1 ساعة بعد الحقن (hpi)، فحص الأجنة المحقونة على مجسم فلوري وفرز xenografts في 2 مجموعات، وفقا لغياب (الشكل 5A) أو وجود (الشكل 5B) من الخلايا المتداولة.
ملاحظة: حتى لو تم الكشف عن خلية سرطانية واحدة فقط في القلب أو الدورة الدموية، وتشمل هذه xenografts في مجموعة من xenografts مع الخلايا المتداولة. بدلا من ذلك، يمكن حقن الخلايا مباشرة في الدورة الدموية لزيادة أعداد xenografts في هذه المجموعة.
7. 1 يوم بعد الحقن
- على مجسم فلوري تحليل بعناية كل جنين واختيار تلك التي مع حقن الأورام بشكل صحيح (الشكل 6).
ملاحظة: إذا لزم الأمر، تخدير الأجنة المحقونة مع الحل Tricaine 1X قبل الفحص. - تجاهل الأجنة التالية / xenografts (الشكل 6A-A''):
• بدون ورم / مورفولوجيا غير طبيعية / ميت ،
• مع وذمة القلب و / أو صفار،
• مع خلايا الورم فقط في صفار،
• مع عدد قليل جدا من الخلايا السرطانية. - فرز xenografts مختارة وفقا لحجم الورم. استخدام حجم العين للمقارنة (الشكل 6B-B'' ، 6C).
• أورام أصغر من حجم العين (+)،
• الأورام بنفس حجم العين (++)،
• أورام أكبر من حجم العين (+++). - توزيع xenografts وفقا للتخطيط التجريبي المطلوب وبدء المقايسة المخدرات (السيطرة مقابل المخدرات، الخ). استبدال الأدوية وE3 المتوسطة يوميا (الجدول 4).
- احتضان xenografts الحفاظ على درجة حرارة 34 درجة مئوية حتى نهاية المقايسة.
8. 4 أيام بعد الحقن
- في اليوم الأخير من الفحص ، تخدير xenografts مع حل 1x Tricaine ومحاذاتها بعناية على لوحة أجار.
ملاحظة: تجاهل أي xenografts ميت أو منتفخة. العلاجات الدوائية وبعض الخلايا السرطانية يمكن أن تحفز السمية وتسبب في نهاية المطاف وفيات xenograft. لا تعتبر هذه xenografts للقياس الكمي engraftment. - لتحديد النسبة المئوية من engraftment: على مجسم فلوري تحليل كل xenograft الحية وتقييم غياب (الشكل 6D) / وجود (الشكل 6E) من الأورام في PVS.

- لتحديد النسبة المئوية للنقائل: على مجسم فلوري تحليل كل xenograft وتقييم وجود / غياب الميكروماتاستاسيس في النسيج الدموي caudal (CHT) من 2 المجموعات المحددة سابقا (CIRC و NO CIRC، الشكل 6F)
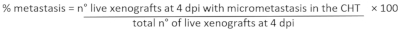
- وفقا لإعداد التجريبية، حدد xenografts من الفائدة والقتل الرحيم لهم مع 25x Tricaine (الجدول 3).
- إصلاحها في 4٪ الفورمالديهايد (FA) لمدة 4 ساعات على الأقل في درجة حرارة الغرفة (RT) أو بين عشية وضحاها في 4 درجة مئوية.
ملاحظة: استخدام الفورمالديهايد خالية من الميثانول (16٪ الاتحاد الإنجليزي) المخفف في 4٪ في PBS/0.1٪ تريتون. ملء الأنابيب إلى الأعلى مع مثبت. وضع أنابيب أفقيا لضمان تثبيت متجانسة لجميع xenografts، وزيادة نفاذية ومنع حمار وحشي من تجميع في الجزء السفلي. - بدلا من ذلك إصلاحها مع أنابيب (لكل 1 مل: 100 ميكرولتر من 1 م أنابيب ملح الصوديوم (4 درجة مئوية)؛ 1 ميكرولتر من 1 M MgSO4 (RT)؛ 4 ميكرولتر من 0.5 M EGTA (RT)؛ 93.7 ميكرولتر من 16٪ FA (RT)؛ 801.3 ميكروغرام من ddH2O).
ملاحظة: تحافظ PIPES على مضان خطوط RFP و mCherry المعدلة وراثيا أفضل من 4٪ FA. - إذا كان سيتم إجراء التلطخ المناعي في يوم مختلف، استبدل الاتحاد الإنجليزي بالميثانول بنسبة 100٪ (MetOH). يمكن تخزين Xenografts الثابتة في الميثانول 100٪ في -20 درجة مئوية إلى أجل غير مسمى.
ملاحظة: يمكن أن يضعف MetOH كفاءة بعض التلطيخات (أي phalloidin) ويروي بعض العلامات الفلورية. تأكيد كفاءة الأجسام المضادة في عينات ثابتة MetOH مسبقا.
9. تركيب كامل المناعي للتصوير confocal
ملاحظة: تستغرق تقنية فلورة المناعة في التركيب بأكملها 3 أيام مقسمة على النحو التالي: اليوم الأول هو ل permeabilization من xenografts واحتضان الأجسام المضادة الأولية. اليوم الثاني لغسل والحضانة الأجسام المضادة الثانوية واليوم الثالث لغسل, تثبيت xenografts والتخزين في وسائل الإعلام المتصاعدة.
- اليوم الأول
- إذا تم تخزين xenografts في 100٪ MetOH، إعادة ترطيب لهم من قبل سلسلة من انخفاض تركيزات MetOH (75٪، 50٪، 25٪ MetOH المخفف في PBS/0.1٪ تريتون). إذا تم إصلاحها في الاتحاد الإنجليزي لكرة القدم، استبدلها ب PBS/0.1٪ تريتون.
- غسل 4x لمدة 5 دقائق في PBS/0.1٪ تريتون.
- اغسل 1x لمدة 5 دقائق في H2O.
ملاحظة: يجب وضع الأنابيب أفقيا دائما في التثبيت، والثبات، وخطوات الغسيل ما لم يذكر خلاف ذلك. - استبدل H2O بالأسيتون البارد الجليدي واحتضنه عند -20 درجة مئوية لمدة 7 دقائق.
ملاحظة: ضع أنبوب 50 مل مع الأسيتون عند -20 درجة مئوية حتى يكون جاهزا للاستخدام. يجب وضع أنابيب الطرد المركزي الدقيق عموديا على حامل بحيث لا يتسرب الأسيتون. - غسل 2x لمدة 10 دقائق في PBS/0.1٪تريتون.
- احتضان مع حل حجب PBDX_GS لمدة 1 ساعة في RT (PBDX_GS العازلة حجب: 50 مل من 1x PBS; 0.5 غرام من الألبومين مصل البقري - BSA; 0.5 مل من DMSO; 250 ميكرولتر من 10٪ تريتون; 750 ميكرولتر من مصل الماعز - GS (15 μL/1 مل)).
- إزالة PBDX_GS وإضافة ~ 40 ميكرولتر من تخفيف الأجسام المضادة الأولية (عموما 1:100).
ملاحظة: يختلف حجم تخفيف الأجسام المضادة الأولية اعتمادا على عدد xenografts الموجودة في أنبوب الطرد المركزي الدقيق. تأكد من أن جميع xenografts مغمورة بالمياه. - حضانة لمدة ساعة واحدة في RT ومن ثم في 4 درجة مئوية بين عشية وضحاها. أنابيب الموقف عموديا.
- اليوم الثاني
- إزالة الأجسام المضادة الأساسية وغسل 2x لمدة 10 دقائق في PBS/0.1٪ تريتون.
- غسل 4x لمدة 30 دقيقة في برنامج تلفزيوني / 0.05 ٪ توين.
ملاحظة: يجب تنفيذ الخطوات التالية في الظلام (استخدام رقائق الألومنيوم لحماية أنابيب من الضوء). - إزالة PBS/0.05٪ توين وإضافة ~ 50-100 ميكرولتر من تخفيف الأجسام المضادة الثانوية (عموما 1:200 - 1:400) + DAPI (50 ميكروغرام / مل) المخفف في PBDX_GS.
- حضانة لمدة ساعة واحدة في RT ومن ثم في 4 درجة مئوية بين عشية وضحاها. أنابيب الموقف عموديا وحماية من الضوء.
- اليوم الثالث (استخدام رقائق الألومنيوم لحماية الأنابيب من الضوء)
- إزالة تخفيف الأجسام المضادة الثانوية وغسل 4x لمدة 15 دقيقة في PBS/0.05٪ توين.
- إصلاح في درجة حرارة الغرفة لمدة 20 دقيقة في 4٪ FA.
- غسل 1x لمدة 5 دقائق في PBS/0.05٪ توين.
- إزالة PBS/0.05٪ توين وإضافة 1 قطرة من المائية تصاعد المتوسطة إلى كل أنبوب الطرد المركزي الدقيق. ضع الأنابيب عموديا.
- جبل أو تخزين في 4 °C محمية من الضوء حتى تصاعد. ضع الأنابيب عموديا.
10. تركيب xenografts
ملاحظة: حماية أنابيب الطرد المركزي الدقيق من الضوء طوال العملية. يتم تركيب xenografts حمار وحشي بين 2 coverslips (24 × 60 ملم # 1.5). وهذا يسمح لقلب xenografts شنت أثناء التصوير confocal بحيث كلا الجانبين من الورم (أعلى وأسفل) يمكن الوصول إليها. لا تستخدم ماصة بلاستيكية مع تصاعد المتوسطة - قد تحصل اشتعلت xenografts في ماصة. راجع الشكل 7 للحصول على تمثيل تخطيطي للخطوات التالية.
- تسمية Y coverslip وختم حواف X coverslip مع هلام البترول أو الشحوم السيليكون لتجنب تسرب وسائل الإعلام المتصاعدة.
- نقل xenografts مع ماصة باستور الزجاج إلى coverslip X.
- محاذاتها بعناية مع دبوس الشعر وإزالة وسائل الإعلام تصاعد مائي الزائدة.
- إضافة وسائط تصاعد مائي إلى coverslip Y.
- وضع بعناية coverslip Y على رأس coverslip X. لا تضغط على الأغطية لأن هذا يمكن أن يعطل xenografts.
- ضع الأغطية المجمعة فوق شريحة المجهر وقم بتأمينها بشريط لاصق شفاف. وهذا يسمح أسهل التلاعب للتصوير confocal والتخزين.
11. التصوير الكونفوجال
ملاحظة: عدسة الهدف الغمر 25x Apochromatic مع تصحيح المياه هو الأمثل لتصوير أورام PVS مع قرار خلية واحدة (انظر الشكل 8C-C" والشكل 9A للحصول على أمثلة).
- الحصول على عينات باستخدام دالة المكدس z بفاصل زمني قدره 5μm بين كل شريحة. للصور التي تهدف إلى إعادة الإعمار 3D، في السفن خاصة، استخدم فاصل زمني من 1-3μm بين شرائح(الشكل 8A).
12. التحليل والتحديد الكمي
- استخدام برنامج فيجي / ImageJ أو ما شابه ذلك لمعالجة الصور confocal وتحليلها.
- فتح البيانات الخام (.czi، .lsm، الخ) في برنامج فيجي.
- لتحديد كل أو مجرد قناة واحدة في الوضع المركب، انقر فوق: صورة > ألوان > Channels Tool.
- لضبط مستويات السطوع والتباين، انقر فوق: صورة > ضبط توازن الألوان >.
- لتحديد حجم الورم
- حدد ثلاث شرائح تمثيلية من الورم، من أعلى ووسط وأسفل، لكل z-كومة لكل xenograft (الشكل 8 A).
ملاحظة: الدقة Confocal يحقق ~ 60-70 ميكرومتر من عمق الورم. إذا كان الورم كبيرا، فقد لا يكون من الممكن تصوير حجمه الإجمالي. - افتح جدول بيانات لشرح البيانات.
- عد كل نواة DAPI التي تتوافق مع الخلايا السرطانية في 3 شرائح مختارة(الشكل 8 A، B). للقيام بذلك:
- فتح البرنامج المساعد عداد الخلية من فيجي / ImageJ بالنقر فوق الإضافات > تحليل عداد الخلية >.
- في أداة عداد الخلية، انقر فوق تهيئة، وحدد نوع العداد، وانقر على الصورة لبدء وضع العد يدويا. لكل نقرة، يضيف العداد عدد الخلايا التي يتم حسابها (عدد النقرات).
- بعد حساب شريحة كاملة واحدة، حفظ رقم الخلية في مستند excel المطابق.
- العودة إلى فيجي، انقر فوق إعادة تعيين من إطار "عداد الخلية" لحذف المعلومات إذا سيتم استخدام نفس العداد. وإلا، يمكن الاحتفاظ بالمعلومات، ويمكن استخدام عدادات أخرى مع شرائح أخرى (أو خلايا).
- الانتقال إلى الشريحة التمثيلية الثانية وتكرار الخطوات السابقة. جمع جميع البيانات.
ملاحظة: عادة ما يستخدم مكافحة DAPI لحساب أرقام الخلايا بسبب تعريف واضح للخلايا الفردية، ومع ذلك، يمكن استخدام تلطيخ خلية محددة أخرى.
- للحصول على العدد الإجمالي للخلايا في الورم استخدم الصيغة التالية:
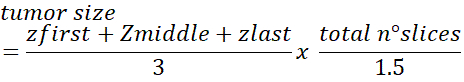
ملاحظة: تم تقدير رقم التصحيح 1.5 للخلايا التي يبلغ متوسط قطر نواتها ~ 10-12 ميكرومتر. قد يحتاج هذا التصحيح إلى تعديل إذا كانت الخلايا أكبر/أصغر. راجع Dicussion لمزيد من التفاصيل حول هذا الأسلوب.
- حدد ثلاث شرائح تمثيلية من الورم، من أعلى ووسط وأسفل، لكل z-كومة لكل xenograft (الشكل 8 A).
- لتحديد علامات أخرى (الخلايا المناعية، والأرقام ميتوتيك، PPH3، Caspase3 تنشيط، Ki67، الخ)، وتحديد جميع شرائح باستخدام نفس البرنامج المساعد (انظر الشكل 8C-C'' لتصور الأرقام ميتوتيك). تقسيم العدد الإجمالي للخلايا التي تم عدها من حجم الورم المقابلة وتتكاثر في 100 للحصول على النسبة المئوية.
ملاحظة: حذار أن بعض الخلايا سوف تكون موجودة بين شريحتين، ذهابا وإيابا في كومة z للتأكد من خلية واحدة لا يتم عدها مرتين.
النتائج
زيبرافيش زينوغرافت كأداة لدراسة العلاجات المضادة للسرطان.
تم وضع علامة على خط خلايا سرطان القولون والمستقيم HCT116 مع CM-DiI وحقنه في PVS لمدة يومين بعد الإخصاب (dpf) الأجنة. بعد الحقن، تم احتضان xenografts في 34 درجة مئوية، وهي درجة حرارة تسمح بنمو الخلايا السرطانية دون المساس بتطوير حمار وحشي. في اليوم التالي، تم فحص xenografts وفقا لوجود أو عدم وجود كتلة الورم في PVS (لم يتم التخلص من حمار وحشي حقن بشكل صحيح والقتل الرحيم)(الشكل 6A-A''). تم تجميع Xenografts وفقا لحجم الورم(الشكل 6B-B'') وتوزيعها عشوائيا (في لوحة من 6 آبار: ~ 12 xenografts لكل بئر) في الضوابط غير المعالجة والعلاج الكيميائي FOLFIRI (0.18 mM حمض الفولينيك، 0.08 mM Irinotecan و 4.2 m فلوروراسيل (5-FU)).
تم استبدال التحكم E3 والمخدرات يوميا ، والتخلص من سمك الحمار الوحشي الميت. 4 نقطة في البوصة، وثلاثة أيام بعد العلاج (dpt)، تم قياس التنجراف كما هو الحال في الخطوة 8.2 من البروتوكول. ويعتبر Engraftment كتردد xenografts التي تقدم كتلة الورم في PVS في 4 نقطة في البوصة. على سبيل المثال ، إذا كان هناك في نهاية التجربة 40 يرقة حية و 35 من أصل 40 تمثل ورما في PVS ، فإن معدل الإصابة هو 87.5٪. تم القتل الرحيم Xenografts وثابتة لتقييم حجم الورم والخلايا المبرمج عن طريق التنظير المناعي والمجهر الكونف البؤري.
تم إجراء immunofluorescence للكشف عن الخلايا المبرمج، وذلك باستخدام المضادة للكاسباس 3 المضادة للمشقوق (Asp175) (أرنب، 1:100، #CST 9661) وDAPI (50 ميكروغرام / مل) لاحتواء النوى. تم الحصول على مجموعات بيانات مكدس الصور (كل 5um) في مجهر LSM710 confocal وتحليل البيانات الذي تم إجراؤه باستخدام برنامج فيجي / ImageJ كما هو موضح في الخطوة 12. القياس الكمي للمؤشر ميتوتيك، موت الخلايا المبرمج (٪ من Caspase3 المنشط) وحجم الورم، كشف أن FOLFIRI يؤدي إلى انخفاض كبير في الانقسام (مان ويتني اختبار، P<0.0001) وتحريض كبير من موت الخلايا المبرمج (مان ويتني اختبار، P<0.0001)، يرافقه انخفاض 54٪ من حجم الورم (P<0.001) (الشكل 8C-E، الشكل 9A-E).
هذه الميزات مفيدة في شاشات المخدرات phenotypic الإنتاجية العالية وكذلك لاختبار الآثار الجوهرية والفسيولوجية للخلية من عدة علاجات السرطان في إطار زمني قصير.
توصيف xenografts الإنسان حمار وحشي مع الأجسام المضادة الخاصة بالإنسان
كما هو الحال في جميع نماذج xenograft، هناك خطر من سوء تحديد الخلايا. على سبيل المثال ، يمكن أن الضامة phagocytose الخلايا السرطانية البشرية ، لتصبح وصفت مع صبغة الليبوفيلي ، ومن ثم السفر على طول المضيف حمار وحشي ، وبالتالي ، يمكن أن تكون هذه الخلايا مخطئة لmicrometastasis الورم. لذلك، وضع علامات xenografts مع أجسام مضادة بشرية محددة مثل HLA الإنسان، كي-67 أو الميتوكوندريا البشرية (hMITO) أمر بالغ الأهمية لتوصيف الأولي وأيضا للتعرف على مورفولوجيا الخلايا السرطانية (الشكل 9F-I).
زيبرافيش زينوغرافت لدراسة التفاعلات الخلية الخلية.
ميزة أخرى كبيرة لنموذج xenograft حمار وحشي هو أنه من الممكن لدراسة تفاعلات الخلايا السرطانية المختلفة وتحليل كيف يمكن لكل نوع من الخلايا التأثير على سلوك الآخر. يمكن حقن خلايا سرطانية بشرية مختلفة (استنساخات مختلفة من نفس الورم أو من أورام مختلفة). في هذا المثال، وصفت اثنين من خطوط خلايا لجنة حقوق الطفل المستمدة من نفس المريض مع الأصباغ الدهنية المختلفة ومختلطة في نسبة 1:1 للحقن(الشكل 9J-K').
عند خلط خطوط الخلايا البشرية (لتوليد الأورام متعددة النسيلة) على نفس الكسب غير المشروع، وتجنب استخدام صبغة ديو لأن هذا يؤدي إلى تلطيخ مزدوجة غير محددة (الجدول 2). بدلا من ذلك استخدام على سبيل المثال ، CM - DiI (خط الخلية # 1) مع CMFDA الخضراء (خط الخلية # 2) ، أو CM - DiI (خط الخلية # 1) مع الأحمر العميق (خط الخلية # 2) (الجدول 2 ، الشكل 9J- K '، للحصول على تمييز سهل للسكان في نهاية التجربة. لتحديد تواتر كل استنساخ داخل الورم، استخدم نوعين مختلفين من العدادات في فيجي لتحديد كل استنساخ ثم قسمته على إجمالي عدد الخلايا (مجموع جميع المستنسخين) للحصول على الكسر النسبي لكل واحد (٪).
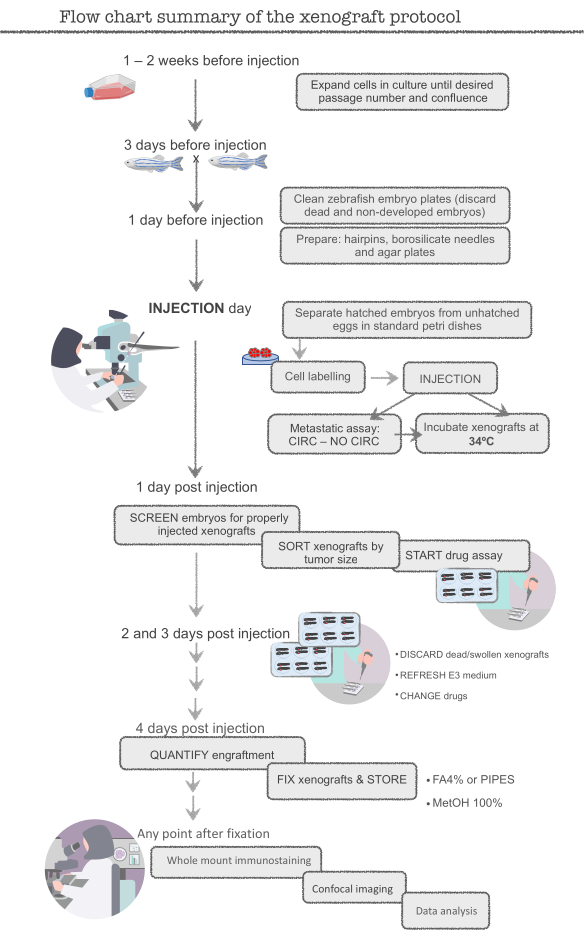
الشكل 1. ملخص مخطط تدفق بروتوكول xenograft حمار وحشي يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
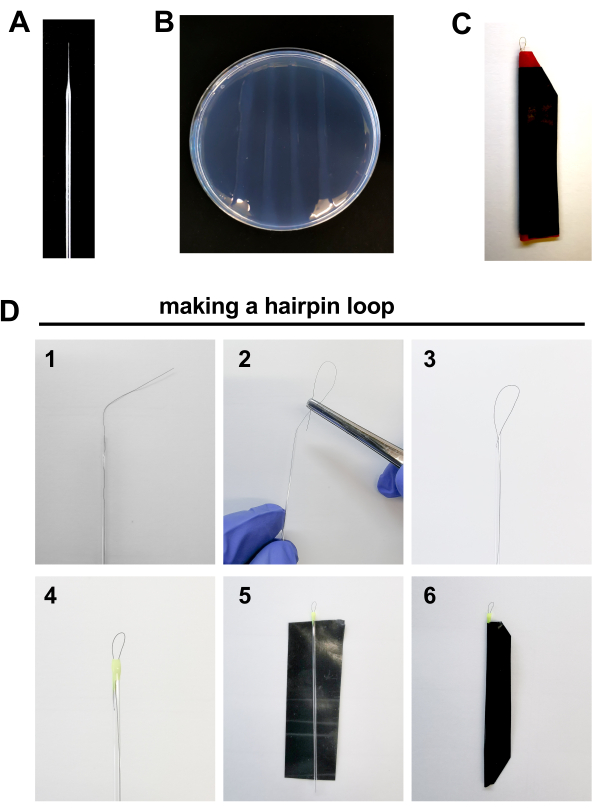
الشكل 2. مواد لحقن جنين حمار وحشي: أ. بوروسيليكات إبرة B. 2٪ لوحة أجاروز. جيم حلقة دبوس الشعر D. خطوات لجعل حلقة دبوس الشعر: 1.ضع 1 الشعر داخل أنبوب زجاجي الشعر ترك ما يقرب من 1 سنتيمتر من الشعر خارج الأنبوب. 2-3. حليقة الطرف الخارجي من الشعر مع مساعدة من ملقط في أنبوب زجاجي الشعرية تشكيل حلقة من ~ 0.5 مم طول. 4.ختم حافة أنبوب الشعرية مع قطرة من طلاء الأظافر. 5-6.ختم قطعة من الشريط الكهربائي حول الشعرية لحمايته من كسر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
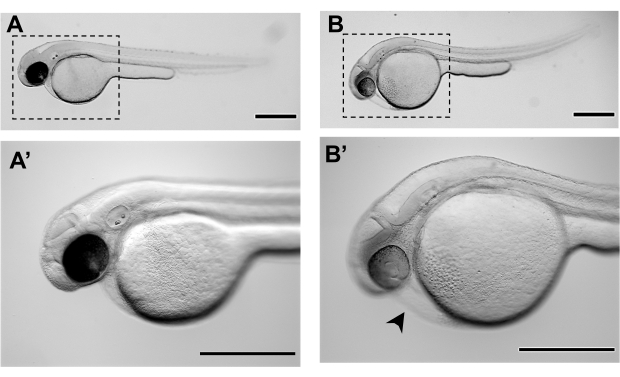
الشكل 3. صور مجسمة تمثيلية للأجنة حمار وحشي في 48 ساعة بعد الإخصاب (48 حصان): A-A'. مورفولوجيا طبيعية لجنين حمار وحشي في 48 حصان من التنمية، وعلى استعداد للميكرويينجيكت B-B'. مورفولوجيا جنين حمار وحشي لم يحقق مرحلة النمو الكافية للتجميل الدقيق عند 48 حصان ويعرض بالفعل درجة ما من الوذمة القلبية (رأس السهم الأسود) والصفار المنزعج. A' و B' هي تكبيرات من A و B على التوالي. تمثل أشرطة المقياس 500 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. التمثيل التخطيطي للوحة الميكروينجيكشن حمار وحشي إعداد: A. محاذاة الأجنة المخدرة في 3٪ Agar/2٪ لوحة Agarose. باء - ال 20 في المائ تمثيل بياني لجنين حمار وحشي بعد الإخصاب لمدة يومين ، مع سهم أسود يشير إلى الفضاء perivitelline (PVS). يمكن حقن الخلايا السرطانية C و D بزوايا مختلفة في PVS التي يتم حقنها في الفضاء perivitelline (PVS) من جنين ما بعد الإخصاب لمدة 48 ساعة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
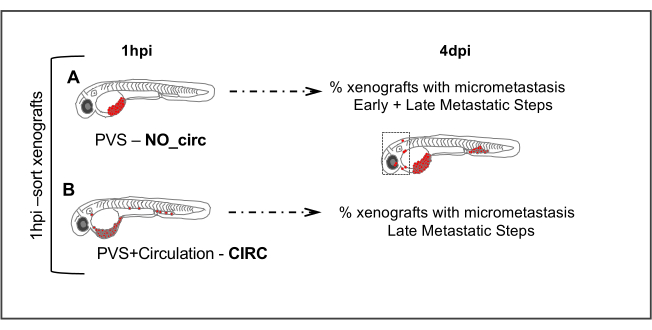
الشكل 5. المقايسة النقيلية. يتم فرز 1 ساعة بعد الحقن (1hpi) الأجنة المحقونة وفقا لغياب (NO_circ) أو وجود (CIRC) من الخلايا السرطانية في الدورة الدموية. في 4 أيام بعد الحقن يتم قياس عدد xenografts في كلتا المجموعتين التي تقدم micrometastasis كميا. الخلايا فيمجموعةNO_circ كان عليها أن تخضع لجميع الخطوات النقيلية لتكون قادرة على تشكيل micrometastasis ، في حين أن الخلايا في مجموعة CIRC(ب)تخضع فقط للخطوات الأخيرة من سلسلة النقيلي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
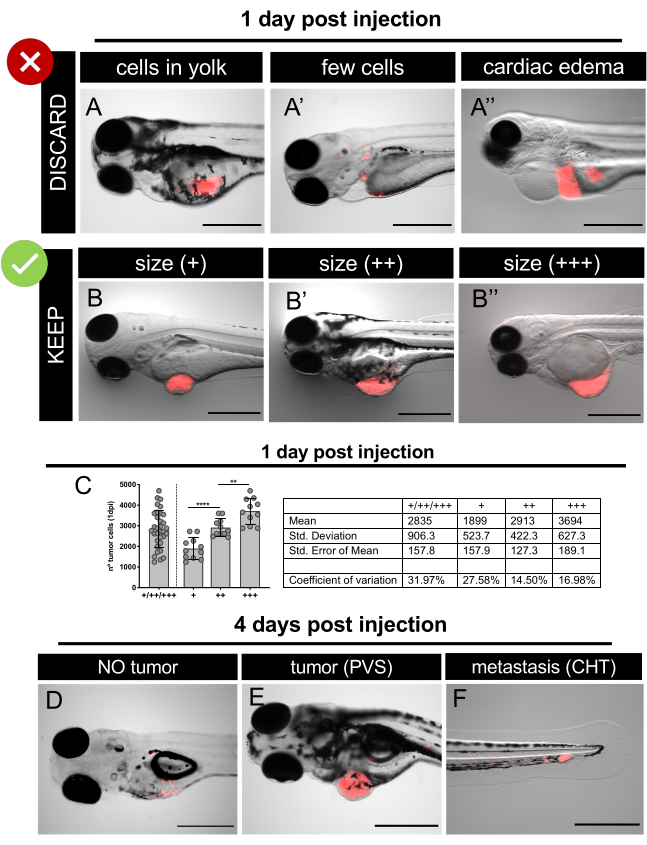
الشكل 6. صور مجسمة فلورية تمثيلية ل xenografts في يوم واحد بعد الحقن و4 أيام بعد الحقن. تم حقن الخلايا السرطانية البشرية التي تعبر عن البروتين الفلوري TdTomato (الأحمر) في جنينين حمار وحشي dpf. عند نقطة 1 نقطة في البوصة، قم بفحص الأجنة المحقونة وتجاهل الأجنة أو الأجنة التي تم حقنها بشكل سيئ بذمة(A-A')فرز الأجنة المحقونة بشكل جيد وفقا لأحجام الأورام(B-B''). ج. تحديد كمي تمثيلي للعدد الإجمالي للخلايا الموجودة في فئات حجم الورم المختلفة عند نقطة واحدة في البوصة في SW620 xenografts. تمثل كل نقطة xenograft كميا كما هو موضح في القسم 12.At 4 نقطة في البوصة ، وفحص اليرقات وتحديد الطبقات المختلفة: لا ورم (D)؛ مع الورم في الكهروضوئية(ه)ومع micrometastasis في CHT (F). تمثل أشرطة المقياس 500 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
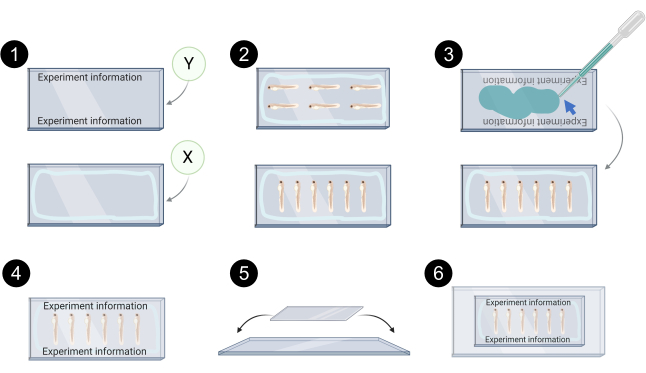
الشكل 7. التمثيل التخطيطي للxenograft تصاعد للتصوير confocal. 1. مثال على وضع العلامات في coverslip Y، خط أزرق فاتح في coverslip X يمثل محيط الذي يتم تطبيق هلام البترول / الشحوم السيليكون لمنع تسرب وسائل الإعلام المتصاعدة. 2. أمثلة من محاذاة xenograft على coverslip X للتصوير confocal. 3. يتم استخدام وسائط تصاعد مائي (السهم الأزرق) لربط coverslip Y على رأس coverslip X. 4. مثال على الأغطية المحملة بشكل صحيح. 5. ثم يتم وضع Coverlips على رأس شريحة زجاجية وتأمينها مع شريط شفاف. 6. شنت xenografts جاهزة للتصوير confocal. تم إنشاؤها باستخدام BioRender.com الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
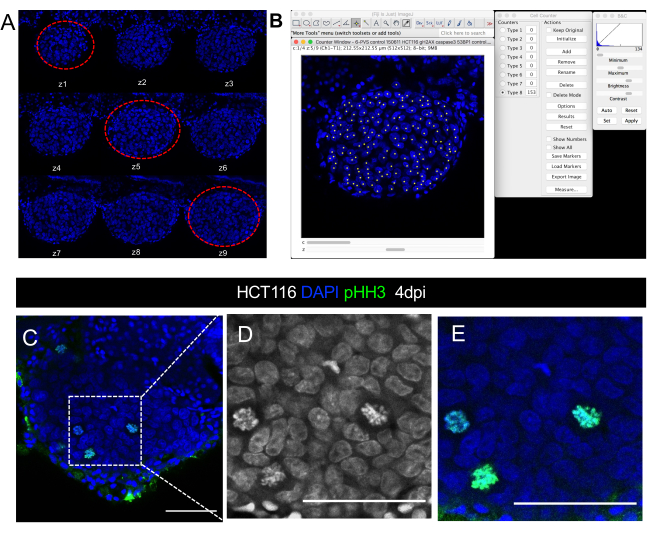
الشكل 8. التمثيل البصري للصورة المجهر confocal كمي لحجم الورم. Confocal صور Xenograft HCT116 في 4 أيام بعد الحقن A. سلسلة من شرائح z-stack في قناة DAPI المكتسبة بفاصل زمني 5 ميكرومتر. خطوط متقطعة حمراء دائرة شرائح تمثيلية الثلاثة المستخدمة لحساب الخلية. باء - ال 20 في المائ توضيح للقياس الكمي لنوى DAPI باستخدام المكون الإضافي لمكافحة الخلية في برنامج ImageJ/Fiji. سي إي. مثال على دقة الخلية الواحدة داخل الورم الذي يمكن فيه تصور / قياس الأرقام الميتوتيكية في DAPI أو استخدام الأجسام المضادة H3 فوسفو-هيستون (الأخضر). D و E يتكبير C. تمثل أشرطة المقياس 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
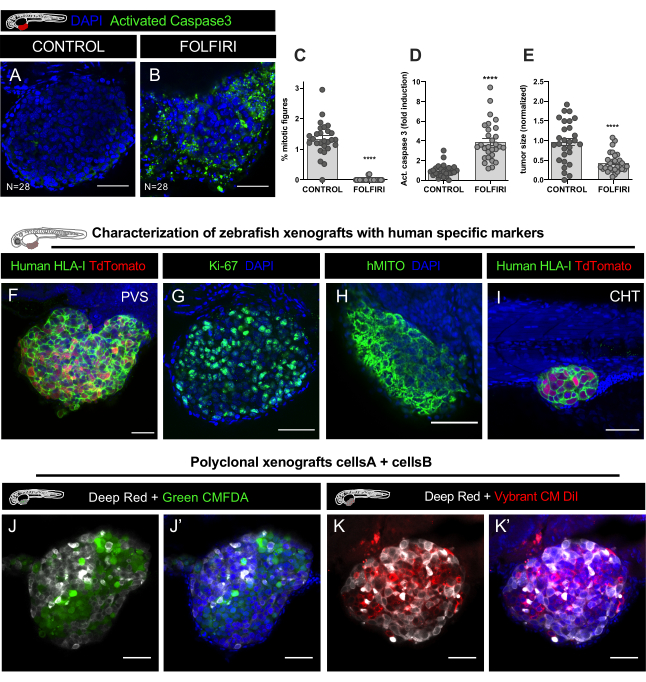
الشكل 9. النتائج التمثيلية. أ. إ. تم وضع علامة على خط خلايا سرطان القولون والمستقيم HCT116 مع Vybrant CM-DiI وحقنه في PVS لمدة يومين بعد الإخصاب (dpf) الأجنة. بعد الحقن، تم احتضان xenografts في 34 درجة مئوية. في 1 نقطة في البوصة، تم فحص xenografts وتوزيعها عشوائيا في الضوابط غير المعالجة وFOLFIRI، وعلاج لمدة 3 أيام متتالية وثابتة في 4 نقطة في البوصة. تمإجراء الفلورة المناعية للكشف عن الخلايا المبرمج ، وذلك باستخدام الأجسام المضادة كاسباس 3 المضادة للمشقوق وDAPI لاحتواء النوى. القياس الكمي للمؤشر mitotic C، موت الخلايا المبرمج (٪ من Caspase3 المنشط) D ، وحجم الورم E, كشفت أن FOLFIRI يؤدي إلى انخفاض كبير في الانقسام (مان ويتني اختبار, P<0.0001) وتحريض كبير من موت الخلايا المبرمج (اختبار مان ويتني, P<0.0001), يرافقه انخفاض 54٪ من حجم الورم (P<0.001). يشار إلى عدد xenografts تحليلها في الشكل وكل نقطة تمثل xenograft واحد. واو - ه. صور تمثيلية لسرطان القولون والمستقيم xenografts في 4 أيام بعد الحقن وصفت مع علامات محددة الإنسان باللون الأخضر (الإنسان HLA, ki67 وhMITO) في PVS وCHT I. جي جي Confocal صور xenografts متعدد النسيلة ، وحقن مع اثنين من مختلف خطوط الخلايا السرطانية القولون والمستقيم الإنسان وصفت مع تلطيخ ليبوفيلي CellTracker الأحمر العميق (Cy5 -- أبيض) ، CellTracker الأخضر CMFDA (488 -- الأخضر) وDAPI مكافحة. ك.ك. Confocal صور اثنين من مختلف خطوط الخلايا السرطانية القولون والمستقيم الإنسان وصفت مع تلطيخ ليبوفيلي CellTracker الأحمر العميق (Cy5 - أبيض)، Vybrant CM DiI (594 - الأحمر) وDAPI مكافحةالالتلوين. تمثل أشرطة المقياس 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| خط الخلية | نسيج | جنس | مورفولوجيا | وضع النمو | التقاء مثالي للحقن | عامل فصل للحقن | وقت الانفصال | بروتوكول وضع العلامات | حقن المتوسطة | تقسيم العدد الإجمالي للخلايا عن طريق (لتحقيق تركيز مثالي للحقن) | |||||||
| SW480 | الورم الغدي القولوني (الابتدائي) | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 2 mM | 5 دقائق | قارورة | برنامج تلفزيوني 1x | 0,25 | |||||||
| SW620 | الورم الغدي القولوني والمستقيم (الانبثاث) | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 2 mM | 5 دقائق | قارورة | برنامج تلفزيوني 1x | 0,25 | |||||||
| HCT116 | سرطان القولون والمستقيم (الابتدائي)، كراس متحولة | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 2 mM | 5 دقائق | قارورة | برنامج تلفزيوني 1x | 0,25 | |||||||
| هونج كونج3 | سرطان القولون والمستقيم، كراس WT | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 2 mM | 5 دقائق | قارورة | برنامج تلفزيوني 1x | 0,25 | |||||||
| HT-29 | الورم الغدي القولوني (الابتدائي) | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 2 mM | 5 دقائق | قارورة | برنامج تلفزيوني 1x | 0,2 | |||||||
| كاكو-2 | الورم الغدي القولوني (الابتدائي) | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 1 mM | 5 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | متوسط كامل | 0,25 | |||||||
| MCF-7 | سرطان الغدة الغدية للثدي (الانبثاث) | بشري | الظهاريه | تابع | 70% - 80 % | برنامج تلفزيوني / EDTA 1 mM | 5 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | 60٪ FBS + 40٪ متوسط كامل | 0,5 | |||||||
| Hs578T | سرطان الثدي (الابتدائي) | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 1 mM | دقيقتان | أنبوب طرد مركزي صغير سعة 1.5 مل | 60٪ FBS + 40٪ متوسط كامل | 0,5 | |||||||
| MDA-MB-468 | سرطان الغدة الغدية للثدي (الانبثاث) | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 1 mM | 8 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | 60٪ FBS + 40٪ متوسط كامل | 0,5 | |||||||
| MDA-MB-231 | سرطان الغدة الغدية للثدي (الانبثاث) | بشري | الظهاريه | تابع | 70% - 75 % | برنامج تلفزيوني / EDTA 1 mM | 5 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | متوسط كامل | 0,5 | |||||||
| RT112 | سرطان الخلايا الانتقالية المثانة البولية (الابتدائي) | بشري | الظهاريه | تابع | 85% - 90% | جربLE | 6 دقائق + كاشط الخلية | أنبوب طرد مركزي صغير سعة 1.5 مل | متوسط كامل | 0,5 | |||||||
| BFTC905 | سرطان الخلايا الانتقالية المثانة البولية (الابتدائي) | بشري | الظهاريه | تابع | 75% - 85% | جربLE | 10 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | 80٪ متوسط كامل + 20٪ PBS/EDTA 2 mM | 0,5 | |||||||
| J82 | سرطان الخلايا الانتقالية المثانة البولية (الابتدائي) | بشري | الظهاريه | تابع | 85% - 90% | جربLE | 10 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | متوسط كامل | 0,5 | |||||||
| RT4 | سرطان الخلايا الانتقالية المثانة البولية (الابتدائي) | بشري | الظهاريه | تابع | 85% - 90% | جربLE | 6 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | متوسط كامل | 0,5 | |||||||
| MIA باكا-2 | سرطان ظهارة البنكرياس (الابتدائي) | بشري | الظهاريه | تابع | 80% - 90% | جربLE | 3 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | 60٪ FBS + 40٪ متوسط كامل | 0,5 | |||||||
| بانك-1 | سرطان ظهارة البنكرياس (الابتدائي) | بشري | الظهاريه | تابع | 80% | جربLE | 5 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | برنامج تلفزيوني / EDTA 2mM | 0,5 | |||||||
| VC8 | الخلايا الليفية الرئة، BRCA2 متحولة، الموارد البشرية ناقصة | الهامستر الصيني | الظهاريه | تابع | 70% - 80 % | برنامج تلفزيوني / EDTA 1 mM | 5 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | متوسط كامل | 0,25 | |||||||
| VC8-B2 | الخلايا الليفية الرئوية، BRCA2 الإنسان، BRCA2 -/− نقص الموارد البشرية | الهامستر الصيني | الظهاريه | تابع | 70% - 80 % | برنامج تلفزيوني / EDTA 1 mM | 5 دقائق | أنبوب طرد مركزي صغير سعة 1.5 مل | متوسط كامل | 0,25 | |||||||
الجدول 1: التقاء مثالي في المختبر لحقن عدة خطوط خلايا
| صبغة الخلية | رقم الكتالوج | الطيف الفلوري (Exc. - Em.) | تخفيف المخزون | العمل تخفيف وصمة عار في قارورة | تخفيف العمل إلى وصمة عار في جهاز طرد مركزي صغير 1.5 مل | وقت الحضانة | الملاحظات | ||||||
| فيبرانت CM-DiI | V22888 | 549 نانومتر - 569 نانومتر | مخفف بالفعل | 4:1000 في برنامج تلفزيوني 1x | 4:1000 في برنامج تلفزيوني 1x | 15 دقيقة عند 37 درجة مئوية + 4 دقائق عند 4 درجات مئوية | |||||||
| فيبرانت ديو | V22886 | 484 نانومتر - 501 نانومتر | مخفف بالفعل | 5:1000 في برنامج تلفزيوني 1x | 5:1000 في برنامج تلفزيوني 1x | 15 دقيقة عند 37 درجة مئوية + 4 دقائق عند 4 درجات مئوية | ليس قرار جيد في التصوير confocal في 4 أيام بعد الحقن | ||||||
| متتبع الخلايا الأحمر العميق | C34565 | 630 نانومتر - 660 نانومتر | 1 mM في DMSO | 0.5 - 2.5 ميكرومتر في برنامج تلفزيوني 1x | 0.5 - 2.5 ميكرومتر في برنامج تلفزيوني 1x | 15 دقيقة عند 37 درجة مئوية | |||||||
| خلية التتبع الأخضر CMFDA | C7025 | 492 نانومتر - 517 نانومتر | 10 mM في DMSO | 0.5 - 2.5 ميكرومتر في برنامج تلفزيوني 1x | 0.5 - 2.5 ميكرومتر في برنامج تلفزيوني 1x | 15 دقيقة عند 37 درجة مئوية | تسرب المنتج إلى تجويف البطن بعد 48 ساعة من الحقن، ولكنه مثالي لدراسات الحقن المشترك | ||||||
الجدول 2: الصبغة والظروف
| حجم | # من اليرقات | E3 1x متوسط الحجم |
| 100 مم × 15 مم (قياسي) | حتى 50 | 20-25 مل |
| 60 مم × 15 مم | حتى 20 | 10 مل |
| 6-لوحة جيدا | حتى 15 لكل بئر | 3-4 مل لكل بئر |
الجدول 3: خيارات طبق بيتري
| E3 متوسطة 50x - الأسهم | ل 10 لترات من الماء العقيم: |
| 146.9 غرام من NaCl | |
| 6.3 غرام من KCl | |
| 24.3 غرام من CaCl2· 2H2O | |
| 40.7 غرام من MgSO4· 7H2O | |
| E3 متوسطة 1x - جاهزة للاستخدام | 400 مل من E3 متوسط 50x |
| 60 مل من 0.01٪ الميثيلين الأزرق الحل | |
| ملء ما يصل إلى 20 لتر من مياه نظام السمك | |
| Tricaine 25x – الأسهم والقتل الرحيم | 2 غرام من مسحوق تريكين |
| 500 مل من مياه التناضح العكسي | |
| 10 مل من 1 متر تريس (pH 9) | |
| ضبط إلى درجة الحموضة 7 | |
| تريكين 1x - التخدير | 20 مل من تريكين 25x |
| تعبئة ما يصل إلى 500 مل من مياه النظام | |
| 60 ملغم/مل بروناز - مخزون 100x | 1 غرام من البروناز |
| 16.7 مل ماء معقم | |
| 0.6 ملغم/مل بروناز – 1x جاهز للاستخدام | 100 ميكرولتر بروناز 100x |
| 9.9 مل من E3 متوسط 1x |
الجدول 4: تركيبات الحلول
Discussion
وقد أدى تزايد أهمية الحمار الوحشي كنموذج لتطوير السرطان وفحص الأدوية في العديد من المنشورات3، 4،7،13،14،16،18،19،20،21. ومع ذلك ، فإن حقن الخلايا السرطانية في أجنة حمار وحشي هو تقنية تتطلب مستوى عال من البراعة التي يمكن أن تكون صعبة للباحثين. في هذا البروتوكول ونحن نهدف إلى توفير معلومات عملية وبعض النصائح التي يمكن أن تساعد في التغلب على التحديات الأولية لإنشاء xenografts جنين حمار وحشي.
التعامل مع الخلية الحقن السابقة
هذا البروتوكول الأمثل لتوليد xenografts حمار وحشي مع خطوط الخلية يمكن تكييفها لأنواع مختلفة من الخلايا (السرطانية) مع مورفولوجيا مختلفة. نوصي بأن جميع خطوط الخلية المستخدمة لxenografts حمار وحشي هي الميكوبلازما الحرة. على عكس التلوث البكتيري الأخرى ، فإن وجود الميكوبلازما في زراعة الخلايا لا يولد تغييرات يمكن اكتشافها بسهولة تحت المجهر22. قد يؤثر تلوث الميكوبلازما على إمكانات الحرمان من خطوط الخلايا ، وحساسيتها للأدوية ، وكذلك صلاحية أجنة حمار وحشي.
على الرغم من أن الخلايا قد تستمر في الانتشار لفترة طويلة، إلا أن النمط الظاهري والنمط الجيني يمكن أن يكونا عرضة للتغيرات. من المهم أن تصبح على دراية مورفولوجيا وسلوك خطوط الخلية في الثقافة. نوصي بالحفاظ على عدد مقاطع الخلايا بعد ذوبانها بين 3-12 للحصول على نتائج قابلة للاستنساخ. وهكذا، ينبغي إجراء اختبارات الميكوبلازما العادية.
يجب أن تكون الخلايا في مرحلة السجل (مرحلة النمو الأسي قبل الوصول إلى التقاء ~ 70٪) في يوم الحقن. وهذا سيمكن من الحرمان الكافي والتطور السليم للسمات المميزة للورم. لمنع الاختلاف في النمط الظاهري للخلايا داخل xenograft، من الأهمية بمكان للحفاظ على التقاء لحقن ثابت بين التجارب. يمكن تكييف عدد الخلايا المحقونة مع خصائص كل خط خلوي لأن بعضها قد يتطلب كثافات أعلى من الحقن من أجل الازدهار في أجنة حمار وحشي.
اعتبارات وضع العلامات على الخلايا
لتصور أفضل للخلايا السرطانية البشرية للحقن والتحليل في المستقبل، يمكن تصنيف الخلايا السرطانية بالأصباغ الفلورية. بسبب الاختلافات في حجم الخلية، يختلف العدد الإجمالي للخلايا/الطول2 في الثقافات الملتصقة بين خطوط الخلايا. وهذا سيؤثر على فعالية بروتوكول تلطيخ وكذلك عدد الخلايا التي تم حصادها للحقن. الخلايا الكبيرة التي تنتج أرقاما منخفضة لكل قارورة (أي Hs578T) أو تنمو في مجموعات (أي BFTC905) سوف تتطلب تجميع عدة قوارير لتجربة واحدة. في هذه الحالة ، لا ينبغي أن يتم تلطيخ الخلايا مباشرة في القارورة لأن هذا سيؤدي إلى استخدام كميات مفرطة من الصبغة (تكلفة عالية). ومن ناحية أخرى، يمكن تلطيخ الخلايا الحساسة للغاية للدورات المفرطة من الطرد المركزي وكذلك تلك التي تنتج أعدادا كبيرة لكل قارورة (أي HCT116) مباشرة في القارورة ثم فصلها بمكشطة EDTA/cell (لمزيد من المعلومات انظر الجدول 1).
كلما كان ذلك ممكنا، بدلا من استخدام نهج الأنزيمية، استخدم EDTA لفصل الخلايا في يوم الحقن، بحيث الخلايا استعادة تقاطعات خلاياها بسرعة أكبر وتتعرض لخطوات أقل الطرد المركزي. ومع ذلك ، إذا كانت الخلايا حساسة لEDTA ، فإنها ملتزمة جدا أو تنمو في مجموعات - يمكن تطبيق طريقة أنزيمية. يعتمد تحسين التركيز المثالي للحقن وكذلك وسيلة الحقن على خصائص كل خط خلية ، وبالتالي قد يحتاج إلى بعض التعديلات(الجدول 1).
معايرة الميكرويجينكشن
على عكس تسليم أوليغونوكليوتيدات أو المخدرات في جنين حمار وحشي، لا يستخدم مساريف لمعايرة الإبرة عند العمل مع خطوط الخلية لxenografts. بعد مرور بعض الوقت أثناء الحقن ، ستبدأ الخلايا في تسد ، ومن الضروري قطع طرف الإبرة لزيادة قطرها أو تغيير الإبرة تماما. هذا الإجراء يعوق معايرة الإكراميات.
لمعالجة هذه المسألة، يتم تنظيم عدد الخلايا التي يتم الاستغناء عنها عن طريق ضغط القذف والوقت اللازم للوصول إلى حجم مماثل لعين الجنين داخل نبضات 1-3. ثم، لمزيد من السيطرة على حجم الورم، في 1 نقطة في البوصة، يتم فرز xenografts وفقا لحجم الورم كما هو مبين في الشكل 6 B-B". كما هو ممثل في المثال الشكل 6C، هذه الطريقة من الفرز فعالة في الحد من الاختلاف في أحجام الورم: إذا كنا تجمع كل منهم معا (+، ++، +++ ) STEV هو ~ ضعف ++ فئة (~ 906 خلايا إلى ~ 422 خلايا) والاختلاف معامل هو ~ 31.9٪ مقارنة مع 14،5٪ في ++الفئة. منذ المرجع للحقن هو حجم، والعدد الإجمالي للخلايا يختلف كثيرا بين أنواع الخلايا - يجري تعتمد على حجم وشكل الخلايا. على سبيل المثال، تنتج الخلايا الكبيرة التي تحتوي على الكثير من السيتوبلازم مثل سرطان الثدي Hs578T أوراما أصغر بكثير (~ 600 خلية). أيضا، يتطلب كل خط الخلية عدد مختلف من الخلايا. على سبيل المثال، أظهرت خطوط خلايا سرطان المثانة البولية HT29 CRC و RT112 أنه كلما ارتفع عدد الخلايا المحقونة، زادت وفيات سمك الحمار الوحشي. لذلك ، هناك حاجة إلى فترة من التحسين أثناء تطوير xenografts لاختبار ما إذا كان خط الخلية له آثار سامة في الجنين أو يتطلب كثافة أعلى / أقل من الحقن.
موقع الحقن
واحدة من التناقضات الأكثر شيوعا عند توليد xenografts جنين حمار وحشي هو موقع الحقن. صفار عادة ما يكون المكان المفضل للحقن بسبب سهولة الوصول إليها. ومع ذلك ، لاحظنا أن الخلايا التي يتم حقنها في الصفار لديها ميل أعلى للموت. على الرغم من أن من الناحية الفنية أكثر صعوبة، نوصي بحقن في PVS وبقدر الإمكان من القلب. داخل PVS ، يمكن للخلايا تجميع أوعية وخلايا مناعية ، والهجرة ، والاتغلغل ، والبذخ وتشكيل الميكروماتاستاسيس ، إذا كانت تظهر خصائص النقيلي8،11.
كفاءة الحرمان
ومن المتوقع الاختلافات في كفاءة engraftment وحجم الورم بين خطوط الخلايا في 4 نقطة في البوصة بسبب درجاتها المتميزة من موت الخلايا القاعدية / البقاء على قيد الحياة / الانتشار ولكن أيضا بسبب المناعة الفطرية التي قد تظهر كل خط الخلية9.
الانبثاث
يتكون الانبثاث من سلسلة متعددة الخطوات من الأحداث التي يمكن تقسيمها إلى مرحلتين تعسفيتين. في المرحلة الأولى ، يجب على الخلايا السرطانية الانفصال عن الموقع الأساسي ، والهجرة وغزو الأنسجة المجاورة ثم التغلغل في مجرى الدم. في المرحلة الثانية ، يجب أن تبقى الخلايا السرطانية في الدورة الدموية ، وتستعمر من الأوعية الدموية أو اللمفاوية ، وتستعمر في النهاية في المواقع الثانوية23. للتمييز بين هذه الأحداث المبكرة والمتأخرة ومعالجة إمكانات / كفاءة الخلايا السرطانية المختلفة لتنفيذ هذه الخطوات ، قمنا بتصميم فحص بسيط.
بشكل عام ، عند حقنها في PVS ، يمكن للخلايا السرطانية الدخول مباشرة في الدورة الدموية ومن ثم الوقوع في فخ جسديا في الأنسجة الدموية الكاودة (CHT) (منطقة الذيل). ومع ذلك ، وفقا لخصائص كل خلية ورم - رأينا أن بعض الخلايا السرطانية تبقى في CHT 4 نقطة في البوصة وقادرة على تشكيل الأورام الدقيقة في حين تختفي الخلايا السرطانية الأخرى (تطهيرها بعد الوقوع في CHT).
لذلك ، من خلال مقارنة كفاءة الميكروميستاسيس (عند 4 نقطة في البوصة) عندما تم وضع الخلايا مباشرة في الدورة الدموية - CIRC (يجب على الخلايا فقط أن تمر عبر الخطوات المتأخرة من الانبثاث) مقابل متى لا - NO CIRC (تحتاج الخلايا إلى المرور بخطوات مبكرة ومتأخرة لتكون قادرة على تشكيل ميثلاستاس) يمكننا تقييم إمكاناتها النقيلية المبكرة أو المتأخرة. لقد لاحظنا الخلايا السرطانية التي يمكن أن تشكل بكفاءة micrometastasis في CHT في كلتا المجموعتين (CIRC و NO CIRC)، مما يشير إلى أن هذه الخلايا لديها القدرة على الخضوع لجميع خطوات سلسلة النقيلي (SW480 و MDA-MB-468 على سبيل المثال)8،11. في المقابل، الخلايا السرطانية الأخرى لديها إمكانات النقيلي منخفضة جدا في كلتا المجموعتين، بالكاد من أي وقت مضى جعل micrometastasis، حتى عندما حقن في الدورة الدموية (أي مرئية في CHT في 24 hpi، ولكن في 4 نقطة في البوصة أنها لم تعد هناك، Hs578T على سبيل المثال)8. ومع ذلك ، وجدنا بوضوح مجموعة أخرى - واحدة قادرة فقط على تشكيل الميكروكميتاسيس عند حقنها في الدورة الدموية (يمكننا فقط مراقبة الميكروفيتاستاسيس في مجموعة CIRC). وهذا يشير إلى أن هذه الخلايا لديها كفاءة منخفضة في تنفيذ الخطوات الأولى من سلسلة النقيلي ولكن من ناحية أخرى قادرة على البقاء على قيد الحياة في الدورة الدموية، والبذخ واستعمار موقع بعيد.
التلطخ المناعي والتصوير
قبل التثبيت، يمكن استخدام بروتوكول الحقن هذا لأساليب التصوير الحية الأخرى مثل المجهر تباين التداخل التفاضلي الحي (DIC)، المجهر قرص الغزل، التصوير البؤري الحي عالي الدقة والمجهر ورقة الضوء، الخ.
الخلايا الميتة والحطام الخلوي تبدو مشرقة عندما لوحظ من خلال مجسم الفلورسنت ويمكن أن يكون مخطئا للخلايا الحية، وخاصة إذا كان الهدف من الدراسة هو تقييم الإمكانات النقيلي لخطوط الخلية. نود أن نؤكد على أهمية إجراء التصوير الكونف البؤري مع علامات صلاحية محددة وDAPI لتقييم حالة بقاء الورم وmicrometastasis. أيضا، من الضروري استخدام أجسام مضادة بشرية محددة للكشف عن الخلايا البشرية مثل الميتوكوندريا المضادة للإنسان أو HLA المضادة للإنسان. عند تنفيذ البروتوكول ، وتدريب عيون المجرب من خلال مقارنة تلطيخ في مجسم مع الصور confocal. بعد مرور بعض الوقت، يمكن للمجربين التمييز بوضوح بين الحطام والخلايا الحية في المنظار المجسم الفلوري.
على الرغم من أن هناك طرق أخرى لقياس عبء الورم مثل منطقة الفلورسينس بأكملها تستخدم على نطاق واسع ، فإننا نوصي بإجراء بقع مناعة التركيب الكامل والتصوير البؤري كطريقة أكثر دقة. ليس فقط كفاءة تلطيخ صبغة الدهون متغير جدا (أي أن بعض الخلايا ملطخة بشكل جيد للغاية في حين أن البعض الآخر ليس - ربما بسبب محتوى الدهون في أغشيتها) ، ولكن أيضا مرات عديدة تشكل الأصباغ الدهنية مجاميع ، وتميل الخلايا الميتة إلى أن تكون أكثر إشراقا - مما يخلق العديد من القطع الأثرية التي يمكن أن تكون خاطئة للخلايا الحية.
يمكن نقل الخلايا مع البروتينات الفلورية للمساعدة في تتبعها وتخطي وضع العلامات على الخلايا. ومع ذلك، تأكد من أن الخلايا المنقولة وغير المنقولة تنتج نفس النتائج في xenografts حمار وحشي.
وبالإضافة إلى ذلك، يمكن الضامة phagocyte هذه الخلايا الفلورية الحطام تصبح وصفت fluorescently والهجرة، وتوليد خلايا النقيلي إيجابية كاذبة. وبالتالي، نوصي بسلسلة من الأدوات التحليلية، والتي بالطبع يمكن توسيعها لتشمل العديد من القراءات الأخرى لتفسير أكثر دقة لسلوك الورم:
- الانتشار - القياس الكمي للأرقام ميتوتي مع DAPI أو المضادة pHH3Ser10 الأجسام المضادة (ميرك Millipore القط #06-570)،
- موت الخلية عن طريق موت الخلايا المبرمج- الأجسام المضادة المضادة Caspase3Asp175 (الخلية Signalling تكنولوجيز القط #9661) أو ما يعادلها،
- حجم الورم - DAPI العد- الخلايا السرطانية البشرية تظهر منظمة الكروماتين متميزة جدا، لذلك يتم تمييزها بسهولة من خلايا حمار وحشي، ومن الممكن دائما لمضاعفة الاختيار مع الصبغة (عندما كنت تدريب العين)،
- للدراسات النقيلي، للكشف عن الخلايا البشرية بشكل لا لبس فيه ، - HLA المضادة للإنسان (Abcam EP1395Y Cat. #ab52922) ، الميتوكوندريا المضادة للإنسان (ميرك ميليبور القط #MAB1273 - استنساخ 113-1).
للحصول على confocal مع فاصل زمني 5 ميكرومتر بين شرائح في كومة Z من الخلايا السرطانية السيطرة HCT116 (متوسط الحجم النووي من 10-12 ميكرومتر من القطر) مع DAPI counterstaining، لاحظنا أن يتم تقاسم ~ 50٪ من الخلايا بين شريحتين متتاليتين. لذلك، إذا تم حساب كل شريحة، هناك خطر كبير من عد نفس الخلايا مرتين. ذهابا وإيابا بين شرائح لتجنب المشاكل في نتائج القياس الكمي في تقنية تستغرق وقتا طويلا وعرضة للخطأ. لتسهيل القياس الكمي للعدد الإجمالي للخلايا والسماح لمزيد من الاستنساخ بين الباحثين، أنشأنا صيغة حجم الورم الموصوفة سابقا في هذا البروتوكول8.
أدرجنا رقم تصحيح (1.5) لحساب ~ 50٪ الخلايا المشتركة بين شرائح. وجدنا أن متوسط الخطأ في العد اليدوي للورم بأكمله بين الباحثين كان 20٪. اثنين من الباحثين الذين يستخدمون الصيغة كان خطأ 2٪. استخدام هذه الصيغة لديها 93٪ معدل الدقة ومعدل إعادة الإنتاج 98٪. كما اختبرنا الأساليب الآلية، ولكنها أظهرت خطأ أعلى من 50٪ بسبب إعدادات العتبة.
نظرا لخصائص الخلايا المبرمج ، فإن التحديد الكمي لخلايا Caspase 3 المنشطة أكثر صعوبة. لتقليل عدد الأخطاء والتباين في النتائج، نوصي بحساب عينات التحكم والتجريبية من قبل نفس الباحث. بالإضافة إلى ذلك ، عند تعلم هذه التقنية ، يجب على الباحث الجديد عد الصور التي تم قياسها بالفعل من قبل الباحثين الأكثر خبرة لمقارنة النتائج والتدريب.
يمكن تمديد مدة الفحص إذا لزم الأمر. ومع ذلك ، من المهم النظر في أن يرقات حمار وحشي تتطلب تغذية حية بدءا من ~ 7 أيام بعد الإخصاب (5 أيام بعد الحقن). بالإضافة إلى ذلك ، قد تختلف المبادئ التوجيهية واللوائح الخاصة برفاه الحيوان المطبقة على اليرقات التي يزيد عمرها عن 6 أيام بعد الإخصاب.
يوفر هذا البروتوكول أدوات مفيدة لتمكين باحث واحد من حقن ما يقرب من ~ 200-300 يرقة حمار وحشي في الساعة؛ ونتائج الفحص الكامل، بما في ذلك التحليل والتفسير الإحصائي، التي تم الحصول عليها في ثلاثة أسابيع. نأمل أن يساعد هذا البروتوكول الباحثين على أن يصبحوا خبراء في توليد زنوبرافت سمك الحمار الوحشي. ليس بالأمر السهل؛ بل هو أمر غير سهل. تحتاج إلى ممارسة ولكن سوف تحصل هناك. حظ سعيد!
Disclosures
اي
Acknowledgements
نشكر مؤسسة شامباليمود، كونجنتو (LISBOA-01-0145-FEDER-022170، بتمويل مشترك من FCT/Lisboa2020) للتمويل. زمالات FCT لنائب الرئيس (SFRH/BD/118252/2016)، MML (PD/BD/138203/2018). جميع أعضاء مختبر فيور لإجراء مناقشات حاسمة؛ ب. كوستا وسي ريبيلو دي ألميدا لتبادل البيانات؛ وأعضاء مختبرنا C. ريبيلو دي ألميدا، م. باروسو و ل. لييت لمشاركتهم في الفيديو. نود أن نشكر مرفق CF Fish Facility (C. Certal و J. Monteiro وآخرون) وفريق شامباليمود للاتصالات والأحداث والتوعية على وجه الخصوص ألكسندر أزينهيرا على صناعة الأفلام الرائعة وكاتارينا راموس وتيريزا فرنانديز على مساعدتهما.
Materials
| Name | Company | Catalog Number | Comments |
| Agar for bacteriology | VWR | 97064-336 | Agar plate |
| anti-Caspase3Asp175 (Rabbit monoclonal) | Cell Signalling Technologies | 9661 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti-human HLA (Rabbit monoclonal) | Abcam EP1395Y | ab52922 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti- 488 (Rabbit monoclonal) | ThermoFisher Scientific | 35552 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| anti- 594 (Rabbit monoclonal) | ThermoFisher Scientific | 35560 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| CellTracker Deep Red Dye | ThermoFisher Scientific | C34565 | Lipophilic dye (Dilution 1:1000) |
| CellTracker Green CMFDA Dye | ThermoFisher Scientific | C2925 | Lipophilic dye (Dilution 1:1000) |
| Conical Centrifuge tube 50mL | VWR | 525-0610 | |
| Conical Centrifuge tube 15mL | VWR | 525-0604 | |
| DAPI | Nuclear and chromosome counterstain | ||
| Laser-Based Micropipette Puller P-2000 | Sutter-Instrument | Micropipette Puller | |
| Microcentrifuge tube 1.5mL | Abdos | P10202 | |
| Microscope slides, cut edge | RS France | BPB016 | Slides for mounting |
| Mowiol | Sigma-Aldrich | 81381 | Mounting medium |
| Pneumatic Picopump | World Precision Instruments | PV820 | Microinjector |
| Rectangular cover glasses, Menzel Gläser | ThermoFisher Scientific | 631-9430 | Coverslips for mounting |
| SeaKem LE Agarose | Lonza | 50004 | Agar plate |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100-4 | Borosilicate capillaries |
| TrypLE | Gibco | 12605036 | Enzymatic detachment solution |
| Vaseline | Petroleum jelly for slide sealing | ||
| Vybrant CM-DiI Dye | ThermoFisher Scientific | V22888 | Lipophilic dye (Dilution 1:1000) |
| Vybrant DiO Cell-Labeling Solution | ThermoFisher Scientific | V22886 | Lipophilic dye (Dilution 1:1000) |
| ZEISS Axio Zoom.V16 for Biology | ZEISS | Fluorescence Stereo Zoom Microscope | |
| Zeiss LSM 710 | ZEISS | Confocal microscope |
References
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97, 889-938 (2017).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. Journal of Clinical Investigation. 122, 2337-2343 (2012).
- Stoletov, K., Klemke, R. Catch of the day: zebrafish as a human cancer model. Oncogene. 27, 4509-4520 (2008).
- Weintraub, A. All eyes on zebrafish. Lab Animals. 46, 323-326 (2017).
- Novoa, B., Figueras, A. Zebrafish: Model for the Study of Inflammation and the Innate Immune Response to Infectious Diseases. Current Topics in Innate Immunity II. Lambris, J. D., Hajishengallis, G. , Springer. 253-275 (2012).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nature Reviews Cancer. 20, 263-273 (2020).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Póvoa, V., et al. Innate immune evasion revealed in a colorectal zebrafish xenograft model. Nature Communications. 12, 1156(2021).
- Galletti, G., et al. Targeting Macrophages Sensitizes Chronic Lymphocytic Leukemia to Apoptosis and Inhibits Disease Progression. Cell Reports. 14, 1748-1760 (2016).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Communications Biology. 3, 1-13 (2020).
- Varanda, A. B., Martins-Logrado, A., Godinho Ferreira, M., Fior, R. Zebrafish Xenografts Unveil Sensitivity to Olaparib beyond BRCA Status. Cancers. 12, 1769(2020).
- Osmani, N., Goetz, J. G. Multiscale Imaging of Metastasis in Zebrafish. Trends in Cancer. 5, 766-778 (2019).
- Hyenne, V., et al. Studying the Fate of Tumor Extracellular Vesicles at High Spatiotemporal Resolution Using the Zebrafish Embryo. Developmental Cell. 48, 554-572 (2019).
- Costa, B., et al. Developments in zebrafish avatars as radiotherapy sensitivity reporters - towards personalized medicine. EBioMedicine. 51, 102578(2020).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish Avatars towards Personalized Medicine-A Comparative Review between Avatar Models. Cells. 9, 293(2020).
- TRICAINE - Protocols. ZFIN Community Wiki. , Available from: https://wiki.zfin.org/display/prot/TRICAINE (2021).
- Zhao, C., et al. A Novel Xenograft Model in Zebrafish for High-Resolution Investigating Dynamics of Neovascularization in Tumors. Plos One. , (2011).
- Veinotte, C. J., Dellaire, G., Berman, J. N. Hooking the big one: the potential of zebrafish xenotransplantation to reform cancer drug screening in the genomic era. Disease Models & Mechanisms. 7, 745-754 (2014).
- Haldi, M., Ton, C., Seng, W. L., McGrath, P. Human melanoma cells transplanted into zebrafish proliferate, migrate, produce melanin, form masses and stimulate angiogenesis in zebrafish. Angiogenesis. 9, 139-151 (2006).
- Zon, L. I., Peterson, R. The New Age of Chemical Screening in Zebrafish. Zebrafish. 7, 1(2010).
- Mycoplasma Contamination of Cell Cultures. InvivoGen. , Available from: https://www.invivogen.com/review-mycoplasma (2016).
- van Zijl, F., Krupitza, G., Mikulits, W. Initial steps of metastasis: cell invasion and endothelial transmigration. Mutation Research. 728, 23-34 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved