Method Article
דור של זברה דג זחל קסנוגרפטים וניתוח התנהגות הגידול
In This Article
Summary
כאן, אנו מספקים פרוטוקול צעד אחר צעד, עם טיפים ליצירת קסנוגרפטים והנחיות לניתוח התנהגות הגידול, חיסוניות של כל ההר, וכימות הדמיה confocal.
Abstract
זברות זברה קסנוגרפטים נמצאים בשימוש נרחב לחקר הסרטן לבצע vivo ומחקרים בזמן אמת של סרטן האדם. האפשרות לדמיין במהירות את התגובה לטיפולים אנטי סרטניים (כימותרפיה, הקרנות וביולוגיות), אנגיוגנזה וגרורות ברזולוציה של תא יחיד, מציבה את מודל קסנוגרפט זברה-דג כבחירה עליונה לפתח מחקרים פרה-קוליניים.
זברת הזברה xenograft assay מציג מספר יתרונות ניסיוניים בהשוואה לדגמים אחרים, אבל כנראה הבולט ביותר הוא הפחתת סולם גודל וכתוצאה מכך זמן. הפחתה זו של קנה המידה מאפשרת הדמיה של תא יחיד, שימוש במספר נמוך יחסית של תאים אנושיים (תואמים לביופסיות), הקרנות סמים בעלות תפוקה בינונית-גבוהה, אך הכי חשוב מאפשרת הפחתה משמעותית של זמן הבדיקה. כל היתרונות הללו הופכים את מבחני הקסנוגרפט של דגי הזברה לאטרקטיביים ביותר עבור יישומי רפואה מותאמים אישית עתידיים.
פרוטוקולי קסנוגרפט רבים של דגי זברה פותחו עם מגוון רחב של גידולים אנושיים; עם זאת, פרוטוקול כללי ומתוקנן כדי ליצור ביעילות זברה זחל זנגוגרפטים עדיין חסר. כאן אנו מספקים פרוטוקול צעד אחר צעד, עם טיפים ליצירת קסנוגרפטים והנחיות לניתוח התנהגות הגידול, חיסונות בכל ההר, וכימות הדמיה confocal.
Introduction
זברהפיש (דניו ריו) מתגלה כאורגניזם מודל בעל חוליות רב עוצמה לחקר התפתחות ומחלות. זברה-פיש חולקת תכונות גנטיות שמורות מאוד (כ-70% הומולוגיה גנטית ו-84% גנים הקשורים למחלות) ותכונות מורפולוגיות בסיסיות של איברים עם בני אדם1,2. שימור זה מאפשר שימוש בזברהפיש כדי לדגמן מספר מחלות אנושיות, כולל סרטן3,4.
הטיפול והתחזוקה של דגי זברה הוא הרבה יותר קל וחסכוני יותר מאשר עכברים בשל גודלם הקטן, פוריות גבוהה כל השנה והפריה חיצונית3,5. עוברי זברה אינם דורשים האכלה חיה במהלך 5-7 הימים הראשונים לחייהם ושימשו כמודל יעיל להתפתחות, זיהום וסרטן1,4,6,7. עוברי זברה בוקעים במהירות של 48 שעות לאחר ההפריה (hpf) והם בעלי חיים שוחים חופשיים עם כל האיברים שנוצרו, לב פועם ומערכת דם תפקודית, כבד, מוח, מוח כליות וכו'1,3. כמו כן, בשלב זה של התפתחות רק חסינות מולדת היא במשחק, חסינות אדפטיבית עדיין מתפתחת, המאפשר תחריט יעיל כללי של תאים אנושיים ללא צורך בשימוש במוטנטים immunocompromised7,8. עם זאת, חשוב לציין כי לא כל התאים האנושיים לחרוט באופן שווה9 וכי, למשל, עבור תאי לוקמיה הוכח כי phagocytes (נויטרופילים ומקפאגים) צריך להיות מדולדל עבור תחריט יעיל10.
המתיחה הגנטית של דג הזברה והשקיפות האופטית של שלבי העובר המוקדמים שלה מאפשרים הדמיה תוך-חיים של תא יחיד ברזולוציה גבוהה ובכך, להקמת טכניקות הדמיה מתקדמות בתחומים מגוונים של ביולוגיה. יתר על כן, בהקשר של סרטן, תכונות אלה שימושיות למחקרים בזמן אמת של השלבים המוקדמים ביותר של אינטראקציות מארח-גידול, כמו לימוד פוטנציאל אנגיוגני גרורתי, כמו גם אינטראקציות עם המערכת החיסונית המולדת8,9,11,12,13.
אמנם במבחן קסנוגרפט קצר אין זמן "אבולוציה" גרורתית - ניתן לנתח את היכולת גרורתית של תאי הגידול (כלומר, היעילות שלהם לעבור צעדים גרורתיים כמו פלישה, intravasation, הישרדות במחזור, פזרנות, קולוניזציה, ולכן ללמוד תהליכים אלה vivo ובזמן אמת8,11,13,14).
מאפייני מחזור החיים שלו מציבים את הזברה-פיש כמודל ייחודי לרפואה מותאמת אישית בסרטן. מבחנים יכולים להתבצע בפרק זמן קצר יותר ותוצאות המתקבלות בכמה שבועות7,8,9,11,12,15,16. הסלריות וההיתכנות של מבחנים אלה מספקים לרופאים ולחוקרים את האפשרות להשיג תוצאות תרגום שיכולות להיות שימושיות לחולי סרטן, שעבורם הזמן הוא צורך חיוני.
למרות הניסיונות הגוברים לייצר קסנוגרפטים מוצלחים לעובר זברה, עדיין יש צורך בתקינה של הליך ההזרקה, כמו גם בהערכת הכדאיות של התא והתנהגות הגידול לאחר ההזרקה.
בפרוטוקול זה אנו מספקים לחוקרים מדריך ברור ומפורט צעד אחר צעד להזרקת קווי תאים סרטניים אנושיים בעוברים של דגי זברה וקיבעון, חיסוני, הדמיה וכימות של התנהגות תאי הגידול.
Protocol
מודל הזברה(דניו ריו)טופל ונשמר על פי הפרוטוקולים הסטנדרטיים של החקיקה האירופית לרווחת בעלי חיים, הוראה 2010/63/EU (הנציבות האירופית, 2016) ופלטפורמת הדגים Champalimaud. כל הפרוטוקולים אושרו על ידי הוועדה לאתית בעלי חיים Champalimaud וארגונים מוסדיים פורטוגזית-ORBEA (Órgão de Bem-Estar e Ética בעלי חיים / בעלי חיים רווחה ואתיקה גוף) ו DGAV (Direção Geral de Alimentação e Veterinária / הדירקטוריון הכללי למזון ווטרינריה).
הערה: לפני תחילת הניסוי העיקרי, להתאמן עם סרטן המעי הגס האנושי (CRC) קו התא HCT116. קו תאים זה קל להכנה (מתפשט מאוד), קל להזרקה וחריטות ביעילות רבה (סביב 95-100%). התחל עם תאים עודף (~ 12x106 תאים, בקבוקון T-75) ודגים עודפים (400 דגים) עד להיות בקיא בטכניקה, שכן תאים ודגים רבים יאבדו במהלך האימון. הניסויים מוכנים ברגע החריטה של ~ 95% מושגת HCT116 xenografts. ראה איור 1 לקבלת שרטוט של הפרוטוקול המלא.
1. הגדרה להזרקה
- שבועיים לפני ההזרקה, להרחיב את התאים בתרבות (ראה טבלה 1 לקבלת מדריך מפורט של המפגש במבחנה אופטימלית להזרקה של מספר קווי תאים).
- שלושה ימים לפני ההזרקה, לחצות את הזברה של הרקע הרצוי.
2. 24 שעות לפני ההזרקה
- נקו את לוחות העובר של הזברה (השליכו את כל העוברים המתים והלא מפותחים) ורענן את המדיום E3.
- בחדר תרבות התא, להשליך את מדיום תרבות התא מן הבקבוקים המתוכננים להזרקה, לשטוף פעם אחת עם 1x פוספט אגירה מלוחים (PBS) כדי להסיר את התאים המתים ולהוסיף מדיום טרי.
- הכינו את הכלים להליך ההזרקה, כגון: מחטי מיקרו-ג'ינג', צלחות אגרוז וסיכות ראש ליישור עוברים להזרקה (איור 2A-D, המפורט להלן).
- מחטי מיקרו-ג'ינג' (איור 2A)
- השתמש נימי זכוכית borosilicate (4 אינץ ', OD 1.0 מ"מ, אין חוט במשיכת מיקרופיפט (חום: ≈500; fil: 10; vel: 50; dec: 60; למשוך: 100).
- הכנת צלחת (איור 2B)
- מכינים 2% agarose ב H2O, לחמם אותו ויוצקים שכבה אחת של agarose מומס במכסה של צלחת פטרי נקי. תן לו polymerize ובעזרת סרגל, לעשות שלושה עד ארבעה קווים agarose ישר עבור היישור של העוברים.
- מכלול סיכת ראש (איור 2C-D)
- מניחים 1 שיער בתוך צינור נימי זכוכית משאיר כ 1 ס"מ של שיער מחוץ לצינור.
- מקפלים את הקצה החיצוני של השיער בעזרת מלקחיים לתוך הצינור נימי זכוכית ויוצרים לולאה של ~ 0.5 מ"מ אורך.
- לאטום את קצה הצינור נימי עם טיפה של לק. זה גם יעזור לתקן את הלולאה במקום. תן לו להתייבש. חזור על ההליך בקצה השני של הצינור.
- חותכים חתיכת סרט חשמלי (עמיד יותר, אמיד ונוקשה יותר מקלטת דבק רגילה).
- לאטום את הקלטת סביב נימי כדי להגן עליו מפני שבירה.
- מחטי מיקרו-ג'ינג' (איור 2A)
3. יום ההזרקה
- הפרד את העוברים שבקעו מביצים ללא מים. הוספת פרונאז 1x (0.6 מ"ג/מ"ל, טבלה 3) למדיום העובר בשלב זה יכולה להגביר את הבקיעה. מניחים את העוברים באינקובטור (ב 28 מעלות צלזיוס) עד להזרקה.
הערה: אין להשאיר את העוברים בתמיסת הפרונאז למשך יותר משעה, שכן האנזים יפעל על העוברים שבקעו ויגדיל את הסיכון לתמותה. ודא כי השלב ההתפתחותי של העוברים הוא זה המתאים ל-48 כ"ס (איור 3A, A') כדי למנוע את הסיכון לבצקת ותמותה. - הכן 1x Tricaine (מתוך מניה 25x).
הערה: מתכון מפורט ניתן למצוא בטבלה 3 וברשת המידע זברה - דף אינטרנט ZFIN17.
4. תיוג תאים להזרקה
הערה: תיוג של תאים יכול להתבצע ישירות בבקבוקון או בצינור microcentrifuge 1.5 מ"ל לאחר ניתוק אנזימטי. ראה דיון לקבלת מידע נוסף.
- הסר את מדיום תרבית התא ולשטוף את הבקבוק פעמיים (2x) עם 1X PBS.
- תווית התאים עם צבע ליפופילי של בחירה או ישירות בבקבוקון (2 פתרון מ"ל / בקבוקון T75) או בצינור מיקרוצנטריפוגה 1.5 מ"ל לאחר ניתוק אנזימטי. הימנע מחשיפה לתאי תאורה ודגרה ב- 37 °C (ראה טבלה 1 וטבלה 2 עבור תנאים/פתרונות).
- אם תיוג בבקבוקון
- הסר את הצבע, לשטוף עם 1x PBS ולנתק את התאים עם EDTA ומגרד תאים.
- העבר תאים לצינורות מיקרוצנטריפוגה של 1.5 מ"ל. צנטריפוגה במשך 5 דקות ב 300 x g ואז ללכת לשלב 4.5.
- אם תיוג בצינור מיקרוצנטריפוגה 1.5 מ"ל:
- צנטריפוגה 5 דקות ב 300 x g כדי להסיר את הצבע ולהשליך את supernatant. התחדש ב 1x PBS לשטוף.
- צנטריפוגה 5 דקות ב 300 x גרם ולאחר מכן ללכת לשלב 4.5.
- השלך את supernatant ו resuspend גלולה עם מדיום תרבות התא (עבור גלולה 50 μL להוסיף ~ 150-200 μL של בינוני).
- כימת את הכדאיות של התא באמצעות תא Neubauer עם הדרה כחולה Trypan או שיטה אחרת של בחירה.
- צנטריפוגה במשך 4 דקות ב 300 x g ולזרוק את supernatant. התחדשו בתאים באמצעי ההזרקה.
הערה: ריכוז התאים המומלץ (באופן כללי מ 0.25-0.5x106 תאים / μL) ובינוני ניתן למצוא בטבלה 1. - מנקודה זו ואילך, לשמור את התאים על קרח.
5. הליך הזרקה
- יש למרדים את העוברים ב-1x Tricaine למשך 5 דקות.
- עם פיפט פסטר פלסטיק, להעביר כמות קטנה (~ 50) של עוברים מורדמים לצלחת agarose וליישר אותם בזהירות בעזרת לולאת סיכת ראש. הקפידו לשמור על מרחק בין העוברים, במיוחד בין החלמון של אחד וראש הבא(איור 4A).
הערה: מספר העוברים ליישר ישתנה בהתאם לרמת המומחיות של החוקר המבצע את הזריקות. התחל עם כמה (~ 10 - 20). לקבלת סכמטיות של המיקום הנכון של העוברים בצלחת אגר/אגרוז ראו איור 4A. - ודא העוברים מיושרים לא להתייבש בצלחת agarose כדי למנוע תמותה, על ידי הוספת בזהירות 1-3 טיפות של פתרון 1x Tricaine לצלחת.
- הקש קלות על צינור המיקרוצנטריפוגה כדי לנצל מחדש את התאים. טען מחדש את מחט ההזרקה עם השעיית התא באמצעות קצה microloader הימנעות בועות אוויר, כפי שהם יכולים לסכן את שלמות העוברים.
- פתח את שסתום לחץ האוויר (40 psi), להגדיר את microinjector בזהירות למקם את מחט microinjection לתוך המחזיק.
הערה: השתמש בהגדרות המיקרו-אינג'קטור המומלצות הבאות: לחץ החזק - פתח אוורור (3 psi); לחץ נפלט - פתח אוורור; טווח - 100 אלפיות השנייה. - חותכים את מחט microinjection קרוב לקצה עם מלקחיים Dumont #5 או דומה תחת stereomicroscope.
הערה: הקצה חייב להיות בוטה ודק מספיק כדי לאפשר לתאים לעבור ללא סתימה, כמו גם כדי למנוע פגיעה בעוברים ואיבוד תאים. קצה מחט microinjection עבה יפגע העובר ולקדם את היווצרות של בצקת או מוות זברה. Graticule אינו משמש לכיול מחט. ראה דיון לקבלת הסבר מפורט. - לפני הזרקת העוברים, לבדוק את הלחץ microinjector החל בלחץ נפלט הנמוך ביותר עד ~ 1-3 פולסים נפח דומה לגודל של העין של העובר זברה מושגת.
הערה: מומלץ להשתמש בסטריאומיקרוסקופ פלואורסצנטי במידת האפשר בתחילת האימון. זה יאפשר זיהוי קל יותר של תאים בעלי תווית פלואורסצנטית. - חודרים בזהירות באמצע החלמון של העובר, מורידים את זווית המחט ודוחפים בזהירות עד שהקצה של המחט מגיע למרחב הצמיג (PVS)(איור 4B-D).
- לחץ על דוושת המיקרו-אינג'קטור והזרק את התאים לתוך PVS. השתמש בעין העובר כמדריך. נסו להזריק נפח של תאים דומים לגודל העין של העובר וככל האפשר מהלב כדי למנוע בצקת לב.
- בזהירות להסיר את המחט ולעבור על העובר הבא.
- כוונן את לחץ המיקרו-אינג'קטור במידת הצורך.
הערה: תאים נוטים להתחיל לסתום, כך שניתן להגביר את הלחץ. במידת הצורך, ניתן לחתוך את נימי (כדי להגדיל את הקוטר) תוך הפחתת הלחץ. - מעבירים את העוברים המוזרקים לצלחת פטרי נקייה(שולחן 4)עם תמיסת 1x Tricaine ומשאירים אותם לנוח במשך 5-10 דקות. זה ייתן זמן לפצע להיסגר.
הערה: כדי להעביר את העוברים מצלחת אגר לצלחת פטרי להוסיף כמה טיפות של 1x פתרון Tricaine על גבי העוברים בזהירות לאסוף אותם עם פיפט פסטר פלסטיק. זרוק את העוברים שנאספו בצלחת פטרי חדשה עם פתרון 1x Tricaine. - הסר את הפתרון 1x Tricaine ולהוסיף בינוני E3 טרי.
- דגירה xenografts ב 34 °C (טמפרטורה נפגעת בין הישרדות קווי התא האנושי ופיתוח זברה8).
6. מבחנים גרורתיים
- כשעה לאחר ההזרקה (hpi), מסננים את העוברים המוזרקים על סטריאומיקרוסקופ פלואורסצנטי וממיינים את הקסנוגרפטים לשתי קבוצות, בהתאם להיעדרות (איור 5A) או לנוכחות (איור 5B) של תאים במחזור.
הערה: גם אם רק תא סרטני אחד מזוהה בלב או במחזור הדם, כוללים קסנוגרפטים אלה בקבוצה של קסנוגרפטים עם תאים במחזור. לחלופין, תאים יכולים להיות מוזרקים ישירות למחזור הדם כדי להגדיל את המספרים של xenografts בקבוצה זו.
7. 1 יום לאחר הזרקה
- בסטריאומיקרוסקופ פלואורסצנטי מנתחים בקפידה כל עובר ובוחרים את אלה עם גידולים מוזרקים כראוי (איור 6).
הערה: במידת הצורך, יש למרדים את העוברים המוזרקים בתמיסת Tricaine 1X לפני ההקרנה. - השלך את העוברים/קסנוגרפטים הבאים (איור 6A-A''):
• ללא גידול/מורפולוגיה חריגה/מת,
• עם בצקת לב ו/או חלמון,
• עם תאים סרטניים רק בחלמון,
• עם מעט מאוד תאים סרטניים. - מיין קסנוגרפטים נבחרים בהתאם לגודל הגידול שלהם. השתמש בגודל העין להשוואה (איור 6B-B', 6C).
• גידולים קטנים מגודל העין (+),
• גידולים באותו גודל כמו העין (++),
• גידולים גדולים מגודל העין (+++). - להפיץ את xenografts על פי הפריסה הניסיונית הרצויה ולהתחיל את בדיקת התרופה (שליטה לעומת סמים, וכו '). החלף את התרופות ואת E3 בינוני מדי יום (טבלה 4).
- דגירה קסנוגרפטים שמירה על הטמפרטורה של 34 מעלות צלזיוס עד סוף ההסתעפות.
8. 4 ימים לאחר הזרקה
- ביום האחרון של ההסתערות, יש למרדים את קסנוגרפטים עם תמיסת 1x Tricaine וליישר אותם בזהירות על צלחת אגר.
הערה: השלך קסנוגרפטים מתים או נפוחים. טיפולים תרופתיים ותאי גידול מסוימים יכולים לגרום לרעילות ובסופו של דבר לגרום לתמותה קסנוגרפט. קסנוגרפטים אלה אינם נחשבים לכימות חריטה. - כדי לקבוע את אחוז החריטה: בסטריאומיקרוסקופ פלואורסצנטי לנתח כל קסנוגרפט חי ולהעריך את ההיעדרות (איור 6D) / נוכחות (איור 6E) של גידולים ב- PVS.

- כדי לקבוע את אחוז הגרורות: בסטריאומיקרוסקופ פלואורסצנטי לנתח כל קסנוגרפט ולהעריך את הנוכחות/היעדר של micrometastasis ברקמה המטוטופיאטית caudal (CHT) של 2 הקבוצות שהוגדרו קודם לכן (CIRC ו- NO CIRC, איור 6F)
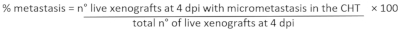
- על פי ההגדרה הניסיונית, בחר את קסנוגרפטים של עניין המתת חסד אותם עם 25x Tricaine (טבלה 3).
- לתקן אותם 4% פורמלדהיד (FA) לפחות 4 שעות בטמפרטורת החדר (RT) או לילה ב 4 מעלות צלזיוס.
הערה: השתמש בפורמלדהיד נטול מתנול (16% FA) מדולל ב-4% ב-PBS/0.1% טריטון. ממלאים את הצינורות למעלה עם קיבוע. מקמו את הצינורות אופקית כדי להבטיח קיבעון הומוגני של כל קסנוגרפטים, הגדלת החדירות ומניעת צבירת דג הזברה בתחתית. - לחילופין לתקן אותם עם צינורות (לכל 1 מ"ל: 100 μL של 1 M PIPES מלח נתרן (4 מעלות צלזיוס); 1 μL של 1 M MgSO4 (RT); 4 μL של 0.5 M EGTA (RT); 93.7 μL של 16% FA (RT); 801.3 μL של ddH2O).
הערה: PIPES משמר את הפלואורסצנטיות של קווים מהונדסים RFP ו- mCherry טוב יותר מ- 4% FA. - אם המערכת החיסונית תבוצע ביום אחר, החלף את ה-FA ב-100% מתנול (MetOH). Xenografts קבוע 100% מתנול ניתן לאחסן ב -20 °C (69 °F) ללא הגבלת זמן.
הערה: MetOH יכול לפגוע ביעילות של כתמים מסוימים (כלומר, פאלודין) ולהרים כמה תיוג פלואורסצנטי. אשר את היעילות של הנוגדנים בדגימות קבועות של MetOH מראש.
9. כל ההר immunostaining עבור הדמיה confocal
הערה: כל טכניקת האימונופלואורסצנטיות של ההר לוקחת 3 ימים מחולקים כדלקמן: היום הראשון הוא עבור חדירה של קסנוגרפטים דגירה נוגדנים ראשונית. היום השני לשטיפה ודגרת נוגדנים משנית והיום השלישי לשטיפה, קיבעון קסנוגרפטים ואחסון במדיית ההרכבה.
- יום 1
- אם xenografts אוחסנו 100% MetOH, rehydrate אותם על ידי סדרה של ירידה ריכוזי MetOH (75%, 50%, 25% MetOH מדולל PBS/0.1% טריטון). אם תוקן ב- FA, החלף אותו ב- PBS/0.1% טריטון.
- יש לשטוף 4x למשך 5 דקות ב-PBS/0.1% טריטון.
- לשטוף 1x במשך 5 דקות H2O.
הערה: הצינורות חייבים להיות ממוקמים אופקית תמיד קיבעון, חדירה ושטיפת צעדים אלא אם כן צוין אחרת. - החלף את H2O עבור אצטון קר כקרח דגירה ב -20 מעלות צלזיוס במשך 7 דקות.
הערה: מניחים צינור 50 מ"ל עם אצטון ב -20 מעלות צלזיוס כך שהוא מוכן לשימוש. צינורות Microcentrifuge חייב להיות ממוקם אנכית על מתלה, כך אצטון לא לדלוף החוצה. - יש לשטוף 2x למשך 10 דקות ב-PBS/0.1%טריטון.
- דגירה עם פתרון חסימת PBDX_GS עבור 1 שעה ב RT (מאגר חסימת PBDX_GS: 50 מ"ל של 1x PBS; 0.5 גרם של אלבומין סרום שור - BSA; 0.5 מ"ל של DMSO; 250 μL של 10% טריטון; 750 μL של סרום עזים - GS (15 μL / 1 מ"ל)).
- הסר PBDX_GS והוסף ~ 40 μL של דילול נוגדנים ראשוני (בדרך כלל 1:100).
הערה: נפח דילול הנוגדנים העיקרי משתנה בהתאם למספר הקסנוגרפטים הקיימים בצינור המיקרוצנטריפוגה. ודא שכל קסנוגרפטים שקועים. - דגירה במשך 1 שעה ב RT ולאחר מכן ב 4 מעלות צלזיוס לילה. מקם צינורות אנכית.
- יום 2
- הסר נוגדן ראשוני ולשטוף 2x במשך 10 דקות ב PBS / 0.1% טריטון.
- לשטוף 4x במשך 30 דקות PBS/0.05% Tween.
הערה: השלבים הבאים חייבים להתבצע בחושך (השתמש בנייר אלומיניום כדי להגן על צינורות מפני אור). - הסר PBS/0.05% Tween והוסף ~ 50-100 μL של דילול נוגדנים משני (בדרך כלל 1:200 - 1:400) + DAPI (50 מיקרוגרם / מ"ל) מדולל PBDX_GS.
- דגירה במשך 1 שעה ב RT ולאחר מכן ב 4 מעלות צלזיוס לילה. מקם צינורות אנכית והגן מפני אור.
- יום 3 (השתמש בנייר אלומיניום כדי להגן על צינורות מפני אור)
- הסר דילול נוגדנים משני ולשטוף 4x במשך 15 דקות ב PBS/0.05% Tween.
- יש לתקן בטמפרטורת החדר למשך 20 דקות ב-4% FA.
- יש לשטוף 1x למשך 5 דקות ב-PBS/0.05% טווין.
- הסר PBS/0.05% Tween והוסף טיפה אחת של מדיום הרכבה מימית לכל צינור מיקרוצנטריפוגה. מקם את הצינורות אנכית.
- הר או אחסן ב 4 מעלות צלזיוס מוגן מפני אור עד הרכבה. מקם את הצינורות אנכית.
10. הרכבה של קסנוגרפטים
הערה: יש להגן על צינורות מיקרוצנטריפוגה מהאור לאורך כל התהליך. קסנוגרפטים של דגי זברה מותקנים בין 2 כיסויים (24 x 60 מ"מ # 1.5). זה מאפשר להפוך את xenografts רכוב במהלך הדמיה confocal כך ששני הצדדים של הגידול (העליון והתחתון) נגישים. אין להשתמש בפיפטות פלסטיק עם מדיום הרכבה - קסנוגרפטים עלולים להיתפס בפיפט. ראה איור 7 לקבלת הייצוג השרטוטי של השלבים הבאים.
- תווית את coverslip Y ולאטום את הקצוות של coverslip X עם ג'לי נפט או גריז סיליקון, כדי למנוע את הדליפה של התקשורת הרכבה.
- מעבירים את קסנוגרפטים עם פיפט פסטר זכוכית לכיסוי X.
- בזהירות ליישר אותם עם סיכת ראש ולהסיר את מדיית הרכבה מימית עודף.
- הוסף מדיית הרכבה מימית כדי לסקר את Y.
- מניחים בזהירות כיסויים Y על גבי coverslip X. אל תלחץ על עטיפות כמו זה עלול לשבש את xenografts.
- הנח את החלקים המורכבים על גבי שקופית מיקרוסקופ ואבטח אותם באמצעות סרט הדבקה שקוף. פעולה זו מאפשרת טיפול קל יותר עבור הדמיה ואחסון confocal.
11. הדמיה קונפוקלית
הערה: עדשה אובייקטיבית טבילה אפוכרומטית 25x עם תיקון מים היא אופטימלית להדמיית גידולי PVS ברזולוציית תא יחיד (ראו איור 8C-C" ואיור 9A לדוגמאות).
- לרכוש דגימות באמצעות הפונקציה מחסנית z עם מרווח של 5μm בין כל פרוסה. לתמונות המיועדות לשחזור תלת-ממדי, בעיקר בכלים, יש להשתמש במרווח של 1.3μm בין פרוסות (איור 8A).
12. ניתוח וכימות
- השתמש בתוכנת FIJI/ImageJ או דומה לעיבוד וניתוח תמונה קונפוקלית.
- פתח את הנתונים הגולמיים ( .czi , .lsm וכו ') בתוכנת FIJI.
- לבחירת ערוץ אחד או כולו במצב ללא הפרדות צבע, לחצו: תמונה > 'צבעים' > הכלי ערוצים.
- להתאמת רמות הבהירות והניגודיות, לחצו על: > 'התאמת > איזון צבעים'.
- כדי לכמת את גודל הגידול
- בחר שלוש פרוסות מייצגות של הגידול, מלמעלה, באמצע ומלמטה, לכל מחסנית z לכל קסנוגרפט(איור 8 A).
הערה: רזולוציית Confocal משיגה ~ 60-70 מיקרומטר של עומק הגידול. אם הגידול גדול, ייתכן שלא ניתן יהיה לדמות את נפחו הכולל. - פתח גיליון אלקטרוני כדי להוסיף ביאורים לנתונים.
- ספור כל גרעין DAPI המתאים לתאי הגידול ב-3 הפרוסות שנבחרו (איור 8 A, B). כדי לעשות זאת:
- פתח את תוסף מונה התאים מ FIJI/ImageJ על-ידי לחיצה על תוספים > לנתח > מונה התאים.
- בכלי מונה תאים, לחץ על אתחול, בחר סוג מונה ולחץ על התמונה כדי להפעיל את מצב הספירה באופן ידני. עבור כל לחיצה, המונה מוסיף את מספר התאים שנספרים (מספר לחיצות).
- לאחר ספירת פרוסה מלאה אחת, שמרו את מספר התא במסמך Excel המתאים.
- בחזרה לפיג'י, לחץ על איפוס מחלון מונה התאים כדי למחוק את המידע אם ייעשה שימוש באותו מונה. אחרת, ניתן לשמור את המידע, וניתן להשתמש במונים אחרים עם פרוסות (או תאים אחרים).
- מעבר לפרוסת הייצוג השניה וחזרה על השלבים הקודמים. אסוף את כל הנתונים.
הערה: צביעה נגדית של DAPI משמשת בדרך כלל לספירת מספרי תאים עקב ההגדרה הברורה של תאים בודדים, עם זאת, ניתן להשתמש בכתמים ספציפיים לתאים אחרים.
- כדי להשיג את המספר הכולל של תאים בגידול להשתמש בנוסחה הבאה:
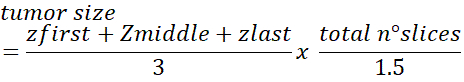
הערה: מספר התיקון 1.5 הוערך עבור תאים בקוטר גרעין ממוצע של ~ 10-12 מיקרומטר. ייתכן שיהיה צורך להתאים תיקון זה אם התאים גדולים/קטנים יותר. עיין בהקשה לקבלת פרטים נוספים אודות שיטה זו.
- בחר שלוש פרוסות מייצגות של הגידול, מלמעלה, באמצע ומלמטה, לכל מחסנית z לכל קסנוגרפט(איור 8 A).
- כדי לכמת סמנים אחרים (תאים חיסוניים, דמויות מיטוטיות, PPH3, Caspase3 מופעל, Ki67 וכו'), לכמת את כל הפרוסות באמצעות אותו תוסף (ראה איור 8C-C'' להדמיה של דמויות מיטוטיות). חלק את המספר הכולל של תאים שנספרו בגודל הגידול המתאים והכפל ב- 100 כדי לקבל את האחוז.
הערה: היזהר שתאים מסוימים ימוקמו בין שתי פרוסות, עבור הלוך ושוב בערימת z כדי לוודא שתא אחד לא נספר פעמיים.
תוצאות
זברה-פיש קסנוגרפט ככלי לחקר טיפולים נגד סרטן.
HCT116 קו תאים סרטן המעי הגס תויג עם CM-DiI והוזרק PVS של 2 ימים לאחר ההפריה (dpf) עוברים. לאחר ההזרקה, קסנוגרפטים היו דגירה ב 34 °C (69 °F), טמפרטורה המאפשרת את הצמיחה של תאים סרטניים מבלי להתפשר על התפתחות זברה. למחרת, קסנוגרפטים נבדקו על פי נוכחות או היעדר מסה של גידול ב- PVS (לא הוזרקו כראוי דגי זברה הושלכו והורדמו)(איור 6A-A'). קסנוגרפטים קובצו בהתאם לגודל הגידול שלהם (איור 6B-B')והופצו באופן אקראי (בצלחת של 6 בארות: ~ 12 xenografts לבאר) בפקדים שאינם מטופלים וכימותרפיה FOLFIRI (0.18 מ"מ חומצה פולינית, 0.08 מ"מ אירינוטקן ו 4.2 מ"מ Fluorouracil (5-FU)).
שליטה E3 וסמים הוחלפו מדי יום, ו zebrafish מת הושלך. 4 dpi, ושלושה ימים לאחר הטיפול (dpt), החריטה כמתה כמו בשלב 8.2 של הפרוטוקול. חריטה נחשבת לתדירות של קסנוגרפטים המציגים מסת גידול ב- PVS ב- 4 dpi. לדוגמה, אם בסוף הניסוי יש 40 זחלים חיים ו -35 מתוך 40 מציגים גידול ב- PVS, שיעור החריטה הוא 87.5%. קסנוגרפטים היו מורדמים וקבועים כדי להעריך את גודל הגידול ואפופטוזיס על ידי כשל חיסוני ומיקרוסקופיה קונפוקלית.
אימונופלואורסצנטיות בוצעה כדי לזהות תאים אפופטוטיים, באמצעות נוגדן Caspase 3 (Asp175) (ארנב, 1:100, #CST 9661) ו- DAPI (50 מיקרוגרם / מ"ל) לנגד גרעינים. ערכות נתונים של מחסנית תמונות (כל 5um) נרכשו במיקרוסקופ קונפוקל LSM710 וניתוח נתונים שבוצעו עם תוכנת FIJI / ImageJ כפי שהוסבר בשלב 12. כימות של האינדקס המיטוטי, אפופטוזיס (% של מופעל Caspase3) וגודל הגידול, התגלה כי FOLFIRI גורם לירידה משמעותית של מיטוזיס (מבחן מאן ויטני, P<0.0001) וגיוס משמעותי של אפופטוזיס (מבחן מאן ויטני, P<0.0001), מלווה בהפחתה של 54% בגודל הגידול (P<0.001) (איור 8C-E, איור 9A-E)
תכונות אלה שימושיות במסכי תרופות פנוטיפיות בתפוקה גבוהה, כמו גם כדי לבדוק את ההשפעות המהותיות והפיזיולוגיות של מספר טיפולים בסרטן בתוך זמן קצר.
אפיון קסנוגרפטים של דגי זברה אנושיים בנוגדנים ספציפיים לבני אדם
כמו בכל דגמי קסנוגרפט, קיים סיכון של זהות שגויה של התאים. לדוגמה, מקרופאגים יכולים phagocytose תאים סרטניים אנושיים, להיות מתויג עם צבע ליפופילי, ולאחר מכן לנסוע לאורך המארח זברה ולכן, תאים אלה יכולים להיות טועים עבור micrometastasis הגידול. לכן, תיוג קסנוגרפטים עם נוגדנים אנושיים ספציפיים כגון HLA אנושי, ki-67 או מיטוכונדריה אנושית (hMITO) הוא חיוני לאפיון ראשוני וגם להכיר את המורפולוגיה של תאי הגידול (איור 9F-I).
זברה-פיש קסנוגרפט לחקר אינטראקציות בין תאים.
יתרון גדול נוסף של מודל קסנוגרפט זברה הוא שניתן ללמוד את האינטראקציות של תאים סרטניים שונים ולנתח כיצד כל סוג של תא יכול להשפיע על ההתנהגות של השני. תאים סרטניים אנושיים שונים (שיבוטים שונים מאותו גידול או מגידולים שונים) ניתן להזריק במשותף. בדוגמה זו, שני קווי תאי CRC הנגזרים מאותו חולה תויגו בצבעים ליפופיליים שונים והתערבבו ביחס של 1:1 להזרקה (איור 9J-K).
כאשר מערבבים קווי תאים אנושיים (כדי ליצור גידולים פוליקלונליים) על אותו שתל, הימנע משימוש בצבע DiO כמו התוצאה של כתמים כפולים לא ספציפיים (טבלה 2). במקום זאת, השתמש ב- CM-DiI (קו תא #1) עם CMFDA ירוק (קו תא #2), או CM-DiI (קו תא #1) עם אדום עמוק (קו תא #2) (טבלה 2, איור 9J-K),כדי לקבל אפליה קלה של האוכלוסיות בסוף הניסוי. כדי לכמת את התדירות של כל שיבוט בתוך הגידול, השתמש בשני סוגי מונה שונים ב- FIJI כדי לזהות כל שיבוט ולאחר מכן חלק לפי מספר התא הכולל (סכום כל השיבוטים) כדי לקבל את החלק היחסי של כל אחד (%).
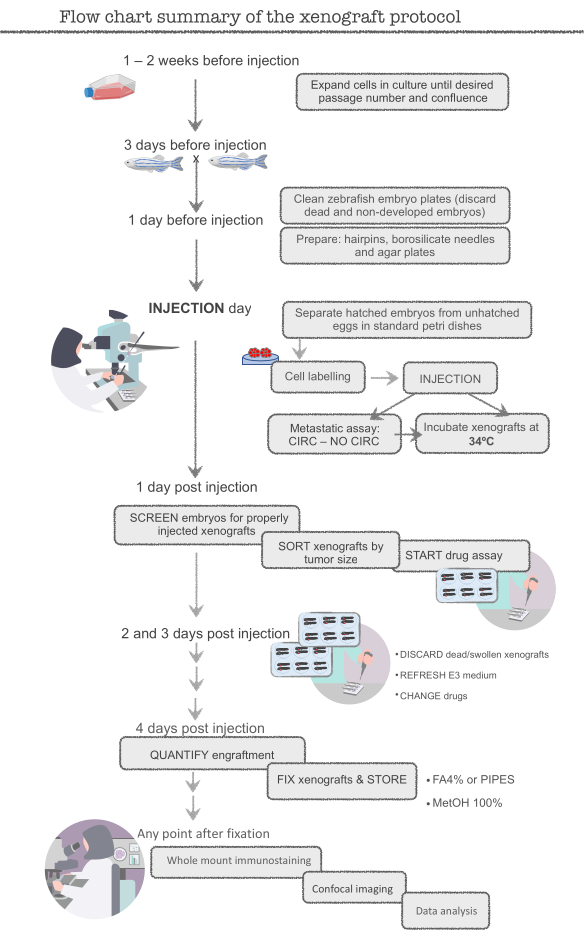
איור 1. סיכום תרשים זרימה של פרוטוקול קסנוגרפט zebrafish אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
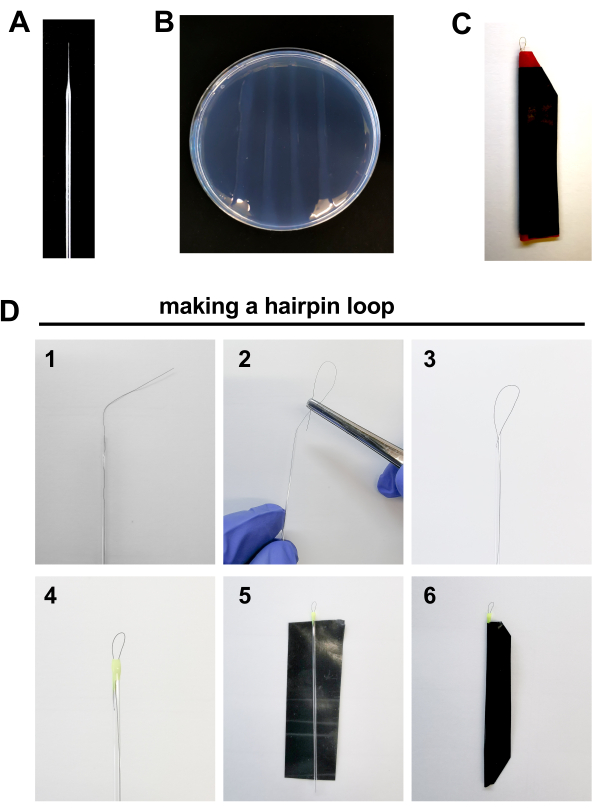
איור 2. חומרים להזרקת עובר זברה: A. מחט בורוסיליקט ב' 2% צלחת אגרוז. ג' לולאה סיכת ראש D. צעדים כדי להפוך לולאת סיכת ראש: 1. 2-3. לסלסל את הקצה החיצוני של השיער בעזרת מלקחיים לתוך צינור נימי זכוכית ויוצרים לולאה של ~ 0.5 מ"מ אורך. 4. לאטום את קצה הצינור נימי עם טיפה של לק. 5-6. לאטום חתיכת קלטת חשמלית סביב נימי כדי להגן עליו מפני שבירה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
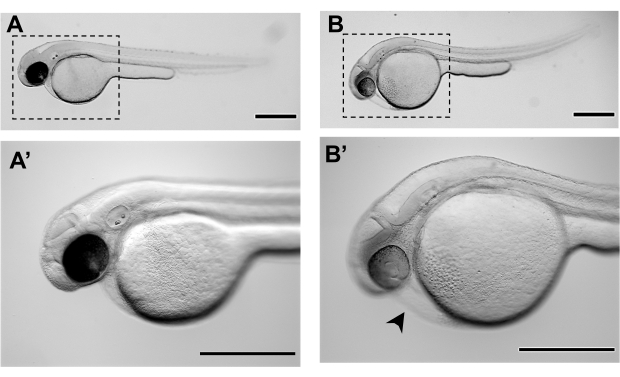
איור 3. תמונות סטריאומיקרוסקופ מייצגות של עוברי זברה-פיש ב-48 שעות לאחר ההפריה (48 כ"ס): A-A'. מורפולוגיה רגילה של עובר זברה ב 48 כ"ס של פיתוח, מוכן microinjection B-B'. מורפולוגיה של עובר זברה שלא השיגה את השלב ההתפתחותי המתאים עבור microinjections ב 48 hpf ומציג כבר מידה מסוימת של בצקת לב (ראש חץ שחור) חלמון נפוח. A' ו- B' הם הגדלות של A ו- B בהתאמה. סרגלי קנה מידה מייצגים 500 מיקרומטר.

איור 4. ייצוג סכמטי של לוחית מיקרו-ג'יטי של דג זברה מוגדר: A. יישור של עוברים מורדמים ב 3% אגר/2% צלחת Agarose. ב. ב. ייצוג גרפי של עובר זברהפיש לאחר הפריה של יומיים, עם חץ שחור המציין את מרחב הפריוויטליין (PVS). C ו- D. תאים סרטניים ניתן להזריק עם זוויות שונות לתוך PVS מוזרק בחלל perivitelline (PVS) של עובר 48 שעות לאחר ההפריה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
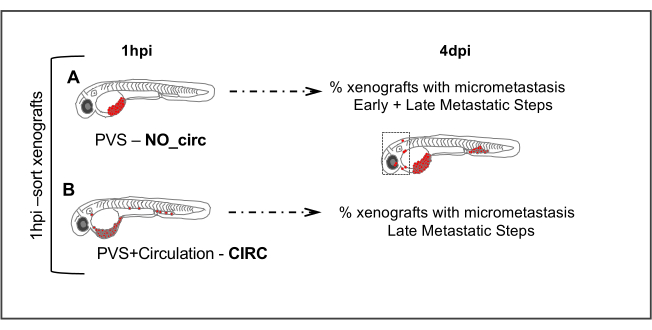
איור 5. מבחנים גרורתיים. 1 שעה לאחר הזרקת (1hpi) עוברים מוזרקים ממוינים על פי היעדרות (NO_circ) או נוכחות (CIRC) של תאים סרטניים במחזור. ב 4 ימים לאחר הזרקת מספר xenografts בשתי הקבוצות המציגות micrometastasis הם מכמתים. תאים בקבוצה (A) NO_circ היו צריכים לעבור את כל השלבים גרורתיים כדי להיות מסוגלים ליצור micrometastasis, ואילו תאים בקבוצה CIRC (B) רק לעבור את השלבים האחרונים של מפל גרורתי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
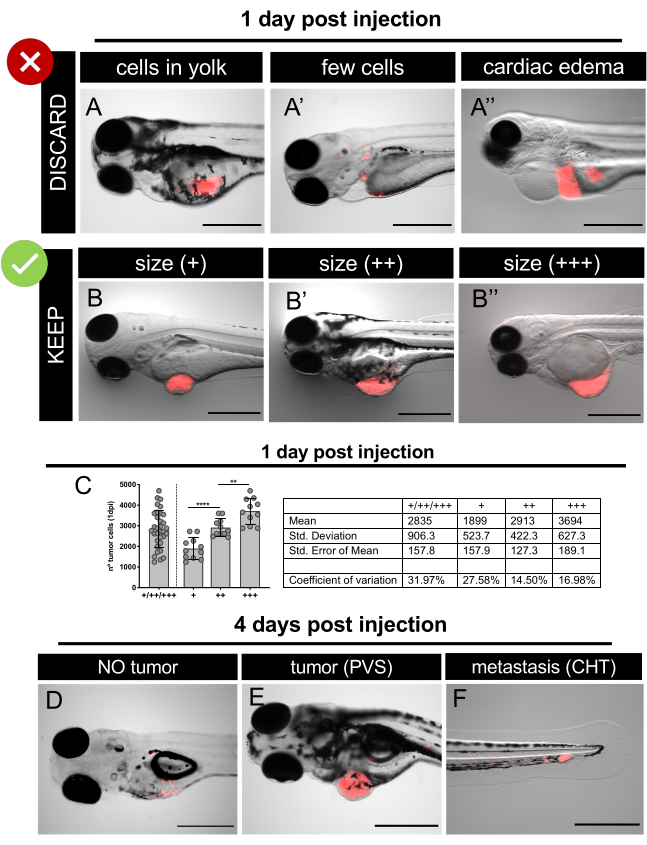
איור 6. תמונות סטריאומיקרוסקופ פלואורסצנטיות מייצגות של קסנוגרפטים ביום אחד לאחר ההזרקה ו-4 ימים לאחר ההזרקה. תאים סרטניים אנושיים המבטאים חלבון פלואורסצנטי TdTomato (אדום) היו microinjected לתוך 2 עוברי זברה dpf. ב 1 dpi, לסנן את העוברים מוזרקים להשליך את אלה מוזרק רע או עוברים עם בצקת(A-A')למיין את העוברים מוזרקים היטב על פי גדלי הגידול (B-B '). ג. כימות מייצג של המספר הכולל של התאים הקיימים בקטגוריות גודל הגידול השונות ב- 1 dpi ב- SW620 xenografts. כל נקודה מייצגת קסנוגרפט שכמת כפי שמוסבר בסעיף 12.At 4 dpi, מסך הזחלים לכמת את המעמדות השונים: אין גידול (D); עם גידול ב- PVS (E) ועם מיקרומטאסטזיס ב- CHT (F). סרגלי קנה מידה מייצגים 500 מיקרומטר.
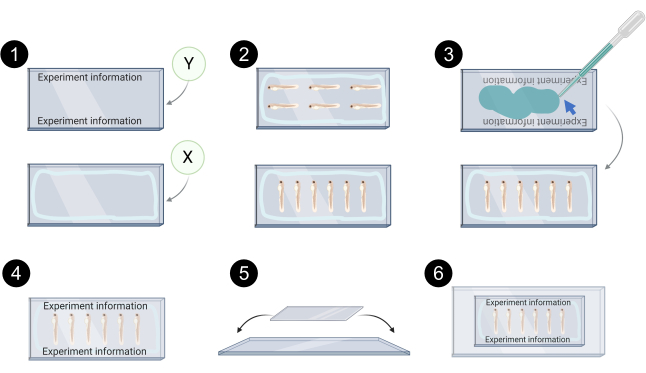
איור 7. ייצוג סכמטי של הרכבה קסנוגרפט עבור הדמיה confocal. 1. דוגמה של תיוג coverslip Y, קו כחול בהיר coverslip X מייצג את ההיקף שבו ג'לי נפט / סיליקון שומן מוחל כדי למנוע דליפה של התקשורת הרכבה. 2. דוגמאות ליישור קסנוגרפט ב- coverslip X להדמיה קונפוקלית. 3. מדיית הרכבה מימית (חץ כחול) משמשת לאגד coverslip Y על גבי coverslip X. 4. דוגמה לכיסויים שנטענו כראוי. 5. Coverslips ממוקמים לאחר מכן על גבי שקופית זכוכית ומאובטחים עם קלטת שקופה. 6. קסנוגרפטים רכובים מוכנים להדמיה קונפוקלית. נוצר באמצעות BioRender.com לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
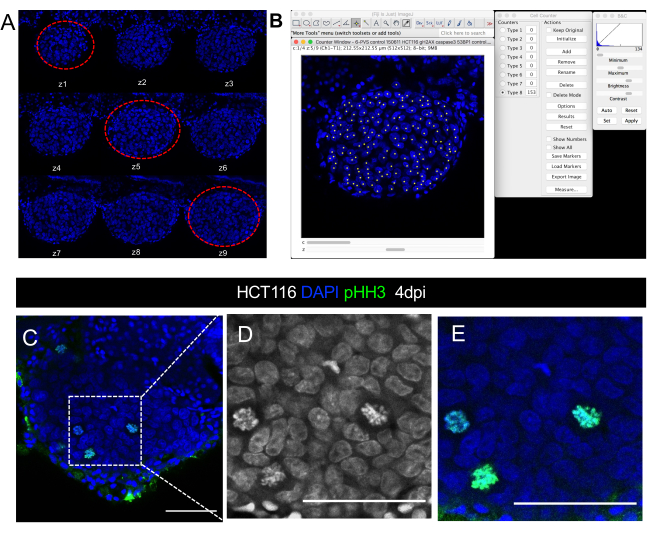
איור 8. ייצוג חזותי של כימות תמונה מיקרוסקופ confocal של גודל הגידול. תמונות Confocal של HCT116 xenograft ב 4 ימים לאחר הזרקה A. סידרה של פרוסות מחסנית z בערוץ DAPI שנרכשו במרווח של 5 מיקרומטר. קווים מקווקווים אדומים מקיפים את שלוש הפרוסות הייצוגיות המשמשות לספירת תאים. ב. ב. איור של כימות גרעיני DAPI עם תוסף מונה התא בתוכנת ImageJ/Fiji. C-E. דוגמה לרזולוציית תא יחיד בתוך הגידול שבו ניתן לדמיין / לכמת דמויות מיטוטיות ב- DAPI או באמצעות נוגדן phospho-histone H3 (ירוק). D ו- E הם הגדלות של C. סרגלי קנה מידה מייצגים 50 מיקרומטר.
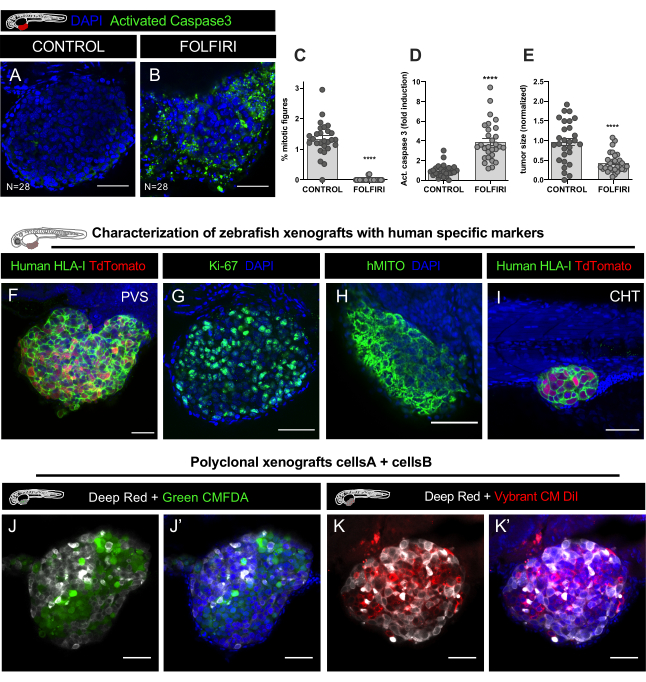
איור 9. תוצאות מייצגות. א-אי. HCT116 קו תאים סרטן המעי הגס תויג עם Vybrant CM-DiI והוזרק PVS של 2 ימים לאחר ההפריה (dpf) עוברים. לאחר ההזרקה, קסנוגרפטים היו דגירה ב 34 °C (69 °F). ב 1 dpi, xenografts הוקרנו והופצו באופן אקראי פקדים שאינם מטופלים FOLFIRI, טופל במשך 3 ימים רצופים קבוע ב 4 dpi. A. Immunofluorescence בוצעה כדי לזהות תאים אפופטוטיים, באמצעות נוגדן Caspase 3 אנטי בקע ו DAPI עבור nuclei counterstaining. כימות של מדד מיטוטי C, אפופטוזיס (% של מופעל Caspase3) D, וגודל הגידול E, גילה כי FOLFIRI גורם לירידה משמעותית של מיטוזיס (מאן ויטני מבחן, P<0.0001) ו אינדוקציה משמעותית של אפופטוזיס (מבחן מאן ויטני, P<0.0001), מלווה בירידה של 54% בגודל הגידול (P<0.001). מספר xenografts מנותח מצוין באיור וכל נקודה מייצגת קסנוגרפט אחד. פ-ה. תמונות מייצגות של קסנוגרפטים סרטן המעי הגס ב 4 ימים לאחר הזרקה שכותרתו עם סמנים ספציפיים אנושי בירוק (אדם HLA, ki67 ו hMITO) ב PVS ו CHT I. ג'יי-ג'יי. תמונות קונפוקליות של קסנוגרפטים פוליקלונליים, מוזרק עם שני קווי תאים שונים של סרטן המעי הגס האנושי שכותרתו עם כתמים lipophilic CellTracker אדום עמוק (Cy5 - לבן), CellTracker ירוק CMFDA (488 - ירוק) ו DAPI counterstaining. קיי-קיי. תמונות קונפוקליות של שני קווי תאים שונים של סרטן המעי הגס האנושי שכותרתו עם כתמים lipophilic CellTracker אדום עמוק (Cy5 - לבן), Vybrant CM DiI (594 - אדום) ו DAPI counterstaining. סרגלי קנה מידה מייצגים 50 מיקרומטר.
| קו תא | טישו | מינים | מורפולוגיה | מצב צמיחה | מפגש אידיאלי להזרקה | סוכן ניתוק להזרקה | זמן ניתוק | פרוטוקול לתיוג | מדיום הזרקה | חלק את המספר הכולל של תאים על ידי (כדי להשיג ריכוז אידיאלי להזרקה) | |||||||
| SW480 | אדנוקרצינומה המעי הגס (ראשי) | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 2 מ"מ | 5 דקות | בקבוקון (בקבוקון) | PBS 1x | 0,25 | |||||||
| SW620 | אדנוקרצינומה המעי הגס (גרורות) | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 2 מ"מ | 5 דקות | בקבוקון (בקבוקון) | PBS 1x | 0,25 | |||||||
| HCT116 | קרצינומה המעי הגס (ראשי), מוטציה קראס | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 2 מ"מ | 5 דקות | בקבוקון (בקבוקון) | PBS 1x | 0,25 | |||||||
| HKE3 | קרצינומה המעי הגס, קרס WT | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 2 מ"מ | 5 דקות | בקבוקון (בקבוקון) | PBS 1x | 0,25 | |||||||
| HT-29 | אדנוקרצינומה המעי הגס (ראשי) | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 2 מ"מ | 5 דקות | בקבוקון (בקבוקון) | PBS 1x | 0,2 | |||||||
| קאקו-2 | אדנוקרצינומה המעי הגס (ראשי) | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 1 מ"מ | 5 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | מדיום שלם | 0,25 | |||||||
| MCF-7 | אדנוקרצינומה של השד (גרורות) | אנוש | אפיתל | חסיד | 70% - 80 % | PBS/אדטה 1 מ"מ | 5 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | 60% FBS + 40% בינוני מלא | 0,5 | |||||||
| Hs578T | קרצינומה של השד (ראשוני) | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 1 מ"מ | 2 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | 60% FBS + 40% בינוני מלא | 0,5 | |||||||
| מד"א-מגה-468 | אדנוקרצינומה של השד (גרורות) | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 1 מ"מ | 8 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | 60% FBS + 40% בינוני מלא | 0,5 | |||||||
| מד"א-מגה-231 | אדנוקרצינומה של השד (גרורות) | אנוש | אפיתל | חסיד | 70% - 75 % | PBS/אדטה 1 מ"מ | 5 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | מדיום שלם | 0,5 | |||||||
| RT112 | קרצינומה של תאי מעבר בשלפוחית השתן (ראשוני) | אנוש | אפיתל | חסיד | 85% - 90% | תרשים (נסיון) | 6 דקות + מגרד תאים | צינור מיקרוצנטריפוגה 1.5 מ"ל | מדיום שלם | 0,5 | |||||||
| BFTC905 | קרצינומה של תאי מעבר בשלפוחית השתן (ראשוני) | אנוש | אפיתל | חסיד | 75% - 85% | תרשים (נסיון) | 10 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | 80% מדיום מלא + 20% PBS/EDTA 2 מ"מ | 0,5 | |||||||
| J82 | קרצינומה של תאי מעבר בשלפוחית השתן (ראשוני) | אנוש | אפיתל | חסיד | 85% - 90% | תרשים (נסיון) | 10 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | מדיום שלם | 0,5 | |||||||
| RT4 | קרצינומה של תאי מעבר בשלפוחית השתן (ראשוני) | אנוש | אפיתל | חסיד | 85% - 90% | תרשים (נסיון) | 6 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | מדיום שלם | 0,5 | |||||||
| מיה פאקה-2 | קרצינומה של אפיתליוד הלבלב (ראשוני) | אנוש | אפיתל | חסיד | 80% - 90% | תרשים (נסיון) | 3 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | 60% FBS + 40% בינוני מלא | 0,5 | |||||||
| PANC-1 | קרצינומה של אפיתליוד הלבלב (ראשוני) | אנוש | אפיתל | חסיד | 80% | תרשים (נסיון) | 5 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | PBS/אדטה 2 מ' | 0,5 | |||||||
| VC8 (סיכון) | פיברובלסטים לריאות, מוטנט BRCA2, חסר משאבי אנוש | אוגר סיני | אפיתל | חסיד | 70% - 80 % | PBS/אדטה 1 מ"מ | 5 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | מדיום שלם | 0,25 | |||||||
| VC8-B2 | פיברובלסטים לריאות, BRCA2 אנושי, BRCA2 -/- חסר משאבי אנוש | אוגר סיני | אפיתל | חסיד | 70% - 80 % | PBS/אדטה 1 מ"מ | 5 דקות | צינור מיקרוצנטריפוגה 1.5 מ"ל | מדיום שלם | 0,25 | |||||||
טבלה 1: מפגש אופטימלי במבחנה להזרקה של מספר קווי תאים
| צבע תא | מספר קטלוג | ספקטרום פלואורסצנטיות (Exc. - Em.) | דילול מלאי | עבודה בדילול כדי להכתים בבקבוקון | עבודה בדילול לכתמים במיקרוצנטריפוגה של 1.5 מ"ל | זמן הדגירה | תצפיות | ||||||
| Vybrant CM-DiI | V22888 | 549 ננומטר - 569 ננומטר | כבר מדולל | 4:1000 ב- PBS 1x | 4:1000 ב- PBS 1x | 15 דקות @ 37 מעלות צלזיוס + 4 דקות @ 4 מעלות צלזיוס | |||||||
| Vybrant דיו | V22886 | 484 ננומטר - 501 ננומטר | כבר מדולל | 5:1000 ב- PBS 1x | 5:1000 ב- PBS 1x | 15 דקות @ 37 מעלות צלזיוס + 4 דקות @ 4 מעלות צלזיוס | רזולוציה לא טובה בהדמיה קונפוקלית ב 4 ימים לאחר הזרקה | ||||||
| תא מעקב אדום עמוק | C34565 | 630 ננומטר - 660 ננומטר | 1 מ"מ ב- DMSO | 0.5 - 2.5 מיקרומטר ב- PBS 1x | 0.5 - 2.5 מיקרומטר ב- PBS 1x | 15 דקות @ 37 מעלות צלזיוס | |||||||
| CMFDA ירוק של מעקב אחר תאים | C7025 | 492 ננומטר - 517 ננומטר | 10 מ"מ ב-DMSO | 0.5 - 2.5 מיקרומטר ב- PBS 1x | 0.5 - 2.5 מיקרומטר ב- PBS 1x | 15 דקות @ 37 מעלות צלזיוס | המוצר דולף לחלל הבטן 48 שעות לאחר ההזרקה, אך אידיאלי למחקרי הזרקה משותפת | ||||||
טבלה 2: צבע ותנאים
| גודל | # של זחלים | עוצמת קול בינונית E3 1x |
| 100 מ"מ x 15 מ"מ (סטנדרטי) | עד 50 | 20-25 מ"ל |
| 60 מ"מ x 15 מ"מ | עד 20 | 10 מ"ל |
| צלחת של 6 בארות | עד 15 לבאר | 3-4 מ"ל לבאר |
טבלה 3: אפשרויות צלחת פטרי
| E3 בינוני 50x - מלאי | עבור 10 ליטר מים סטריליים: |
| 146.9 גרם של NaCl | |
| 6.3 גרם של KCl | |
| 24.3 גרם של CaCl2·2H2O | |
| 40.7 גרם של MgSO4·7H2O | |
| E3 בינוני 1x – מוכן לשימוש | 400 מ"ל של E3 בינוני 50x |
| 60 מ"ל של 0.01% מתילן פתרון כחול | |
| למלא עד 20 ליטרים של מים מערכת דגים | |
| טריקאין 25x – מלאי והמתת חסד | 2 גרם של אבקת טריקיין |
| 500 מ"ל של מי אוסמוזה הפוכים | |
| 10 מ"ל של 1 M Tris (עמ' 9) | |
| התאם ל-pH 7 | |
| טריקאין 1x - הרדמה | 20 מ"ל של טריקאין 25x |
| למלא עד 500 מ"ל של מי מערכת | |
| פרונאז 60 מ"ג/מ"ל - מלאי 100x | 1 גרם של פרונה |
| 16.7 מ"ל מים סטריליים | |
| פרונאז 0.6 מ"ג/מ"ל – 1x מוכן לשימוש | 100 פרונה μL 100x |
| 9.9 מ"ל של E3 בינוני 1x |
טבלה 4: קומפוזיציות פתרון
Discussion
החשיבות הגוברת של דג הזברה כמודל להתפתחות סרטן והקרנת תרופות הביאה לפרסומים רבים3,4,7,13,14,16,18,19,20,21. עם זאת, הזרקת תאים סרטניים בעוברים זברה הוא טכניקה הדורשת רמה גבוהה של דרגה אשר יכול להיות מאתגר עבור החוקרים. בפרוטוקול זה אנו שואפים לספק מידע מעשי וכמה טיפים שיכולים לעזור להתגבר על האתגרים הראשוניים של הגדרת קסנוגרפטים עובר זברה.
טיפול בתאים לפני הזרקה
זה פרוטוקול אופטימיזציה עבור הדור של קסנוגרפטים זברה עם קווי תאים ניתן להתאים סוגים שונים של (סרטן) תאים עם morphologies שונים. אנו ממליצים כי כל קווי התא המשמשים קסנוגרפטים זברה-פיש הם ללא mycoplasma. שלא כמו זיהומים חיידקיים אחרים, נוכחות של mycoplasma בתרבית התא אינו יוצר שינויים שניתן לזהות בקלות תחת מיקרוסקופ22. זיהום Mycoplasma עשוי להשפיע על פוטנציאל החריטה של קווי התא, הרגישות שלהם לסמים, כמו גם את הכדאיות של עוברי זברה.
למרות שהתאים עשויים להמשיך להתרבות לתקופה ממושכת, הפנוטיפ והגנוטיפ שלהם עשויים להיות מועדים לשינויים. חשוב להכיר את המורפולוגיה וההתנהגות של קווי התאים בתרבות. אנו ממליצים לשמור על מספר מעברי התא לאחר הפשרה בין 3-12 כדי לקבל תוצאות לשחזור. לכן, בדיקות mycoplasma רגיל צריך להתבצע.
תאים צריכים להיות בשלב יומן הרישום שלהם (שלב צמיחה מעריכי לפני הגעה להתכנסות ~ 70%) ביום ההזרקה. זה יאפשר חריטה נאותה ופיתוח נאות של סימני ההיכר הייחודיים של הגידול. כדי למנוע וריאציה של פנוטיפ של תאים בתוך xenograft, זה קריטי כדי לשמור על המפגש עבור קבוע הזרקה בין ניסויים. מספר התאים מוזרקים יכול להיות מותאם למאפיינים של כל קו תאים כמו כמה עשויים לדרוש צפיפויות גבוהות יותר של הזרקה על מנת לשגשג בעוברים זברה.
שיקולי תיוג תאים
כדי לדמיין טוב יותר תאים סרטניים אנושיים להזרקה וניתוח עתידי, תאים סרטניים יכולים להיות מסומנים עם צבעים פלואורסצנטיים. בשל הבדלים בגודל התא, המספר הכולל של תאים / ס"מ 2 בתרביות חסידים משתנהבין קווי התא. זה ישפיע על היעילות של פרוטוקול הכתם, כמו גם את מספר התאים שנקטפו להזרקה. תאים גדולים המניבים מספרים נמוכים לכל בקבוקון (כלומר, Hs578T) או גדלים באשכולות (כלומר, BFTC905) ידרשו איגום של מספר בקבוקונים לניסוי יחיד. במקרה זה, הכתמת תאים לא צריך להתבצע ישירות בבקבוק כמו זה יגרום לשימוש בכמויות מוגזמות של צבע (עלות גבוהה). מצד שני, תאים רגישים מאוד מחזורים מוגזמים של צנטריפוגה, כמו גם אלה המניבים מספרים גבוהים לכל בקבוק (כלומר, HCT116) יכול להיות מוכתם ישירות בבקבוק ולאחר מכן מנותק עם מגרד EDTA / תא (לקבלת מידע נוסף ראה טבלה 1).
במידת האפשר, במקום להשתמש בגישה אנזימטית, להשתמש EDTA כדי לנתק את התאים ביום ההזרקה, כך תאים לשחזר צמתים התא שלהם במהירות רבה יותר והם נתונים פחות צעדי צנטריפוגה. עם זאת, אם התאים רגישים EDTA, מאוד חסידים או לגדול באשכולות - שיטה אנזימטית ניתן ליישם. אופטימיזציה של הריכוז האידיאלי להזרקה, כמו גם את מדיום ההזרקה תלוי במאפיינים של כל קו תא, ולכן זה עשוי להזדקק כמה התאמות (טבלה 1).
כיול מיקרו-שינג
בניגוד למסירת אוליגונוקלאוטידים או סמים לעובר זברה, גרטיקולה אינה משמשת לכיול המחט בעת עבודה עם קווי תאים עבור קסנוגרפטים. לאחר זמן מה במהלך ההזרקה, התאים יתחילו לסתום, ויש צורך לחתוך את קצה המחט כדי להגדיל את קוטרו או לשנות את המחט לגמרי. הליך זה מעכב את כיול הגרטיקולה.
כדי לטפל בבעיה זו, מספר התאים שניתנו מוסדר על ידי לחץ נפלט וזמן הדרוש כדי להגיע לגודל דומה לעין העובר בתוך 1-3 פולסים. לאחר מכן, כדי לשלוט עוד יותר בגודל הגידול, ב- 1 dpi, קסנוגרפטים ממוינים לפי גודל הגידול כפי שמוצג באיור 6 B-B". כפי המיוצג בדוגמה של איור 6C, שיטת מיון זו יעילה בהפחתת הווריאציה של גדלי הגידול: אם אנו אוגדים את כולם יחד (+, ++, ++) STEV הוא ~ כפול מהמחלקה ++(~ 906 תאים ~ 422 תאים) והווריאציה המקדם היא ~ 31.9% לעומת 14,5% במחלקה ++. מאז ההפניה להזרקה היא נפח, המספר הכולל של תאים משתנה הרבה בין סוגי תאים - להיות תלוי בגודל ובצורה של התאים. לדוגמה, תאים גדולים עם הרבה ציטופלסמה כמו סרטן השד Hs578T, לייצר גידולים קטנים בהרבה (~ 600 תאים). כמו כן, כל קו תא דורש מספר תאים שונה. לדוגמה, קווי התאים סרטניים שלפוחית השתן HT29 CRC ו- RT112 הראו כי ככל שמספר התאים שהוזרקו גבוה יותר, כך התמותה של דגי הזברה גבוהה יותר. לכן, תקופה של אופטימיזציה בעת פיתוח xenografts יש צורך לבדוק אם קו התא יש השפעות רעילות בעובר או דורש צפיפויות גבוהות / נמוכות יותר של הזרקה.
אתר הזרקה
אחד הפערים הנפוצים ביותר בעת יצירת קסנוגרפטים עובר זברה הוא אתר ההזרקה. החלמון הוא בדרך כלל מקום הבחירה להזרקה בשל הנגישות הקלה שלה. עם זאת, ראינו כי תאים מוזרקים חלמון יש נטייה גבוהה יותר למות. למרות שטכנית קשה יותר, אנו ממליצים להזריק ב- PVS וככל האפשר מהלב. בתוך PVS, תאים יכולים לצבור, לגייס כלי דם ותאי חיסון, ולהגר, intravasate, אקסטרווסטזיס וליצור micrometastasis, אם הם מציגים מאפיינים גרורתיים8,11.
יעילות חריטה
הבדלים ביעילות החריטה וגודל הגידול בין קווי תאים ב 4 dpi צפויים בשל דרגות ברורות של מוות תאים בסיסיים / הישרדות / התפשטות, אלא גם בשל האימונוגניות המולדת כי כל קו תא עשוי להציג9.
גרורה
גרורות כוללות מפל רב-שלבי של אירועים שניתן לחלק לשני שלבים שרירותיים. בשלב הראשון, תאים סרטניים צריכים להתנתק מהאתר הראשי, לנדוד ולפלוש לרקמות סמוכות ולאחר מכן להיכנס למחזור הדם. בשלב השני, תאים סרטניים חייבים לשרוד במחזור הדם, פזרן מן הדם או כלי הלימפה, ולבסוף להתיישב באתרים משניים23. כדי להבחין בין אירועים מוקדמים ומאוחרים אלה ולטפל בפוטנציאל/בקיאות של תאי הגידול השונים לביצוע שלבים אלה, עיצבנו בדיקה פשוטה.
באופן כללי, כאשר מוזרק לתוך PVS, תאים סרטניים יכולים להיכנס ישירות למחזור ולאחר מכן להילכד פיזית ברקמה hematopoietic caudal (CHT) (אזור הזנב). עם זאת, על פי המאפיינים של כל תא גידול - ראינו כי כמה תאים סרטניים להישאר ב CHT 4 dpi והם מסוגלים ליצור micrometastasis בעוד תאים סרטניים אחרים נעלמים (פינה לאחר שנתפס CHT).
לכן, על ידי השוואת יעילות micrometastasis (ב 4 dpi) כאשר התאים הונחו ישירות לתוך זרימת הדם - CIRC (תאים רק צריך לעבור את השלבים המאוחרים של גרורות) לעומת כאשר לא - אין CIRC (תאים צריכים לעבור צעדים מוקדמים ומאוחרים כדי להיות מסוגל ליצור micrometastasis) אנו יכולים להעריך את הפוטנציאל גרורתי מוקדם או מאוחר שלהם. ראינו תאים סרטניים שיכולים ליצור ביעילות micrometastasis ב- CHT בשתי הקבוצות (CIRC ו- NO CIRC), מה שמרמז כי תאים אלה יש את היכולת לעבור את כל השלבים של מפל גרורתי (SW480 ו MDA-MB-468 למשל)8,11. לעומת זאת, לתאי גידול אחרים יש פוטנציאל גרורתי נמוך מאוד בשתי הקבוצות, כמעט אף פעם לא עושה micrometastasis, גם כאשר מוזרק למחזור (כלומר, גלוי CHT ב 24 hpi, אבל ב 4 dpi הם כבר לא שם, Hs578T למשל)8. עם זאת, מצאנו בבירור קבוצה אחרת - אחת כי הוא מסוגל רק ליצור micrometastasis כאשר מוזרק לתוך זרימת הדם (אנחנו יכולים רק לצפות micrometastasis בקבוצה CIRC). זה מרמז כי תאים אלה יש יעילות נמוכה בביצוע השלבים הראשונים של מפל גרורתי אבל מצד שני מסוגלים לשרוד במחזור, אקסטרווסייט ליישב אתר מרוחק.
חיסון והדמיה
לפני הקיבעון, פרוטוקול הזרקה זה יכול לשמש עבור גישות הדמיה חיה אחרות כמו מיקרוסקופיה של ניגודיות הפרעה דיפרנציאלית חיה (DIC), מיקרוסקופיה של דיסק מסתובב, הדמיה קונפוקלית חיה ברזולוציה גבוהה ומיקרוסקופיית יריעות אור וכו '.
תאים מתים ופסולת תאית מופיעים בהירים כאשר הם נצפים דרך הסטריאומיקרוסקופ הפלואורסצנטי וניתן לטעות בהם לגבי תאים חיים, במיוחד אם מטרת המחקר היא להעריך את הפוטנציאל גרורתי של קווי התאים. ברצוננו להדגיש את החשיבות של ביצוע הדמיה confocal עם סמני כדאיות ספציפיים DAPI כדי להעריך את מצב ההישרדות של הגידול micrometastasis. כמו כן, זה היסוד להשתמש בנוגדנים אנושיים ספציפיים כדי לזהות תאים אנושיים כגון מיטוכונדריה אנטי אנושית או HLA אנטי אנושי. בעת יישום הפרוטוקול, לאמן את עיני הניסוי על ידי השוואת הכתמים בסטריומיקרוסקופ עם תמונות confocal. לאחר זמן מה, ניסויים יכולים להבחין בבירור בין פסולת לתאים חיים בסטריאומיקרוסקופ הפלואורסצנטי.
למרות ששיטות אחרות לכימות נטל הגידול כגון אזור פלואורסצנטי שלם נמצאות בשימוש נרחב, אנו ממליצים לבצע הדמיה חיסונית ו confocal הר שלם כשיטה מדויקת יותר. לא רק היעילות של כתמי צבע lipophilic משתנה מאוד (כלומר, תאים מסוימים מוכתמים היטב ואילו אחרים אינם - כנראה בשל התוכן השומנים של הממברנות שלהם), אלא גם פעמים רבות צבעים ליפופילי טופס אגרגטים, ותאים מתים נוטים להיות בהירים יותר - יצירת מספר חפצים שניתן לטעות עבור תאים חיים.
תאים יכולים להיות transduced עם חלבונים פלואורסצנטיים כדי לסייע במעקב שלהם לדלג על תיוג התא. עם זאת, ודא כי תאים transduced ולא transduced לייצר את אותן תוצאות קסנוגרפטים זברה.
בנוסף, מקרופאגים יכולים phagocyte אלה פסולת תא פלואורסצנטי הופך פלואורסצנטי שכותרתו נודד, יצירת תאים גרורתיים חיוביים כוזבים. לכן, אנו ממליצים על סדרה של כלים אנליטיים, אשר כמובן ניתן להרחיב קריאות רבות אחרות לפרשנות מדויקת יותר של התנהגות הגידול:
- התפשטות - כימות של דמויות מיטוטיות עם DAPI או נוגדן נגד pHH3Ser10 (מרק מיליפור חתול. #06-570),
- מוות תאי על ידי אפופטוזיס- נוגדן נגד מופעל Caspase3Asp175 (תא איתות טכנולוגיות חתול. #9661) או שווה ערך,
- גודל הגידול - ספירת DAPI - תאים סרטניים אנושיים מראים ארגון כרומטין מובהק מאוד, כך שהם נבדלים בקלות מתאי הזברה ותמיד ניתן לבדוק שוב עם הצבע (כאשר אתה מאמן את העין שלך),
- עבור מחקרים גרורתיים, כדי לזהות באופן חד משמעי תאים אנושיים, - HLA אנטי אנושי (Abcam EP1395Y Cat. #ab52922), המיטוכונדריה האנטי אנושית (מרק מיליפור חתול. #MAB1273- שיבוט 113-1).
עבור רכישה confocal עם מרווח של 5 מיקרומטר בין פרוסות מחסנית Z של תאי סרטן הבקרה HCT116 (גודל גרעיני ממוצע של 10-12 מיקרומטר קוטר) עם DAPI counterstaining, ראינו כי ~ 50% מהתאים משותפים בין שתי פרוסות רצופות. לכן, אם כל פרוסה נספרת, קיים סיכון גבוה לספירת אותם תאים פעמיים. הולך הלוך ושוב בין פרוסות כדי למנוע בעיות כימות תוצאות טכניקה זמן רב שגיאה נוטה. כדי להקל על הכימות של המספר הכולל של תאים ולאפשר רבייה רבה יותר בין החוקרים, יצרנו את הנוסחה גודל הגידול שתוארה בעבר בפרוטוקול זה8.
כללנו מספר תיקון (1.5) כדי להסביר את התאים ~ 50% המשותפים בין פרוסות. מצאנו כי השגיאה הממוצעת של ספירה ידנית של הגידול כולו בין החוקרים הייתה 20%. שני חוקרים שהשתמשו בנוסחה היו 2% שגיאה. השימוש בנוסחה זו הוא בעל שיעור דיוק של 93% ושיעור רבייה של 98%. בדקנו גם שיטות אוטומטיות, אך הן הדגימו שגיאה הגבוהה מ- 50% הנגרמת על-ידי הגדרות סף.
בשל המאפיינים של תאים אפופטוטיים, הכימות של תאי Caspase מופעל 3 קשה יותר. כדי להפחית את מספר הטעויות ואת השונות בתוצאות, אנו ממליצים כי דגימות הבקרה והניסוי נספרים על ידי אותו חוקר. בנוסף, כאשר לומדים טכניקה זו, חוקר חדש חייב לספור תמונות שכבר כימתו על ידי חוקרים מנוסים יותר כדי להשוות תוצאות ולהתאמן.
ניתן להאריך את אורך ההסתעפות במידת הצורך. עם זאת, חשוב לקחת בחשבון כי זחלים זברה דורשים האכלה חיה החל ~ 7 ימים לאחר ההפריה (5 ימים לאחר הזרקה). בנוסף, ההנחיות והתקנות לרווחת בעלי חיים החלות על זחלים מעל גיל 6 ימים לאחר ההפריה עשויות להשתנות.
פרוטוקול זה מספק כלים שימושיים כדי לאפשר לחוקר יחיד להזריק כ ~ 200-300 זחלי זברה לשעה; ותוצאות לבדיקה המלאה, כולל ניתוח ופרשנות סטטיסטית, המתקבלות בשלושה שבועות. אנו מקווים כי פרוטוקול זה יכול לעזור לחוקרים להיות מומחים ביצירת קסנוגרפטים זברה. זה לא קל; אתה צריך להתאמן אבל תגיע לשם. בהצלחה!
Disclosures
ללא
Acknowledgements
אנו מודים לקרן Champalimaud, קונג'נטו (LISBOA-01-0145-FEDER-022170, במימון משותף של FCT/Lisboa2020) למימון. מלגות FCT לסמנכ"ל (SFRH/BD/118252/2016), MML (PD/BD/138203/2018). כל חברי מעבדת פיור לדיונים קריטיים; ב. קוסטה ו- C. רבלו דה אלמיידה לשיתוף נתונים; וחברי המעבדה שלנו C. רבלו דה אלמיידה, מ ' בארוסו ול. לייטה על השתתפותם בסרטון. ברצוננו להודות למתקן הדגים CF (C. Certal, J. Monteiro et al) ולצוות התקשורת, האירועים והסיוע של Champalimaud במיוחד לאלכסנדר אזינהירה על עשיית הסרטים הפנטסטיים ולקתרינה ראמוס ותרזה פרננדס על עזרתם.
Materials
| Name | Company | Catalog Number | Comments |
| Agar for bacteriology | VWR | 97064-336 | Agar plate |
| anti-Caspase3Asp175 (Rabbit monoclonal) | Cell Signalling Technologies | 9661 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti-human HLA (Rabbit monoclonal) | Abcam EP1395Y | ab52922 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti- 488 (Rabbit monoclonal) | ThermoFisher Scientific | 35552 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| anti- 594 (Rabbit monoclonal) | ThermoFisher Scientific | 35560 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| CellTracker Deep Red Dye | ThermoFisher Scientific | C34565 | Lipophilic dye (Dilution 1:1000) |
| CellTracker Green CMFDA Dye | ThermoFisher Scientific | C2925 | Lipophilic dye (Dilution 1:1000) |
| Conical Centrifuge tube 50mL | VWR | 525-0610 | |
| Conical Centrifuge tube 15mL | VWR | 525-0604 | |
| DAPI | Nuclear and chromosome counterstain | ||
| Laser-Based Micropipette Puller P-2000 | Sutter-Instrument | Micropipette Puller | |
| Microcentrifuge tube 1.5mL | Abdos | P10202 | |
| Microscope slides, cut edge | RS France | BPB016 | Slides for mounting |
| Mowiol | Sigma-Aldrich | 81381 | Mounting medium |
| Pneumatic Picopump | World Precision Instruments | PV820 | Microinjector |
| Rectangular cover glasses, Menzel Gläser | ThermoFisher Scientific | 631-9430 | Coverslips for mounting |
| SeaKem LE Agarose | Lonza | 50004 | Agar plate |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100-4 | Borosilicate capillaries |
| TrypLE | Gibco | 12605036 | Enzymatic detachment solution |
| Vaseline | Petroleum jelly for slide sealing | ||
| Vybrant CM-DiI Dye | ThermoFisher Scientific | V22888 | Lipophilic dye (Dilution 1:1000) |
| Vybrant DiO Cell-Labeling Solution | ThermoFisher Scientific | V22886 | Lipophilic dye (Dilution 1:1000) |
| ZEISS Axio Zoom.V16 for Biology | ZEISS | Fluorescence Stereo Zoom Microscope | |
| Zeiss LSM 710 | ZEISS | Confocal microscope |
References
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97, 889-938 (2017).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. Journal of Clinical Investigation. 122, 2337-2343 (2012).
- Stoletov, K., Klemke, R. Catch of the day: zebrafish as a human cancer model. Oncogene. 27, 4509-4520 (2008).
- Weintraub, A. All eyes on zebrafish. Lab Animals. 46, 323-326 (2017).
- Novoa, B., Figueras, A., Lambris, J. D., Hajishengallis, G. Zebrafish: Model for the Study of Inflammation and the Innate Immune Response to Infectious Diseases. Current Topics in Innate Immunity II. , 253-275 (2012).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nature Reviews Cancer. 20, 263-273 (2020).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Póvoa, V., et al. Innate immune evasion revealed in a colorectal zebrafish xenograft model. Nature Communications. 12, 1156 (2021).
- Galletti, G., et al. Targeting Macrophages Sensitizes Chronic Lymphocytic Leukemia to Apoptosis and Inhibits Disease Progression. Cell Reports. 14, 1748-1760 (2016).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Communications Biology. 3, 1-13 (2020).
- Varanda, A. B., Martins-Logrado, A., Godinho Ferreira, M., Fior, R. Zebrafish Xenografts Unveil Sensitivity to Olaparib beyond BRCA Status. Cancers. 12, 1769 (2020).
- Osmani, N., Goetz, J. G. Multiscale Imaging of Metastasis in Zebrafish. Trends in Cancer. 5, 766-778 (2019).
- Hyenne, V., et al. Studying the Fate of Tumor Extracellular Vesicles at High Spatiotemporal Resolution Using the Zebrafish Embryo. Developmental Cell. 48, 554-572 (2019).
- Costa, B., et al. Developments in zebrafish avatars as radiotherapy sensitivity reporters - towards personalized medicine. EBioMedicine. 51, 102578 (2020).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish Avatars towards Personalized Medicine-A Comparative Review between Avatar Models. Cells. 9, 293 (2020).
- TRICAINE - Protocols. ZFIN Community Wiki Available from: https://wiki.zfin.org/display/prot/TRICAINE (2021)
- Zhao, C., et al. A Novel Xenograft Model in Zebrafish for High-Resolution Investigating Dynamics of Neovascularization in Tumors. Plos One. , (2011).
- Veinotte, C. J., Dellaire, G., Berman, J. N. Hooking the big one: the potential of zebrafish xenotransplantation to reform cancer drug screening in the genomic era. Disease Models & Mechanisms. 7, 745-754 (2014).
- Haldi, M., Ton, C., Seng, W. L., McGrath, P. Human melanoma cells transplanted into zebrafish proliferate, migrate, produce melanin, form masses and stimulate angiogenesis in zebrafish. Angiogenesis. 9, 139-151 (2006).
- Zon, L. I., Peterson, R. The New Age of Chemical Screening in Zebrafish. Zebrafish. 7, 1 (2010).
- Mycoplasma Contamination of Cell Cultures. InvivoGen Available from: https://www.invivogen.com/review-mycoplasma (2016)
- van Zijl, F., Krupitza, G., Mikulits, W. Initial steps of metastasis: cell invasion and endothelial transmigration. Mutation Research. 728, 23-34 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved