Method Article
斑马鱼拉瓦尔异种草和肿瘤行为分析的一代
摘要
在这里,我们提供一个分步协议,为肿瘤行为分析、全山免疫荧光和共焦成像定量提供生成异种移植物的提示和指南。
摘要
斑马鱼幼虫异种草被广泛用于癌症研究,用于人体癌症 的体内 和实时研究。快速可视化对抗癌疗法(化疗、放射治疗和生物)、血管生成和转移的反应与单细胞分辨率的可能性,将斑马鱼异种草模型作为开发前cclin研究的首选。
与其他模型相比,斑马鱼幼虫异种草检测具有几个实验优势,但最引人注目的可能是尺寸尺度的缩小,从而缩短了时间。这种规模的缩小允许单细胞成像,使用相对较少的人体细胞(与活检兼容),中高通量药物筛选,但最重要的是使检测时间显著缩短。所有这些优势使得斑马鱼异种草检测对于未来的个性化药物应用极具吸引力。
许多斑马鱼异种移植协议已经开发与人类肿瘤的广泛多样性:然而,仍然缺乏一个普遍和标准化的协议,有效地产生斑马鱼幼虫异种草。在这里,我们提供一个分步协议,提供生成异种移植的提示和肿瘤行为分析、全山免疫荧光和共焦成像定量的指南。
引言
斑马鱼(丹尼奥·雷里奥)正在成为研究发育和疾病的强大的脊椎动物模型有机体。斑马鱼与人类1,2共享高度保存的遗传(约70%的遗传同源和~84%的疾病相关基因)和基本的器官形态特征。这种保护允许使用斑马鱼模型几个人类疾病,包括癌症3,4。
斑马鱼的处理和维护比小鼠容易得多,成本更划算,因为小鼠体积小,常年高产,外来受精3,5。斑马鱼胚胎在生命的头5-7天不需要活喂养,并被用作发育、感染和癌症1、4、6、7的有效模型。斑马鱼胚胎在受精后48小时孵化(hpf),是自由游泳动物,所有器官形成,跳动的心脏和功能循环系统,肝脏,大脑,肾脏骨髓等1,3。此外,在这个发展阶段,只有与生俱来的免疫力在起作用,适应性免疫仍在发展,允许人类细胞普遍有效移植,而无需使用免疫功能减小突变体7,8。然而,重要的是要注意,并非所有的人类细胞都同样具有9,例如,对于白血病细胞,它表明噬细胞(嗜中细胞和巨噬细胞)需要耗尽才能有效移植10。
斑马鱼的遗传可遗传性和早期胚胎阶段的光学透明度允许高分辨率的单细胞内视成像,从而在生物学的不同领域建立最先进的成像技术。此外,在癌症的背景下,这些功能是有用的实时研究宿主肿瘤相互作用的最初阶段,如研究血管原性和转移潜力,以及与天生的免疫系统的相互作用8,9,11,12,13。
虽然在短的异种移植检测中,没有时间进行转移性"进化"——但可以分析肿瘤细胞的转移能力(即它们通过转移步骤(如入侵、内化、循环生存、外泄和殖民化)的效率,从而在体内和实时8、11、13、14中研究这些过程。
其生命周期的特点使斑马鱼成为癌症中个性化医学的独特模式。测定可以在较短的时间跨度内进行,结果在几周内获得7、8、9、11、12、15、16。这些检测的可耐性和可行性为医生和研究人员提供了获得转化结果的可能性,这些结果对癌症患者非常有用,而对于癌症患者来说,时间是一个基本需求。
尽管越来越多的尝试产生成功的斑马鱼胚胎异种移植物,仍然需要标准化的注射程序,以及评估细胞生存能力和注射后的肿瘤行为。
在此协议中,我们为研究人员提供了一个清晰而详细的分步指南,用于在斑马鱼胚胎中注入人类癌细胞系,以及随后对肿瘤细胞行为的固定、免疫染色、成像和定量。
研究方案
斑马鱼(Danio rerio)模型是根据欧洲动物福利立法、2010/63/欧盟指令(欧盟委员会,2016 年)和香帕利莫鱼平台的标准协议处理和维护的。所有议定书均得到香帕利莫动物伦理委员会和葡萄牙机构组织-ORBEA(动物/动物福利和伦理机构)和DGAV(埃里埃勒·德·阿利门塔·埃韦泰里内里亚/食品和兽医总局)的批准。
注:在开始主要实验之前,练习人类结肠直肠癌(CRC)细胞系HCT116。此细胞系易于准备(高度增殖),易于注射和有效移植(约 95-100%)。从细胞过剩(+12x106细胞,T-75烧瓶)和多余的鱼(400鱼)开始,直到精通技术,因为许多细胞和鱼将在训练中丢失。一旦在 HCT116 异种移植中实现约 95% 的灌装,实验者就准备好了。有关完整协议的示意图,请参阅图 1。
1. 设置注射
- 注射前两周,在培养中扩大细胞(见 表1, 详细指南注射几个细胞系的最佳 体外 汇合)。
- 注射前三天,穿过需要背景的斑马鱼。
2. 注射前24小时
- 清洁斑马鱼胚胎板(丢弃所有死亡和未发育的胚胎),并刷新E3介质。
- 在细胞培养室中,丢弃计划注射的烧瓶中的细胞培养介质,用1倍磷酸盐缓冲盐水(PBS)清洗一次,以去除死细胞并添加新鲜介质。
- 准备注射程序的工具,如:微注射针,糖板和发夹对齐胚胎注射(图2A-D,详见下文)。
- 微注射针 (图2A)
- 使用薄膜玻璃毛细管(4英寸,OD 1.0毫米,微皮拉器中无丝(热度:≈500;fil:10;天鹅绒:50;dec:60;拉:100)。
- 板制备 (图 2B)
- 在 H 2 O 中准备2%的糖,加热并倒入一层溶解的甘蔗糖在干净的培养皿的盖子中。让它聚合,并在尺子的帮助下,使三到四个直的阿加罗斯线的胚胎对齐。
- 发夹组件 (图 2C-D)
- 将 1 根头发放在玻璃毛细管内,在管外留下大约 1 厘米的头发。
- 在钳子的帮助下将头发的外尖卷曲到玻璃毛细管中,形成一个长度约0.5毫米的循环。
- 用一滴指甲油密封毛细管的边缘。这也将有助于修复循环到位。让它干燥。在管子的另一边重复程序。
- 切一块电胶带(比普通胶带更具耐磨性、不可渗透性和刚性)。
- 将胶带密封在毛细金周围,以防止其断裂。
- 微注射针 (图2A)
3. 注射日
- 将孵化的胚胎与未孵化的卵子分开。在这个阶段,在胚胎介质中加入1x个质子 (0.6毫克/mL,表3)可以促进孵化。将胚胎放入孵化器(28 °C)直到注射。
注:不要将胚胎留在蛋白酶溶液中超过1小时,因为酶会作用于孵化的胚胎,增加其死亡风险。确保胚胎的发育阶段与48马力(图3A,A')相对应,以避免水肿和死亡的风险。 - 准备1x三角(从25倍的股票)。
注:详细的食谱可以在 表3 和斑马鱼信息网络 -ZFIN网页17找到。
4. 注射细胞标签
注意:细胞的标记可以在酶分离后直接在烧瓶中或在1.5 mL微中流管中进行。有关更多信息,请参阅 讨论 。
- 取出细胞培养介质,用 1X PBS 洗两次(2 倍)烧瓶。
- 直接在烧瓶(2 mL 溶液/T75 烧瓶)或酶分离后在 1.5 mL 微中微富管中用首选脂质染料标记细胞。避免暴露在37°C的光和孵化细胞(参见 表1 和 表2 的条件/解决方案)。
- 如果在烧瓶中贴标签
- 取出染料,用 1 倍 PBS 清洗,然后用 EDTA 和细胞刮刀分离细胞。
- 将细胞转移到 1.5 mL 微中微管。离心机在300 x g 下5分钟,然后转到步骤4.5。
- 如果在 1.5 mL 微中流管中贴标签:
- 离心机在300 x g 下5分钟取出染料并丢弃超自然。在1倍PBS中重新使用以进行清洗。
- 离心机5分钟在300 x g, 然后去步骤4.5。
- 丢弃超自然物,用细胞培养介质重新加入颗粒(对于 50 μL 颗粒,添加约 150-200 μL 的介质)。
- 使用带有Trypan蓝色排除或其他选择方法的Neubauer腔室量化细胞的生存能力。
- 离心机在300 x g 下4分钟,丢弃超自然。在注射介质中补充细胞。
注:推荐的细胞浓度(一般为0.25-0.5x106 个细胞/μL)和介质可在 表1中找到。 - 从这一点开始,将细胞保存在冰上。
5. 注射程序
- 在1x三角形中麻醉胚胎5分钟。
- 使用塑料巴斯德移液器,将少量(约50)麻醉胚胎转移到蔗糖板上,并在发夹环的帮助下小心地对齐它们。确保保持胚胎之间的距离,特别是一个蛋黄和下一个蛋黄之间的距离(图4A)。
注:要对齐的胚胎数量将因进行注射的研究人员的专业知识水平而异。从几个开始(~10-20)。有关胚胎在阿加/阿加罗斯板块中正确定位的示意图,请参阅 图 4A。 - 通过在板中小心添加 1-3 滴 1x 三角溶液,确保对齐的胚胎不会在糖板中干燥,以防止死亡。
- 轻轻敲击微中微管以补充细胞。使用微加载器尖端避免气泡,用细胞悬架回装注射针,因为它们会损害胚胎的完整性。
- 打开气压阀(40 psi),设置微注射器,小心地将微投射针插入支架。
注意:使用以下推荐的微注射器设置:保持压力 - 通风口(3 psi);喷射压力 - 通风口;范围 - 100毫秒 - 在立体显微镜下,用杜蒙钳切开靠近尖端的微注射针,#5或类似。
注意:尖端必须足够钝和薄,使细胞通过不堵塞,以及避免损害胚胎和失去细胞。厚厚的微注射针尖会伤害胚胎,促进水肿或斑马鱼死亡的形成。格栅不用于针头校准。有关详细信息,请参阅 讨论 。 - 在注入胚胎之前,先测试微注射器压力,从最低的喷射压力开始,直到在+1-3脉冲中达到与斑马鱼胚胎眼睛大小相似的体积。
注意:建议在培训开始时尽可能使用荧光立体显微镜。这将允许更轻松地识别荧光标记的细胞。 - 小心地刺穿胚胎蛋黄中间,降低针头的角度,小心地推,直到针尖到达近视线空间(PVS)(图4B-D)。
- 按微注射器踏板,将细胞注入 PVS。以胚胎的眼睛为向导。尽量从心脏注射一批与胚胎眼睛大小相似的细胞,以防止心脏水肿。
- 小心地取出针头,进入下一个胚胎。
- 如有必要,调整微注射器压力。
注意:细胞往往开始堵塞,因此压力可能会增加。如果需要,可以削减毛细(增加直径),同时降低压力。 - 将注射的胚胎转移到一个干净的培养皿(表4)与1x三角溶液,让他们休息5-10分钟。这将给伤口关闭的时间。
注意:要将胚胎从阿加板转移到培养皿中,在胚胎顶部加入几滴1x三角形溶液,然后用塑料巴斯德移液器小心地收集它们。将收集的胚胎丢弃在新的培养皿中,并配有1x三叶草溶液。 - 删除 1x 三卡因解决方案,并添加新的 E3 介质。
- 在34°C(人类细胞系生存和斑马鱼发育8之间的温度受损)孵化异种草。
6. 转移性测定
- 注射后约1小时(hpi),在荧光立体显微镜上筛选注射的胚胎,并根据循环细胞的缺失(图5A)或存在(图5B)将异种移植物分成2组。
注:即使心脏或循环中只检测到一个癌细胞,也包括这些异种移植物,这些异种移植物与循环细胞有关。或者,细胞可以直接注射到循环中,以增加该组的异种移植物的数量。
7. 注射后1天
- 在荧光立体显微镜上仔细分析每个胚胎,并选择那些有正确注射肿瘤的胚胎(图6)。
注意:如果需要,在筛查前用三卡因1X溶液麻醉注射的胚胎。 - 丢弃以下胚胎/异种移植物(图6A-A'):
• 无肿瘤/异常形态/死亡,
•心脏和/或蛋黄水肿,
•肿瘤细胞仅在蛋黄中,
•与很少的癌细胞。 - 根据其肿瘤大小对选定的异种移植物进行排序。使用眼睛的大小进行比较(图6B-B',6C)。
•小于眼睛大小的肿瘤(+),
•肿瘤大小与眼睛相同(+),
• 大于眼睛大小的肿瘤(+)。 - 根据所需的实验布局分配异种草,并开始药物检测(控制与药物等)。每天更换药物和E3介质(表4)。
- 孵育保持 34°C 温度的异种草,直到检测结束。
8. 注射后4天
- 在检测的最后一天,用1x三角溶液麻醉异种草,并小心地将它们对齐在阿加板上。
注意:丢弃任何死亡或肿胀的异种草。药物治疗和一些肿瘤细胞可以诱发毒性,并最终导致异种移植死亡。这些异种移植物不考虑用于放大定量。 - 要确定移植百分比:在荧光立体显微镜上分析每个活异种移植物,并评估 PVS 中肿瘤的缺失(图 6D) / 存在 (图 6E)。

- 确定转移百分比:在荧光立体显微镜上分析每个异种移植物,并评估2个先前定义的组(CIRC和NO CIRC, 图6F)中微微介质组织(CHT)的存在/缺失
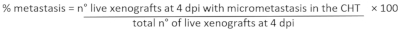
- 根据实验设置,选择感兴趣的异种草,用25倍三角(表3)安乐死它们。
- 在室温 (RT) 或 4 °C 的夜间将它们固定在 4% 甲醛 (FA) 中至少 4 小时。
注意:使用无甲醇甲醛 (16% FA) 稀释在 PBS/0.1% 特里顿的 4%。将管子填充到顶部,并固定。水平放置管子,以确保所有异种草的均匀固定,增加渗透性,防止斑马鱼聚集在底部。 - 或者用 PIPES 修复它们(每 1 mL: 100 μL 的 1 M PIPES 钠盐 (4 °C); 1 μL 的 1 M mgSO4 (RT); 4 μL 的 0.5 M EGTA (RT); 93.7 μL 的 16% FA (RT); 801.3 μL 的ddH 2O)。
注:PIPES 比 4% FA 更能保留 RFP 和 mCherry 转基因线的荧光。 - 如果免疫染色将在不同的一天进行,用100%甲醇(MetOH)代替FA。固定在100%甲醇中的异种草可以无限期地储存在-20°C。
注意:MetOH 会损害某些染色剂(即法洛丁)的效率,并淬火一些荧光标签。事先确认 MetOH 固定样品中抗体的效率。
9. 用于共焦成像的全安装免疫染色
注:整个安装免疫荧光技术需要3天,分为如下:第一天是用于异种移植和原抗体孵化的渗透。第二天用于洗涤和二次抗体孵化,第三天用于洗涤、固定异种草和储存在安装介质中。
- 第 1 天
- 如果异种草储存在 100% MetOH 中,则通过一系列降低的 MetOH 浓度(75%、50%、25% MetOH 在 PBS/0.1% Triton 中稀释)来补充水分。如果固定在FA中,则替换为PBS/0.1%特里顿。
- 在PBS/0.1%特里顿中洗4次5分钟。
- 在H2O中洗1次5分钟。
注意:除非另有说明,否则管子必须始终水平定位在固定、渗透和清洗步骤中。 - 将 H2O 替换为冰冷丙酮,在 -20 °C 孵育 7 分钟。
注意:放置一个50 mL管与丙酮在-20°C,所以它是准备使用。微中流管必须 垂直 放置在机架上,以免传出。 - 在PBS/0.1%特里顿中清洗2次10分钟。
- 在 RT(PBDX_GS阻塞缓冲区)用PBDX_GS阻塞解决方案孵化 1 小时:1x PBS 的 50 mL; 0.5 克牛血清白蛋白 - BSA; 0.5 mL 的 DMSO; 250 μL 的 10% 特里顿; 750 μL 的山羊血清 - GS (15μL/1 mL).
- 取出PBDX_GS并添加~40微L的原抗体稀释(一般为1:100)。
注:主要抗体稀释的体积因微中微管中存在的异种草的数量而异。确保所有异种草被淹没。 - 在RT孵育1小时,然后在4°C过夜。垂直定位管。
- 第2天
- 取出原抗体,在PBS/0.1%Triton中洗2次10分钟。
- 在PBS/0.05%补间中洗4次30分钟。
注意:以下步骤必须在黑暗中执行(使用铝箔保护管免受光线的照射)。 - 删除 PBS/0.05% Tween,并在PBDX_GS中稀释 50-100 μL 的二次抗体稀释(一般为 1:200 - 1:400) = DAPI(50μg/mL)。
- 在RT孵育1小时,然后在4°C过夜。垂直定位管,防止光线照射。
- 第3天(使用铝箔保护管免受光线的照射)
- 去除二次抗体稀释,在PBS/0.05%补间中洗4次15分钟。
- 在室温下修复20分钟,在4%FA。
- 在PBS/0.05%补间中洗1次5分钟。
- 取出 PBS/0.05% Tween,并在每个微中福管中加入 1 滴水安装介质。垂直定位管。
- 在4°C下安装或存储,防止光线照射,直到安装。垂直定位管。
10. 异种草的安装
注意:在整个过程中保护微中微管免受光线的照射。斑马鱼异种草安装在2个盖片(24 x 60毫米= 1.5)之间。这允许在共焦成像过程中翻转安装的异种移植物,以便可以访问肿瘤的两侧(顶部和底部)。不要使用带有安装介质的塑料移液器 - 异种草可能会夹在移液器中。有关以下步骤的示意图表示,请参阅图 7。
- 给盖子贴上 Y 的标签,用石油果冻或硅胶油脂密封盖片 X 的边缘,以避免安装介质泄漏。
- 将带玻璃巴斯德移液器的异种草转移到盖片 X 上。
- 小心地将它们与发夹对齐,并去除多余的水性安装介质。
- 添加浇合安装介质以覆盖滑点 Y。
- 小心地将盖子 Y 放在盖单 X 的顶部。不要按盖子,因为这可能会破坏异种草。
- 将组装好的盖子放在显微镜滑梯上,用透明胶带固定。这允许更轻松地操作共焦成像和存储。
11. 共焦成像
注:具有水校正的Apochromatic 25倍浸入式客观透镜最适合单细胞分辨率成像PVS肿瘤(见图8C-C"和图9A示例)。
- 使用 z 堆栈函数获取样品,每片之间的间隔为 5μm。对于针对 3D 重建的图像,特别是容器,在切片之间使用 1-3μm 的间隔(图 8A)。
12. 分析和量化
- 使用 FIJI/ImageJ 软件或类似软件进行对焦图像处理和分析。
- 打开FIJI软件中的原始数据(。czi、。lsm等)。
- 要在复合模式下选择全部或只是一个通道,请单击: 图像>颜色>通道工具。
- 要调整亮度和对比度水平,请单击: 图像>调整>颜色平衡。
- 量化肿瘤大小
- 从顶部、中间和底部选择肿瘤的三个具有代表性的切片,每个异种格拉夫特(图 8 A)。
注:共焦分辨率达到约60-70微米的肿瘤深度。如果肿瘤很大,它可能无法映像其总体积。 - 打开电子表格以注释数据。
- 数一数与3个选定切片中的肿瘤细胞相对应的每个DAPI核(图8 A,B)。要做到这一点:
- 通过单击 插件>分析>细胞计数器,打开 FIJI/ImageJ 的单元格计数器插件。
- 在单元格计数器工具中,单击 "初始化",选择计数器类型,然后单击图像以手动启动计数模式。每次点击,计数器都会添加计数的单元格(点击次数)。
- 计算完一整片后,将细胞号保存在相应的优秀文档中。
- 返回斐济后,单击"从蜂窝计数器"窗口重置以删除信息(如果将使用同一计数器)。否则,信息可以保留,其他计数器可用于其他切片(或单元格)。
- 移动到第二个代表性切片并重复以前的步骤。收集所有数据。
注意:DAPI计数器通常用于计算细胞数量,由于单个细胞的清晰定义,但是,可以使用其他细胞特定的染色。
- 要获得肿瘤细胞总数,请使用以下公式:
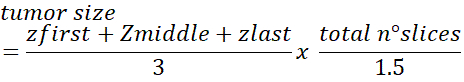
注:平均核直径为~10-12μm的细胞估计为1.5校正数。如果细胞更大/更小,此校正可能需要调整。有关此方法的更多详细信息,请参阅Dicussion。
- 从顶部、中间和底部选择肿瘤的三个具有代表性的切片,每个异种格拉夫特(图 8 A)。
- 要量化其他标记(免疫细胞、线粒体数字、PPH3、激活的 Caspase3、Ki67 等),请使用相同的插件量化所有切片(有关线粒体数字可视化,请参阅图 8C-C')。将计数细胞总数除以相应的肿瘤大小,乘以 100 以获得百分比。
注意:注意某些单元位于两片之间,在 z 堆栈中来回移动,以确保一个单元格不会被计算两次。
结果
斑马鱼异种草作为研究抗癌疗法的工具。
HCT116结肠直肠癌细胞系被贴上CM-DiI的标签,并在受精后2天的PVS中注射(dpf)胚胎。注射后,异种草在34°C下孵育,这种温度允许肿瘤细胞生长,同时不影响斑马鱼的发育。第二天,根据PVS中肿瘤质量的存在或不存在(未正确注射斑马鱼被丢弃和安乐死)(图6A-A')对异种草进行了筛查。Xenografts 根据肿瘤大小(图 6B-B')进行分组,并在非治疗对照组和 FOLFIRI 化疗(0.18 mM 叶酸、0.08 mM Irinotecan 和 4.2 m 氟酸 (5-FU) 中随机分布(在 6 井板中:每口井 12 xenograft)。
每天更换控制E3和药物,丢弃死斑马鱼。4 dpi 和治疗后三天 (dpt), 包扎被量化为协议的第 8.2 步。移植被认为是在 PVS 中呈现肿瘤质量的异种移植频率为 4 dpi。例如,如果在实验结束时有40只活幼虫,40只幼虫中有35只在PVS中出现肿瘤,则移植率为87.5%。Xenografts 被安乐死和固定,通过免疫荧光和共聚焦显微镜来评估肿瘤大小和凋亡。
使用抗裂壳3抗体(Asp175)(兔子,1:100,#CST 9661)和DAPI(50μg/mL)进行免疫荧光检测细胞,用于核对抗。图像堆栈数据集(每5um)是在LSM710共焦显微镜和数据分析与FIJI/ImageJ软件进行,如第12步所解释的。线粒体指数、凋亡(激活 Caspase3 的百分比)和肿瘤大小的量化, 发现FOLFIRI诱发线粒体病(曼惠特尼测试,P<0.0001)显著减少,凋亡显著诱导(曼惠特尼测试,P<0.0001),同时肿瘤大小减少54%(P<0.001图)(图8C-E,图9A-E)。
这些功能在高吞吐量表型药物筛选中很有用,并在短时间内测试多种癌症治疗的细胞内在和生理影响。
人-斑马鱼异种草与人特异性抗体的特征
与所有异种移植模型一样,存在误识别细胞的风险。例如,巨噬细胞可以法戈细胞酶人类癌细胞,成为与脂亲染料的标签,然后沿着斑马鱼宿主旅行,因此,这些细胞可能被误认为肿瘤微转移。因此,将异种草贴在特定的人类抗体(如人类HLA、ki-67或人类线粒体(hMITO)上,对于初始特征的描述至关重要,并且还要熟悉肿瘤细胞的形态(图9F-I)。
斑马鱼异种移植研究细胞与细胞的相互作用。
斑马鱼异种移植模型的另一个巨大优点是,可以研究不同肿瘤细胞的相互作用,并分析每种细胞如何影响对方的行为。不同的人类癌细胞(来自同一肿瘤或不同肿瘤的不同克隆)可以共同注射。在此示例中,来自同一患者的两个 CRC 细胞系被贴上不同的脂亲染料标签,并混合在 1:1 的比例进行注射(图 9J-K)。
当将人体细胞系(产生多克隆肿瘤)混合在同一移植物上时,避免使用迪奥染料,因为这会导致非特异性双染色(表2)。相反,使用CM-DiI(细胞系#1)与绿色CMFDA(细胞系#2),或CM-DiI(细胞线#1)与深红色(细胞线#2)(表2,图9J-K'),以获得在实验结束时容易歧视人群。要量化肿瘤内每个克隆的频率,请使用 FIJI 中的 2 种不同的计数器类型来识别每个克隆,然后按总细胞数(所有克隆的总和)进行除以,以获得每个克隆的相对分数(%)。
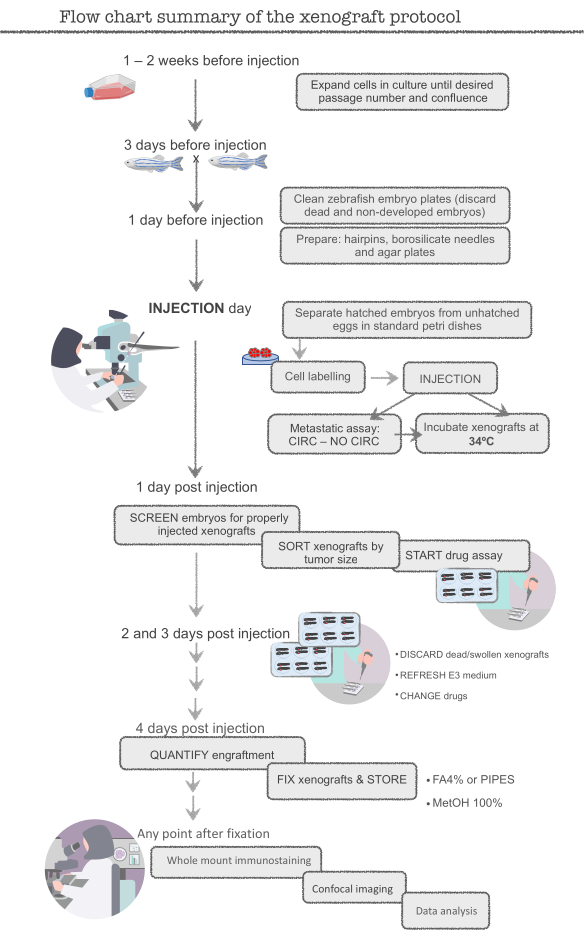
图1。斑马鱼异种草协议的流程图摘要请单击此处查看此图的更大版本。
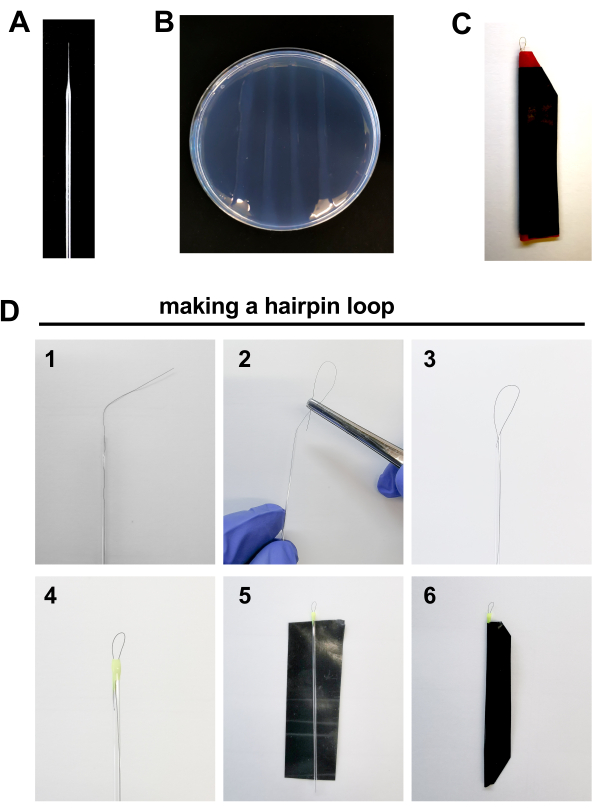
图2。斑马鱼胚胎注射材料:A. 博罗西酸针 B。 2% 阿加罗斯板。 C 发夹循环 D。 制作发夹循环的步骤 :1.将 1 根头发放在玻璃毛细管内,在管外留下大约 1 厘米的头发。 2-3. 在钳子的帮助下将头发的外尖卷曲到玻璃毛细管中,形成一个长度约0.5毫米的循环。 4. 用一滴指甲油密封毛细管的边缘。 5-6. 在毛细纸周围密封一块电胶带,以防止其断裂。 请单击此处查看此图的较大版本。
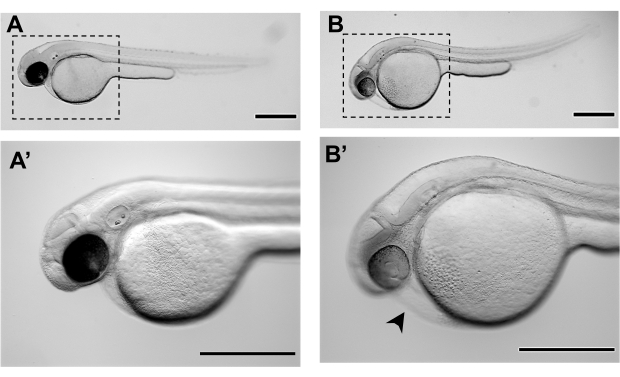
图3。在受精后48小时(48 hpf):A-A'的代表立体显微镜图像斑马鱼胚胎。 斑马鱼胚胎的正常形态在48马力的发育,准备微注射 B-B'。 斑马鱼胚胎的形态学,尚未达到48马力的微注射的充分发育阶段,并呈现了一定程度的心脏水肿(黑箭头)和分离的蛋黄。 A 和 B 分别是 A 和 B 的放大倍数。比例栏表示 500μm。 请单击此处查看此图的更大版本。

图4。斑马鱼微注射板设置的示意图表示:A. 麻醉胚胎在3%阿加/2%阿加罗斯板对齐。 B. 受精后斑马鱼胚胎的图形表示,黑色箭头指示围线空间 (PVS)。 C 和 D. 癌细胞可以以不同角度注射到受精后胚胎的围线空间 (PVS) 中。 请单击此处查看此图的较大版本。
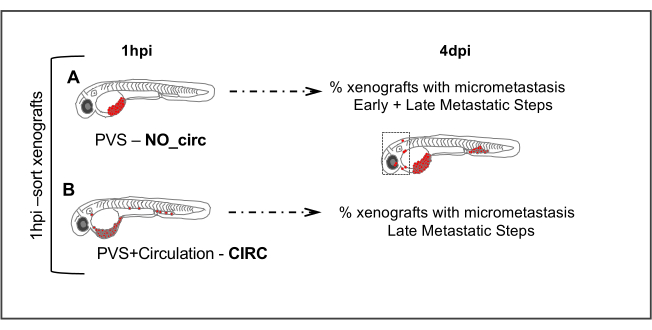
图5。转移性检测。注射后1小时(1hpi)注射胚胎根据肿瘤细胞在循环中的缺失(NO_circ)或存在(CIRC)进行排序。注射后4天,对两组存在微转移的异种移植物数量进行量化。(A )NO_circ组的细胞必须经过所有转移步骤才能形成微转移,而 CIRC 组(B)中的细胞只能经历转移级联的最后步骤。请单击此处查看此图的较大版本。
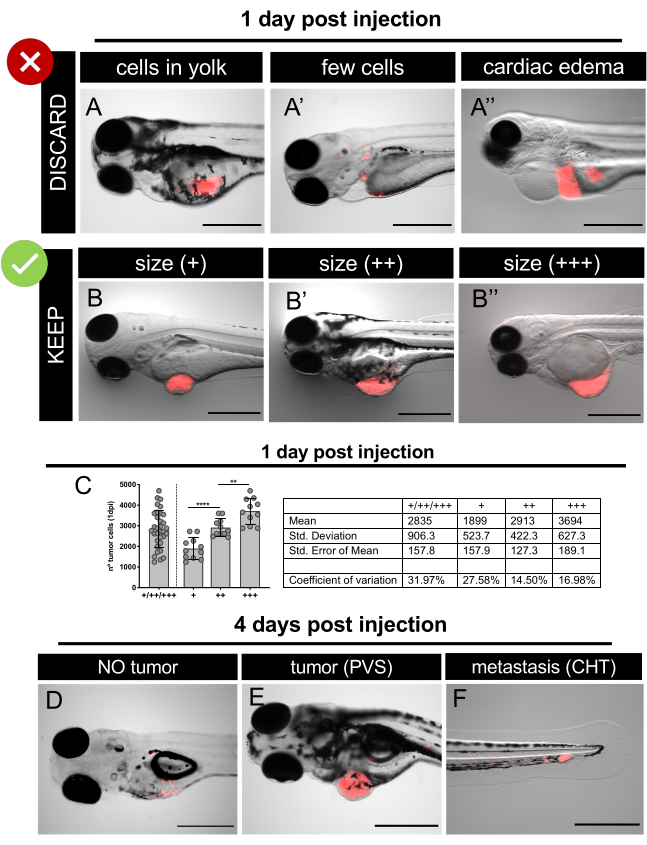
图6。注射后1天和注射后4天,具有代表性的荧光立体显微镜图像。表达荧光蛋白TdTomato(红色)的人类癌细胞被微注入2个斑马鱼胚胎。在1分,筛选注射的胚胎,并丢弃注射不当的胚胎或带有水肿(A-A'')的胚胎,根据肿瘤大小(B-B')对注射良好的胚胎进行排序。C.代表在 SW620 异种移植物中对不同肿瘤大小类别中存在的细胞总数进行定量,为 1 dpi。每个点代表一个异种格拉夫特量化,如第4dpi节 12.At 解释,筛选幼虫和量化不同的类:无肿瘤(D):PVS(E)中的肿瘤和 CHT(F)中的微代谢。比例栏表示 500μm。请单击此处查看此图的更大版本。
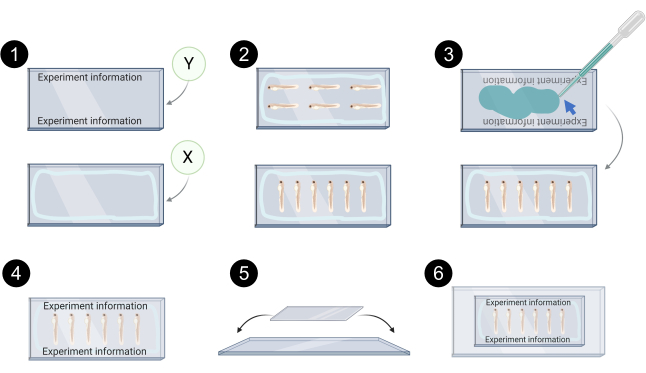
图7。用于对焦成像的异种格拉夫特安装的示意图表示。1. 盖唇 Y 中标记的示例,盖片 X 中的浅蓝色线表示应用石油果冻/硅油脂以防止安装介质泄漏的周界。 2. 用于对焦成像的盖片 X 上的异种格拉夫特对齐示例。 3. Aques 安装介质(蓝色箭头)用于将盖子 Y 绑在盖片 X. 4 的顶部。正确安装盖片的示例。 5. 然后将盖片放在玻璃滑梯上,用透明胶带固定。 6. 安装的异种移植物,可进行对焦成像。 用 BioRender.com 创建请单击此处查看此图的更大版本。
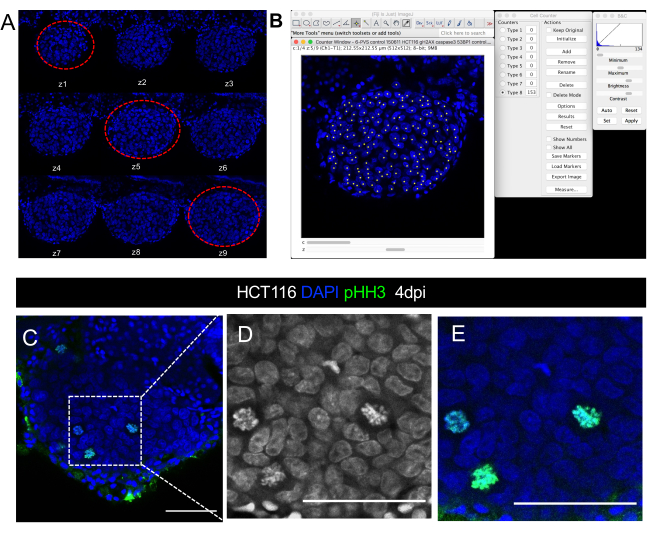
图8。肿瘤大小共焦显微镜图像定量的视觉表示。 注射后 4 天的 HCT116 异种移植的对焦图像 。 DAPI 通道中的 z 堆栈切片系列,间隔为 5 μm。红色冲线围绕用于细胞计数的三个具有代表性的切片。 B. 使用图像J/斐济软件中的细胞计数器插件对DAPI核进行量化的说明。 C-E.肿瘤内单细胞分辨率示例,其中可以可视化/量化 DAPI 中的线粒体数字或使用磷-高石 H3 抗体(绿色)。 D 和 E 是 C 的放大倍数 。 比例栏表示 50μm。 请单击此处查看此图的更大版本。
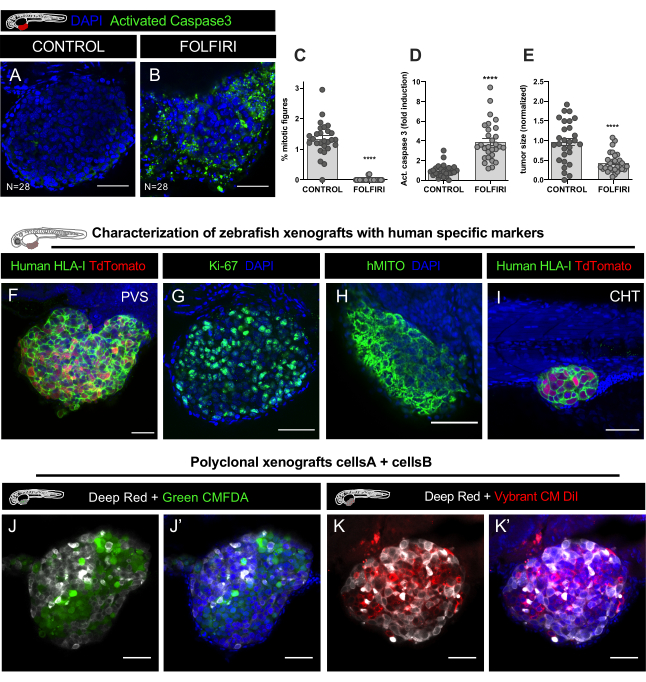
图9。代表性结果。A-E. HCT116结肠直肠癌细胞系被贴上维布兰特CM-DiI的标签,并在受精后2天的PVS中注入(dpf)胚胎。注射后,异种草在34°C孵育。 在1分皮,异种草被筛选和随机分布在非处理控制和FOLFIRI,连续治疗3天,固定在4分。 A.利用抗裂解的卡斯帕塞3抗体和DAPI进行免疫荧光来检测凋亡细胞,用于核反污。线粒体指数 C的量化, 凋亡 (激活的卡斯帕塞 3 的百分比) D, 和肿瘤大小 E,揭示了FOLFIRI诱导线粒体病(曼惠特尼测试,P<0.0001)和凋亡显著诱导(曼惠特尼测试,P<0.0001),伴随着肿瘤大小减少54%(P<0.001)。分析的异种草的数量在图中表示,每个点表示一个异种格拉夫特。 F-H. 在PVS和CHT I中标有绿色(人类HLA、ki67和hMITO)的人类特定标记的注射后4天结肠直肠癌异种移植的代表图像。 J-J'。 多克隆异种移植物的对立图像,注射了两种不同的人类结肠直肠癌细胞系,标记为嗜脂染色细胞跟踪器深红色(Cy5 - 白色)、细胞跟踪器绿色CMFDA(488 - 绿色)和DAPI计数器。 K-K'。 两种不同的人类结肠直肠癌细胞系的对立图像,标记为脂质染色细胞跟踪器深红色(Cy5 - 白色)、维布兰特CM DiI(594 - 红色)和DAPI计数器。比例栏表示 50μm。 请单击此处查看此图的更大版本。
| 细胞线 | 组织 | 物种 | 形态学 | 增长模式 | 注射的理想汇合 | 注射分离剂 | 分离时间 | 标签协议 | 注射介质 | 将细胞总数除以(以达到注射的理想浓度) | |||||||
| SW480 | 结肠直肠腺癌(原发) | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 2m | 5 分钟 | 瓶 | PBS 1x | 0,25 | |||||||
| SW620 | 结肠直肠腺癌(转移) | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 2m | 5 分钟 | 瓶 | PBS 1x | 0,25 | |||||||
| HCT116 | 结肠直肠癌(原发性),克拉斯突变体 | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 2m | 5 分钟 | 瓶 | PBS 1x | 0,25 | |||||||
| HKE3 | 结肠直肠癌, 克拉斯 WT | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 2m | 5 分钟 | 瓶 | PBS 1x | 0,25 | |||||||
| HT-29 | 结肠直肠腺癌(原发) | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 2m | 5 分钟 | 瓶 | PBS 1x | 0,2 | |||||||
| 可可-2 | 结肠直肠腺癌(原发) | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 1米 | 5 分钟 | 1.5 mL 微中福管 | 完整介质 | 0,25 | |||||||
| 麦克夫-7 | 乳房腺癌(转移) | 人 | 上皮 | 粘 附 | 70% - 80 % | PBS/EDTA 1米 | 5 分钟 | 1.5 mL 微中福管 | 60% FBS + 40% 完整介质 | 0,5 | |||||||
| Hs578T | 乳腺癌(原发性) | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 1米 | 2 分钟 | 1.5 mL 微中福管 | 60% FBS + 40% 完整介质 | 0,5 | |||||||
| MDA-MB-468 | 乳房腺癌(转移) | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 1米 | 8 分钟 | 1.5 mL 微中福管 | 60% FBS + 40% 完整介质 | 0,5 | |||||||
| MDA-MB-231 | 乳房腺癌(转移) | 人 | 上皮 | 粘 附 | 70% - 75 % | PBS/EDTA 1米 | 5 分钟 | 1.5 mL 微中福管 | 完整介质 | 0,5 | |||||||
| RT112 | 尿膀胱过渡细胞癌(原发性) | 人 | 上皮 | 粘 附 | 85% - 90% | 特里普勒 | 6分钟+细胞刮刀 | 1.5 mL 微中福管 | 完整介质 | 0,5 | |||||||
| BFTC905 | 尿膀胱过渡细胞癌(原发性) | 人 | 上皮 | 粘 附 | 75% - 85% | 特里普勒 | 10 分钟 | 1.5 mL 微中福管 | 80% 完整介质 + 20% PBS/EDTA 2 mM | 0,5 | |||||||
| J82 | 尿膀胱过渡细胞癌(原发性) | 人 | 上皮 | 粘 附 | 85% - 90% | 特里普勒 | 10 分钟 | 1.5 mL 微中福管 | 完整介质 | 0,5 | |||||||
| RT4 | 尿膀胱过渡细胞癌(原发性) | 人 | 上皮 | 粘 附 | 85% - 90% | 特里普勒 | 6 分钟 | 1.5 mL 微中福管 | 完整介质 | 0,5 | |||||||
| 米娅·帕卡-2 | 胰腺上皮癌(原发) | 人 | 上皮 | 粘 附 | 80% - 90% | 特里普勒 | 3 分钟 | 1.5 mL 微中福管 | 60% FBS + 40% 完整介质 | 0,5 | |||||||
| 潘克-1 | 胰腺上皮癌(原发) | 人 | 上皮 | 粘 附 | 80% | 特里普勒 | 5 分钟 | 1.5 mL 微中福管 | PBS/EDTA 2m | 0,5 | |||||||
| VC8 | 肺成纤维细胞,BRCA2突变体,人力资源缺陷 | 中国仓鼠 | 上皮 | 粘 附 | 70% - 80 % | PBS/EDTA 1米 | 5 分钟 | 1.5 mL 微中福管 | 完整介质 | 0,25 | |||||||
| VC8-B2 | 肺成纤维细胞,人类BRCA2,BRCA2−/−人力资源缺陷 | 中国仓鼠 | 上皮 | 粘 附 | 70% - 80 % | PBS/EDTA 1米 | 5 分钟 | 1.5 mL 微中福管 | 完整介质 | 0,25 | |||||||
表1:注射几个细胞系的最佳体外汇合
| 细胞染料 | 目录编号 | 荧光谱 (执行 - Em.) | 股票稀释 | 工作稀释到烧瓶中的污渍 | 在 1.5 mL 微中微浓缩中稀释以弄脏 | 孵化时间 | 观察 | ||||||
| 维布兰特 · 厘米 - 迪伊 | V22888 | 549纳米 - 569纳米 | 已稀释 | 4:1000 在 PBS 1x | 4:1000 在 PBS 1x | 15 分钟 = 37 oC = 4 分钟 = 4 oC | |||||||
| 维布兰特迪奥 | V22886 | 484纳米 - 501纳米 | 已稀释 | 5:1000 在 PBS 1x | 5:1000 在 PBS 1x | 15 分钟 = 37 oC = 4 分钟 = 4 oC | 注射后4天共焦成像的分辨率不高 | ||||||
| 细胞跟踪器深红色 | C34565 | 630纳米 - 660纳米 | DMSO中的1立方米 | 0.5 - 2.5μM 在 PBS 1x | 0.5 - 2.5μM 在 PBS 1x | 15 分钟 = 37 °C | |||||||
| 细胞跟踪器绿色 CMFDA | C7025 | 492纳米 - 517纳米 | DMSO中的10米 | 0.5 - 2.5μM 在 PBS 1x | 0.5 - 2.5μM 在 PBS 1x | 15 分钟 = 37 °C | 注射后 48 小时产品泄漏到腹腔,但非常适合共同注射研究 | ||||||
表2:染料和条件
| 大小 | 幼虫的 # | E3 1x 中等音量 |
| 100 毫米 x 15 毫米(标准) | 最多 50 | 20-25毫升 |
| 60 毫米 x 15 毫米 | 最多 20 个 | 10升 |
| 6 井板 | 每口井最多15口 | 每口井3-4毫升 |
表3:培养皿选项
| E3 中等 50 倍 - 库存 | 对于10升无菌水: |
| 146.9克纳克 | |
| 6.3克的KCl | |
| 24.3 克卡克2[2H2O | |
| 40.7 克 MgSO4[7H2O | |
| E3中等1x-准备使用 | 400 mL 的 E3 中等 50 倍 |
| 60 mL 0.01% 甲基蓝解决方案 | |
| 填充多达 20 升的鱼系统水 | |
| 三角25倍-股票和安乐死 | 2克三卡因粉末 |
| 500mL 反渗透水 | |
| 10 mL 的 1 M 三轮车 (pH 9) | |
| 调整到pH 7 | |
| 三卡因 1x - 麻醉 | 20 mL的三角25倍 |
| 填充高达 500 mL 的系统水 | |
| 60毫克/mL质酶 - 库存 100 倍 | 1克质子 |
| 16.7 mL 无菌水 | |
| 0.6毫克/mL质酶 - 1倍准备使用 | 100μL质子100x |
| 9.9 mL 的 E3 中等 1 倍 |
表4:解决方案构图
讨论
斑马鱼作为癌症发展和药物筛选的典范的重要性日益增强,导致许多出版物3,4,7,13,14,16,18,19,20,21。然而,在斑马鱼胚胎中注入癌细胞是一种需要高水平灵巧的技术,这对研究人员来说可能具有挑战性。在本协议中,我们旨在提供实用信息和一些提示,以帮助克服建立斑马鱼胚胎异种草的初始挑战。
细胞处理事先注射
这种优化的协议,为生成斑马鱼异种草与细胞系可以适应不同类型的(癌症)细胞与不同的形态。我们建议,用于斑马鱼异种草的所有细胞系均不含支原体。与其他细菌污染不同,支原体在细胞培养中的存在不会产生在显微镜22下很容易检测到的变化。支原体污染可能影响细胞系的移植潜力、它们对药物的敏感性以及斑马鱼胚胎的生存能力。
虽然细胞可能会继续长期增殖,但其表型和基因型可能容易发生变化。熟悉文化中细胞系的形态和行为很重要。我们建议在 3-12 之间解冻后保留细胞通道的数量,以获得可重复的结果。因此,应定期进行支原体测试。
细胞应处于日志阶段(在达到汇合之前呈指数增长阶段~70%)在注射当天。这将使肿瘤的独特特征得到充分的增强和适当发展。为了防止异种移植细胞表型的变化,保持实验之间注射的汇合至关重要。注射的细胞数量可以适应每个细胞系的特征,因为有些细胞可能需要更高的注射密度才能在斑马鱼胚胎中茁壮成长。
细胞标记考虑
为了更好地可视化人类肿瘤细胞进行注射和未来分析,肿瘤细胞可以贴上荧光染料的标签。由于细胞大小的差异,细胞系中细胞/cm2的总数因细胞系而异。这将影响染色协议的功效以及为注射而收获的细胞数量。每个烧瓶(即 Hs578T)或在集群中生长(即 BFTC905)的大细胞需要为单个实验汇集多个烧瓶。在这种情况下,细胞的染色不应该直接在烧瓶中进行,因为这将导致使用过量的染料(高成本)。另一方面,对离心周期过高高度敏感的细胞以及每瓶产生高数的细胞(即 HCT116)可直接在烧瓶中染色,然后用 EDTA/细胞刮刀分离(有关更多信息,请参阅表 1)。
尽可能,不要使用酶方法,而是在注射当天使用EDTA分离细胞,使细胞更快地恢复细胞-细胞结,并接受更少的离心步骤。然而,如果细胞对EDTA敏感,非常粘附或在群中生长 - 可以应用酶方法。注射理想浓度的优化以及注射介质的优化取决于每个细胞系的特性,因此可能需要一些调整(表1)。
微投射校准
与将寡核苷酸或药物输送到斑马鱼胚胎相反,无偿使用无偿药物在使用细胞系进行异种移植时不用于校准针头。注射一段时间后,细胞会开始堵塞,有必要切针尖以增加其直径或完全改变针头。此过程妨碍了格栅校准。
为了解决这个问题,分配的细胞数量受弹出压力和达到1-3脉冲内胚胎眼大小所需的时间的调节。然后,为了进一步控制肿瘤大小,在1 dpi,异种草根据肿瘤大小排序,如图6 B-B所示。如图6C示例所示,这种分拣方法可有效减少肿瘤大小的变化:如果我们将它们汇集在一起(+、+、++),STEV 是 +类(+906 细胞到 +422 细胞)的两倍,系数变化为 +31.9%,而 +类为 14,5%。由于注射的参考是体积,细胞总数因细胞类型而异 - 取决于细胞的大小和形状。例如,像乳腺癌Hs578T这样细胞质大的细胞产生小得多的肿瘤(~600个细胞)。此外,每个细胞系需要不同数量的细胞。例如,HT29 CRC和RT112尿膀胱癌细胞系表明,注射的细胞数量越高,斑马鱼的死亡率就越高。因此,在开发异种移植物时需要一段时间的优化来测试细胞系是否对胚胎有毒性作用,或者需要更高/更低的注射密度。
注射部位
生成斑马鱼胚胎异种移植物时最常见的差异之一是注射部位。蛋黄通常是注射的首选地点,因为它易于使用。然而,我们观察到,注射在蛋黄中的细胞有更高的死亡倾向。虽然技术上比较困难,但我们建议注射PVS,并尽可能远离心脏。在PVS中,细胞可以聚集、招募血管和免疫细胞,如果它们表现出转移特征8、11,则可以迁移、侵入、外化并形成微转移。
增大效率
由于基底细胞死亡/存活/增殖程度不同,而且由于每个细胞系可能显示9的与生俱来的免疫原性,预计细胞系之间的移植效率和肿瘤大小在4dpi的差异。
转移
转移包括一个多步骤级联的事件,可以分为两个任意阶段。在第一阶段,肿瘤细胞必须脱离原位,迁移和入侵相邻的组织,然后侵入血液。在第二阶段,肿瘤细胞必须在循环中存活,从血液或淋巴血管中外泄,最后在23号二级位聚。为了区分这些早期和后期事件,并解决不同肿瘤细胞执行这些步骤的潜在/熟练程度,我们设计了一个简单的检测。
一般来说,当注射到PVS中时,肿瘤细胞可以直接进入循环,然后被物理困在细胞造血组织(CHT)(尾部区域)中。然而,根据每个肿瘤细胞的特征 - 我们已经看到,一些肿瘤细胞留在CHT 4 dpi,并能够形成微转移,而其他肿瘤细胞消失(在被夹在CHT后清除)。
因此,通过比较微转移效率(在4分贝),当细胞直接进入循环 - CIRC(细胞只需要经历转移的后期步骤)与时不 - 没有保监会(细胞需要经过早期和后期的步骤,才能形成微转移),我们可以评估其早期或后期转移的潜力。我们观察到肿瘤细胞可以有效地形成微介质在CHT在两组(CIRC和NO CIRC),表明这些细胞有能力经历转移级联的所有步骤(SW480和MDA-MB-468例如)8,11。相比之下,其他肿瘤细胞在这两组的转移潜力非常低,几乎从来没有作出微转移,即使注射到循环(即,可见的CHT在24hpi,但在4 dpi他们不再存在,Hs578T例如)8。然而,我们清楚地发现了另一个群体——一个只有在注入循环时才能形成微代谢的群体(我们只能观察保监会组中的微代谢)。这表明,这些细胞在执行转移级联的第一步效率较低,但另一方面,它们能够在循环中生存、外化和殖民遥远的部位。
免疫染色和成像
固定前,此注塑方案可用于其他实时成像方法,如活微分干扰对比 (DIC) 显微镜、旋转盘显微镜、高分辨率实时共焦成像和光片显微镜等。
当通过荧光立体显微镜观察时,死细胞和细胞碎片看起来是明亮的,并且可能被误认为是活细胞,特别是如果研究的目的是评估细胞系的转移潜力。我们想强调使用特定的生存能力标记和DAPI进行共焦成像的重要性,以评估肿瘤和微转移的生存状态。此外,使用特定的人类抗体来检测人体细胞(如反人类线粒体或反人类HLA)也是至关重要的。在实施该协议时,列车实验者通过比较立体显微镜中的污渍和对焦图像来眼睛。一段时间后,实验者可以清楚地区分荧光立体显微镜中活细胞的碎片。
虽然其他方法量化肿瘤负担,如整个荧光区被广泛使用,我们建议执行全安装免疫染色和共焦成像作为一个更准确的方法。不仅嗜脂染料染色的效率非常可变(即,有些细胞染色良好,而另一些细胞则不是-可能是由于其膜的脂质含量),而且很多时候嗜脂染料形成聚合物,死细胞往往更亮 - 产生一些可能被误认为是活细胞的神器。
细胞可以用荧光蛋白进行转化,以帮助跟踪细胞并跳过细胞标签。但是,请确保转导细胞和非转导细胞在斑马鱼异种草中产生相同的结果。
此外,巨噬细胞可以使这些荧光细胞碎片成为荧光标记和迁移,产生假阳性转移细胞。因此,我们推荐一系列分析工具,当然可以扩展到许多其他读数,以便更准确地解释肿瘤行为:
- 增殖 - 使用DAPI或抗pHH3Ser10 抗体(默克米利波雷猫,#06-570)对线粒体数字进行定量,
- 细胞凋亡死亡- 抗体抗激活卡斯帕塞3Asp175( 细胞信号技术猫#9661)或等效,
- 肿瘤大小 - DAPI计数 - 人类肿瘤细胞表现出非常独特的染色质组织,因此它们很容易与斑马鱼细胞区分,并且总是可以与染料仔细检查(当你训练你的眼睛),
- 对于转移研究,明确检测人体细胞, - 反人类HLA (Abcam EP1395Y 猫. #ab52922), 反人类线粒体 (默克米利波雷猫. #MAB1273 - 克隆 113-1).
对于控制癌细胞 HCT116 Z 堆中的切片(平均核直径为 10-12μm)与 DAPI 计数器之间的 5μm 间隔的共焦采集,我们观察到,50% 的细胞在连续两片之间共享。因此,如果计算每片,则计算相同细胞两次的风险很高。在切片之间来回移动以避免量化问题,可产生耗时且容易出错的技术。为了简化细胞总数的量化,并允许研究人员之间有更多的可重复性,我们创建了本协议8中先前描述的肿瘤大小公式。
我们包括一个校正编号 (1.5), 以占切片之间共享的约 50% 的细胞。我们发现研究人员之间对整个肿瘤的人工计数平均误差为20%。使用该公式的两名研究人员有2%的错误。此公式的使用具有 93% 的准确率和 98% 的可重复率。我们还测试了自动化方法,但它们显示阈值设置导致的错误大于 50%。
由于凋亡细胞的特点,活性卡斯帕斯3细胞的定量比较困难。为了减少错误和结果的变化,我们建议由同一研究人员计算控制和实验样本。此外,在学习这项技术时,新研究人员必须计算经验更丰富的研究人员已经量化的图像,以比较结果并进行训练。
如有需要,可以延长检测的长度。然而,重要的是要考虑到斑马鱼幼虫需要从受精后7天(注射后5天)开始进行活食喂养。此外,适用于受精后6天以上的幼虫的动物福利准则和条例可能有所不同。
该协议提供了有用的工具,使单个研究人员能够每小时注射约200-300个斑马鱼幼虫:并在三周内获得完整检测的结果,包括分析和统计解释。我们希望,这一协议可以帮助研究人员成为专家,在产生斑马鱼异种草。这并不容易:你需要练习,但你会到达那里。祝你好运!
披露声明
没有
致谢
我们感谢香帕利莫基金会,康根托(LISBOA-01-0145-FEDER-022170,由FCT/利斯博亚2020共同出资)提供资金。FCT 奖学金,用于副总裁(SFRH/BD/118252/2016)、MML(PD/BD/138203/2018)。Fior 实验室的所有成员进行批判性讨论;B. 科斯塔和C.雷贝洛·德阿尔梅达分享数据;和我们的实验室成员 C. 雷贝洛 · 德 · 阿尔梅达, M. 巴罗佐和 L. 莱特参与视频。我们要感谢CF鱼类设施(C.Certal,J.蒙泰罗等人)和尚帕利莫沟通,活动和外展团队,特别是亚历山大·阿津海拉的梦幻般的电影制作和卡塔琳娜·拉莫斯和特雷莎·费尔南德斯的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Agar for bacteriology | VWR | 97064-336 | Agar plate |
| anti-Caspase3Asp175 (Rabbit monoclonal) | Cell Signalling Technologies | 9661 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti-human HLA (Rabbit monoclonal) | Abcam EP1395Y | ab52922 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti- 488 (Rabbit monoclonal) | ThermoFisher Scientific | 35552 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| anti- 594 (Rabbit monoclonal) | ThermoFisher Scientific | 35560 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| CellTracker Deep Red Dye | ThermoFisher Scientific | C34565 | Lipophilic dye (Dilution 1:1000) |
| CellTracker Green CMFDA Dye | ThermoFisher Scientific | C2925 | Lipophilic dye (Dilution 1:1000) |
| Conical Centrifuge tube 50mL | VWR | 525-0610 | |
| Conical Centrifuge tube 15mL | VWR | 525-0604 | |
| DAPI | Nuclear and chromosome counterstain | ||
| Laser-Based Micropipette Puller P-2000 | Sutter-Instrument | Micropipette Puller | |
| Microcentrifuge tube 1.5mL | Abdos | P10202 | |
| Microscope slides, cut edge | RS France | BPB016 | Slides for mounting |
| Mowiol | Sigma-Aldrich | 81381 | Mounting medium |
| Pneumatic Picopump | World Precision Instruments | PV820 | Microinjector |
| Rectangular cover glasses, Menzel Gläser | ThermoFisher Scientific | 631-9430 | Coverslips for mounting |
| SeaKem LE Agarose | Lonza | 50004 | Agar plate |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100-4 | Borosilicate capillaries |
| TrypLE | Gibco | 12605036 | Enzymatic detachment solution |
| Vaseline | Petroleum jelly for slide sealing | ||
| Vybrant CM-DiI Dye | ThermoFisher Scientific | V22888 | Lipophilic dye (Dilution 1:1000) |
| Vybrant DiO Cell-Labeling Solution | ThermoFisher Scientific | V22886 | Lipophilic dye (Dilution 1:1000) |
| ZEISS Axio Zoom.V16 for Biology | ZEISS | Fluorescence Stereo Zoom Microscope | |
| Zeiss LSM 710 | ZEISS | Confocal microscope |
参考文献
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97, 889-938 (2017).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. Journal of Clinical Investigation. 122, 2337-2343 (2012).
- Stoletov, K., Klemke, R. Catch of the day: zebrafish as a human cancer model. Oncogene. 27, 4509-4520 (2008).
- Weintraub, A. All eyes on zebrafish. Lab Animals. 46, 323-326 (2017).
- Novoa, B., Figueras, A. Zebrafish: Model for the Study of Inflammation and the Innate Immune Response to Infectious Diseases. Current Topics in Innate Immunity II. Lambris, J. D., Hajishengallis, G. , Springer. 253-275 (2012).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nature Reviews Cancer. 20, 263-273 (2020).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Póvoa, V., et al. Innate immune evasion revealed in a colorectal zebrafish xenograft model. Nature Communications. 12, 1156(2021).
- Galletti, G., et al. Targeting Macrophages Sensitizes Chronic Lymphocytic Leukemia to Apoptosis and Inhibits Disease Progression. Cell Reports. 14, 1748-1760 (2016).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Communications Biology. 3, 1-13 (2020).
- Varanda, A. B., Martins-Logrado, A., Godinho Ferreira, M., Fior, R. Zebrafish Xenografts Unveil Sensitivity to Olaparib beyond BRCA Status. Cancers. 12, 1769(2020).
- Osmani, N., Goetz, J. G. Multiscale Imaging of Metastasis in Zebrafish. Trends in Cancer. 5, 766-778 (2019).
- Hyenne, V., et al. Studying the Fate of Tumor Extracellular Vesicles at High Spatiotemporal Resolution Using the Zebrafish Embryo. Developmental Cell. 48, 554-572 (2019).
- Costa, B., et al. Developments in zebrafish avatars as radiotherapy sensitivity reporters - towards personalized medicine. EBioMedicine. 51, 102578(2020).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish Avatars towards Personalized Medicine-A Comparative Review between Avatar Models. Cells. 9, 293(2020).
- TRICAINE - Protocols. ZFIN Community Wiki. , Available from: https://wiki.zfin.org/display/prot/TRICAINE (2021).
- Zhao, C., et al. A Novel Xenograft Model in Zebrafish for High-Resolution Investigating Dynamics of Neovascularization in Tumors. Plos One. , (2011).
- Veinotte, C. J., Dellaire, G., Berman, J. N. Hooking the big one: the potential of zebrafish xenotransplantation to reform cancer drug screening in the genomic era. Disease Models & Mechanisms. 7, 745-754 (2014).
- Haldi, M., Ton, C., Seng, W. L., McGrath, P. Human melanoma cells transplanted into zebrafish proliferate, migrate, produce melanin, form masses and stimulate angiogenesis in zebrafish. Angiogenesis. 9, 139-151 (2006).
- Zon, L. I., Peterson, R. The New Age of Chemical Screening in Zebrafish. Zebrafish. 7, 1(2010).
- Mycoplasma Contamination of Cell Cultures. InvivoGen. , Available from: https://www.invivogen.com/review-mycoplasma (2016).
- van Zijl, F., Krupitza, G., Mikulits, W. Initial steps of metastasis: cell invasion and endothelial transmigration. Mutation Research. 728, 23-34 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。