Method Article
제브라피시 애벌레 제노이식 및 종양 행동 분석의 생성
요약
여기서는 종양 거동 분석, 전산 면역형화 및 공초점 이미징 정량화를 위한 xenografts 및 지침을 생성하는 팁과 함께 단계별 프로토콜을 제공합니다.
초록
Zebrafish 애벌레 xenografts널리 생체 및 인간 암의 실시간 연구에서 수행 하는 암 연구에 사용 되 고. 항암 요법(화학요법, 방사선 요법 및 생물학), 혈관신생 및 단일 세포 해상도의 전이에 대한 반응을 빠르게 시각화할 수 있는 가능성은 제브라피시 이종이이식 모델을 임상 전 연구를 개발하기 위한 최고의 선택으로 배치합니다.
제브라피시 애벌레 제노이식 분석은 다른 모델에 비해 여러 가지 실험적인 이점을 제공하지만, 아마도 가장 눈에 띄는 것은 크기 규모의 감소와 결과적으로 시간입니다. 규모의 이 감소는 단하나 세포 화상 진찰을 허용하고, 상대적으로 적은 수의 인간 세포 (생검과 호환), 중간 처리량 약물 검진의 사용을 허용하지만, 가장 중요한 것은 분석의 시간의 상당한 감소를 가능하게한다. 이러한 모든 장점은 미래의 개인화 된 의학 응용 프로그램에 대한 제브라 피쉬 xenograft 분석이 매우 매력적으로 만듭니다.
많은 제브라피시 이노이식 프로토콜은 인간의 종양의 넓은 다양성으로 개발되었습니다; 그러나, 제브라피시 애벌레 제노이식을 효율적으로 생성하는 일반적이고 표준화된 프로토콜은 여전히 부족합니다. 여기서 우리는 종양 거동 분석, 전체 마운트 면역 형광 및 공초점 이미징 정량화를 위한 xenografts 및 지침을 생성하는 팁과 함께 단계별 프로토콜을 제공합니다.
서문
Zebrafish (Danio rerio)는 발달과 질병을 연구하는 강력한 척추 동물 모델 유기체로 부상하고 있습니다. Zebrafish는 매우 보존된 유전(~70% 유전상동성 및 ~84% 질병 관련 유전자)과인간1,2와기본 기관 형태학적 특징을 공유합니다. 이 보존은 제브라피쉬를 사용하여 암3,4를포함한 여러 인간 질환을 모델링할 수 있습니다.
제브라피쉬의 취급 및 유지보수는 생쥐보다 훨씬 쉽고 비용 효율적이며, 일년 내내 높은 배설도, 외장 수정3,5로인해 더욱 효과적이다. Zebrafish 배아는 생애 첫 5-7일 동안 생수급을 필요로 하지 않으며 발달, 감염 및암1,4,6,7을위한 효과적인 모델로 사용되어 왔다. Zebrafish 배아는 48시간 후 수정(hpf)에서 부화하고 모든 장기가 형성된 자유로운 수영 동물이며, 심장과 기능순환 시스템, 간, 뇌, 신장 골수등이다. 또한, 이 단계에서는 선천성 면역만이 작용하고 있으며, 적응성 면역력이 여전히 발달하고 있어면역절돌연변이7,8을사용할 필요 없이 인간 세포의 일반적인 효율적인 이식을 가능하게 한다. 그럼에도 불구하고, 모든 인간 세포가 동등하게9로 이식되는 것은 아니며, 예를 들어 백혈병 세포의 경우 식세포(호중구 및 대식세포)가 효율적인 생생을 위해고갈되어야 한다는 것을 보여주었다.
제브라피시 유전적 관성과 초기 배아 단계의 광학적 투명성은 고해상도로 단일 세포 내 인트라비티드 이미징을 허용하므로 다양한 생물학 분야에서 최첨단 이미징 기술을 수립할 수 있습니다. 더욱이, 암의 맥락에서, 이러한 특징은 혈관신생 및 전이성 전이성 전위, 그리고 타고난 면역계통과의상호 작용8,9,11,12,13과의상호 작용과 같은 숙주 종양 상호 작용의 초기 단계의 실시간 연구에 유용하다.
짧은 이노크소식분석에서 전이성 "진화"에 대한 시간이 없지만 종양 세포의 전이성 용량을 분석할 수 있습니다(즉, 침략, 흡폐, 순환 생존, 사치, 식민지화 와 같은 전이성 단계를 거치도록 하는 효율성, 따라서 생체 내 및 본래8,11,14)
그 수명 주기의 특성은 암에서 개인화 된 의학을위한 독특한 모델로 제브라피쉬를 배치합니다. 아세이는 짧은 시간 범위에서 수행될 수 있으며, 몇 주7,8,9,11,12,15,16에서얻은 결과를 얻을 수 있다. 이 assays의 셀러리티와 타당성은 의사와 연구원에게 시간이 필수적인 필수 인 암 환자에게 유용 할 수있는 번역 결과를 얻을 수있는 가능성을 제공합니다.
성공적인 제브라피시 배아 이종이이식생성시도가 증가하고 있음에도 불구하고, 주사 후 세포 생존가능성 및 종양 행동의 평가뿐만 아니라 주사 절차의 표준화에 대한 필요성이 여전히 존재한다.
이 프로토콜에서 우리는 제브라피시 배아에 있는 인간 암 세포 주사제 및 후속 고정, 면역 염색, 화상 진찰 및 종양 세포 행동의 정량화를 위한 명확하고 상세한 단계별 가이드를 연구원에게 제공합니다.
프로토콜
제브라피쉬(Daniorerio)모델은 유럽 동물 복지 법안, 지침 2010/63/EU(유럽위원회, 2016) 및 샴페인보어 피쉬 플랫폼의 표준 프로토콜에 따라 처리 및 유지되었습니다. 모든 프로토콜은 참팔리모 동물 윤리위원회와 포르투갈 기관 기관인 ORBEA(우르가오 데 Bem-Estar e Ética Animal/Animal Welfare and Ethics Body)와 DGAV(디렉샤오 제랄 데 알리멘타샤오 e 베테리나리아/식품 수의학 사무총장)의 승인을 받았습니다.
참고: 주요 실험을 시작하기 전에 인간 대장암(CRC) 세포주 HCT116을 연습하십시오. 이 세포주 준비하기 쉽습니다 (매우 증식), 주입하기 쉽고 매우 효율적으로 이식 (약 95-100 %). 많은 세포와 물고기가 훈련 중에 손실되기 때문에, 기술에 능숙해질 때까지 초과 세포 (~12x106 세포, T-75 플라스크) 및 초과 물고기 (400 물고기)로 시작합니다. 실험자는 HCT116 제노이식에서 ~95%의 이식이 달성되면 준비됩니다. 전체 프로토콜의 회로도는 그림 1을 참조하십시오.
1. 주입 을 위한 설정
- 주입 2 주 전에 배양에서 세포를 확장하십시오 (여러 세포주 주입을위한 최적의 체외 합류에 대한 자세한 가이드표 1 참조).
- 주입 3 일 전에 원하는 배경의 제브라피시를 교차합니다.
2. 주입 전 24 시간
- 제브라피시 배아 플레이트를 청소하고 (모든 죽은 및 비 개발 배아를 폐기) E3 배지를 새로 고침.
- 세포 배양실에서는 주사를 위해 계획된 플라스크로부터 세포 배양 배지를 버리고, 1x 인산염 완충식염수(PBS)로 한 번 세척하여 죽은 세포를 제거하고 신선한 배지를 추가한다.
- 주사 시술을 위한 공구를 준비하십시오: 미세 주입 바늘, 아가로즈 플레이트 및 헤어핀은 주사를 위한 배아를 정렬합니다(그림2A-D,아래에 자세히 설명).
- 미세 주입 바늘(그림 2A)
- borosilicate 유리 모세 혈관을 사용 하 여 (4 인치, OD 1.0 mm, 마이크로 피펫 풀러에 필라멘트 없음 (열: ≈500; fil: 10; 벨: 50; 12 월: 60; 풀: 100).
- 플레이트 준비(도 2B)
- H2O로 2% 아가로즈를 준비하고, 가열하고 깨끗한 페트리 접시 뚜껑에 용해된 아가로즈 한 층을 붓습니다. 그것은 중합하고 통치자의 도움으로, 배아의 정렬을 위해 3 ~ 4 개의 직선 아가로즈 라인을 만들 수 있습니다.
- 헤어핀 어셈블리(그림2C-D)
- 유리 모세관 튜브 내부에 머리카락 1발을 두면 튜브 바깥쪽에 약 1센티미터의 머리카락이 남습니다.
- ~0.5 mm 길이의 루프를 형성하는 유리 모세관 튜브에 집게의 도움으로 머리의 외부 끝을 컬.
- 모세관 튜브의 가장자리를 매니큐어 한 방울로 밀봉하십시오. 이것은 또한 장소에 루프를 해결하는 데 도움이됩니다. 건조하게 하십시오. 튜브의 다른 가장자리에서 절차를 반복합니다.
- 전기 테이프 조각을 잘라 (일반 접착 테이프보다 더 저항, 불투과성, 단단한).
- 모세관 주위에 테이프를 밀봉하여 파손으로부터 보호하십시오.
- 미세 주입 바늘(그림 2A)
3. 사출일
- 해치되지 않은 계란에서 부화 배아를 분리합니다. 이 단계에서 배아 배지에 1x pronase(0.6 mg/mL, 표 3)를첨가하면 부화를 높일 수 있다. 배아를 주입 할 때까지 인큐베이터 (28 °C에서)에 넣습니다.
참고: 효소가 사망 위험을 증가 해치 배아에 작용하기 때문에 1 시간 이상 pronase 용액에 배아를 두지 마십시오. 배아의 발달 단계가 부종 및 사망의 위험을 피하기 위해 48 hpf(도 3A,A')에해당하는 단계인지 확인하십시오. - 1x 트리카인(25배 스톡)을 준비합니다.
참고: 자세한 레시피는 표 3및 제브라피시 정보 네트워크 - ZFIN 웹 페이지17에서찾을 수 있습니다.
4. 주입을 위한 세포 라벨
참고: 세포의 라벨링은 플라스크또는 효소 분리 후 1.5mL 미세 원심분리기 튜브에서 직접 수행될 수 있다. 자세한 내용은 토론을 참조하십시오.
- 세포 배양 배지를 제거하고 1X PBS로 플라스크를 두 번(2배)으로 세척한다.
- 플라스크(2mL 용액/T75 플라스크) 또는 효소 분리 후 1.5mL 마이크로센트심분리기 튜브에서 직접 선택된 리포메이션 염료로 세포를 라벨로 부착합니다. 37°C에서 빛 및 인큐베이션 셀에 노출되지 마십시오(조건/용액의 표 1 및 표 2 참조).
- 플라스크에 라벨을 붙이는 경우
- 염료를 제거하고 1x PBS로 세척하고 EDTA 및 셀 스크레이퍼로 세포를 분리하십시오.
- 세포를 1.5mL 마이크로원심분리기 튜브로 이송합니다. 300 x g에서 5 분 동안 원심 분리기다음 4.5 단계로 이동하십시오.
- 1.5 mL 마이크로 센심 분리기 튜브에 라벨을 붙이는 경우 :
- 원심 분리기는 300 x g에서 5 분 동안 염료를 제거하고 상체를 폐기합니다. 세척을 위해 1 x PBS로 다시 중단하십시오.
- 원심 분리기는 300 x g에서 5 분 후 4.5 단계로 이동합니다.
- 수퍼네티드를 버리고 세포 배양 배지로 펠릿을 다시 놓습니다(50 μL 펠릿의 경우 ~ 150-200 μL의 배지).
- 트라이판 블루 제외 또는 다른 선택의 방법으로 노이바우어 챔버를 사용하여 세포 생존가능성을 정량화합니다.
- 300 x g에서 4 분 동안 원심 분리기를 제거하고 상체를 폐기하십시오. 사출 배지에서 세포를 다시 중단합니다.
참고: 권장셀 농도(일반적으로 0.25-0.5x106 셀/μL에서) 및 배지는 표 1에서찾을 수 있다. - 이 시점부터 는 세포를 얼음 위에 두십시오.
5. 사출 절차
- 1x 트리카인에서 5분간 배아를 마취시합니다.
- 플라스틱 파스퇴르 파이펫을 사용하여 소량의 마취 배아를 아가로즈 플레이트에 옮기고 헤어핀 루프의 도움으로 조심스럽게 정렬합니다. 배아 사이의 거리를 유지해야 하며, 특히 다음 배의 노른자와 머리 사이의 거리를 유지하십시오(그림4A).
참고: 정렬하는 배아의 수는 주사를 수행하는 연구원의 전문 지식 수준에 따라 달라집니다. 몇 가지 (~10-20)로 시작합니다. 한천/아가로즈 플레이트내의 배아의 올바른 위치의 회로도를 보려면 도 4A를참조하십시오. - 정렬된 배아가 아가로즈 플레이트에서 건조되지 않도록 하여 1-3방울의 트리카인 용액을 플레이트에 조심스럽게 첨가하여 사망률을 방지하십시오.
- 마이크로센트심분리기 튜브를 가볍게 탭하여 세포를 다시 보냅니다. 배아의 무결성을 손상시킬 수 있기 때문에 기포를 피하는 마이크로 로더 팁을 사용하여 세포 현탁액으로 주사 바늘을 역로드합니다.
- 기압 밸브(40 psi)를 열고 마이크로인젝터를 설치하고 미세 주입 바늘을 홀더에 조심스럽게 배치합니다.
참고 : 다음과 같은 권장 마이크로 인젝터 설정을 사용 : 압력을 유지 - 통풍구 (3 psi); 배출 압력 - 통풍구; 범위 - 100 ms. - 입체 현미경의 밑에 #5 또는 이와 유사한 Dumont 집게로 끝에 가까운 미세 주입 바늘을 잘라.
참고: 팁은 세포가 막힘 없이 통과할 수 있을 뿐만 아니라 배아를 손상시키고 세포를 잃지 않도록 할 수 있을 만큼 무뚝뚝하고 얇아야 합니다. 두꺼운 미세 주입 바늘 팁은 배아를 다치게하고 부종 이나 제브라피시 죽음의 형성을 촉진합니다. 그레이티쿨은 바늘 교정에 사용되지 않습니다. 자세한 설명은 토론을 참조하십시오. - 배아를 주입하기 전에, 제브라피쉬 배아의 눈크기와 유사한 부피를 ~1-3 펄스에서 펄스할 때까지 가장 낮은 배출 압력으로 시작하는 마이크로인젝터 압력을 테스트한다.
참고: 훈련 초기에 가능하면 형광 스테레오현미경을 사용하는 것이 좋습니다. 이것은 형광표가 붙은 세포의 쉽게 확인을 허용할 것입니다. - 조심스럽게 배아의 노른자의 중간에 관통, 바늘의 각도를 낮추고 조심스럽게 바늘의 끝이 각막에 도달 할 때까지 밀어 (PVS)(도 4B-D).
- 마이크로 인젝터 페달을 누르고 PVS에 세포를 주입합니다. 배아의 눈을 안내자로 사용하십시오. 배아의 눈크기와 유사한 세포의 부피를 심혼 부종을 방지하기 위하여 심혼에서 가능한 한 멀리 주입해 보십시오.
- 조심스럽게 바늘을 제거하고 다음 배아로 이동합니다.
- 필요한 경우 마이크로 인젝터 압력을 조정합니다.
참고: 세포는 막힘을 시작하기 때문에 압력이 증가할 수 있습니다. 필요한 경우, 압력을 줄이면서 모세관 (직경을 증가)을 절단 할 수 있습니다. - 주입된 배아를 1x 트리카인 용액으로 깨끗한 페트리접시(표 4)로옮기고 5-10분 동안 그대로 둡니다. 이것은 상처가 닫히기위한 시간을 줄 것입니다.
참고: 한천 접시에서 페트리 접시로 배아를 옮기려면 배아 위에 1배 트리카인 용액을 몇 방울 더 추가하고 플라스틱 파스퇴르 파이펫으로 조심스럽게 수집합니다. 수집된 배아를 1x 트리카인 용액으로 새로운 페트리 접시에 넣습니다. - 1x 트리카인 용액을 제거하고 신선한 E3 배지를 추가합니다.
- 34°C에서 이종이이식을 배양한다(인간 세포주 생존과 제브라피시 발달8사이의 손상된 온도).
6. 전이성 분석
- 약 1시간 후 사출(hpi)에서, 형광 스테레오현미경에 주입된 배아를 스크린하고 혈중 세포의부재(도 5A)또는 존재(도5B)에따라 2그룹으로 제노이식을 분류한다.
참고: 심장이나 순환에서 암세포가 하나만 검출되더라도, 순환하는 세포와 함께 이 종이 이식의 단에 이 종이이식을 포함하십시오. 대안적으로, 세포는 이 단에 있는 제노이식의 수를 증가시키기 위하여 순환으로 직접 주입될 수 있다.
7. 1 일 사후 주입
- 형광성 스테레오현미경은 각 배아를 주의 깊게 분석하고 제대로 주입된 종양을 가진 종양을 선택한다(도6).
참고: 필요한 경우, 선별 전에 트리카인 1X 용액으로 주입된 배아를 마취시합니다. - 다음 배아/제노이식을 폐기하십시오(그림6A-A'):
• 종양/비정상적인 형태/죽은,
• 심장 및 노른자 부종,
• 노른자에서만 종양 세포가 있는 경우,
• 암세포가 거의 없습니다. - 그들의 종양 크기에 따라 선택된 이종이 이식을 정렬합니다. 비교를 위해 눈의 크기를 사용합니다(그림 6B-B',6C).
• 눈의 크기보다 작은 종양 (+),
• 종양은 눈과 같은 크기 (++),
• 눈의 크기보다 큰 종양 (++++). - 원하는 실험 레이아웃에 따라 xenografts를 배포하고 약물 분석 (약물 대조군 등)을 시작합니다. 매일 약물 및 E3 배지를 교체하십시오(표4).
- 분석이 끝날 때까지 34°C의 온도를 유지하는 제노이식을 배양합니다.
8. 4 일 사후 주입
- 분석의 마지막 날에, 1x Tricaine 용액으로 제노 이식을 마취하고 조심스럽게 한천 접시에 정렬합니다.
참고: 죽거나 부어 오른 제노이식을 버리십시오. 약물 치료 및 일부 종양 세포는 독성을 유도하고 결국 xenograft 사망을 일으킬 수 있습니다. 이러한 이 종이 이식은 이식 정량화에 대해 간주되지 않습니다. - 이식 비율을 결정하기 위해: 형광 스테레오 현미경은 각 살아있는 이노 이식을 분석하고 PVS내 종양의부재(도 6D)/ 존재(도6E)를평가한다.

- 전이의 백분율을 결정하기 위하여: 형광 스테레오현미경에 각 xenograft를 분석하고 2개의 이전에 정의된 단의 caudal 조혈 조직 (CHT)에 있는 micrometastasis의 존재/부재를 평가합니다 (CIRC 및 NO CIRC, 그림 6F)
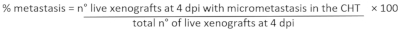
- 실험 설정에 따르면, 관심의 xenografts를 선택하고 25 x 트리카인(표 3)로안락사.
- 실온(RT)에서 4시간 이상 또는 4°C에서 하룻밤 동안 4% 포름알데히드(FA)로 수정합니다.
참고: PBS/0.1% 트리톤에서 4%로 희석된 메탄올 프리 포름알데히드(16% FA)를 사용하십시오. 튜브를 상단에 고정하여 채웁니다. 튜브를 수평으로 배치하여 모든 이종이이식의 균일한 고정을 보장하고 투과성을 높이고 제브라피시가 바닥에 응집되는 것을 방지합니다. - 또는 파이프(1mL당: 1M PIPES 나트륨 염(4°C)의 100 μL( 4°C); 1M MgSO 4(RT)의 1μL; 0.5M EGTA(RT)의 4μL; 16%의 FA(RT)의 93.7 μL; ddH2O의801.3 μL)로 수정하십시오.
참고: PIPES는 RFP 및 mCherry 트랜스제닉 라인의 형광을 4% FA보다 더 잘 보존합니다. - 면역스테인링이 다른 날에 수행될 경우 FA를 100% 메탄올(MetOH)으로 교체한다. 100% 메탄올에 고정된 제노이식은 -20°C에 무기한 저장될 수 있다.
참고: MetOH는 일부 염색체(예: phalloidin)의 효율성을 손상시키고 일부 형광 라벨링을 담금질할 수 있습니다. MetOH 고정 시료에서 항체의 효율을 미리 확인합니다.
9. 공초점 이미징을 위한 전체 마운트 면역 염색
참고: 전체 산 면역 형광 기술은 다음과 같이 3 일 정도 나뉘며: 첫날은 제노이식 및 1 차 항체 배큐어의 투과화를 위한 것입니다. 세탁 및 이차 항체 배양에 대한 둘째 날과 세안, 제노이식의 고정 및 마운팅 매체의 보관을 위한 셋째 날.
- 1일차
- 이종이이식이 100% MetOH에 저장된 경우, 일련의 MetOH 농도 감소(75%, 50%, 25% MetOH+PBS/0.1% Triton)로 재수화한다. FA에 고정된 경우 PBS/0.1% 트리톤으로 교체하십시오.
- PBS/0.1% 트리톤으로 4배 를 5분간 씻으시다.
- H2O에서 5분간 1x를 씻으시다.
참고: 튜브는 달리 명시되지 않는 한 고정, 투과 및 세척 단계에 항상 수평으로 배치되어야 합니다. - H2O를 얼음 차가운 아세톤으로 교체하고 -20°C에서 7분간 배양합니다.
참고: 아세톤이 있는 50mL 튜브를 -20°C에 배치하여 사용할 수 있습니다. 미세 원심 분리기 튜브는 아세톤이 누출되지 않도록 랙에 수직으로 배치해야합니다. - PBS/0.1%트리톤으로 2배 10분간 세척합니다.
- RT에서 1h에 대한 PBDX_GS 차단 용액 (PBDX_GS 차단 버퍼 : 1 x PBS의 50 mL; 소 세럼 알부민 - BSA의 0.5 g; DMSO의 0.5 mL; 10 % 트리톤의 250 μL; 750 μL - GS (15 μL / 1 mL)).
- PBDX_GS 제거하고 기본 항체 희석의 ~40 μL(일반적으로 1:100)을 추가합니다.
참고: 1차 항체 희석의 부피는 마이크로센트심분리기 관에 존재하는 제노이식의 수에 따라 달라집니다. 모든 이종이 이식이 침수되었는지 확인합니다. - RT에서 1 시간 동안 인큐베이션한 다음 하룻밤 사이에 4 °C에서 배양하십시오. 위치 튜브를 수직으로 배치합니다.
- 2일차
- 1 차적인 항체를 제거하고 PBS/0.1% 트리톤에서 10분 동안 2배 세척하십시오.
- PBS/0.05% 트웬에서 30분 동안 4배 세척합니다.
참고: 다음 단계는 어둠 속에서 수행해야 합니다(알루미늄 호일을 사용하여 튜브를 빛으로부터 보호하십시오). - PBS/0.05% 트위엔을 제거하고 PBDX_GS 희석된 이차 항체 희석(일반적으로 1:200 - 1:400) + DAPI(50 μg/mL)를 추가합니다.
- RT에서 1 시간 동안 인큐베이션한 다음 하룻밤 사이에 4 °C에서 배양하십시오. 튜브를 수직으로 배치하고 빛으로부터 보호합니다.
- 3일차(알루미늄 호일을 사용하여 빛으로부터 튜브를 보호하십시오)
- 이차 항체 희석을 제거하고 PBS /0.05 % Tween에서 15 분 동안 4 배 세척하십시오.
- 4 % FA에서 20 분 동안 실온에서 수정하십시오.
- PBS/0.05% 트웬에서 5분간 1배 세척합니다.
- PBS/0.05% 트위엔을 제거하고 각 미세 원심 분리기 튜브에 수성 장착 매체 1방울을 추가하십시오. 튜브를 수직으로 배치합니다.
- 장착할 때까지 빛으로부터 보호된 4°C에 장착하거나 보관하십시오. 튜브를 수직으로 배치합니다.
10. 제노이식 장착
참고: 공정 전반에 걸쳐 빛으로부터 마이크로원심분리기 튜브를 보호합니다. Zebrafish xenografts는 2 개의 커버립 (24 x 60mm # 1.5) 사이에 장착됩니다. 이를 통해 종양(위쪽과 아래쪽)의 양쪽에 접근할 수 있도록 공초점 이미징 중에 장착된 xenografts를 뒤집을 수 있습니다. 장착 매체와 플라스틱 파이펫을 사용하지 마십시오 - xenografts파이펫에 잡힐 수 있습니다. 다음 단계의 회로도 표현은 그림 7을 참조하십시오.
- 커버슬립 Y에 라벨을 부착하고 커버슬립 X의 가장자리를 석유 젤리 또는 실리콘 그리스로 밀봉하여 장착 매체의 누출을 방지합니다.
- 유리 파스퇴르 파이펫으로 이종이 접목을 커버슬립 X로 옮기습니다.
- 조심스럽게 헤어 핀에 정렬하고 과도한 수성 장착 매체를 제거합니다.
- 수성 장착 미디어를 추가하여 Y를 덮어드려합니다.
- 커버슬립 X 위에 커버슬립 Y를 조심스럽게 배치합니다. 이 잠재적으로 xenografts를 방해 할 수 있기 때문에 커버립을 누르지 마십시오.
- 조립된 커버립을 현미경 슬라이드 위에 놓고 투명한 접착제 테이프로 고정합니다. 이를 통해 공초점 이미징 및 저장을 쉽게 조작할 수 있습니다.
11. 공초점 이미징
참고: 물 보정을 하는 Apochromatic 25x 침지 목표 렌즈는 단일 세포 해상도를 가진 PVS 종양 을 이미징하는 데 최적입니다(예례는 그림 8C-C" 및 그림 9A 참조).
- 각 슬라이스 사이에 5μm의 간격으로 z 스택 함수를 사용하여 샘플을 획득합니다. 3D 재구성을 목표로 하는 이미지의 경우, 특히 선박에서 슬라이스 사이에 1-3μm 간격을사용합니다(그림 8A).
12. 분석 및 정량화
- 공초점 이미지 처리 및 분석에 피지/ImageJ 소프트웨어 또는 이와 유사한 소프트웨어를 사용합니다.
- 피지 소프트웨어에서 원시 데이터(.czi, .lsm 등)를 엽니다.
- 복합 모드에서 단일 채널의 전부 또는 단일 채널을 선택하려면 이미지 > 색상 > 채널 도구를 클릭합니다.
- 밝기 및 대비 수준을 조정하려면 이미지 > > 색상 균형을 조정합니다.
- 종양 크기를 정량화하기 위해
- xenograft 당 z 스택 당 상단, 중간 및 아래에서 종양의 3 개의 대표적인 조각을 선택(그림 8 A).
참고: 공초점 분해능은 종양 깊이의 ~60-70 μm을 달성합니다. 종양이 큰 경우 총 부피를 이미지화할 수 없을 수 있습니다. - 스프레드시트를 열어 데이터에 기름을 부습니다.
- 3개의 선택된 조각에서 종양 세포에 대응하는 모든 DAPI 핵을 계산합니다(도 8 A, B). 이렇게 하려면 다음을 수행하십시오.
- 플러그인을 클릭하여 FIJI /ImageJ에서 셀 카운터 플러그인을 엽니 다 > 셀 카운터를 분석 할 >.
- 셀 카운터 도구에서 초기화를클릭하고 카운터 유형을 선택하고 이미지를 클릭하여 수동으로 계수 모드를 시작합니다. 클릭 할 때마다 카운터는 계산되는 셀 수(클릭 수)를 추가합니다.
- 전체 슬라이스를 계산한 후 해당 Excel 문서에 셀 번호를 저장합니다.
- 피지로 돌아가면 셀 카운터 창에서 재설정을 클릭하여 동일한 카운터를 사용하는 경우 정보를 삭제합니다. 그렇지 않으면 정보를 보관할 수 있으며 다른 카운터는 다른 슬라이스(또는 셀)와 함께 사용할 수 있습니다.
- 두 번째 대표 슬라이스로 이동하여 이전 단계를 반복합니다. 모든 데이터를 수집합니다.
참고: DAPI 카운터스테인링은 일반적으로 개별 세포의 명확한 정의로 인해 셀 수를 계산하는 데 사용되지만, 다른 세포 특이적 염색을 사용할 수 있다.
- 종양내의 총 세포 수를 얻으려면 다음 공식을 사용합니다.
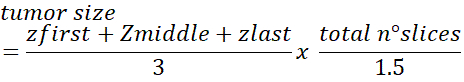
참고: 1.5 교정 수는 평균 핵 직경이 ~10-12 μm인 세포에 대해 추정되었다. 이 보정은 세포가 더 크면 조정이 필요할 수 있습니다. 이 방법에 대한 자세한 내용은 Dicussion을 참조하십시오.
- xenograft 당 z 스택 당 상단, 중간 및 아래에서 종양의 3 개의 대표적인 조각을 선택(그림 8 A).
- 다른 마커(면역 세포, 미토틱 피규어, PPH3, 활성화된 Caspase3, Ki67 등)를 정량화하기 위해 동일한 플러그인을 사용하여 모든 조각을 정량화합니다(미토틱 피규어 시각화를 위한 도8C-C'참조). 계산된 세포의 총 수를 해당 종양 크기로 나누고 백분율을 얻기 위해 100으로 곱합니다.
참고: 일부 셀이 두 조각 사이에 위치하고 z 스택에서 앞뒤로 이동하여 한 셀이 두 번 계산되지 않도록 주의하십시오.
결과
제브라피쉬 이종이이식은 항암 요법을 연구하는 도구로서.
HCT116 대장암 세포선은 CM-DiI로 표시되어 2일간의 PVS에 주입되었다.dpf) 배아. 주사 후, 제노이식은 34°C에서 배양되었고, 이는 제브라피시 발달을 손상시키지 않고 종양 세포의 성장을 가능하게 하는 온도이다. 다음날, 제노이식은 PVS에서 종양 질량의 존재 또는 부재에 따라 스크리니크(제브라피시를 적절히 주입하지 않음)(그림6A-A'). 제노이식은 종양 크기(도6B-B')에따라 그룹화되었고 무작위로 분포(6웰 플레이트: ~12xenografts+당)를 비처리 대조군 및 FOLFIRI 화학요법(0.18m 폴리닉산, 0.08 mM Irinotecan 및 4.2m플루어실라)에서 배분하였다.
제어 E3와 약물은 매일 대체되었고 죽은 제브라피쉬가 버려졌습니다. 4 dpi, 및 3 일 후 처리 (dpt), 이식은 프로토콜의 단계 8.2에서와 같이 정량화되었다. 이식은 4 dpi에서 PVS에 종양 질량을 제시하는 xenografts의 주파수로 간주됩니다. 예를 들어, 실험이 끝나면 40개의 살아있는 유충과 40개 중 35개의 살아있는 유충이 PVS에서 종양을 존재하는 경우, 이식율은 87.5%이다. 제노이식은 면역형광및 공초점 현미경검사법에 의한 종양 크기 및 세포멸을 평가하기 위해 안락사및 고정되었다.
면역형광은 핵대항을 위한 항갈라카파세 3 항체(Asp175) (토끼, 1:100, #CST 9661) 및 DAPI(50 μg/mL)를 사용하여 세포 세포를 검출하기 위해 수행되었다. 이미지 스택 데이터 세트(매 5um)는 12단계에서설명한 바와 같이 FIJI/ImageJ 소프트웨어로 수행된 LSM710 공초점 현미경 및 데이터 분석에서 획득되었다. 미토틱 지수의 정량화, 세포사증(활성화 된 Caspase3의 %) 및 종양 크기, FOLFIRI는 미토시스 (Mann Whitney Test, P<0.0001)의 현저한 감소와 세포멸(Mann Whitney Test, P<0.0001) 종양 크기(P<0.001)및 8C 의 54% 감소(P<0.010)를 동반한 것으로나타났습니다.
이러한 특징은 높은 처리량 phenotypic 약물 스크린뿐만 아니라 짧은 시간 프레임에 여러 암 치료의 세포 내재 및 생리적 효과를 테스트하는 데 유용합니다.
인간 특정 항체를 가진 인간-제브라피시 제노이식의 특성화
모든 xenograft 모델에서와 마찬가지로 세포를 잘못 식별 할 위험이 있습니다. 예를 들어, 대식세포는 인간 암세포를 세포화하여 지피성 염료로 표시되고, 그 후 제브라피시 숙대를 따라 여행할 수 있으며, 따라서 이러한 세포는 종양 미세메타증으로 오인될 수 있다. 따라서, 인간 HLA, ki-67 또는 인간 미토콘드리아(hMITO)와 같은 특정 인체 항체를 가진 xenografts를 표시하는 것은 초기 특성화에 매우 중요하며 또한 종양 세포의 형태에 익숙해지기 위해(도9F-I).
세포 세포 상호 작용을 연구하는 Zebrafish xenograft.
zebrafish xenograft 모델의 또 다른 큰 장점은 다른 종양 세포의 상호 작용을 연구하고 세포의 각 유형이 다른 사람의 행동에 영향을 미칠 수있는 방법을 분석 할 수 있다는 것입니다. 상이한 인간 암세포(동일한 종양또는 상이한 종양에서 다른 클론)를 공동 주입할 수 있다. 이 예에서, 동일한 환자로부터 유래된 2개의 CRC 세포주들은 상이한 리포메이션 염료로 표시되고 주사를 위한 1:1의 비율로 혼합하였다(그림9J-K').
동일한 이식편에서 인간 세포주(폴리클론 종양생성)를 혼합할 때, 비특이적 이중염색(표 2)을초래하므로 DiO 염료를 사용하지 마십시오. 대신 녹색 CMFDA (셀 라인 #2) 또는 CM-DiI (셀 라인 #2)를 가진 CM-DiI (셀 라인 #1) 또는 깊은 빨간색 (셀 라인 #2)(표2, 도 9J-K')을 사용하여 실험의 끝에 있는 인구의 쉬운 차별을 얻을 수 있습니다. 종양 내의 각 클론의 주파수를 정량화하려면, 피지에서 2개의 상이한 카운터 유형을 사용하여 각 클론을 식별한 다음 총 세포 수(모든 클론의 합)로 나누어 각 클론의 상대적 분획을 얻습니다(%).
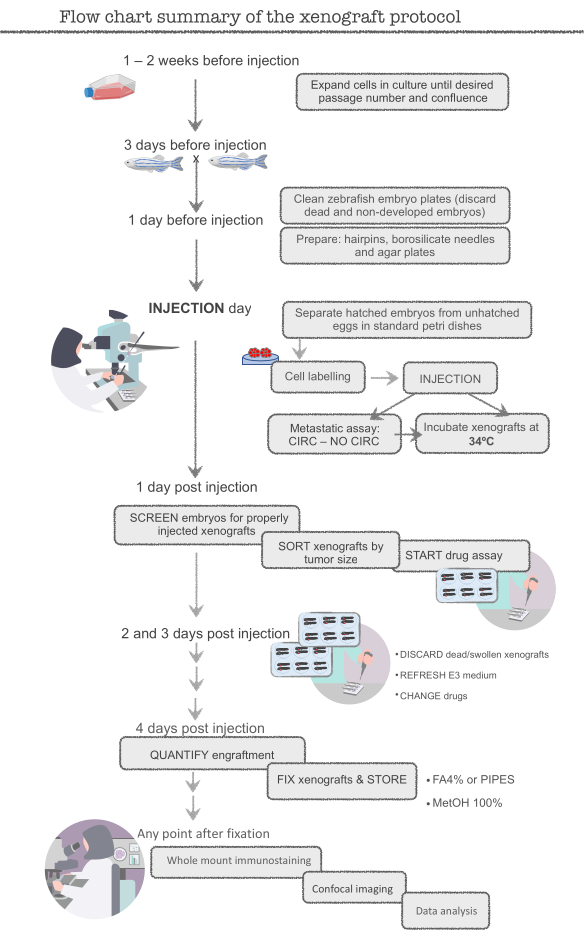
그림 1. 제브라피쉬 제노이식 프로토콜의 플로우차트 요약은 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
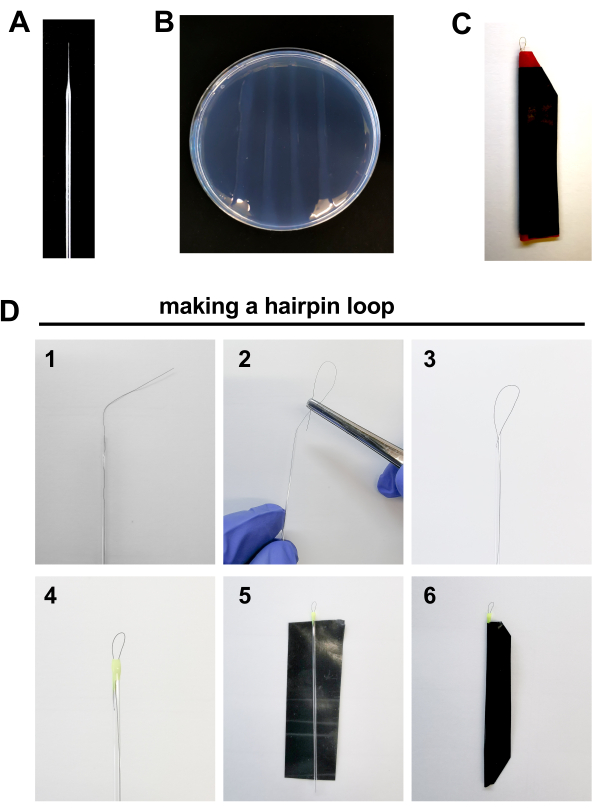
그림 2. 제브라피시 배아 주입을 위한 재료: A. 보로실리케이트 바늘 B. 2% 아가로즈 플레이트. C 헤어핀 루프 D. 헤어핀 루프를 만드는 단계 : 1. 튜브 외부에 약 1 센티미터의 머리카락을 남기는 유리 모세관 튜브 내부에 머리카락 1 개 놓습니다. 2-3. ~0.5 mm 길이의 루프를 형성하는 유리 모세관 튜브에 집게의 도움으로 모발의 외부 끝을 컬. 4.모세관 튜브의 가장자리를 매니큐어 한 방울로 밀봉합니다. 5-6. 모세관 주위에 전기 테이프 조각을 밀봉하여 파손으로부터 보호하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
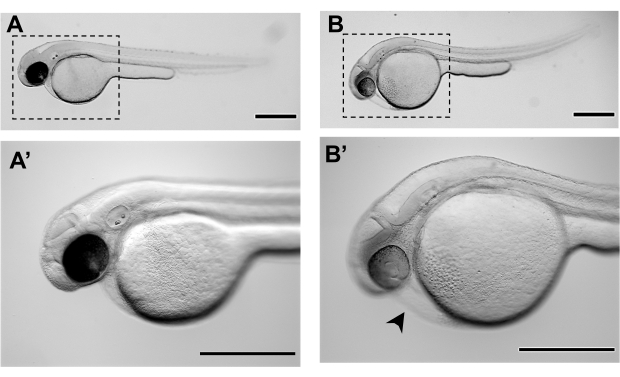
그림 3. 제브라피시 배아의 대표적인 입체 현미경 이미지는 48시간 후 수정(48hpf): A-A'에서 개발의 48 hpf에서 제브라피시 배아의 정상적인 형태학, 미세 주입 B-B'에 대한 준비. 48 hpf에서 미세 주입을위한 적절한 발달 단계를 달성하지 못하고 이미 어느 정도의 심장 부종 (검은 화살촉)과 변태 된 노른자를 제시하지 않은 제브라피시 배아의 형태. A'와 B'는 각각 A와 B의 배율이다. 스케일 바는 500 μm을 나타냅니다.

그림 4. 제브라피시 미세 주입 플레이트 의 회로도 표현 설정: A. 마취 배아의 정렬 3% Agar/2% 아가로즈 플레이트. B. 2일 후 제브라피쉬 배아의 그래픽 표현, 계각 공간(PVS)을 나타내는 검은 화살표가 있습니다. C 와 D. 암세포는 48시간 후 수정 배아의 각막 공간(PVS)에 주입된 PVS 내로 상이한 각도로 주입될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
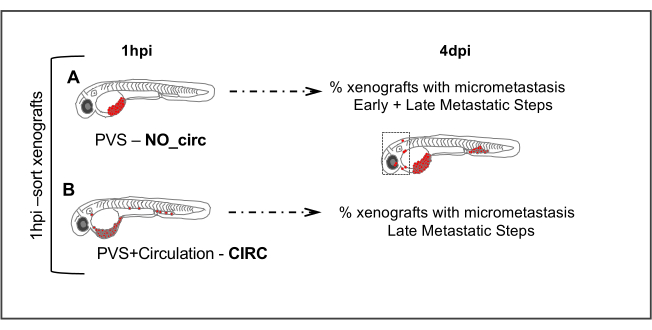
그림 5. 전이성 분석. 1시간 후 주사(1hpi) 주입된 배아는 순환 중인 종양 세포의 부재(NO_circ) 또는 존재(CIRC)에 따라 분류된다. 에서 4 주 후 주입 시 미세 메타염을 현재 두 그룹에서 xenografts의 수는 정량화된다. (A)NO_circ 그룹의 세포는 미세전이성 을 형성할 수 있도록 모든 전이성 단계를 거쳐야 했지만 CIRC그룹(B)의세포는 전이성 캐스케이드의 마지막 단계만 겪어야 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
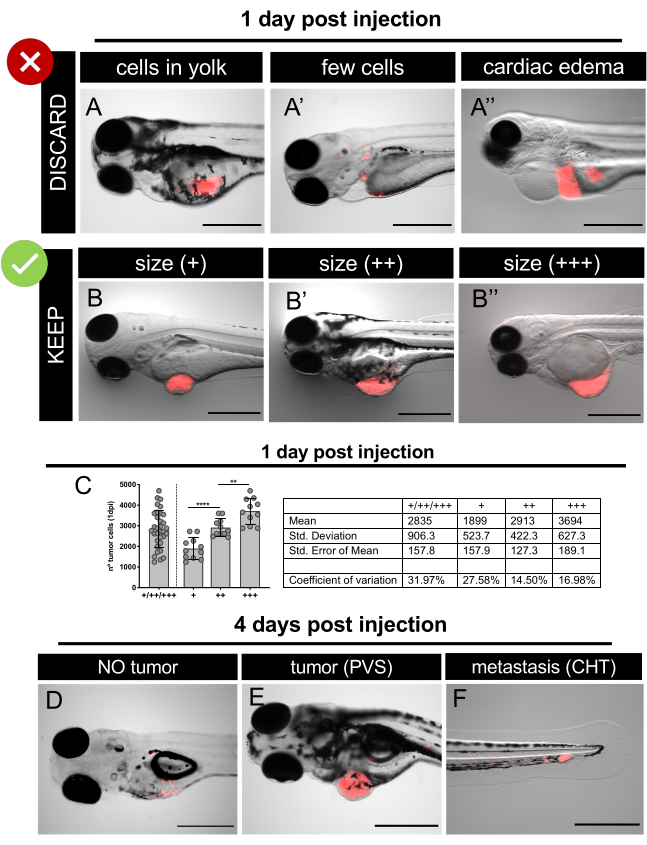
그림 6. 1일 후 주사 후 및 4일 후 소생시 의 대표적인 형광 입체 현미경 이미지. 형광 단백질 TdTomato (빨간색)를 발현하는 인간 암세포는 2 dpf 제브라피시 배아로 마이크로 주입되었습니다. 1 dpi에서 주입된 배아를 검사하고 부종(A-A')을 사용하여 심하게 주입된 배아를 폐기하여 종양크기(B-B')에따라 잘 주입된 배아를분류한다. C. SW620 xenografts에서 1 dpi에서 상이한 종양 크기 범주에 존재하는 세포의 총 수의 대표적인 정량화. 각 점은 섹션 12.At 4 dpi에서 설명한 바와 같이 정량화된 제노이식을 나타내고, 애벌레를 스크린하고 다른 클래스를 정량화한다: 종양 없음(D); PVS(E)와CHT(F)에서미세 메타염을 가진 종양으로. 스케일 바는 500 μm을 나타냅니다.
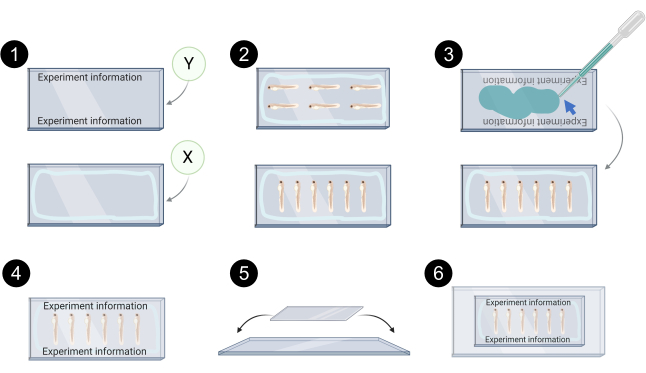
그림 7. 공초점 화상 진찰을 위한 xenograft 장착의 회로도 표현. 1. 커버슬립 Y, 커버슬립 X의 밝은 파란색 선에 라벨링의 예는 장착 매체의 누출을 방지하기 위해 석유 젤리/실리콘 그리스가 적용되는 경계를 나타낸다. 2. 공초점 이미징을 위한 커버슬립 X에 있는 xenograft 정렬의 예. 3. 수성 장착 미디어 (파란색 화살표)는 커버 슬립 X. 4 위에 커버 슬립 Y를 바인딩하는 데 사용됩니다. 제대로 장착 된 커버립의 예입니다. 5. 커버립은 유리 슬라이드 위에 놓고 투명 테이프로 고정됩니다. 6. 공초점 이미징을 위한 탑재 된 xenografts. BioRender.com 만든 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
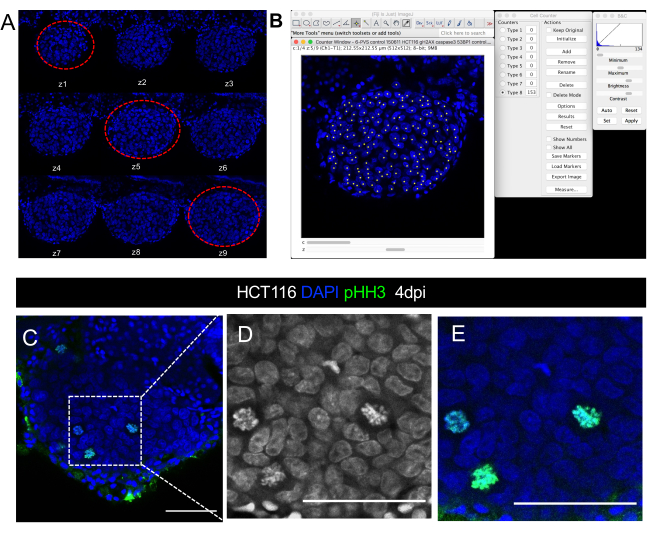
그림 8. 종양 크기의 공초점 현미경 이미지 정량화의 시각적 표현. HCT116 xenograft의 공초점 이미지 4 일 후 주입 A. DAPI 채널의 일련의 z 스택 슬라이스는 5 μm 간격으로 획득됩니다. 빨간색 파선선이 셀 계산에 사용되는 세 가지 대표적인 슬라이스를 동그라미로 합니다. B. ImageJ/Fiji 소프트웨어의 셀 카운터 플러그인과 DAPI 핵 정량화의 그림. C-E. DAPI에서 미토아 수치를 시각화/정량화하거나 인성-히스톤 H3 항체(green)를 사용하는 종양 내의 단일 세포 분해의 예. D와 E는 C의 배율입니다. 스케일 바는 50 μm을 나타냅니다.
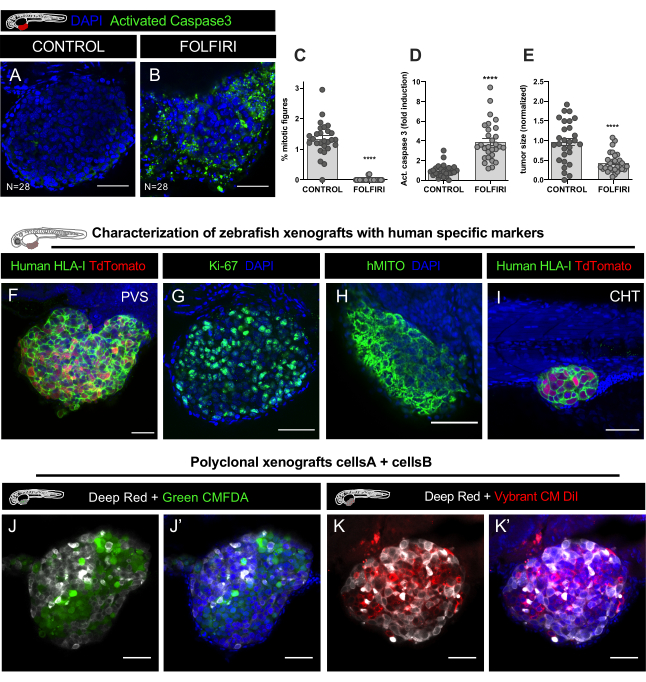
그림 9. 대표적인 결과. A-E. HCT116 대장암 세포선은 Vybrant CM-DiI로 표시되고 2일 후 수정(dpf) 배아의 PVS에 주입되었다. 주입 후, 이노 이식은 34°C에서 배양되었다. 1dpi에서, xenografts는 처리되지 않는 대조군 및 FOLFIRI에서 무작위로 검열되고 무작위로 분포되고, 3 일 연속 취급되고 4 dpi에서 고정되었습니다. A.면역형광은 핵 대항을 위한 항갈라진 카스파제 3 항체 및 DAPI를 사용하여 세포 세포를 검출하기 위해 수행되었다. 미토성 지수 C의정량화, 세포사멸(활성화 된 Caspase3의 %) D 및 종양 크기 E는FOLFIRI가 미토시스 (Mann Whitney Test, P<0.0001)의 현저한 감소와 세포멸의 상당한 유도 (Mann Whitney test, P<0.001)를 유도하는 것으로 나타났습니다< 50%의 종양 감소(Mann Whitney test, P<0.0001)의 50%의 감소(Mann Whitney test, P<0.0001)의 상당한 유도가 나타났다. 분석된 xenografts의 수는 그림에 표시되고 각 점은 하나의 xenograft를 나타냅니다. F-H. PVS 및 CHT I에서녹색(인간 HLA, ki67 및 hMITO)의 인간 특이적 마커로 라벨이 붙은 4일 후 주사 후 대장암 제노이식의 대표적인 이미지. J-J'. 폴리 클론 제노 이식의 공초점 이미지, 리포필 염색 셀트래커 딥 레드 (Cy5 - 화이트), 셀 트래커 그린 CMFDA (488 - 녹색) 및 DAPI 카운터 스테닝으로 표시 두 개의 다른 인간 대장암 세포 주선주입. K-K'. 각질 염색 셀트래커 딥 레드(Cy5- 화이트), 비브란트 CM DiI(594-레드) 및 DAPI 카운터스테인닝으로 표기된 두 가지 다른 인간 대장암 세포라인의 공초점 이미지. 스케일 바는 50 μm을 나타냅니다.
| 셀 라인 | 조직 | 종 | 형태학 | 성장 모드 | 주입에 이상적인 합류 | 주입용 해리 제 | 해리 시간 | 라벨링을 위한 프로토콜 | 사출 배지 | 총 세포 수를 나누어 주며 (주사에 이상적인 농도를 달성하기 위해) | |||||||
| SW480 | 대장 선암 (1 차) | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 2 mM | 5분 | 플라스크 | PBS 1x | 0,25 | |||||||
| SW620 | 대장 선암 (전이) | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 2 mM | 5분 | 플라스크 | PBS 1x | 0,25 | |||||||
| HCT116 | 대장 암종 (기본), 크라스 돌연변이 | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 2 mM | 5분 | 플라스크 | PBS 1x | 0,25 | |||||||
| HKE3 | 대장암, 크라스 WT | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 2 mM | 5분 | 플라스크 | PBS 1x | 0,25 | |||||||
| HT-29 | 대장 선암 (1 차) | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 2 mM | 5분 | 플라스크 | PBS 1x | 0,2 | |||||||
| CACO-2 | 대장 선암 (1 차) | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 1 mM | 5분 | 1.5 mL 마이크로센트리슈어지 튜브 | 전체 매체 | 0,25 | |||||||
| MCF-7 | 유방 선암 (전이) | 사람의 | 상피 | 점착 | 70% - 80 % | PBS/EDTA 1 mM | 5분 | 1.5 mL 마이크로센트리슈어지 튜브 | 60% FBS + 40% 완전 매체 | 0,5 | |||||||
| Hs578T | 유방 암 (1 차) | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 1 mM | 2분 | 1.5 mL 마이크로센트리슈어지 튜브 | 60% FBS + 40% 완전 매체 | 0,5 | |||||||
| MDA-MB-468 | 유방 선암 (전이) | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 1 mM | 8분 | 1.5 mL 마이크로센트리슈어지 튜브 | 60% FBS + 40% 완전 매체 | 0,5 | |||||||
| MDA-MB-231 | 유방 선암 (전이) | 사람의 | 상피 | 점착 | 70% - 75 % | PBS/EDTA 1 mM | 5분 | 1.5 mL 마이크로센트리슈어지 튜브 | 전체 매체 | 0,5 | |||||||
| RT112 | 오줌 방광 과도 세포 암 (1 차) | 사람의 | 상피 | 점착 | 85% - 90% | 트립글 | 6분 + 셀 스크레이퍼 | 1.5 mL 마이크로센트리슈어지 튜브 | 전체 매체 | 0,5 | |||||||
| BFTC905 | 오줌 방광 과도 세포 암 (1 차) | 사람의 | 상피 | 점착 | 75% - 85% | 트립글 | 10분 | 1.5 mL 마이크로센트리슈어지 튜브 | 80% 완전 매체 + 20% PBS/EDTA 2 mM | 0,5 | |||||||
| J82 | 오줌 방광 과도 세포 암 (1 차) | 사람의 | 상피 | 점착 | 85% - 90% | 트립글 | 10분 | 1.5 mL 마이크로센트리슈어지 튜브 | 전체 매체 | 0,5 | |||||||
| RT4 | 오줌 방광 과도 세포 암 (1 차) | 사람의 | 상피 | 점착 | 85% - 90% | 트립글 | 6분 | 1.5 mL 마이크로센트리슈어지 튜브 | 전체 매체 | 0,5 | |||||||
| 미아 파카-2 | 췌장 상피암 (1차) | 사람의 | 상피 | 점착 | 80% - 90% | 트립글 | 3분 | 1.5 mL 마이크로센트리슈어지 튜브 | 60% FBS + 40% 완전 매체 | 0,5 | |||||||
| PANC-1 | 췌장 상피암 (1차) | 사람의 | 상피 | 점착 | 80% | 트립글 | 5분 | 1.5 mL 마이크로센트리슈어지 튜브 | PBS/EDTA 2mM | 0,5 | |||||||
| VC8 | 폐 섬유아세포, BRCA2 돌연변이, HR 결핍 | 중국 햄스터 | 상피 | 점착 | 70% - 80 % | PBS/EDTA 1 mM | 5분 | 1.5 mL 마이크로센트리슈어지 튜브 | 전체 매체 | 0,25 | |||||||
| VC8-B2 | 폐 섬유아세포, 인간 BRCA2, BRCA2 -/− HR 결핍 | 중국 햄스터 | 상피 | 점착 | 70% - 80 % | PBS/EDTA 1 mM | 5분 | 1.5 mL 마이크로센트리슈어지 튜브 | 전체 매체 | 0,25 | |||||||
표 1: 여러 세포주 주입을 위한 최적의 체외 합류
| 세포 염료 | 카탈로그 번호 | 형광 스펙트럼 (Exc. - Em.) | 재고 희석 | 플라스크에 얼룩질 희석 작업 | 1.5 mL 마이크로센트리슈에 얼룩질 희석 작업 | 인큐베이션 시간 | 관찰 | ||||||
| 비브란트 CM-DiI | V22888 | 549 nm - 569 nm | 이미 희석 | PBS 1x에서 4:1000 | PBS 1x에서 4:1000 | 15 분 @ 37 ºC + 4 분 @ 4 ºC | |||||||
| 비브란트 디오 | V22886 | 484 nm - 501 nm | 이미 희석 | 5:1000 PBS 1x | 5:1000 PBS 1x | 15 분 @ 37 ºC + 4 분 @ 4 ºC | 4 일 사후 주입에서 공초점 이미징에 좋은 해상도 | ||||||
| 셀트래커 딥 레드 | C34565 | 630 nm - 660 nm | DMSO에서 1mM | PBS 1x에서 0.5 - 2.5 μM | PBS 1x에서 0.5 - 2.5 μM | 15분 @ 37 ºC | |||||||
| 셀트래커 그린 CMFDA | C7025 | 492 nm - 517 nm | DMSO 에서 10 mM | PBS 1x에서 0.5 - 2.5 μM | PBS 1x에서 0.5 - 2.5 μM | 15분 @ 37 ºC | 복강 후 48시간 후 복강에 제품 누출, 하지만 공동 주입 연구에 이상적 | ||||||
표 2: 염료 및 조건
| 크기 | # 애벌레 | E3 1x 중간 볼륨 |
| 100mm x 15mm(표준) | 최대 50개까지 | 20-25 mL |
| 60mm x 15mm | 최대 20개까지 | 10mL |
| 6웰 플레이트 | 웰당 최대 15개까지 | 웰 당 3-4 mL |
표 3: 페트리 요리 옵션
| E3 중간 50x - 재고 | 멸균 물 10리터: |
| NaCl 146.9 g | |
| KCl 6.3 g | |
| CaCl2g24.3 g ·2H2O | |
| 40.7 g 의 MgSO4·7H2O | |
| E3 중간 크기 1x - 사용 준비 | E3 중간 50x 400mL |
| 60 mL 0.01% 메틸렌 블루 솔루션 | |
| 최대 20리터의 어류 시스템 워터 채우기 | |
| 트리카인 25x – 주식 및 안락사 | 트리카인 파우더 2 g |
| 역삼투수 500mL | |
| 1M 트라이10mL (pH 9) | |
| pH 7에 적응 | |
| 트리카인 1x - 마취 | 트리사인 25x 20mL |
| 최대 500mL의 시스템 워터 채우기 | |
| 60 mg / mL Pronase - 주식 100x | pronase 1 g |
| 16.7 mL 멸균 수 | |
| 0.6 mg/mL Pronase – 1x 사용 준비 | 100 μL pronase 100x |
| 9.9 mL 의 E3 중간 1x |
표 4: 솔루션 컴포지션
토론
암 개발 및 약물 검진의 모델로서제브라피쉬의 중요성이 증가함에 따라 수많은 간행물3,4,7,13,14,16,18,19,20,21이발생했다. 그러나, 제브라피시 배아에 있는 암세포의 주입은 연구원을 위해 도전할 수 있는 손재주성의 높은 수준을 요구하는 기술입니다. 이 프로토콜에서 우리는 제브라피시 배아 xenografts를 설치하는 초기 도전을 극복하는 데 도움이 될 수있는 실용적인 정보와 몇 가지 팁을 제공하는 것을 목표로합니다.
세포 취급 사전 주입
세포주를 가진 제브라피시 제노이식의 생성을 위한 이 최적화된 프로토콜은 상이한 형태를 가진 다양한 유형의 (암) 세포에 적응될 수 있다. 제브라피시 제노이식에 사용되는 모든 세포주는 마이코플라즈마가 없는 것이 좋습니다. 다른 세균 오염과 달리, 세포 배양에 마이코플라즈마의 존재는현미경(22)에서쉽게 검출될 수 있는 변화를 생성하지 않는다. 마이코플라즈마 오염은 세포주 이식 잠재력, 약물에 대한 민감성, 제브라피시 배아의 생존가능성에 영향을 미칠 수 있습니다.
세포가 장기간 계속 증식할 수 있지만 표현형과 유전자형은 변화에 취약할 수 있습니다. 배양시 세포주의 형태와 행동에 익숙해지는 것이 중요합니다. 재현 가능한 결과를 얻으려면 3-12 사이를 해동한 후 세포 구절수를 유지하는 것이 좋습니다. 따라서, 정기적인 마이코플라즈마 테스트는 수행되어야 한다.
세포는 로그 단계에 있어야 합니다(합류 ~70% 전에 기하급수적 성장 단계) 주사 당일. 이것은 종양의 특유한 특징의 적당한 이식 및 적당한 발달을 가능하게 할 것입니다. 이노이식 내 세포의 표현형의 변이를 방지하기 위해 실험 사이에 분사 상수를 유지하는 것이 중요합니다. 주입된 세포의 수는 제브라피시 배아에서 번창하기 위하여 주사의 더 높은 밀도를 요구할 수 있기 때문에 각 세포주의 특성에 적응될 수 있습니다.
셀 라벨링 고려 사항
주사 및 미래 분석을 위해 인간 종양 세포를 더 잘 시각화하기 위해 종양 세포는 형광 염료로 표시 될 수 있습니다. 세포 크기의 차이로 인해, 부착 배양에서 세포 /cm2의 총 수는 세포주마다 다릅니다. 이것은 염색 프로토콜의 효험뿐만 아니라 주입을 위해 수확된 세포의 수에 영향을 미칩니다. 플라스크당 낮은 숫자를 산출하거나 클러스터(즉, BFTC905)에서 성장하는 큰 셀은 단일 실험을 위해 여러 플라스크의 풀링이 필요합니다. 이 경우, 세포의 염색은 과도 한 양의 염료 (높은 비용)의 사용을 일으킬 수 있으므로 플라스크에서 직접 수행해서는 안됩니다. 한편, 원심분리의 과도한 주기에 매우 민감한 세포뿐만 아니라 플라스크당 높은 숫자를 산출하는 세포(즉, HCT116)는 플라스크에 직접 염색한 다음 EDTA/셀 스크레이퍼로 분리될 수 있습니다(자세한 내용은 표 1참조).
가능하면 효소 접근법을 사용하는 대신 EDTA를 사용하여 주입 당일 세포를 분리하여 세포세포 접합부를 보다 신속하게 복구하고 원심 분리 단계를 덜 수행합니다. 그럼에도 불구하고, 세포가 EDTA에 민감하다면 클러스터에서 매우 응집되거나 자라는 경우 효소 방법을 적용할 수 있습니다. 주사 배지뿐만 아니라 주사에 대한 이상적인 농도의 최적화는 각 세포주의 특성에 따라 달라지므로 일부 조정이 필요할 수있습니다(표 1).
미세 주입 교정
제브라피시 배아로 올리고뉴클레오티드 또는 약물을 전달하는 것과는 달리, 잎이 트개 이식을 위해 세포주로 작업할 때 그레이티쿨은 바늘을 보정하는 데 사용되지 않습니다. 주입 하는 동안 몇 시간 후, 세포 는 막히기 시작 됩니다., 그리고 그것의 직경을 증가 하거나 바늘을 완전히 변경 하는 바늘의 끝을 잘라 필요. 이 절차는 무상 교정을 방해합니다.
이 문제를 해결하기 위해, 분배된 세포의 수는 1-3 펄스 내의 배아 눈과 유사한 크기에 도달하는 데 필요한 방출 압력 및 시간에 의해 조절됩니다. 이어서, 종양 크기를 추가로 조절하기 위해, 1dpi에서, xenografts는 도 6 B-B에도시된 바와 같이 종양 크기에 따라 분류된다" . 도 6C 예제에서 와 같이, 선별의이 방법은 종양 크기의 변화를 줄이는 데 효율적입니다 : 우리가 그들 모두를 함께 풀경우 (+, ++, +++++) STEV는 ++클래스의 두 배 (~906 세포 ~ ~ 422 세포) 및 계수 변동은 ++클래스의 14,5 %에 비해 ~31.9 %입니다. 주입에 대한 참조는 부피이기 때문에 셀 유형 마다 셀 의 총 수가 많이 다릅니다 - 세포의 크기와 모양에 의존합니다. 예를 들면, 유방암 Hs578T 같이 세포질이 많은 큰 세포는, 훨씬 더 작은 종양 (~600 세포)를 일으킵니다. 또한, 각 세포주 세포의 다른 수를 필요로한다. 예를 들어, HT29 CRC 및 RT112 오줌 방광암 세포주는 주입된 세포의 수가 높을수록 제브라피시 사망률이 높다는 것을 보여주었습니다. 따라서, 세포주가 배아에 독성 효과가 있거나 주사밀도가 더 높거나 더 낮은 지밀도가 필요한지 테스트하기 위해서는 이종이이식을 개발하는 동안 최적화기간이 필요하다.
사출 사이트
제브라피시 배아 제노이식을 생성할 때 가장 흔한 불일치 중 하나는 주사 부위입니다. 노른자는 일반적으로 쉽게 접근성으로 인해 주입을위한 장소입니다. 그러나, 우리는 노른자에서 주입된 세포가 정지하는 더 높은 경향이 있다는 것을 관찰했습니다. 기술적으로 더 어렵지만, 우리는 PVS에 가능한 한 심장에서 주입하는 것이 좋습니다. PVS 내에서, 세포는 전이성 특성8,11을표시하는 경우에, 혈관 및 면역 세포를 집계하고, 결합하고, 사치시키고, micrometastasis를 형성할 수 있다.
이식 효율
4dpi에서 세포주 중 이식 효율 및 종양 크기의 차이는 기저 세포 사멸/생존/증식의 뚜렷한 정도뿐만 아니라 각 세포선이9를표시할 수 있는 타고난 면역원성 으로 인해 예상된다.
전이
전이는 두 임의단계로 나눌 수 있는 다단계 이벤트 로 구성됩니다. 첫 번째 단계에서 종양 세포는 1 차 부위에서 분리하고 인접한 조직을 마이그레이션및 침입한 다음 혈류로 침입해야합니다. 두 번째 단계에서, 종양 세포는 순환에서 살아 나야하며 혈액 이나 림프관에서 사치스럽게 만들고, 마지막으로 이차 부위(23)에서식민지화해야합니다. 이 초기 및 늦은 사건을 구별하고 이 단계를 수행하기 위하여 다른 종양 세포의 잠재력/숙련도를 다루기 위하여, 우리는 간단한 분석기를 디자인했습니다.
일반적으로, PVS에 주입될 때, 종양 세포는 순환으로 직접 입력한 다음 카우달 조혈 조직(CHT)(TAIL region)에 물리적으로 갇힐 수 있다. 그러나, 각 종양 세포의 특성에 따라 - 우리는 몇몇 종양 세포가 CHT 4 dpi에 남아 있고 그밖 종양 세포가 사라지는 동안 micrometastasis를 형성할 수 있다는 것을 보았습니다 (CHT에 붙잡힌 후에 삭제).
따라서, 세포가 순환에 직접 배치되었을 때 미세 전염 효율(4dpi에서)을 비교하여 - CIRC (세포는 전이의 늦은 단계를 거쳐야만) 대 하지 않을 때 - NO CIRC (세포는 미세 전이를 형성할 수 있는 초기 및 후반 단계를 통과해야 합니다)를 초기 또는 후기 metastatic 잠재력을 평가할 수 있습니다. 우리는 두 그룹 (CIRC 및 NO CIRC)에서 CHT에서 마이크로 메타아시스를 효율적으로 형성 할 수있는 종양 세포를 관찰했으며, 이러한 세포는 전이성 캐스케이드 (SW480 및MDA-MB-468)의 모든 단계를 겪을 수있는 능력을 가지고 있음을시사8,11. 대조적으로, 다른 종양 세포는 두 단에서 매우 낮은 전이성 전위력을 가지며, 거의 마이크로메타시스를 만들지 않으며, 혈중 (즉, 24 hpi에서 CHT에서 볼 수 있지만 4 dpi에서 더 이상 존재하지 않는다, Hs578T)8. 그러나, 우리는 명확하게 다른 단을 찾아냈습니다 - 순환에 주입될 때 단지 micrometastasis를 형성할 수 있는 하나 (우리는 CIRC 단에 있는 micrometastasis를 관찰할 수 있습니다). 이것은 이 세포가 전이성 폭포의 첫번째 단계를 수행하는 저효율을 가지고 있다는 것을 건의합니다 그러나 다른 한편으로는 순환에서 살아남을 수 있고, 사치화하고 먼 사이트를 식민지화할 수 있습니다.
면역 염색 및 이미징
고정하기 전에, 이 주입 프로토콜은 살아있는 차등 간섭 대조 (DIC) 현미경 검사법, 회전 디스크 현미경 검사법, 고해상도 라이브 공초점 화상 진찰 및 광시트 현미경 검사법과 같은 그밖 살아있는 화상 진찰 접근에 사용될 수 있습니다.
죽은 세포와 세포 파편은 형광 스테레오 현미경을 통해 관찰될 때 밝게 나타나고 연구 결과의 목적이 세포주의 전이성 잠재력을 평가하는 경우에 특히 살아있는 세포로 착각될 수 있습니다. 우리는 종양과 미세 메타염의 생존 상태를 평가하기 위해 특정 생존 마커 및 DAPI와 함께 공초점 이미징수행의 중요성을 강조하고 싶습니다. 또한, 특정 인간 항체를 사용하여 항인간 미토콘드리아 또는 항인간 HLA와 같은 인간 세포를 검출하는 것이 기본이다. 프로토콜을 구현할 때, 스테레오현미경의 염색을 공초점 이미지와 비교하여 실험자의 눈을 훈련시다. 몇 시간 후, 실험자는 형광 스테레오 현미경의 살아있는 세포와 파편을 명확하게 구별 할 수 있습니다.
전체 형광 영역과 같은 종양 부담을 정량화하는 다른 방법이 널리 사용되지만, 보다 정확한 방법으로 전체 마운트 면역 염색 및 공초점 이미징을 수행하는 것이 좋습니다. 뿐만 아니라 지방 성 염료 염색의 효율은 매우 가변 (즉, 일부 세포는 매우 잘 얼룩진 반면 다른 사람은 -아마 그들의 막의 지질 함량으로 인해), 뿐만 아니라 여러 번 지방 혈성 염료 형성 집계, 죽은 세포는 밝은 경향이 - 살아있는 세포에 대한 오해 될 수있는 여러 유물을 만드는.
세포는 그들의 추적에 원조하고 세포 라벨을 건너 뛰기 위하여 형광 단백질로 변환될 수 있습니다. 그러나, 변환된 및 비변환된 세포가 제브라피시 제노이식에서 동일한 결과를 생성하는지 확인하십시오.
또한, 대식세포는 이러한 형광 세포 파편이 형광으로 표시되고 이동하여 거짓 양성 전이성 세포를 생성할 수 있습니다. 따라서 종양 행동의 보다 정확한 해석을 위해 여러 가지 다른 판독도구로 확장 될 수있는 일련의 분석 도구를 권장합니다.
- 확산 - DAPI 또는 항 pHH3Ser10 항체를 가진 미토틱 피규어의 정량화 (머크 밀리포어 고양이. #06-570),
- 세포 사멸- 항체 항활성 Caspase3Asp175 (셀 신호 기술 고양이 #9661) 또는 이와 동등한,
- 종양 크기 - DAPI 계수 - 인간 종양 세포는 매우 뚜렷한 크로마틴 조직을 나타내므로 제브라피시 세포와 쉽게 구별되며 항상 염료로 다시 검사 할 수 있습니다 (눈을 훈련 할 때),
- 전이성 연구를 위해,인간 세포를 명확하게 검출하기 위해 - 항인간 HLA (Abcam EP1395Y 고양이 #ab52922), 항인간 미토콘드리아 (머크 밀리포어 고양이. #MAB1273-클론 113-1).
DAPI 카운터스테인링과 대조암세포 HCT116의 Z 스택(직경 10-12 μm의 평균 핵 크기)에서 슬라이스 사이에 5μm 간격을 갖는 공초점 획득을 위해, 세포의 ~50%가 2개의 연속슬라이스 사이에서 공유되는 것을 관찰하였다. 따라서 모든 슬라이스가 계산되면 동일한 셀을 두 번 계산할 위험이 높습니다. 정량화의 문제를 피하기 위해 슬라이스 사이를 오가면 시간이 많이 걸리고 오류가 발생하기 쉬운 기술이 발생합니다. 총 세포 수의 정량화를 용이하게 하고 연구자 들 간의 더 많은 재현성을 허용하기 위해, 우리는 이전에 이프로토콜8에기술된 종양 크기 공식을 만들었습니다.
우리는 슬라이스 사이에 공유 된 ~50 %의 세포를 설명하기 위해 보정 번호 (1.5)를 포함했습니다. 우리는 연구원 사이 전체 종양의 수동 계산의 평균 오류가 20%이었다는 것을 것을을 발견했습니다. 포뮬러를 사용하는 두 명의 연구원은 2%의 오차를 가지고 있었습니다. 이 포뮬러의 사용은 93%의 정확도와 98%의 재현성률을 가지고 있습니다. 또한 자동화된 메서드를 테스트했지만 임계값 설정으로 인해 50% 이상의 오류를 보여 주였습니다.
세포 세포의 특성으로 인해 활성화된 Caspase 3 세포의 정량화가 더 어렵습니다. 결과의 실수와 변화의 수를 줄이기 위해, 우리는 제어 및 실험 샘플이 동일한 연구원에 의해 계산하는 것이 좋습니다. 또한,이 기술을 배울 때, 새로운 연구원은 이미 결과와 훈련을 비교하기 위해 경험이 풍부한 연구원에 의해 정량화 된 이미지를 계산해야합니다.
필요한 경우 분석의 길이를 연장할 수 있습니다. 그러나, 제브라피시 애벌레는 ~7일 후 수정(5일 후 주입)부터 생수급이 필요하다는 점을 고려하는 것이 중요하다. 또한, 6일 이상 유충에 적용되는 동물복지 지침 및 규정은 변할 수 있다.
이 프로토콜은 단일 연구원이 시간당 약 ~ 200-300 제브라피어 애벌레를 주입 할 수있는 유용한 도구를 제공합니다. 분석 및 통계 해석을 포함한 전체 분석 결과에 대한 결과는 3주 만에 수득됩니다. 우리는 이 프로토콜이 연구원이 제브라피시 제노이식생성에 있는 전문가가 되는 것을 도울 수 있기를 바랍니다. 그것은 쉽지 않다; 연습을 해야 하지만 거기에 도착 합니다. 행운을 빌어!
공개
없음
감사의 말
우리는 샴페인 마우드 재단, 콘겐토 (LISBOA-01-0145-FEDER-022170, FCT / 리스보아2020에 의해 공동 자금 조달)에 감사드립니다. 부사장FCT 펠로우십(SFRH/BD/118252/2016), MML(PD/BD/138203/2018). 중요한 토론을 위한 Fior Lab의 모든 구성원; B. 코스타와 C. 레벨로 드 알메이다 데이터 공유; 그리고 우리의 실험실 구성원 C. 레벨로 드 알메이다, M. 바로소와 L. 라이트 비디오에 참여. CF 피쉬 시설(C. 세르탈, J. 몬테이로 등)과 샴페인 커뮤니케이션, 이벤트 및 아웃리치 팀에게 환상적인 영화 제작에 대한 알렉산드르 아진헤이라와 카타리나 라모스와 테레사 페르난데스의 도움을 부탁드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Agar for bacteriology | VWR | 97064-336 | Agar plate |
| anti-Caspase3Asp175 (Rabbit monoclonal) | Cell Signalling Technologies | 9661 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti-human HLA (Rabbit monoclonal) | Abcam EP1395Y | ab52922 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti- 488 (Rabbit monoclonal) | ThermoFisher Scientific | 35552 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| anti- 594 (Rabbit monoclonal) | ThermoFisher Scientific | 35560 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| CellTracker Deep Red Dye | ThermoFisher Scientific | C34565 | Lipophilic dye (Dilution 1:1000) |
| CellTracker Green CMFDA Dye | ThermoFisher Scientific | C2925 | Lipophilic dye (Dilution 1:1000) |
| Conical Centrifuge tube 50mL | VWR | 525-0610 | |
| Conical Centrifuge tube 15mL | VWR | 525-0604 | |
| DAPI | Nuclear and chromosome counterstain | ||
| Laser-Based Micropipette Puller P-2000 | Sutter-Instrument | Micropipette Puller | |
| Microcentrifuge tube 1.5mL | Abdos | P10202 | |
| Microscope slides, cut edge | RS France | BPB016 | Slides for mounting |
| Mowiol | Sigma-Aldrich | 81381 | Mounting medium |
| Pneumatic Picopump | World Precision Instruments | PV820 | Microinjector |
| Rectangular cover glasses, Menzel Gläser | ThermoFisher Scientific | 631-9430 | Coverslips for mounting |
| SeaKem LE Agarose | Lonza | 50004 | Agar plate |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100-4 | Borosilicate capillaries |
| TrypLE | Gibco | 12605036 | Enzymatic detachment solution |
| Vaseline | Petroleum jelly for slide sealing | ||
| Vybrant CM-DiI Dye | ThermoFisher Scientific | V22888 | Lipophilic dye (Dilution 1:1000) |
| Vybrant DiO Cell-Labeling Solution | ThermoFisher Scientific | V22886 | Lipophilic dye (Dilution 1:1000) |
| ZEISS Axio Zoom.V16 for Biology | ZEISS | Fluorescence Stereo Zoom Microscope | |
| Zeiss LSM 710 | ZEISS | Confocal microscope |
참고문헌
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97, 889-938 (2017).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. Journal of Clinical Investigation. 122, 2337-2343 (2012).
- Stoletov, K., Klemke, R. Catch of the day: zebrafish as a human cancer model. Oncogene. 27, 4509-4520 (2008).
- Weintraub, A. All eyes on zebrafish. Lab Animals. 46, 323-326 (2017).
- Novoa, B., Figueras, A., Lambris, J. D., Hajishengallis, G. Zebrafish: Model for the Study of Inflammation and the Innate Immune Response to Infectious Diseases. Current Topics in Innate Immunity II. , 253-275 (2012).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nature Reviews Cancer. 20, 263-273 (2020).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Póvoa, V., et al. Innate immune evasion revealed in a colorectal zebrafish xenograft model. Nature Communications. 12, 1156 (2021).
- Galletti, G., et al. Targeting Macrophages Sensitizes Chronic Lymphocytic Leukemia to Apoptosis and Inhibits Disease Progression. Cell Reports. 14, 1748-1760 (2016).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Communications Biology. 3, 1-13 (2020).
- Varanda, A. B., Martins-Logrado, A., Godinho Ferreira, M., Fior, R. Zebrafish Xenografts Unveil Sensitivity to Olaparib beyond BRCA Status. Cancers. 12, 1769 (2020).
- Osmani, N., Goetz, J. G. Multiscale Imaging of Metastasis in Zebrafish. Trends in Cancer. 5, 766-778 (2019).
- Hyenne, V., et al. Studying the Fate of Tumor Extracellular Vesicles at High Spatiotemporal Resolution Using the Zebrafish Embryo. Developmental Cell. 48, 554-572 (2019).
- Costa, B., et al. Developments in zebrafish avatars as radiotherapy sensitivity reporters - towards personalized medicine. EBioMedicine. 51, 102578 (2020).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish Avatars towards Personalized Medicine-A Comparative Review between Avatar Models. Cells. 9, 293 (2020).
- TRICAINE - Protocols. ZFIN Community Wiki Available from: https://wiki.zfin.org/display/prot/TRICAINE (2021)
- Zhao, C., et al. A Novel Xenograft Model in Zebrafish for High-Resolution Investigating Dynamics of Neovascularization in Tumors. Plos One. , (2011).
- Veinotte, C. J., Dellaire, G., Berman, J. N. Hooking the big one: the potential of zebrafish xenotransplantation to reform cancer drug screening in the genomic era. Disease Models & Mechanisms. 7, 745-754 (2014).
- Haldi, M., Ton, C., Seng, W. L., McGrath, P. Human melanoma cells transplanted into zebrafish proliferate, migrate, produce melanin, form masses and stimulate angiogenesis in zebrafish. Angiogenesis. 9, 139-151 (2006).
- Zon, L. I., Peterson, R. The New Age of Chemical Screening in Zebrafish. Zebrafish. 7, 1 (2010).
- Mycoplasma Contamination of Cell Cultures. InvivoGen Available from: https://www.invivogen.com/review-mycoplasma (2016)
- van Zijl, F., Krupitza, G., Mikulits, W. Initial steps of metastasis: cell invasion and endothelial transmigration. Mutation Research. 728, 23-34 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유