Method Article
Поколение зебрафиш Ларвал Ксенотрансплант и анализ поведения опухолей
В этой статье
Резюме
Здесь мы предоставляем пошаговой протокол с советами по генерации ксенотрансплантатов и руководящими принципами для анализа поведения опухолей, иммунофлуоресценции целых гор и количественной оценки конфокальных изображений.
Аннотация
Ксенотрансплантаты зебры широко используются для исследования рака для выполнения in vivo и в режиме реального времени исследований рака человека. Возможность быстрой визуализации реакции на противораковой терапии (химио, лучевая терапия и биология), ангиогенез и метастазы с разрешением одной клетки, ставит модель ксенотрансплантата зебры в качестве лучшего выбора для разработки доклинкологических исследований.
Анализ личинки зебры ксенотрансплантата представляет несколько экспериментальных преимуществ по сравнению с другими моделями, но, вероятно, наиболее ярким является уменьшение масштабов размера и, следовательно, времени. Такое уменьшение масштаба позволяет одноклеточной визуализации, использование относительно небольшого числа клеток человека (совместимых с биопсией), средне-высокой пропускной способности скрининга наркотиков, но самое главное позволяет значительно сократить время анализа. Все эти преимущества делают анализ ксенотрансплантата зебры чрезвычайно привлекательным для будущих персонализированных приложений медицины.
Многие протоколы ксенотрансплантата зебры были разработаны с широким разнообразием опухолей человека; однако, общий и стандартизированный протокол для эффективного создания личинки зебры ксенотрансплантатов по-прежнему отсутствует. Здесь мы предоставляем пошаговой протокол, с советами по генерации ксенотрансплантатов и руководящих принципов для анализа поведения опухоли, цельно-монтаж иммунофлуоресценции, и конфокальные количественной визуализации.
Введение
Зебрафиш (Danio rerio) становится мощным позвоночным моделью организма для изучения развития и болезней. Зебрафиш разделяет высокосхраняемые генетические (70% генетической гомологии и 84% связанных с болезнью генов) и основные морфологическиеособенности органов с людьми 1,2. Эта консервация позволяет использовать зебру для моделирования нескольких заболеваний человека, в том числерака 3,4.
Обработка и обслуживание зебры гораздо проще и рентабельнее, чем мыши из-за их небольшого размера, высокой плодовитости круглый год ивнешнего оплодотворения 3,5. Эмбрионы зебры не требуют живого кормления в течение первых 5-7 дней жизни и были использованы в качестве эффективной модели для развития, инфекции ирака 1,4,6,7. Эмбрионы зебры вылупляются в течение 48 часов после оплодотворения (hpf) и являются свободно плавающими животными со всеми сформированными органами, бьющимся сердцем и функциональной кровеносной системой, печенью, мозгом, мозгом, мозгом ит.д. 1,3. Также на данном этапе развития только врожденный иммунитет находится в игре, адаптивный иммунитет все еще развивается, что позволяет общее эффективное присвещание клеток человека без необходимости использования иммунокомпромиссныхмутантов 7,8. Тем не менее, важно отметить, что не все клетки человека engraftодинаково 9 и что, например, для клеток лейкемии было показано, что фагоциты (нейтрофилов и макрофагов) должны быть истощены для эффективного притягаения10.
Генетическая трактивность зебры и оптическая прозрачность ее ранних эмбриональных стадий позволяют одноклеточную интравитационную визуализацию с высоким разрешением и, таким образом, для создания самых современной техники визуализации в различных областях биологии. Кроме того, в контексте рака, эти функции полезны для в режиме реального времени исследования ранних стадиях взаимодействия хозяина-опухоли, как изучение ангиогенного и метастатического потенциала, а также взаимодействия с врожденнойиммунной системой 8,9,11,12,13.
Хотя в коротком анализе ксенотрансплантата нет времени на метастатическую «эволюцию» - можно проанализировать метастатические способности опухолевых клеток (т.е. их эффективность пройти через метастатические шаги вроде вторжения, интравазации, выживания в кровообращении, экстравазации и колонизации, и поэтому изучить эти процессы в виво ив режиме реального времени 8,11,13,14).
Характеристики его жизненного цикла место зебры в качестве уникальной модели для персонализированной медицины в раке. Анализы могут быть выполнены в более короткий промежуток времени ирезультаты,полученные в течение нескольких недель 7,8,9,11,12,15,16. Селерность и осуществимость этих анализов предоставляют врачам и исследователям возможность получения трансляционных результатов, которые могут быть полезны для онкологических больных, для которых время является существенной необходимостью.
Несмотря на все более все более многочисленные попытки создания успешных ксенотрансплантатов эмбрионов зебры, по-прежнему существует необходимость в стандартизации процедуры инъекций, а также оценки жизнеспособности клеток и поведения опухоли после инъекции.
В этом протоколе мы предоставляем исследователям четкое и подробное пошаговое руководство для инъекций линий раковых клеток человека в эмбрионах зебры и последующей фиксации, иммуностеинации, визуализации и количественной оценки поведения опухолевых клеток.
протокол
Модель зебры(Danio rerio) обрабатывалась и поддерживалась в соответствии со стандартными протоколами Европейского законодательства о защите животных, Директивы 2010/63/EU (Европейская комиссия, 2016) и Рыбной платформы Шампалаймо. Все протоколы были одобрены Шампаладом животных этического комитета и португальских институциональных организаций-ORBEA (Эргао де Bem-Estar электронной тика животных / животных благосостояния и этики органа) и DGAV (Диреао Гераль де Алиментаньо электронной Veterin'ria / Генерального директората по продовольствию и ветеринарии).
ПРИМЕЧАНИЕ: Перед началом основного эксперимента, практика с человеческим колоректальным раком (CRC) клеточной линии HCT116. Эта линия клеток легко готовить (высоко пролиферативная), легко вводить и присвековывать очень эффективно (около 95-100%). Начните с клеток в избытке (12x106 клеток, Т-75 колба) и избыток рыбы (400 рыб), пока не станет опытным в технике, так как многие клетки и рыбы будут потеряны во время обучения. Экспериментаторы готовы после того, как присвековка в размере 95% достигается в ксенотрансплантатах HCT116. См. рисунок 1 для схемы полного протокола.
1. Настройка для инъекций
- За две недели до инъекции расширьте клетки в культуре (см. таблицу 1 для подробного руководства по оптимальному слиянию in vitro для инъекций нескольких клеточных линий).
- За три дня до инъекции пересеки зебру из нужного фона.
2. 24 ч до инъекции
- Очистите пластины эмбриона зебры (отбросьте все мертвые и неразвитые эмбрионы) и освежите E3 medium.
- В комнате культуры клетки, сбросьте средство культуры клетки от колб запланированных для впрыски, моете раз с 1x фосфат-буфером солевым раствором (PBS) для того чтобы извлечь мертвые клетки и добавить свежую среду.
- Подготовь инструменты для процедуры инъекции, такие как: микроинъекции иглы, агарозные пластины и шпильки для выравнивания эмбрионов для инъекций(рисунок 2A-D, подробно ниже).
- Микроинъекции иглы (Рисунок 2A)
- Используйте борозиликатные стеклянные капилляры (4 дюйма, OD 1,0 мм, Нет нити в шкиве микропипта (тепло: ≈500; фил: 10; vel: 50; dec: 60; тянуть: 100).
- Подготовка плиты(рисунок 2B)
- Приготовьте 2% агарозы в H2O, разогрейте ее и вылейте один слой растворенного агарозы в крышку чистой чашки Петри. Пусть он полимеризируется и с помощью линейки, сделать три-четыре прямые линии агарозы для выравнивания эмбрионов.
- Сборка шпильки(рисунок 2C-D)
- Поместите 1 волос в стеклянную капиллярную трубку, оставляя около 1 сантиметра волос за пределами трубки.
- Завясть внешнюю кончик волос с помощью типсов в стеклянную капиллярную трубку, образуя петлю длиной 0,5 мм.
- Печать края капиллярной трубки с каплей лака для ногтей. Это также поможет исправить цикл на месте. Дайте ему высохнуть. Повторите процедуру на другом краю трубки.
- Вырезать кусок электрической ленты (более устойчивый, непроницаемый и жесткий, чем обычные клейкой лентой).
- Печать ленты вокруг капилляра, чтобы защитить его от взлома.
- Микроинъекции иглы (Рисунок 2A)
3. День инъекций
- Отделить вылупившихся эмбрионов от неугодных яйцеклеток. Добавление 1x pronase (0,6 мг/мл, таблица 3) к среде эмбриона на данном этапе может увеличить вылупление. Поместите эмбрионы в инкубатор (при 28 градусов по Цельсию) до инъекции.
ПРИМЕЧАНИЕ: Не оставляйте эмбрионы в проназовом растворе дольше 1 часа, так как фермент будет действовать на вылупившихся эмбрионов, увеличивая риск их смертности. Убедитесь, что стадия развития эмбрионов соответствует 48 л.с.(рисунок 3A, A'), чтобы избежать риска отеков и смертности. - Подготовка 1x Tricaine (из 25x акций).
ПРИМЕЧАНИЕ: Подробный рецепт можно найти в таблице 3 и в информационной сети Зебрафиш - веб-страница17.
4. Маркировка клеток для инъекций
ПРИМЕЧАНИЕ: Маркировка клеток может быть выполнена либо непосредственно в колбе, либо в микроцентрифуге 1,5 мл после энзиматической отслоения. Дополнительную информацию можно получить в ходе обсуждения.
- Удалите среду клеточной культуры и помойте колбу дважды (2x) с помощью 1X PBS.
- Этикетка клеток с липофиличным красителем выбора либо непосредственно в колбе (2 мл раствор / T75 колбы) или в 1,5 мл микроцентрифуг трубки после энзиматический отслоение. Избегайте воздействия света и инкубации клеток при 37 градусов по Цельсию (см. таблицу 1 и таблицу 2 для условий/решений).
- Если маркировка в колбе
- Удалите краситель, мыть с 1x PBS и отделить клетки с EDTA и сотовый скребок.
- Передача ячеек в 1,5 мл микроцентрифуг труб. Центрифуга в течение 5 минут при 300 х г затем перейти к шагу 4,5.
- При маркировке в трубке микроцентрифуга 1,5 мл:
- Центрифуга 5 минут при 300 х г, чтобы удалить краситель и отказаться от супернатанта. Resuspend в 1x PBS для мытья.
- Центрифуга 5 минут при 300 х г, а затем перейти к шагу 4,5.
- Отбросьте супернатант и бавьте гранулы со средой клеточной культуры (для гранулы 50 МКЛ добавьте 150-200 МКЛ среды).
- Количественная жизнеспособность клеток с помощью камеры Neubauer с исключением Трипан синий или другой метод выбора.
- Центрифуга в течение 4 минут при 300 х г и отказаться от супернатанта. Повторное использование клеток в среде инъекций.
ПРИМЕЧАНИЕ: Рекомендуемая концентрация клеток (в целом от 0,25-0,5x106 клеток/ йЛ) и среды можно найти в таблице 1. - С этого момента держите клетки на льду.
5. Процедура инъекций
- Обезболизывать эмбрионы в 1x Tricaine в течение 5 минут.
- С помощью пластиковой пипетки Pasteur перенесите небольшое количество (50 евро) анестезированых эмбрионов на агарозную пластину и аккуратно выровняйте их с помощью петли шпильки. Убедитесь в том, чтобы сохранить расстояние между эмбрионами, особенно между желтком одного и головой следующего(рисунок 4A).
ПРИМЕЧАНИЕ: Количество эмбрионов для выравнивания будет варьироваться в зависимости от уровня знаний исследователя, выполняя инъекции. Начните с нескольких (10-20 евро). Для схемы правильного позиционирования эмбрионов в пластине агар/агароза см. Рисунок 4A. - Убедитесь, что выровненные эмбрионы не высыхают в агарозной пластине, чтобы предотвратить смертность, тщательно добавляя 1-3 капли раствора 1x Tricaine к пластине.
- Слегка коснитесь микроцентрифугной трубки, чтобы повторно использовать клетки. Перегрузить инъекционной иглы с клеточной подвеской с помощью микрозагрузчика отзыв избегая пузырьков воздуха, так как они могут поставить под угрозу целостность эмбрионов.
- Откройте клапан давления воздуха (40 пси), установите микроинъектор и аккуратно поместите микроинъекцию иглы в держатель.
ПРИМЕЧАНИЕ: Используйте следующие рекомендуемые настройки микроинъектора: Удерживайте давление - вентиляционное отверстие (3 psi); Давление выброса - вентиляционное; Диапазон - 100 мс. - Вырезать микроинъекции иглы близко к кончику с Dumont типсы #5 или аналогичные под стереомикроскопом.
ПРИМЕЧАНИЕ: Кончик должен быть тупым и достаточно тонким, чтобы клетки проходят без засорения, а также, чтобы избежать повреждения эмбрионов и потери клеток. Толстый микроинъекции иглы кончик будет травмировать эмбрион и способствовать образованию отеков или зебры смерти. Graticule не используется для калибровки иглы. Подробнее об этом можно найти в обсуждении. - Перед введением эмбрионов, проверить давление микроинжектора, начиная с самого низкого давления выброса до тех пор, пока в 1-3 импульсов объем похож на размер глаза эмбриона зебры достигается.
ПРИМЕЧАНИЕ: Рекомендуется использовать стереомикроскоп флуоресценции, когда это возможно в начале тренировки. Это позволит упростить идентификацию клеток с флуоресцентной маркировкой. - Тщательно прокалывайте в середине желтка эмбриона, опуская угол иглы и осторожно нажимайте, пока кончик иглы не достигнет перивителлина пространства (PVS)(рисунок 4B-D).
- Нажмите на педаль микроинжектора и ввимите клетки в ПВХ. Используйте глаз эмбриона в качестве руководства. Попробуйте ввести объем клеток, похожий на размер глаза эмбриона и, насколько это возможно от сердца, чтобы предотвратить отек сердца.
- Аккуратно удалите иглу и переместите на следующий эмбрион.
- При необходимости отрегулируйте давление микроинъектора.
ПРИМЕЧАНИЕ: Клетки, как правило, начинают засоряться, поэтому давление может быть увеличено. При необходимости можно сократить капилляр (увеличить диаметр) при одновременном снижении давления. - Перенесите вводимые эмбрионы в чистую чашкуПетри (таблица 4)с раствором Tricaine 1x и оставьте их на 5-10 минут. Это даст время для раны, чтобы закрыть.
ПРИМЕЧАНИЕ: Для переноса эмбрионов из агарной пластины в чашку Петри добавьте несколько капель раствора Tricaine 1x поверх эмбрионов и тщательно соберите их с помощью пластиковой пипетки Pasteur. Бросьте собранные эмбрионы в новую чашку Петри с 1x Tricaine раствором. - Удалите раствор 1x Tricaine и добавьте свежий E3 средний.
- Инкубировать ксенотрансплантатов при температуре 34 градусов по Цельсию (скомпрометированная температура между выживанием человеческих клеточных линий и развитиемзебры 8).
6. Метастатический анализ
- Приблизительно в 1 час после инъекции (hpi), экран вводили эмбрионы на флуоресцентный стереомикроскоп и сортировать ксенотрансплантаторы в 2 группы, в зависимости от отсутствия (Рисунок 5A) или наличие (Рисунок 5B) клеток в обращении.
ПРИМЕЧАНИЕ: Даже если только одна раковая клетка обнаружена в сердце или циркуляции, включить эти ксенотрансплантаты в группу ксенотрансплантатов с клетками в обращении. Кроме того, клетки могут быть непосредственно введены в кровообращение, чтобы увеличить количество ксенотрансплантатов в этой группе.
7. 1 день после инъекции
- На флуоресцентном стереомикроскопе тщательно проанализируйте каждый эмбрион и выберите тех, у кого правильно вводили опухоли(рисунок 6).
ПРИМЕЧАНИЕ: При необходимости, анестезировать инъекционные эмбрионы с Tricaine 1X решение перед скринингом. - Отбросьте следующие эмбрионы/ксенотрансплантаты(рисунок 6A-A'':
без опухоли/аномальной морфологии/мертвой,
с сердечным и/или желткным отеком,
с опухолевыми клетками только в желтке,
с очень мало раковых клеток. - Сортировать выбранные ксенотранспланты в зависимости от размера опухоли. Используйте размер глаза для сравнения(рисунок 6B-B'', 6C).
Опухоли меньше, чем размер глаза (я),
Опухоли такого же размера, как глаз (я),
Опухоли больше, чем размер глаза (я). - Распределить ксенотранспланты в соответствии с желаемой экспериментальной компоновкой и начать анализ препарата (контроль против препарата и т.д.). Замените препараты и E3 средний ежедневно (Таблица 4).
- Инкубировать ксенотрансплантаты, поддерживая температуру 34 градусов по Цельсию до конца анализа.
8. 4 дня после инъекции
- В последний день анализа, анестезировать ксенотрансплантатов с 1x Tricaine раствор и тщательно выровнять их на агар пластины.
ПРИМЕЧАНИЕ: Отбросьте любые мертвые или опухшие ксенотрансплантаты. Лекарственное лечение и некоторые опухолевые клетки могут вызвать токсичность и в конечном итоге привести к ксенотрансплантатной смертности. Эти ксенотрансплантаты не считаются количественной оценкой. - Чтобы определить процент прививки: на флуоресцентном стереомикроскопе проанализируйте каждый живой ксенотрансплантат иоцените отсутствие (рисунок 6D) / наличие(рисунок 6E)опухолей в ПВЗ.

- Для определения процента метастазов: на флуоресцентном стереомикроскопе проанализируйте каждый ксенотрансплант и оцените наличие/отсутствие микрометастаса в хвостовой гематопоэтической ткани (CHT) из 2 ранее определенных групп (CIRC и NO CIRC, рисунок 6F)
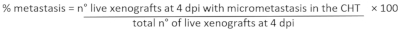
- В соответствии с экспериментальной создан, выберите ксенотрансплантаты интереса и усыплять их с 25x Tricaine (Таблица 3).
- Зафиксите их в 4% формальдегиде (FA) в течение по крайней мере 4 часов при комнатной температуре (RT) или на ночь при температуре 4 градусов по Цельсию.
ПРИМЕЧАНИЕ: Используйте формальдегид без метанола (16% FA), разбавленный при 4% в PBS/0.1% Triton. Заполните трубки доверху с фиксацией. Распоистите трубки горизонтально, чтобы обеспечить однородную фиксацию всех ксенотрансплантатов, повышая проницаемость и предотвращая агрегацию зебры внизу. - В качестве альтернативы их фиксатором с помощью PIPES (за 1 мл: 100 л соли натрия 1 M PIPES (4 МКС); 1 л 1 МГСО4 (RT); 4 л 0,5 М ЭГТА (РТ); 93,7 л 16% ФА (RT); 801,3 МЛДДХ 2OdH).
ПРИМЕЧАНИЕ: PIPES сохраняет флуоресценцию трансгенных линий RFP и mCherry лучше, чем 4% FA. - Если иммуностимулятор будет выполнен в другой день, замените ФА на 100% метанол (MetOH). Ксенотрансплантаты, зафиксированные в 100% метаноле, могут храниться при -20 градусов по Цельсию на неопределенный срок.
ПРИМЕЧАНИЕ: MetOH может ухудшить эффективность некоторых окрашивания (т.е. фаллоидин) и утолить некоторые флуоресцентные маркировки. Подтвердите эффективность антител в фиксированных образцах MetOH заранее.
9. Целый монтировать иммуностимулятор для конфокальных изображений
ПРИМЕЧАНИЕ: Вся техника иммунофлюоресценции монтирует занимает 3 дня, разделенных следующим образом: первый день для проницаемость ксенотрансплантата и первичного инкубации антител. Второй день для мытья и вторичной инкубации антител и третий день для мытья, фиксации ксенотрансплантата и хранения в монтажных средствах.
- День 1
- Если ксенотранспланты хранились в 100% MetOH, регидратировать их серией снижения концентраций MetOH (75%, 50%, 25% MetOH разбавленных в PBS/0.1% Тритон). Если зафиксировано в FA, замените его PBS/0.1% Triton.
- Вымойте 4x в течение 5 минут в PBS/0.1% Тритон.
- Вымойте 1x в течение 5 минут в H2O.
ПРИМЕЧАНИЕ: Трубы должны быть расположены горизонтально всегда в фиксации, протеабилизации и стирки шаги, если не указано иное. - Замените H2O на ледяной ацетон и инкубировать при -20 градусов по Цельсию в течение 7 минут.
ПРИМЕЧАНИЕ: Поместите трубку 50 мл с ацетоном при -20 градусов по Цельсию, чтобы она была готова к использованию. Микроцентрифуговые трубки должны распоигаться вертикально на стойке, чтобы ацетон не вытекал. - Вымойте 2x в течение 10 минут в PBS/0.1%Triton.
- Инкубировать с PBDX_GS блокирующий раствор для 1 ч на RT (PBDX_GS блокирующий буфер: 50 мл 1x PBS; 0,5 г бычьего альбумин сыворотки - BSA; 0,5 мл DMSO; 250 йл 10% Тритон; 750 йл козьей сыворотки - GS (15 йл/1 мл)).
- Удалите PBDX_GS и добавьте 40 мл первичного разбавления антител (обычно 1:100).
ПРИМЕЧАНИЕ: Объем первичного разбавления антител варьируется в зависимости от количества ксенотрансплантатов, присутствующих в микроцентрифуге трубки. Убедитесь, что все ксенотранспланты погружены. - Инкубировать в течение 1 часа на RT, а затем при 4 градусов по Цельсию на ночь. Позиционые трубки вертикально.
- День 2
- Удалить первичные антитела и мыть 2x в течение 10 минут в PBS/0.1% Тритон.
- Вымойте 4x в течение 30 мин в PBS/0.05% Tween.
ПРИМЕЧАНИЕ: Следующие шаги должны быть выполнены в темноте (использовать алюминиевую фольгу для защиты труб от света). - Удалите PBS/0.05% Tween и добавьте 50-100 мкл вторичного разбавления антител (обычно 1:200 - 1:400) и DAPI (50 мкг/мл), разбавленного в PBDX_GS.
- Инкубировать в течение 1 часа на RT, а затем при 4 градусов по Цельсию на ночь. Позиция труб вертикально и защитить от света.
- День 3 (использовать алюминиевую фольгу для защиты труб от света)
- Удалить вторичное разбавление антител и мыть 4x в течение 15 минут в PBS/0.05% Tween.
- Исправить при комнатной температуре в течение 20 минут в 4% FA.
- Вымойте 1x в течение 5 минут в PBS/0.05% Tween.
- Удалите PBS/0.05% Tween и добавьте 1 каплю акальной крепления среды к каждой микроцентрифуге трубки. Распоить трубки вертикально.
- Гора или хранить при 4 градусов по Цельсию защищены от света до монтажа. Распоить трубки вертикально.
10. Монтаж ксенотрансплантатов
ПРИМЕЧАНИЕ: Защитите микроцентрифуговые трубки от света на протяжении всего процесса. Ксенотрансплантаты зебры устанавливаются между 2 крышками (24 х 60 мм и 1,5). Это позволяет переворачивать установленные ксенотрансплантаты во время конфокальных изображений, чтобы обе стороны опухоли (вверху и снизу) были доступны. Не используйте пластиковые пипетки с монтажной средой - ксенотранспланты могут попасть в пипетки. См. Рисунок 7 для схематического представления следующих шагов.
- Этикетка coverslip Y и печать края крышки X с вазелин или силиконовый жир, чтобы избежать утечки монтажа средств массовой информации.
- Перенесите ксенотранспланты со стеклянной пипеткой Pasteur на крышку X.
- Аккуратно выровняйте их с помощью шпильки и удалите излишки аквеяющих монтажных средств.
- Добавить aqueous монтажа средств массовой информации для coverslip Y.
- Тщательно поместите крышку Y поверх крышки X. Не нажимать крышки, как это потенциально может нарушить ксенотрансплантатов.
- Поместите собранные крышки поверх слайда микроскопа и закрепите их прозрачной клейкой лентой. Это позволяет упростить манипуляции для конфокальных изображений и хранения.
11. Конфокальные изображения
ПРИМЕЧАНИЕ: Апохроматическое 25x погружение объектив с коррекцией воды является оптимальным для визуализации опухолей ПВХ с разрешением одной клетки (см. рисунок 8C-C " и рисунок 9A для примеров).
- Приобретайте образцы с помощью функции z-stack с интервалом в 5 мкм между каждым ломтиком. Для изображений, направленных на 3D реконструкцию, в частности сосудов, используйте интервал 1-3 мкм между ломтиками(рисунок 8A).
12. Анализ и количественная оценка
- Используйте программное обеспечение FIJI/ImageJ или аналогичное для обработки и анализа конфокальных изображений.
- Откройте необработанные данные (.czi, .lsm и т.д.) в программном обеспечении FIJI.
- Чтобы выбрать все или только один канал в композитном режиме, нажмите: Изображение > цвета > channels Tool.
- Чтобы настроить уровень яркости и контрастности, нажмите: Image > отрегулируйте > цветовой баланс.
- Для количественной оценки размера опухоли
- Выберите три репрезентативных ломтика опухоли, сверху, середине и снизу, на z-стек на ксенотрансплантат(рисунок 8 A).
ПРИМЕЧАНИЕ: Конфокальные разрешения достигает 60-70 мкм глубины опухоли. Если опухоль большая, то может оказаться невозможно изображение ее общего объема. - Откройте электронную таблицу, чтобы аннотировать данные.
- Подсчитайте все ядра DAPI, которые соответствуют опухолевым клеткам в 3 выбранных ломтиках(рисунок 8 A, B). Для этого:
- Откройте плагин счетчика ячейки от FIJI/ImageJ, нажав на плагины > анализ > сотовый счетчик.
- В инструменте счетчика ячеек нажмите Initialize,выберите тип счетчика и нажмите на изображение, чтобы начать режим подсчета вручную. Для каждого клика счетчик добавляет, сколько ячеек подсчитано (количество кликов).
- После подсчета одного полного среза сохраните номер ячейки в соответствующем документе Excel.
- Вернувшись на Фиджи, нажмите Сброс из окна Cell Counter, чтобы удалить информацию, если тот же счетчик будет использоваться. В противном случае, информация может быть сохранена, и другие счетчики могут быть использованы с другими ломтиками (или ячейками).
- Переместите на второй репрезентативный срез и повторите предыдущие шаги. Соберите все данные.
ПРИМЕЧАНИЕ: DAPI counterstaining обычно используется для подсчета номеров клеток из-за четкого определения отдельных клеток, однако, другие клетки конкретного окрашивания могут быть использованы.
- Для получения общего количества клеток в опухоли используйте следующую формулу:
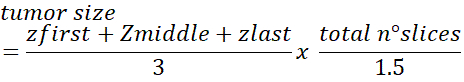
ПРИМЕЧАНИЕ: Число коррекции 1,5 было оценено для ячеек, которые имеют средний диаметр ядра 10-12 мкм. Эта коррекция может потребовать корректировки, если ячейки больше/меньше. Более подробную информацию об этом методе можно узнать в dicussion.
- Выберите три репрезентативных ломтика опухоли, сверху, середине и снизу, на z-стек на ксенотрансплантат(рисунок 8 A).
- Для количественной оценки других маркеров (иммунные клетки, митотические фигуры, PPH3, активированный Caspase3, Ki67 и т.д.), количественно все ломтики с использованием одного и того же плагина (см. рисунок 8C-C'' для митотических фигур визуализации). Разделите общее количество подсчитанных клеток на соответствующий размер опухоли и умножьте на 100, чтобы получить процент.
ПРИМЕЧАНИЕ: Остерегайтесь, что некоторые ячейки будут расположены между двумя ломтиками, идти вперед и назад в z-стек, чтобы убедиться, что одна ячейка не считается в два раза.
Результаты
Ксенотрансплантат зебры как инструмент для изучения противоопухоковой терапии.
Линия колоректальных раковых клеток HCT116 была помечена CM-DiI и введена в PVS 2-дней после оплодотворения (dpf) эмбрионов. После инъекции ксенотрансплантаты инкубировали при температуре 34 градусов по Цельсию, что позволяет рост опухолевых клеток без ущерба для развития зебры. На следующий день, ксенотранспланты были проверены в зависимости от наличия или отсутствия опухолевой массы в ПВХ (не правильно вводили зебры были отброшены и усыпаны) (Рисунок 6A-A''). Ксенотранспланты были сгруппированы в зависимостиот размера опухоли (рисунок 6B-B')и случайным образом распределены (в 6-хорошо пластины: 12 ксенотрансплантов на колодец) в необработаемых контролях и FOLFIRI химиотерапии (0,18 мМ Фолиновой кислоты, 0,08 мМ Иронотекан и 4,2 мМ фторурацил (5-FU)).
Контроль E3 и наркотики были заменены ежедневно, и мертвые зебры отбрасываются. 4 dpi, и три дня после лечения (dpt), engraftment был количественно, как в шаге 8.2 протокола. Engraftment считается частота ксенотрансплантатов, которые представляют емку опухоли в ПВХ на 4 dpi. Например, если в конце эксперимента в ПВХ 40 живых личинок и 35 из 40 присутствуют опухоли, то уровень присвещания составляет 87,5%. Ксенотранспланты были усыплены и зафиксированы для оценки размера опухоли и апоптоза с помощью иммунофлуоресценции и конфокальные микроскопии.
Иммунофлюоресценция была выполнена для обнаружения апоптотических клеток, используя анти-расщепленные антитела Каспаса 3 (Asp175) (кролик, 1:100, #CST 9661) и DAPI (50 мкг/мл) для противопояснения ядер. Наборы данных стека изображений (каждые 5um) были приобретены в конфокальце LSM710 и анализе данных, выполненной с помощью программного обеспечения FIJI/ImageJ, как это объясняется в шаге 12. Количественная оценка митотического индекса, апоптоза (% активированного Caspase3) и размера опухоли, выяснилось, что FOLFIRI вызывает значительное снижение митоза (Mann Whitney Test, P<0.0001) и значительное индукции апоптоза (тест Манн Уитни, P<0.0001), сопровождается 54% уменьшение размера опухоли (P<0.001) (Рисунок 8C-E, Рисунок 9A-E).
Эти функции полезны в высокой пропускной способности фенотипических экранов наркотиков, а также для проверки клеток внутренних и физиологических эффектов нескольких методов лечения рака в короткие сроки.
Характеристика ксенотрансплантатов человека-зебры с человеческими антителами
Как и во всех моделях ксенотрансплантата, существует риск неправильной идентификации клеток. Например, макрофаги могут фагоцитозы раковых клеток человека, становится помечены липофильной красителя, а затем путешествовать по зебрафиш хозяина и, таким образом, эти клетки могут быть ошибочно приняты за микрометастаз опухоли. Таким образом, маркировка ксенотрансплантатов с конкретными человеческими антителами, такими как HLA человека, ки-67 или митохондрии человека (hMITO) имеет решающее значение для первоначальной характеристики, а также познакомиться с морфологией опухолевых клеток(рисунок 9F-I).
Ксенотрансплантат зебры для изучения взаимодействия клеток и клеток.
Еще одним большим преимуществом модели ксенотрансплантата зебры является то, что можно изучить взаимодействия различных опухолевых клеток и проанализировать, как каждый тип клетки может влиять на поведение другого. Различные раковые клетки человека (различные клоны из одной и той же опухоли или из разных опухолей) могут быть совместно введены. В этом примере две клеточные линии CRC, полученные от одного и того же пациента, были помечены различными липофильными красителями и смешаны в соотношении 1:1 для инъекций(рисунок 9J-K').
При смешивании линий клеток человека (для генерации поликлональных опухолей) на том же трансплантате, избегайте использования красителя DiO, так как это приводит к неспецифическому двойному окрашиваниям(таблица 2). Вместо этого используйте, например, CM-DiI (клеточная линия No1) с зеленым CMFDA (клеточная линия No2), или CM-DiI (клеточная линия No1) с deep red (клеточнаялиния No2) (таблица 2, рисунок 9J-K'),чтобы получить легкую дискриминацию населения в конце эксперимента. Для количественной оценки частоты каждого клона в опухоли, используйте 2 различных типа счетчика в FIJI для идентификации каждого клона, а затем разделить на общее число клеток (сумма всех клонов), чтобы получить относительную долю каждого из них (%).
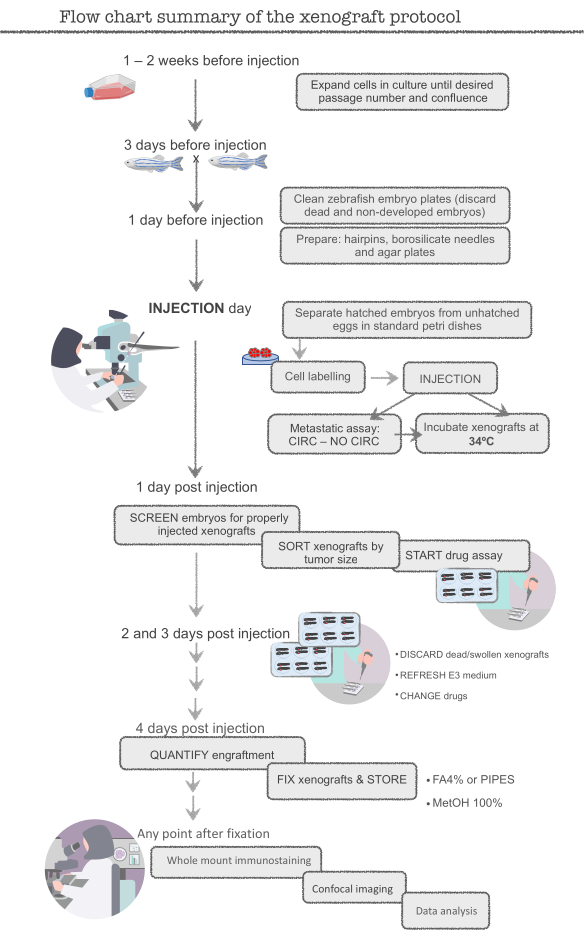
Рисунок 1. Поток диаграммы резюме протокола ксенотрансплантата зебры Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
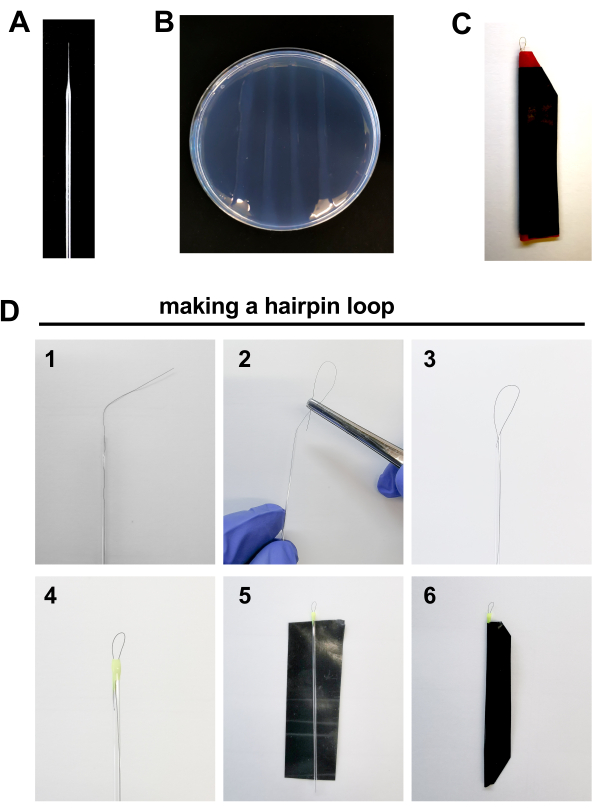
Рисунок 2. Материалы для инъекции эмбриона зебры: А. Боросиликатная игла В. 2% агарозная тарелка. C Петля шпильки D. Шаги, чтобы сделать петлю шпильки: 1. Место 1 волосы внутри стеклянной капиллярной трубки оставляя около 1 сантиметра волос за пределами трубки. 2-3. Завясть внешнюю кончик волос с помощью миппов в стеклянную капиллярную трубку, образуя петлю длиной 0,5 мм. 4. Печать края капиллярной трубки с каплей лака для ногтей. 5-6. Печать кусок электрической ленты вокруг капилляра, чтобы защитить его от разрушения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
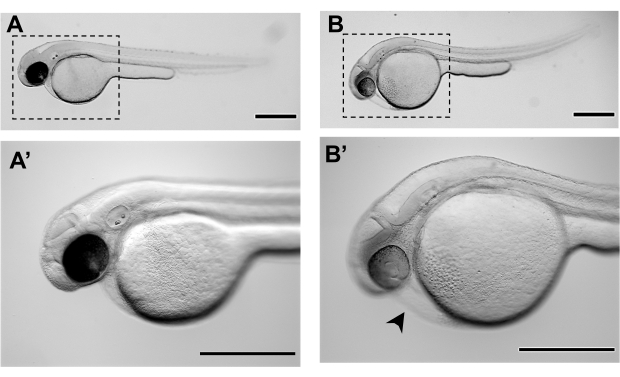
Рисунок 3. Представитель стереомикроскоп изображения эмбрионов зебры на 48 часов после оплодотворения (48 л.с.): A-A'. Нормальная морфология эмбриона зебры на уровне 48 л.с. развития, готовая к микроинъекции B-B'. Морфология эмбриона зебры, которая не достигла адекватной стадии развития микроинъекций при 48 л.с. и представляет уже некоторую степень сердечного отека (черная наконечник стрелы) и разтянутого желтка. A' и B' являются увеличениями A и B соответственно. Шкала баров составляет 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4. Схематическое представление микроинъекции зебры: А. Выравнивание анестезирования эмбрионов в 3% агарозной пластине Агар/2%. Б. Графическое изображение 2 дней после оплодотворения эмбриона зебры, с черной стрелкой, указывающей на перивителлин пространства (PVS). C и D. Раковые клетки могут быть введены под разными углами в ПВХ, введенные в перивильное пространство (PVS) 48-часового эмбриона после оплодотворения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
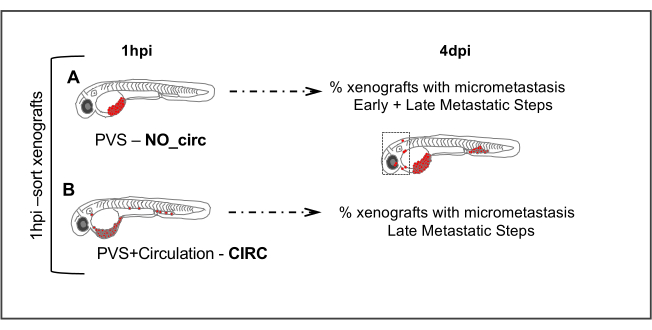
Рисунок 5. Метастатический анализ. 1 час после инъекции (1hpi) вводили эмбрионы сортируются в зависимости от отсутствия (NO_circ) или наличие (CIRC) опухолевых клеток в обращении. При 4 днях после инъекции количественно измеряется количество ксенотрансплантатов в обеих группах, которые представляют микрометастаз. Клетки в группеNO_circ (A) должны были пройти все метастатические шаги, чтобы иметь возможность формировать микрометастаз, в то время как клетки в группе CIRC(B) проходят только последние шаги метастатического каскада. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
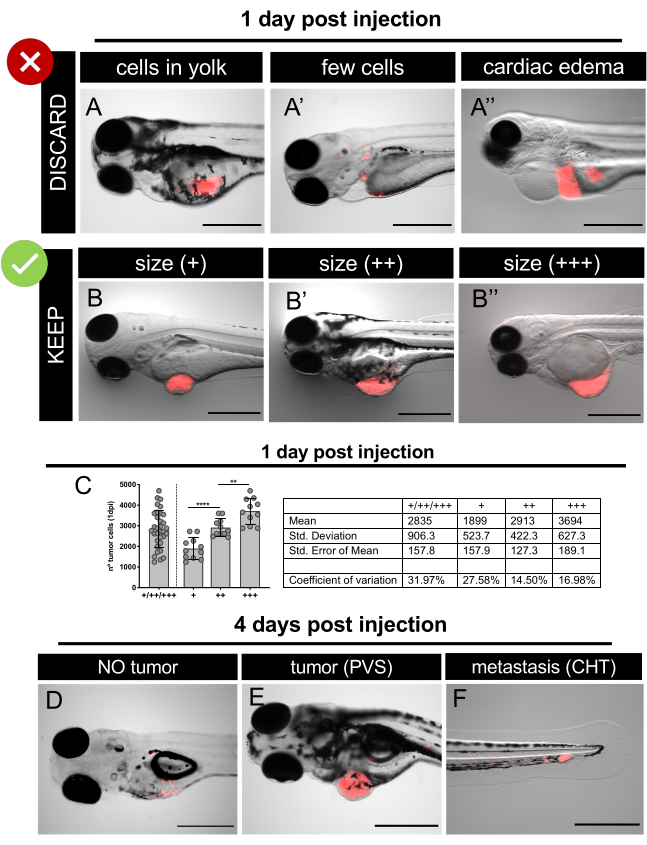
Рисунок 6. Представитель флуоресцентных стереомикроскоп изображения ксенотрансплантатов на 1 день после инъекции и 4 дней после инъекции. Раковые клетки человека, выражаюющие флуоресцентный белок TdTomato (красный), были микроинъектированы в 2 эмбриона зебры dpf. На 1 dpi, экран вводили эмбрионы и отказаться от плохо вводили те или эмбрионы с отеком (A-A'') сортировать хорошо вводили эмбрионы в соответствии с размерами опухоли (B-B ''. C. Репрезентативная количественная оценка общего количества клеток, присутствующих в различных категориях размера опухоли на 1 dpi в ксенотрансплантатах SW620. Каждая точка представляет собой ксенотрансплантат количественно, как объясняется в разделе 12.At 4 dpi, экран личинок и количественно различных классов: нетопухоли( D ); с опухолью в PVS (E) и с микрометастазом в CHT (F). Шкала баров составляет 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
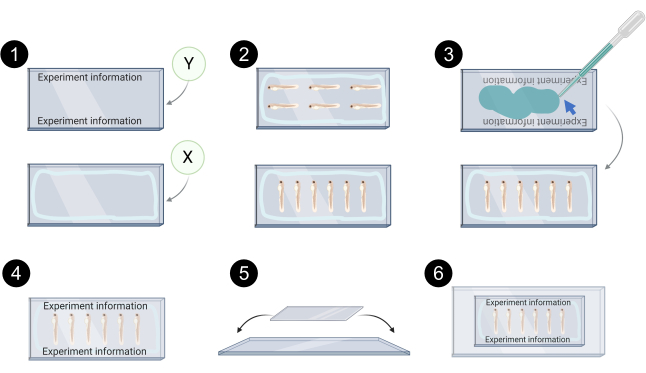
Рисунок 7. Схематичное представление ксенотрансплантата для конфокального изображения. 1. Пример маркировки в крышке Y, светло-голубая линия в coverslip X представляет периметр, в котором вазелин / силиконовая смазка применяется для предотвращения утечки монтажа средств массовой информации. 2. Примеры выравнивания ксенотрансплантата на крышке X для конфокальных изображений. 3. Aqueous монтажа средств массовой информации (голубая стрелка) используется для связывания coverslip Y на вершине coverslip X. 4. Пример правильно смонтированных обложек. 5. Крышки затем помещаются поверх стеклянной горки и закреплены прозрачной лентой. 6. Конные ксенотрансплантаты готовы к конфокальные изображения. Созданный с BioRender.com Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
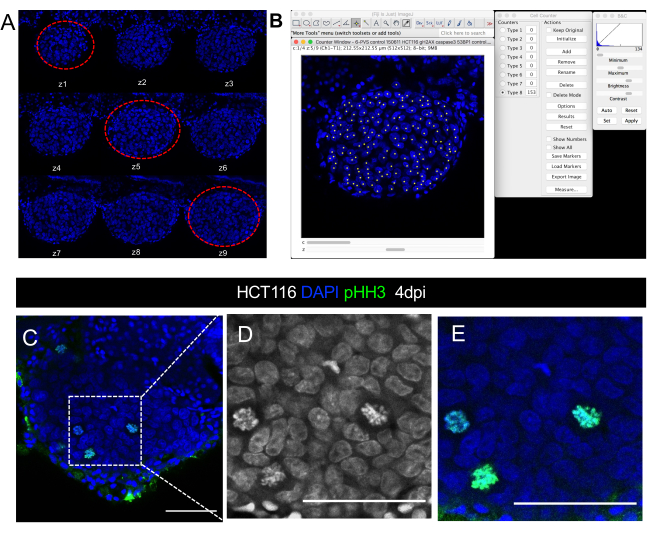
Рисунок 8. Визуальное представление изображения конфокального микроскопа, количественного размера опухоли. Конфокальные изображения ксенотрансплантата HCT116 в течение 4 дней после инъекции А. Серия срезов z-stack в канале DAPI, приобретенных с интервалом в 5 мкм. Красные пунктирной линии окружают три репрезентативных среза, используемых для подсчета ячеев. Б. Иллюстрация ядра DAPI количественно с помощью плагина Cell Counter в программном обеспечении ImageJ/Fiji. C-E. Пример разрешения одной клетки в опухоли, в которой можно визуализировать / количественно митотические цифры в DAPI или с помощью фосфо-гистона H3 антитела (зеленый). D и E являются увеличением C. Шкала баров составляет 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
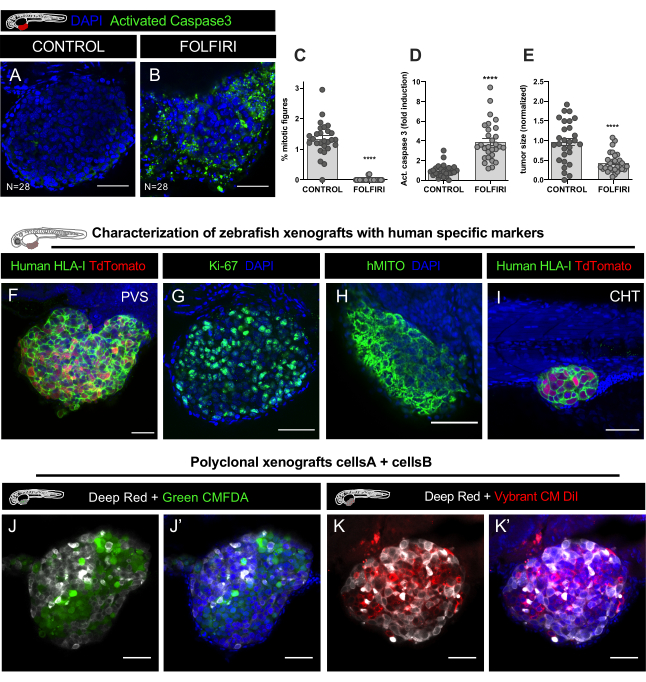
Рисунок 9. Результаты представительов. А-Е. Линия колоректальных раковых клеток HCT116 была помечена выбрантом CM-DiI и введена в ПВХ эмбрионов после оплодотворения (dpf). После инъекции ксенотрансплантаты инкубировали при 34 градусах Цельсия. На 1 dpi, ксенотрансплантанты были проверены и случайным образом распределены в необработаемых элементов управления и FOLFIRI, лечение в течение 3 дней подряд и фиксированной на 4 dpi. .Иммунофторесценция была выполнена для обнаружения апоптотических клеток, используя антитела к каспазе 3 и DAPI для противопояснения ядер. Количественная оценка митотического индекса C, апоптоза (% активированного Caspase3) D, и размер опухоли E, показал, что FOLFIRI вызывает значительное снижение митоза (Манн Уитни тест, P<0.0001) и значительное индукции апоптоза (Манн Уитни тест, P<0.0001), сопровождается 54% уменьшение размера опухоли (P<0.001). Количество анализируемых ксенотрансплантатов указывается на рисунке, и каждая точка представляет собой один ксенотрансплантат. Ф-Х. Представитель изображения колоректального рака ксенотрансплантатов на 4 дней после инъекции помечены человека конкретных маркеров в зеленом (человеческий HLA, ki67 и hMITO) в PVS и CHT I. Джей-Джей. Конфокальные изображения поликлональных ксенотрансплантатов, введенных с двумя различными человеческими колоректальными линиями раковых клеток, помеченных липофильными окрашиваниями CellTracker Deep Red (Cy5 - белый), CellTracker Green CMFDA (488 - зеленый) и DAPI противопоявление. К-К.. Конфокальные изображения двух различных человеческих колоректальных линий раковых клеток, помеченных липофильным окрашиванием CellTracker Deep Red (Cy5 - белый), Vybrant CM DiI (594 - красный) и DAPI противопоявление. Шкала баров составляет 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Сотовая линия | ткань | вид | морфология | Режим роста | Идеальное слияние для инъекций | Диссоциирующий агент для инъекций | Время диссоциации | Протокол маркировки | Среда инъекций | Разделите общее количество клеток на (для достижения идеальной концентрации для инъекций) | |||||||
| SW480 | Колоректальная аденокарцинома (первичная) | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 2 мМ | 5 минут | фляга | PBS 1x | 0,25 | |||||||
| SW620 | Колоректальная аденокарцинома (метастазы) | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 2 мМ | 5 минут | фляга | PBS 1x | 0,25 | |||||||
| HCT116 | Колоректальная карцинома (первичная), Красный мутант | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 2 мМ | 5 минут | фляга | PBS 1x | 0,25 | |||||||
| HKE3 | Колоректальная карцинома, Крас WT | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 2 мМ | 5 минут | фляга | PBS 1x | 0,25 | |||||||
| HT-29 | Колоректальная аденокарцинома (первичная) | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 2 мМ | 5 минут | фляга | PBS 1x | 0,2 | |||||||
| КАКО-2 | Колоректальная аденокарцинома (первичная) | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 1 мМ | 5 минут | 1,5 мл микроцентрифуг трубки | Полная среда | 0,25 | |||||||
| MCF-7 | Аденокарцинома молочной железы (метастазы) | человеческий | эпителиальный | приверженец | 70% - 80 % | PBS/EDTA 1 мМ | 5 минут | 1,5 мл микроцентрифуг трубки | 60% FBS и 40% полная среда | 0,5 | |||||||
| Hs578T | Карцинома молочной железы (первичная) | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 1 мМ | 2 минуты | 1,5 мл микроцентрифуг трубки | 60% FBS и 40% полная среда | 0,5 | |||||||
| MDA-MB-468 | Аденокарцинома молочной железы (метастазы) | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 1 мМ | 8 минут | 1,5 мл микроцентрифуг трубки | 60% FBS и 40% полная среда | 0,5 | |||||||
| МДА-МБ-231 | Аденокарцинома молочной железы (метастазы) | человеческий | эпителиальный | приверженец | 70% - 75 % | PBS/EDTA 1 мМ | 5 минут | 1,5 мл микроцентрифуг трубки | Полная среда | 0,5 | |||||||
| RT112 | Рак переходных клеток мочевого пузыря (первичный) | человеческий | эпителиальный | приверженец | 85% - 90% | Трипле | 6 минут и сотовый скреппер | 1,5 мл микроцентрифуг трубки | Полная среда | 0,5 | |||||||
| BFTC905 | Рак переходных клеток мочевого пузыря (первичный) | человеческий | эпителиальный | приверженец | 75% - 85% | Трипле | 10 минут | 1,5 мл микроцентрифуг трубки | 80% полная среда - 20% PBS/EDTA 2 мМ | 0,5 | |||||||
| J82 | Рак переходных клеток мочевого пузыря (первичный) | человеческий | эпителиальный | приверженец | 85% - 90% | Трипле | 10 минут | 1,5 мл микроцентрифуг трубки | Полная среда | 0,5 | |||||||
| RT4 | Рак переходных клеток мочевого пузыря (первичный) | человеческий | эпителиальный | приверженец | 85% - 90% | Трипле | 6 минут | 1,5 мл микроцентрифуг трубки | Полная среда | 0,5 | |||||||
| МИА Пака-2 | Эпителиоз поджелудочной железы (первичный) | человеческий | эпителиальный | приверженец | 80% - 90% | Трипле | 3 минуты | 1,5 мл микроцентрифуг трубки | 60% FBS и 40% полная среда | 0,5 | |||||||
| ПАНК-1 | Эпителиоз поджелудочной железы (первичный) | человеческий | эпителиальный | приверженец | 80% | Трипле | 5 минут | 1,5 мл микроцентрифуг трубки | PBS/EDTA 2mM | 0,5 | |||||||
| VC8 | Фибробласты легких, мутант BRCA2, HR-дефицит | Китайский хомяк | эпителиальный | приверженец | 70% - 80 % | PBS/EDTA 1 мМ | 5 минут | 1,5 мл микроцентрифуг трубки | Полная среда | 0,25 | |||||||
| VC8-B2 | Фибробласты легких, человеческий BRCA2, BRCA2 | Китайский хомяк | эпителиальный | приверженец | 70% - 80 % | PBS/EDTA 1 мМ | 5 минут | 1,5 мл микроцентрифуг трубки | Полная среда | 0,25 | |||||||
Таблица 1: Оптимальное слияние in vitro для инъекций нескольких клеточных линий
| Клеточный краситель | Номер каталога | Спектр флуоресценции (Exc. - Em.) | Разбавление запасов | Рабочее разбавление для окрашивания в колбе | Рабочее разбавление для окрашивания в микроцентрифуг 1,5 мл | Время инкубации | Наблюдения | ||||||
| Выбрант СМ-ДиИ | V22888 | 549 нм - 569 нм | Уже разбавленный | 4:1000 в PBS 1x | 4:1000 в PBS 1x | 15 мин. 37 oC 4 мин. | |||||||
| Выбрант ДиО | V22886 | 484 нм - 501 нм | Уже разбавленный | 5:1000 в PBS 1x | 5:1000 в PBS 1x | 15 мин. 37 oC 4 мин. | Не очень хорошее разрешение в конфокальных изображений на 4 дней после инъекции | ||||||
| Сотовый трекер Deep Red | C34565 | 630 нм - 660 нм | 1 мМм в ДМСО | 0,5 - 2,5 МКМ в PBS 1x | 0,5 - 2,5 МКМ в PBS 1x | 15 мин. 37 oC | |||||||
| Сотовый трекер Зеленый CMFDA | C7025 | 492 нм - 517 нм | 10 мМ в ДМСО | 0,5 - 2,5 МКМ в PBS 1x | 0,5 - 2,5 МКМ в PBS 1x | 15 мин. 37 oC | Утечка продукта в брюшную полость 48 часов после инъекции, но идеально подходит для совместного исследования инъекций | ||||||
Таблица 2: Краситель и условия
| размер | - личинок | E3 1x средний объем |
| 100 мм x 15 мм (стандарт) | До 50 | 20-25 мл |
| 60 мм x 15 мм | До 20 | 10 мл |
| 6-хорошо пластины | До 15 на колодец | 3-4 мл на колодец |
Таблица 3: Варианты чашек Петри
| E3 средний 50x - акции | На 10 литров стерильной воды: |
| 146,9 г NaCl | |
| 6,3 г KCl | |
| 24,3 г CaCl2х 2H2O | |
| 40,7 г MgSO4 х7H2O | |
| E3 средний 1x - готов к использованию | 400 мл E3 средний 50x |
| 60 мл 0,01% метиленовый синий раствор | |
| Заполните до 20 литров воды рыбной системы | |
| Tricaine 25x - акции и эвтаназия | 2 г порошка Tricaine |
| 500 мл воды обратного осмоса | |
| 10 мл 1 М Трис (рН 9) | |
| Отрегулируйте до рН 7 | |
| Трикаин 1x - Анестезия | 20 мл Tricaine 25x |
| Заполните до 500 мл системной воды | |
| 60 мг/мл Проназэ - бульон 100x | 1 г проназ |
| 16,7 мл стерильной воды | |
| 0,6 мг/мл Проназэ - 1x готов к использованию | 100 йл проназ 100x |
| 9,9 мл E3 среднего 1x |
Таблица 4: Композиции решений
Обсуждение
Растущее значение зебры в качестве модели для развития рака и скрининга наркотиков привело к многочисленнымпубликациям 3,4,7,13,14,16,18,19,20,21. Тем не менее, инъекция раковых клеток в эмбрионы зебры является метод, который требует высокого уровня ловкости, которая может быть сложной задачей для исследователей. В этом протоколе мы стремимся предоставить практическую информацию и некоторые советы, которые могут помочь преодолеть первоначальные проблемы создания ксенотрансплантатов эмбрионов зебры.
Обработка клеток до инъекций
Этот оптимизированный протокол для генерации ксенотрансплантатов зебры с клеточными линиями может быть адаптирован к различным типам (раковых) клеток с различными морфологиями. Мы рекомендуем, чтобы все клеточные линии, используемые для ксенотрансплантатов зебры, не являются микоплазмой. В отличие от других бактериальных загрязнений, наличие микоплазмы в клеточной культуре не генерирует изменений, которые можно легко обнаружить под микроскопом22. Загрязнение микоплазмой может повлиять на потенциал присвящания клеточных линий, их чувствительность к препаратам, а также жизнеспособность эмбрионов зебры.
Хотя клетки могут продолжать размножаться в течение длительного периода времени, их фенотип и генотип могут быть подвержены изменениям. Важно ознакомиться с морфологией и поведением клеточных линий в культуре. Мы рекомендуем сохранить количество проходов клеток после оттаивания между 3-12, чтобы получить воспроизводимые результаты. Таким образом, необходимо проводить регулярные микоплазма-тесты.
Клетки должны быть на стадии регистрации (экспоненциальная фаза роста до достижения слияния 70%) в день инъекции. Это позволит адекватное привещание и надлежащее развитие отличительных признаков опухоли. Для предотвращения изменения фенотипа клеток в ксенотрансплантате, крайне важно поддерживать слияние для инъекций постоянной между экспериментами. Количество инъекционных клеток может быть адаптировано к характеристикам каждой клеточной линии, так как некоторые из них могут потребовать более высокой плотности инъекций, чтобы процветать в эмбрионах зебры.
Соображения маркировки ячеей
Чтобы лучше визуализировать опухолевые клетки человека для инъекций и будущего анализа, опухолевые клетки могут быть помечены флуоресцентными красителями. Из-за различий в размерах клеток, общее количество клеток/см 2 вкультурах адептов варьируется между клеточными линиями. Это повлияет на эффективность протокола окрашивания, а также количество клеток, собранных для инъекций. Большие ячейки, которые дают низкие цифры на колбу (т.е. Hs578T) или растут в кластерах (т.е. BFTC905) потребует объединения нескольких колб для одного эксперимента. В этом случае окрашивание клеток не должно проводиться непосредственно в колбе, так как это приведет к использованию чрезмерного количества красителя (высокая стоимость). С другой стороны, клетки, которые очень чувствительны к чрезмерным циклам центрифугации, а также те, которые дают большое количество на колбу (т.е. HCT116) могут быть окрашены непосредственно в колбе, а затем отделены от EDTA / cell скребок (Для получения дополнительной информации см. таблицу 1).
Всякий раз, когда это возможно, вместо того, чтобы использовать энзиматический подход, используйте ЭДТА, чтобы отделить клетки в день инъекции, так что клетки восстанавливают свои клеточно-клеточные соединения быстрее и подвергаются меньшей центрифугации шагов. Тем не менее, если клетки чувствительны к ЭДТА, очень привержены или растут в кластерах - можно применить энзиматический метод. Оптимизация идеальной концентрации для инъекций, а также среды инъекций зависит от характеристик каждой клеточной линии, поэтому может потребоваться некоторые корректировки(таблица 1).
Калибровка микроинъекции
Вопреки доставке олигонуклеотидов или препаратов в эмбрион зебры, гратикула не используется для калибровки иглы при работе с клеточными линиями для ксенотрансплантата. Через некоторое время во время инъекции клетки начнут закупоривания, и необходимо сократить кончик иглы, чтобы увеличить ее диаметр или изменить иглу вообще. Эта процедура препятствует калибровке решетки.
Для решения этой проблемы количество дозированных клеток регулируется давлением и временем выброса, необходимым для достижения размера, аналогичного глазу эмбриона в пределах 1-3 импульсов. Затем, для дальнейшего контроля размера опухоли, на 1 dpi, ксенотрансплантаты сортируются в соответствии с размером опухоли, как показано на рисунке 6 B-B ". Как по представлено в примере рисунка 6C, этот метод сортировки эффективен в снижении вариации размеров опухоли: если мы удвоим их все вместе (я, Кью, З) STEV является «двойным из класса » (906 клеток до 422 клеток), а изменение коэффициента составляет 31,9% по сравнению с 14,5% в классе. Поскольку ссылка на инъекцию является объемной, общее количество клеток сильно варьируется между типами клеток - зависит от размера и формы клеток. Например, большие клетки с большим количеством цитоплазмы, как рак молочной железы Hs578T, производят гораздо меньшие опухоли (600 клеток). Кроме того, каждая линия ячейки требует разного количества ячеек. Например, линии клеток рака мочевого пузыря HT29 CRC и RT112 показали, что чем выше количество вводимых клеток, тем выше смертность от зебры. Таким образом, период оптимизации при разработке ксенотрансплантата необходим для проверки, если линия клеток имеет токсическое воздействие на эмбрион или требует более высокой/нижней плотности инъекций.
Сайт инъекций
Одним из наиболее распространенных расхождений при генерации ксенотрансплантата зебры является место инъекции. Как правило, желток является местом выбора для инъекций из-за его легкой доступности. Тем не менее, мы заметили, что клетки, введенные в желток имеют более высокую тенденцию к смерти. Хотя технически сложнее, мы рекомендуем инъекционных ВИО и, насколько это возможно от сердца. В pvS, клетки могут агрегировать, набирать сосуды и иммунные клетки, и мигрировать, интравазат, экстравазат и образуют микрометастаз, если они отображаютметастатические характеристики 8,11.
Эффективность привязания
Различия в эффективности engraftment и размер опухоли среди клеточных линий на 4 dpi, как ожидается, из-за их различных степеней базально-клеточной смерти / выживания / распространения, но и из-за врожденной иммуногенности, что каждая линия клеток можетотображать 9.
метастаз
Метастаз состоит из многоступенчатого каскада событий, которые можно разделить на два произвольных этапа. На первом этапе опухолевые клетки должны отделяться от основного участка, мигрировать и вторгаться в соседние ткани, а затем интравазать в кровоток. На втором этапе опухолевые клетки должны выживать в циркуляции, экстравазать из крови или лимфатических сосудов, и, наконец, колонизировать на вторичныхучастках 23. Чтобы провести различие между этими ранними и поздними событиями и рассмотреть потенциал / знание различных опухолевых клеток для выполнения этих шагов, мы разработали простой анализ.
В целом, при введении в ПВХ опухолевые клетки могут входить непосредственно в кровообращение, а затем физически попасть в хвостовую гематопоэтическую ткань (CHT) (хвостовая область). Однако, в соответствии с характеристиками каждой опухолевой клетки - мы видели, что некоторые опухолевые клетки остаются на CHT 4 dpi и способны образовывать микрометастаз, в то время как другие опухолевые клетки исчезают (очищены после того, как попали в CHT).
Таким образом, сравнивая эффективность микрометастасиса (на 4 dpi), когда клетки были помещены непосредственно в циркуляцию - CIRC (клетки только должны пройти через поздние шаги метастазирования) против, когда нет - NO CIRC (клетки должны пройти через ранние и поздние шаги, чтобы иметь возможность сформировать микрометастаз) мы можем оценить их ранний или поздний метастатический потенциал. Мы наблюдали опухолевые клетки, которые могут эффективно формировать микрометастаз в CHT в обеих группах (CIRC и NO CIRC), предполагая, что эти клетки имеют возможность пройти все этапы метастатического каскада (SW480 и MDA-MB-468например) 8,11. В отличие от этого, другие опухолевые клетки имеют очень низкий метастатический потенциал в обеих группах, почти никогда не делая микрометастаза, даже при введении в циркуляцию (т.е. видимые в CHT на 24 л.с., но при 4 dpi они больше не существует, Hs578Tнапример) 8. Тем не менее, мы четко нашли другую группу - такую, которая способна формировать микрометастаз только при введении в циркуляцию (мы можем наблюдать только микрометастаз в группе CIRC). Это говорит о том, что эти клетки имеют низкую эффективность в выполнении первых шагов метастатического каскада, но с другой стороны, способны выжить в циркуляции, экстравазать и колонизировать отдаленный участок.
Иммуностиминг и визуализация
Перед фиксацией этот протокол инъекций может быть использован для других живых подходов к визуализации, таких как интерскопия контрастного дифференциального интерференции (DIC), вращающаяся микроскопия диска с высоким разрешением, живая конфокаленная визуализация и микроскопия светового листа и т.д.
Мертвые клетки и клеточный мусор появляются яркие при наблюдении через флуоресцентный стереомикроскоп и могут быть ошибочно приняты за живые клетки, особенно если целью исследования является оценка метастатического потенциала клеточных линий. Мы хотели бы подчеркнуть важность выполнения конфокальных изображений с конкретными маркерами жизнеспособности и DAPI для оценки состояния выживаемости опухоли и микрометастаса. Кроме того, важно использовать специфические человеческие антитела для обнаружения человеческих клеток, таких как анти-человеческие митохондрии или анти-человеческой HLA. При реализации протокола тренируйте глаза экспериментатора, сравнивая окрашивание в стереомикроскопе с конфокальные изображения. Через некоторое время экспериментаторы могут четко отличить мусор от живых клеток в флуоресцентном стереомикроскопе.
Хотя широко используются другие методы количественной оценки бремени опухоли, такие как целая флуоресценция, мы рекомендуем выполнять иммуностимментацию и конфоканую визуализацию в качестве более точного метода. Не только эффективность липофильных красителей окрашивания очень изменчива (т.е. некоторые клетки очень хорошо окрашены в то время как другие не -вероятно, из-за содержания липидов в их мембранах), но и много раз липофильные красители образуют агрегаты, и мертвые клетки, как правило, ярче - создание нескольких артефактов, которые могут быть ошибочно приняты за живые клетки.
Клетки могут быть трансуцированы флуоресцентными белками, чтобы помочь в их отслеживании и пропустить маркировку клеток. Однако убедитесь, что транс индуцированные и нетранспрививные клетки производят те же результаты в ксенотрансплантатах зебры.
Кроме того, макрофаги могут фагоцитов этих флуоресцентных клеточных мусора становится флуоресцентно помечены и мигрировать, генерации ложноположительных метастатических клеток. Таким образом, мы рекомендуем ряд аналитических инструментов, которые, конечно, могут быть распространены на многие другие считывания для более точной интерпретации поведения опухоли:
- Пролиферация - количественная оценка митотических фигур с помощью DAPI или антитела anti-pHH3Ser10 (Merck Millipore Cat. #06-570),
- Клеточная смерть от апоптоза- антитела антиактивного Caspase3Asp175 (Cell Signalling Technologies Cat. #9661) или эквивалент,
- Размер опухоли - DAPI подсчета опухолевых клеток человека показывают очень различные хроматин организации, поэтому они легко отличить от клеток зебры и всегда можно дважды проверить с красителем (когда вы тренируете глаза),
- Для метастатических исследований,чтобы однозначно обнаружить человеческие клетки, - анти-человеческого HLA (Abcam EP1395Y Cat. #ab52922), анти-человеческие митохондрии (Merck Millipore Cat. #MAB1273- Клон 113-1).
Для конфокального приобретения с интервалом в 5 мкм между ломтиками в стеке контрольных раковых клеток HCT116 (средний ядерный размер 10-12 мкм диаметра) с помощью счетчиков DAPI мы заметили, что 50% клеток делятся между двумя последовательными ломтиками. Поэтому, если каждый кусочек подсчитан, существует высокий риск подсчета одной и той же клетки дважды. Переход взад и вперед между ломтиками, чтобы избежать проблем в количественной оценке приводит к отовремени и подверженных ошибкам техники. Чтобы облегчить количественную оценку общего количества клеток и обеспечить более воспроизводимость между исследователями, мы создали формулу размера опухоли, ранее описанную в этомпротоколе 8.
Мы включили номер коррекции (1,5), чтобы учесть ячейки в размере 50%, которые делятся между ломтиками. Мы обнаружили, что средняя погрешность ручного подсчета всей опухоли между исследователями составила 20%. Два исследователя, использующие формулу, имели погрешность 2%. Использование этой формулы имеет 93% точность и 98% воспроизводимость. Мы также протестировали автоматизированные методы, но они продемонстрировали ошибку выше 50%, вызванную настройками порога.
Из-за особенностей апоптотических клеток, количественная оценка активированных клеток Caspase 3 сложнее. Чтобы уменьшить количество ошибок и вариаций в результатах, мы рекомендуем, чтобы контрольные и экспериментальные образцы были подсчитаны одним и тем же исследователем. Кроме того, при изучении этого метода, новый исследователь должен подсчитать изображения, которые уже были количественно более опытных исследователей для сравнения результатов и подготовки.
При необходимости продолжительность анализа может быть увеличена. Тем не менее, важно учитывать, что личинки зебры требуют живого кормления, начиная с 7 дней после оплодотворения (5 дней после инъекции). Кроме того, руководящие принципы и положения, применяемые к личинкам старше 6 дней после оплодотворения, могут варьироваться.
Этот протокол предоставляет полезные инструменты, позволяющие одному исследователю вводить примерно 200-300 личинок зебры в час; и результаты полного анализа, включая анализ и статистическое толкование, полученные за три недели. Мы надеемся, что этот протокол поможет исследователям стать экспертами в генерации ксенотрансплантатов зебры. Это не просто; Вы должны практиковать, но вы получите там. Удачи!
Раскрытие информации
никакой
Благодарности
Благодарим Фонд Шампалауда, Congento (LISBOA-01-0145-FEDER-022170, совместно финансируемый FCT/Lisboa2020) для финансирования. Стипендии FCT для вице-президента (SFRH/BD/118252/2016), MML (PD/BD/138203/2018). Все члены лаборатории Fior для критических обсуждений; Б. Коста и К. Ребелу де Алмейда для обмена данными; и члены нашей лаборатории К. Ребело де Алмейда, М. Баррозу и Л. Лейт за участие в видео. Мы хотели бы поблагодарить CF Рыбный фонд (C. Certal, J. Монтейру и др.) и Champalimaud связи, событий и информационно-пропагандистской команды, в частности Александр Azinheira за фантастический фильм решений и Катарина Рамос и Тереза Фернандес за их помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Agar for bacteriology | VWR | 97064-336 | Agar plate |
| anti-Caspase3Asp175 (Rabbit monoclonal) | Cell Signalling Technologies | 9661 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti-human HLA (Rabbit monoclonal) | Abcam EP1395Y | ab52922 | Primary antibody for whole mount immuno staining (Dilution 1:100) |
| anti- 488 (Rabbit monoclonal) | ThermoFisher Scientific | 35552 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| anti- 594 (Rabbit monoclonal) | ThermoFisher Scientific | 35560 | Secondary antibody for whole mount immuno staining (Dilution 1:200) |
| CellTracker Deep Red Dye | ThermoFisher Scientific | C34565 | Lipophilic dye (Dilution 1:1000) |
| CellTracker Green CMFDA Dye | ThermoFisher Scientific | C2925 | Lipophilic dye (Dilution 1:1000) |
| Conical Centrifuge tube 50mL | VWR | 525-0610 | |
| Conical Centrifuge tube 15mL | VWR | 525-0604 | |
| DAPI | Nuclear and chromosome counterstain | ||
| Laser-Based Micropipette Puller P-2000 | Sutter-Instrument | Micropipette Puller | |
| Microcentrifuge tube 1.5mL | Abdos | P10202 | |
| Microscope slides, cut edge | RS France | BPB016 | Slides for mounting |
| Mowiol | Sigma-Aldrich | 81381 | Mounting medium |
| Pneumatic Picopump | World Precision Instruments | PV820 | Microinjector |
| Rectangular cover glasses, Menzel Gläser | ThermoFisher Scientific | 631-9430 | Coverslips for mounting |
| SeaKem LE Agarose | Lonza | 50004 | Agar plate |
| Thin Wall Glass Capillaries | World Precision Instruments | TW100-4 | Borosilicate capillaries |
| TrypLE | Gibco | 12605036 | Enzymatic detachment solution |
| Vaseline | Petroleum jelly for slide sealing | ||
| Vybrant CM-DiI Dye | ThermoFisher Scientific | V22888 | Lipophilic dye (Dilution 1:1000) |
| Vybrant DiO Cell-Labeling Solution | ThermoFisher Scientific | V22886 | Lipophilic dye (Dilution 1:1000) |
| ZEISS Axio Zoom.V16 for Biology | ZEISS | Fluorescence Stereo Zoom Microscope | |
| Zeiss LSM 710 | ZEISS | Confocal microscope |
Ссылки
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiological Reviews. 97, 889-938 (2017).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. Journal of Clinical Investigation. 122, 2337-2343 (2012).
- Stoletov, K., Klemke, R. Catch of the day: zebrafish as a human cancer model. Oncogene. 27, 4509-4520 (2008).
- Weintraub, A. All eyes on zebrafish. Lab Animals. 46, 323-326 (2017).
- Novoa, B., Figueras, A., Lambris, J. D., Hajishengallis, G. Zebrafish: Model for the Study of Inflammation and the Innate Immune Response to Infectious Diseases. Current Topics in Innate Immunity II. , 253-275 (2012).
- Fazio, M., Ablain, J., Chuan, Y., Langenau, D. M., Zon, L. I. Zebrafish patient avatars in cancer biology and precision cancer therapy. Nature Reviews Cancer. 20, 263-273 (2020).
- Fior, R., et al. Single-cell functional and chemosensitive profiling of combinatorial colorectal therapy in zebrafish xenografts. Proceedings of the National Academy of Sciences of the United States of America. 114, 8234-8243 (2017).
- Póvoa, V., et al. Innate immune evasion revealed in a colorectal zebrafish xenograft model. Nature Communications. 12, 1156 (2021).
- Galletti, G., et al. Targeting Macrophages Sensitizes Chronic Lymphocytic Leukemia to Apoptosis and Inhibits Disease Progression. Cell Reports. 14, 1748-1760 (2016).
- Rebelo de Almeida, C., et al. Zebrafish xenografts as a fast screening platform for bevacizumab cancer therapy. Communications Biology. 3, 1-13 (2020).
- Varanda, A. B., Martins-Logrado, A., Godinho Ferreira, M., Fior, R. Zebrafish Xenografts Unveil Sensitivity to Olaparib beyond BRCA Status. Cancers. 12, 1769 (2020).
- Osmani, N., Goetz, J. G. Multiscale Imaging of Metastasis in Zebrafish. Trends in Cancer. 5, 766-778 (2019).
- Hyenne, V., et al. Studying the Fate of Tumor Extracellular Vesicles at High Spatiotemporal Resolution Using the Zebrafish Embryo. Developmental Cell. 48, 554-572 (2019).
- Costa, B., et al. Developments in zebrafish avatars as radiotherapy sensitivity reporters - towards personalized medicine. EBioMedicine. 51, 102578 (2020).
- Costa, B., Estrada, M. F., Mendes, R. V., Fior, R. Zebrafish Avatars towards Personalized Medicine-A Comparative Review between Avatar Models. Cells. 9, 293 (2020).
- TRICAINE - Protocols. ZFIN Community Wiki Available from: https://wiki.zfin.org/display/prot/TRICAINE (2021)
- Zhao, C., et al. A Novel Xenograft Model in Zebrafish for High-Resolution Investigating Dynamics of Neovascularization in Tumors. Plos One. , (2011).
- Veinotte, C. J., Dellaire, G., Berman, J. N. Hooking the big one: the potential of zebrafish xenotransplantation to reform cancer drug screening in the genomic era. Disease Models & Mechanisms. 7, 745-754 (2014).
- Haldi, M., Ton, C., Seng, W. L., McGrath, P. Human melanoma cells transplanted into zebrafish proliferate, migrate, produce melanin, form masses and stimulate angiogenesis in zebrafish. Angiogenesis. 9, 139-151 (2006).
- Zon, L. I., Peterson, R. The New Age of Chemical Screening in Zebrafish. Zebrafish. 7, 1 (2010).
- Mycoplasma Contamination of Cell Cultures. InvivoGen Available from: https://www.invivogen.com/review-mycoplasma (2016)
- van Zijl, F., Krupitza, G., Mikulits, W. Initial steps of metastasis: cell invasion and endothelial transmigration. Mutation Research. 728, 23-34 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены