A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل تتبع الجسيمات النانوية لتحديد كمي وحجم الحويصلات خارج الخلية
In This Article
Summary
نحن نبين كيفية استخدام أداة جديدة لتحليل تتبع الجسيمات النانوية لتقدير توزيع الحجم والتركيز الكلي للجسيمات الحويصلات خارج الخلية المعزولة عن الأنسجة الدهنية perigonadal الماوس والبلازما البشرية.
Abstract
أصبحت الأدوار الفسيولوجية والفيزيولوجية المرضية لل الحويصلات خارج الخلية (EVs) معترف بها بشكل متزايد ، مما يجعل مجال EV مجالا سريعا من مجالات البحث. هناك العديد من الطرق المختلفة لعزل EV ، ولكل منها مزايا وعيوب متميزة تؤثر على العائد النهائي ونقاء المركبات الكهربائية. وبالتالي، فإن توصيف الإعدادية EV معزولة عن مصدر معين من قبل طريقة مختارة مهم لتفسير نتائج المصب ومقارنة النتائج عبر المختبرات. توجد طرق مختلفة لتحديد حجم وكمية المركبات الكهربائية، والتي يمكن تغييرها من قبل حالات المرض أو استجابة للظروف الخارجية. تحليل تتبع الجسيمات النانوية (NTA) هي واحدة من التقنيات البارزة المستخدمة لتحليل الإنتاجية العالية للمركبات الكهربائية الفردية. هنا، نقدم بروتوكول مفصل للقياس الكمي وتحديد حجم المركبات الكهربائية المعزولة عن الأنسجة الدهنية perigonadal الماوس والبلازما البشرية باستخدام تكنولوجيا اختراق لNTA تمثل التقدم الكبير في هذا المجال. وتبين النتائج أن هذه الطريقة يمكن أن توفر تركيز الجسيمات الكلي القابل للاستنساخ والصالح وبيانات توزيع الحجم للمركبات الكهربائية المعزولة عن مصادر مختلفة باستخدام أساليب مختلفة، كما أكد ذلك المجهر الإلكتروني الإرسال. تكييف هذا الصك لNTA سوف تلبي الحاجة إلى توحيد في أساليب NTA لزيادة الدقة والتكرار في البحوث EV.
Introduction
الحويصلات خارج الخلية (EVs) صغيرة (0.03-2 ميكرومتر) الحويصلات المرتبطة بالغشاء التي تفرزها جميع أنواع الخلايا تقريبا1. وغالبا ما يشار إليها باسم "exosomes" ، "microvesicles" ، أو "الهيئات المبرمج" اعتمادا على آلية الإفراج عنها وحجم2. في حين كان يعتقد في البداية أن المركبات الكهربائية كانت مجرد وسيلة للقضاء على النفايات من الخلية للحفاظ على التوازن3، ونحن نعلم الآن أنها يمكن أن تشارك أيضا في الاتصالات بين الخلايا عن طريق نقل المواد الجزيئية -- بما في ذلك الحمض النووي ، الجيش الملكي النيبالي (ميرنا ، ميكرورنا) ، والدهون ، والبروتينات4،5 -- وأنها هي المنظمين المهمين لعلم وظائف الأعضاء الطبيعية ، فضلا عن العمليات المرضية1، 5،6،7،8.
هناك العديد من الطرق المختلفة لعزل وقياس المركبات الكهربائية، والتي تم وصفها في مكان آخر9،10،11،12. بروتوكول العزل المستخدمة وكذلك مصدر المركبات الكهربائية يمكن أن تؤثر بشكل كبير EV الغلة والنقاء. وحتى الطرد المركزي التفاضلي، الذي طالما اعتبر نهج "المعيار الذهبي" للعزلة الخارجية، يمكن أن يخضع لتباين كبير يؤثر في وقت لاحق على السكان EV التي تم الحصول عليها وتحليلات المصب13. وهكذا، فإن مختلف المنهجيات المختلفة لعزل EV وتحديد كمي تجعل من الصعب مقارنة واستنساخ وتفسير نتائج التجارب المبلغ عنها في الأدب14. وعلاوة على ذلك، يمكن تنظيم إطلاق EV من خلال الظروف الخلوية أو عوامل خارجية مختلفة. وقد اقترح أن المركبات الكهربائية تلعب دورا في الحفاظ على التوازن الخلوي من خلال حماية الخلايا ضد الإجهاد داخل الخلايا15, كما أظهرت العديد من الدراسات أن الإجهاد الخلوي يحفز إفراز EV. على سبيل المثال، تم الإبلاغ عن زيادة إطلاق EV بعد التعرض الخلوي لنقص الأكسيجة، والإجهاد الشبكي بطانة الرحم، والإجهاد التأكسدي، والإجهاد الميكانيكي، ومستخلص دخان السجائر، وتلوث الهواء الجسيمات16،17،18،19،20،21،22. كما تبين أن إطلاق EV قد تم تعديله في الجسم الحي؛ الفئران التي تعرضت لنظام غذائي عالي الدهون أو الصيام لمدة ستة عشر ساعة صدر أكثر المركبات EVsadipocyte 23. للتحقيق فيما إذا كان علاج أو حالة معينة يغير إطلاق EV، يجب تحديد عدد المركبات الكهربائية بدقة. تقييم توزيع حجم EV قد تشير أيضا إلى الأصل شبه الخلوي السائد من المركبات الكهربائية (على سبيل المثال، الانصهار من الأجسام الاندوسومات المتأخرة / متعددة المركبات مع غشاء البلازما مقابل الناشئة من غشاء البلازما)24. وبالتالي، هناك حاجة إلى أساليب قوية لقياس بدقة التركيز الكلي وتوزيع حجم الإعدادية EV التي تجري دراستها.
طريقة سريعة وحساسة للغاية لتصور وتوصيف المركبات الكهربائية في الحل هو تحليل تتبع الجسيمات النانوية (NTA). وقد وصف شرح مفصل لمبادئ هذه الطريقة والمقارنة مع الطرق البديلة لتقييم حجم EV والتركيز سابقا25،26،27،28. باختصار، أثناء قياس NTA، يتم تصور المركبات الكهربائية بواسطة الضوء المتناثر عندما يتم تشعيعها بشعاع ليزر. يركز الضوء المتناثر بواسطة المجهر على الكاميرا التي تسجل حركة الجسيمات. يتتبع برنامج NTA الحركة الحرارية العشوائية لكل جسيم ، والمعروفة باسم الحركة البراونية ، لتحديد معامل الانتشار الذي يستخدم لحساب حجم كل جسيم باستخدام معادلة ستوكس آينشتاين. تم تطبيق NTA لأول مرة على قياس المركبات الكهربائية في عينة بيولوجية في عام 201125. حتى وقت قريب، كان هناك سوى شركتين التيار الرئيسي التي تقدم أدوات NTA التجارية29 حتى إدخال ViewSizer 3000 (يشار إليها فيما بعد باسم أداة تتبع الجسيمات) الذي يستخدم مزيجا من الأجهزة الجديدة وحلول البرمجيات للتغلب على قيود كبيرة من تقنيات NTA الأخرى.
تميز أداة تتبع الجسيمات الجسيمات النانوية في العينات السائلة من خلال تحليل حركتها البراونية وتميز جزيئات أكبر بحجم ميكرون من خلال تحليل استقرار الجاذبية. يسمح النظام البصري الفريد لهذا الجهاز، والذي يتضمن إضاءة متعددة الأطياف مع ثلاثة مصادر ضوء ليزر (عند 450 نانومتر و520 نانومتر و635 نانومتر)، للباحثين بتحليل مجموعة واسعة من أحجام الجسيمات (على سبيل المثال، إكسوسومات، ميكروفيسيكليس) في وقت واحد. يظهر تخطيطي لإعداد الأداة في الشكل 1.
هنا، ونحن نبين كيفية تنفيذ توزيع حجم الجسيمات وقياسات تركيز الماوس المعزولة والمركبات الكهربائية البشرية باستخدام أداة NTA جديدة.
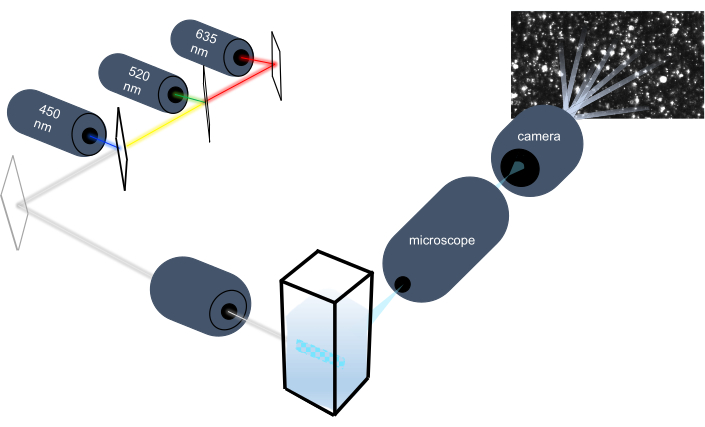
الشكل 1: نظام بصري أداة تتبع الجسيمات. تضيء أداة NTA الجسيمات باستخدام ثلاثة أشعة ليزر ذات أطوال موجية تالية: 450 نانومتر، 520 نانومتر، 635 نانومتر. يتم الكشف عن تسجيل الفيديو للضوء المتناثر من الجسيمات الفردية وتتبعها بواسطة كاميرا فيديو رقمية موجهة 90 درجة من cuvette. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
وقد تم تنفيذ جميع الأعمال مع هذه العينات وفقا للجنة المؤسسية للعناية بالحيوانات واستخدامها والمبادئ التوجيهية لمجلس المراجعة المؤسسية. يتم تصوير نظرة عامة تخطيطية لطريقة NTA في الشكل 2.
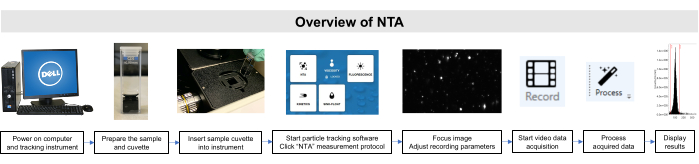
الشكل 2:نظرة عامة على طريقة NTA باستخدام أداة تتبع الجسيمات. يتم إعداد العينة وإدراجها في الصك. يتم فتح برنامج NTA، ويتم ضبط معلمات التسجيل، ويتم تركيز العينة. ثم يتم تسجيل البيانات ومعالجتها وعرضها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. عزل الحويكل خارج الخلية
ملاحظة: تم عزل الماوس perigonadal الأنسجة الدهنية EVs كما وصف سابقا23. تم عزل البلازما EVs من 1 مل من البلازما البشرية باستخدام البروتوكول التالي:
- جمع البلازما والطرد المركزي في 3000 س غ لمدة 15 دقيقة لإزالة الحطام الخلوي. نقل supernatant إلى أنبوب جديد.
ملاحظة: إذا بقي الحطام الإضافي قابلا للكشف، قم بالطرد المركزي للناتنات الفائق لمدة 10 دقائق إضافية عند 12,000 × ز ونقل الناطور إلى أنبوب جديد. - أضف 67 ميكرولتر من كاشف العزل exosome لكل 250 ميكرولتر من البلازما. مزيج جيدا عن طريق عكس أو النقر على الأنبوب.
- احتضان على الجليد تستقيم لمدة 30 دقيقة.
- الطرد المركزي كواشف العزلة إكسوسوم / خليط البلازما في 3000 × ز لمدة 10 دقيقة في 4 درجة مئوية.
ملاحظة: يمكن إجراء الطرد المركزي في درجة حرارة الغرفة أو 4 درجات مئوية مع نتائج مماثلة، ولكن يفضل 4 درجة مئوية. بعد الطرد المركزي، قد تظهر المركبات الكهربائية كبيليه بيج أو أبيض في الجزء السفلي من الأنبوب. - يستنشق بعناية قبالة supernatant. تدور أسفل أي حل العزل exosome المتبقية وإزالة جميع آثار السوائل عن طريق الطموح، مع الحرص الشديد على عدم تعكير صفو المركبات الكهربائية عجلت في بيليه.
- Resuspend بيليه في 200 ميكرولتر من المخزن المؤقت B (التي تقدمها الشركة المصنعة). قياس وتسجيل تركيز البروتين العينة (للخطوة 2.8) باستخدام مطياف، مقياس الفلور، برادفورد المقايسة، أو طريقة أخرى مفضلة.
2. تنقية المركبات الكهربائية المعزولة
- إضافة 200 ميكرولتر من المخزن المؤقت A (التي توفرها الشركة المصنعة) إلى إعادة تعليق المركبات الكهربائية.
- إخراج العمود تنقية (المقدمة)، وتخفيف الغطاء المسمار، والمفاجئة قبالة إغلاق القاع. ضع العمود في أنبوب تجميع.
ملاحظة: حفظ إغلاق أسفل للخطوات 2.7-2.9. - جهاز طرد مركزي 1000 x g لمدة 30 s لإزالة المخزن المؤقت للتخزين.
- تجاهل التدفق من خلال ووضع العمود مرة أخرى في أنبوب جمع.
- لغسل العمود، قم بإزالة الغطاء وتطبيق 500 ميكرولتر من العازلة B فوق الراتنج والطرد المركزي عند 1000 × غرام لمدة 30 ثانية. تجاهل التدفق من خلال. حفظ الغطاء للخطوات 2.7-2.9.
- كرر الخطوات 2.4-2.5 مرة أخرى لغسل العمود.
- قم بتوصيل الجزء السفلي من العمود بإغلاق أسفل (من الخطوة 2.2). تطبيق 100 ميكرولتر من المخزن المؤقت B على رأس الراتنج لإعداده لتحميل العينة.
- إضافة المحتوى بأكمله من الخطوة 1.6 (أو ما يعادل حجم 4 ملغ من البروتين الكلي) إلى الراتنج. ضع الغطاء المسماري في أعلى العمود.
- تخلط في درجة حرارة الغرفة على شاكر الدورية لمدة لا تزيد عن 5 دقائق.
3. عينة elution
- تخفيف الغطاء المسمار وإزالة إغلاق القاع، ونقل فورا إلى أنبوب microcentrifuge 2 مل.
ملاحظة: سيبدأ النموذج إلى elute بمجرد إزالة إغلاق أسفل. يرجى التأكد من أن أنبوبي الطرد المركزي الدقيق 2 مل جاهزان لاستقبال اليوات لتقليل فقدان العينة. - جهاز طرد مركزي 1000 x g لمدة 30 s للحصول على المركبات الكهربائية النقية. تجاهل العمود.
4. إعداد عينة لتحليل تتبع الجسيمات النانوية
- استخدم مادة خالية من الوبر مثل قطعة قماش من الألياف الدقيقة لتغطية مساحة العمل ومنع الألياف من دخول اللحاف.
- ارتداء القفازات، ووضع cuvette على الرقصة cuvette المغناطيسي، ثم وضع شريط اثارة في cuvette. تعامل دائما مع اللحافات باستخدام قفازات لمنع ظهور بصمات الأصابع واللطخات على سطح cuvette.
- استخدام أداة هوك لوضع إدراج في cuvette كما هو مبين في الشكل 3. من المهم ملاحظة اتجاه الإدراج للأحدث (الخطوة 5.4).

الشكل 3: التوجه السليم لإدراج داخل كوفيت الكوارتز. يجب أن يكون "درجة" الإدراج مرئيا من الجزء الأمامي من cuvette. وينبغي إدراج هذا في الصك التي تواجه الكاميرا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- باستخدام ماصة، إضافة ببطء 400-500 ميكرولتر من عينة مخففة أو مخففة في درجة حرارة الغرفة إلى cuvette من خلال ثقب في إدراج. ماصة بلطف صعودا وهبوطا لخلط. تجنب إدخال فقاعات الهواء.
- أولا إعداد cuvette محملة بالعزلة المختارة (فارغة) لقياس تركيز الجسيمات من الذوبان. وينبغي أن يتم ذلك قبل قياس العينة بحيث يمكن تصحيح تركيز الخلفية للعينة.
ملاحظة: فارغة جيدة (الفوسفات المخزنة مؤقتا المالحة [PBS] في هذه الحالة) سيكون لها تركيز <9 × 106 (اعتمادا على مخفف) وسوف تعرض 1-10 جزيئات لكل شاشة في عرض حية(الشكل 4). من المستحسن أن يكون تركيز الجسيمات العينة الفعلية على الأقل 3 أضعاف تركيز الخلفية. - اختياريا، قبل تسجيل رئيس العينة cuvette مع 400-500 ميكرولتر من عينة مخففة أو مخففة قبل القياس. للقيام بذلك، قم بتحميل 400-500 ميكرولتر من العينة المخففة في الكوفيت، وتجاهل المحلول، ثم أضف 400-500 ميكرولتر أكثر من العينة للقياس. وهذا قد يساعد في غسل المخلفات داخل الكوفيت.
- أولا إعداد cuvette محملة بالعزلة المختارة (فارغة) لقياس تركيز الجسيمات من الذوبان. وينبغي أن يتم ذلك قبل قياس العينة بحيث يمكن تصحيح تركيز الخلفية للعينة.

الشكل 4:عرض البث المباشر التمثيلي للمزهول داخل نطاق التركيز المناسب للفراغ. تمييع EV preps في تصفية (0.02 ميكرومتر أو 3 كيلودا، المفضل) برنامج تلفزيوني. وهناك فارغة جيدة عرض ~ 1-10 الجسيمات لكل شاشة في عرض حية، مما أسفر عن تركيز داخل النطاق 105-106. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بوضع غطاء للكوفيت وتحقق من وجود فقاعات. اضغط على الفقاعات إذا لزم الأمر. استخدام قطعة قماش خالية من الوبر لمسح الوجوه الخارجية للcuvette.
5. بدء إجراءات أداة تتبع الجسيمات
- تشغيل محطة عمل الكمبيوتر وجهاز، انتظر بضع دقائق قبل تشغيل العينة الأولى وبدء تشغيل البرنامج بالنقر على رمز البرنامج. عند مطالبتك بذلك، انقر فوق NTA على الشاشة لإجراء تحليل تتبع الجسيمات النانوية. تبدأ في تسجيل علامة التبويب وانقر على علامات التبويب البرامج المختلفة(سجل، عملية، مؤامرة)للتبديل بينهما في جميع أنحاء البروتوكول. تسجيل العينة (ثنائي أو EV الإعدادية) أولا، ثم معالجة التسجيلات، وأخيرا رسم النتائج.
- اتبع الإرشادات التي تظهر على الشاشة لملء جميع المعلومات اللازمة حول العينة. تأكد من اكتمال جميع الحقول الضرورية ودقتها، أي اسم العينة والوصف وإعداد العينة وعامل التخفيف [1000] ودرجة الحرارة المستهدفة (تعيين إلى 22 درجة مئوية) وDiluent: حدد مخفف من القائمة المنسدلة واستخدم PBS كمخفف للمركبات الكهربائية. اختيار برنامج تلفزيوني من القائمة المنسدلة سوف لصناعة السيارات في ملء الملوحة إلى 9٪. هذه المعلومات ضرورية لتحديد اللزوجة الديناميكية للسائل.
ملاحظة: يمكن أن يستغرق الأمر ما يصل إلى 3 دقائق حتى تستقر درجة الحرارة داخل الكوفيت حتى لو أظهر المسبار بالفعل درجة الحرارة المطلوبة (أي أن النقطة الخضراء تصبح مستقرة). يمكن أن تختلف قراءات العينة بشكل كبير إذا لم يتم تعيين درجة الحرارة المستهدفة ، حيث يمكن أن تغير اختلافات درجة حرارة العينة بشكل كبير الحركة البراونية للجسيمات. - افتح غطاء الجهاز وأزل الغطاء الواقي حيث سيتم وضع الكوفيت.
تنبيه: تم اعتماد أداة تتبع الجسيمات كمنتج ليزر من الفئة 1 (21 CFR Ch. أنا جزء 1040)، التي تحتوي على أشعة الليزر التي يمكن أن تكون خطرة ويمكن أن تسبب إصابات خطيرة مثل الحروق و / أو ضرر دائم للبصر. لمنع وقوع حادث أو إصابة، لا تقم بإزالة غطاء الجهاز عن طريق فك البراغي من الجانب. لاحظ أنه أثناء التشغيل ، تكون أشعة الليزر مغلقة تماما ، مما لا يشكل تهديدا للمستخدمين. كما يتم تضمين قفل أمان مغناطيسي في حامل عينة الجهاز لمنع أشعة الليزر من العمل عند إزالة غطاء حامل العينة. - ضع الكوفيت (من الخطوة 4.3) داخل الجهاز في الاتجاه الصحيح (انظر الشكل 5). استبدال الغطاء على cuvette وإغلاق غطاء الصك. دائما تشغيل الصك مع الغطاء في مكان على حامل العينة. لا تقم بتعطيل ميزة الأمان المتشابك أو محاولة التحايل عليها.

الشكل 5:التوجه السليم للكوفيت داخل أداة تتبع الجسيمات. وجه cuvette (مع "درجة" إدراج مرئية) يجب أن تواجه الكاميرا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتشغيل الكاميرا بالنقر فوق السهم الموجود أعلى البث.
- انقر فوق سهم شيفرون لتوسيع إعدادات السجل. تعيين قوة Gain و Laser إلى القيم المناسبة للتطبيق. انظر الجدول 1 (والشكل التكميلي 1)للاطلاع على المعلمات المستخدمة في المركبات الكهربائية الصغيرة (100 نانومتر).
ملاحظة: قد تكون هذه الإعدادات المتقدمة الوصول إليها بالنقر فوق السهم chevron محمية بكلمة مرور. استخدم نفس الإعدادات لتسجيل ومعالجة الفواصل (فارغة) مثل تلك المستخدمة للعينات اللاحقة. - ضبط التركيز حتى يتم تركيز الجسيمات بشكل صحيح. وينبغي التركيز على الجسيمات الصغيرة نسبيا(الشكل 6). بالنسبة للقياس الكمي EV الصغير (بما يتفق مع exosomes) ، يوصى بإعدادات التسجيل التالية: معدل الإطار: 30 إطارا في الثانية ، التعرض: 15 مللي ثانية ، وقت التقليب: 5 ثانية ، وقت الانتظار: 3 ثانية ، طاقة الليزر - الأزرق: 210 ميجاوات ، الأخضر: 12 مللي واط ، الأحمر: 8 ملليواط ، الإطارات لكل فيديو: 300 إطار ، والكسب: 30 ديسيبل.
ملاحظة: يمكن للمستخدم زيادة تكبير/تصغير إلى 1x و/أو زيادة كسب للمساعدة في التركيز. تذكر إعادة تعيين هذه المعلمات إلى القيم الموصى بها قبل تسجيل مقاطع الفيديو.
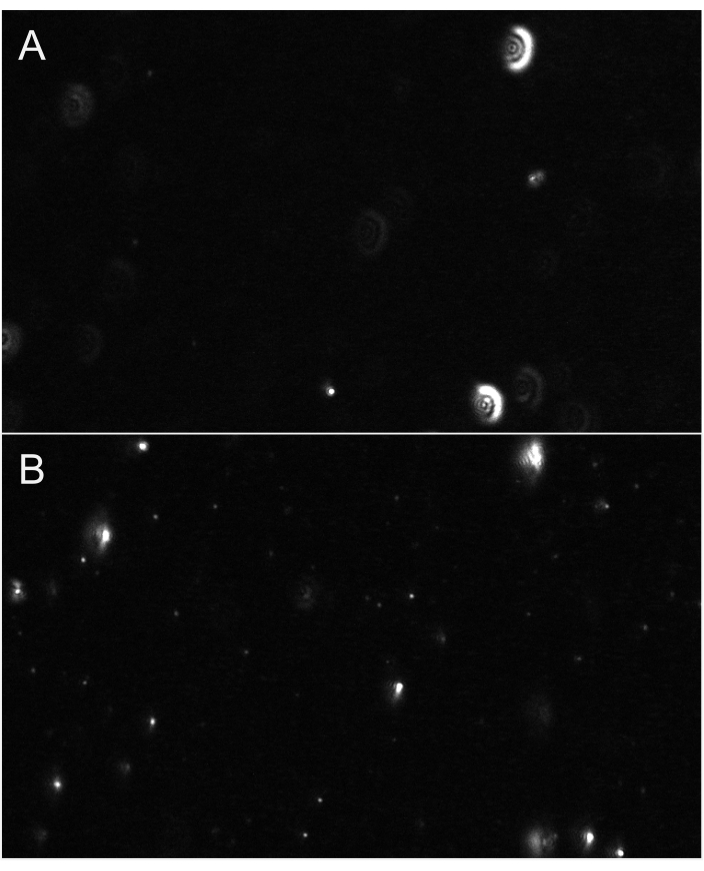
الشكل 6: ممثل وجهات النظر البث المباشر تظهر تركيز الجسيمات. (أ) مثال عرض البث المباشر للجسيمات ليست في التركيز. الجسيمات لديها هالة تشبه توهج أو تبدو ضبابية. ضبط التركيز. (ب) مثال على عرض البث المباشر للجسيمات في التركيز المناسب. أصغر الجسيمات هي في التركيز. بدء التسجيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إجراء فحص جودة مرئية للتأكد من أن العينة مخففة بشكل صحيح. إذا كانت العينة مركزة جدا، قم بإزالة الكوفيت من الجهاز وتمييع العينة بشكل متسلسل. كرر حتى يتم تخفيف العينة بشكل صحيح قبل المتابعة إلى الخطوة 6.
ملاحظة: لا تخفف العينة أكثر من ذلك! دائما جعل التخفيفات بالتسلسل. سوف فارغة مثالية عرض سوى عدد قليل من الجسيمات على الشاشة (1-4) كما هو مبين في الشكل 4. وفيما يتعلق بعينات EV، سيكون لعينة مخففة بشكل صحيح ما يقرب من 20-100 جسيم مرئية على الشاشة، مع عدم وجود صور تشبه توهج أو غائم في الخلفية (انظر الشكل 7 كمثال). وينبغي أن يؤدي ذلك إلى تركيز الجسيمات الأمثل في نطاق 5 × 106 إلى 2 × 108 جزيئات لكل مل (عدم التكيف مع عامل التخفيف).
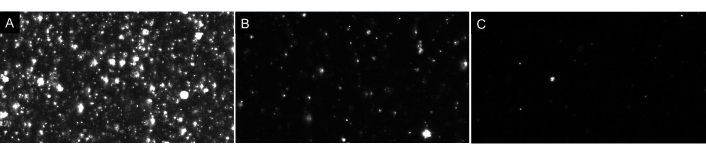
الشكل 7: مناظر البث المباشر التمثيلية التي تصور تخفيفات الجسيمات المختلفة. (A)مثال على عرض البث المباشر لعينة مركزة للغاية. تسجيل عينة مركزة جدا سوف تسفر عن نتائج غير دقيقة. (ب) مثال على عرض البث المباشر لعينة مخففة بشكل صحيح. هناك 60-100 جزيئات مرئية على الشاشة وتسجيل النتائج في تركيز الخام من 5 × 106- 2 × 108 جزيئات / مل. (ج)مثال على عرض البث المباشر لعينة مخففة للغاية. إذا كانت العينة هي هذا التخفيف ، فلن يكون هناك ما يكفي من الجسيمات التي تم تعقبها ، مما يقلل من حجم العينة ، وبالتالي ، فإن النتائج ستكون غير صالحة إحصائيا. في هذه الحالة، ينصح بزيادة عدد مقاطع الفيديو المسجلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. الحصول على بيانات الفيديو
- (اختياري) تعيين إعداد التكبير/التصغير إلى 0.5x لحفظ عرض النطاق الترددي ومنع الإطارات المفقودة.
- ابدأ تسجيل مقاطع الفيديو بالنقر على سجل (انظر الجدول 1 للحصول على معلمات التسجيل الموصى بها).
ملاحظة: افتراضيا، الأداة سوف يحرك العينة لمدة 5 s، انتظر 3 s، ثم قم بتسجيل لمدة 10 s قبل تكرار هذه العملية. وقت القياس النموذجي لمقاطع الفيديو 50 هو ~ 15 دقيقة للتسجيل و ~ 13 دقيقة للمعالجة. - لا تلمس الجهاز أثناء تسجيل مقاطع الفيديو. تأكد من أن سطح مقاعد البدلاء المختبر لا يهتز.
ملاحظة: يفضل أن يتم تعيين الأداة على منصة أو طاولة مضادة للاهتزاز لتقليل أي اضطرابات اهتزاز من المعدات القريبة التي ستتداخل مع تحديد حركة الجسيمات النانوية. تجنب تشغيل أجهزة الطرد المركزي أو خلاطات الدوامات أو غيرها من الأجهزة المحتملة لتوليد الاهتزاز على نفس مقاعد البدلاء مثل أداة تتبع الجسيمات. الاهتزازات مرئية بسهولة على الشاشة كما استطالة الجسيمات المستديرة عادة. إذا تعرضت لاهتزازات قوية، قد تتطلب الأداة إعادة تنظيم العناصر البصرية. لم يتم تصميم الأداة ليتم خدمتها أو معايرة من قبل العميل؛ اتصل بالشركة المصنعة للصيانة والخدمة والمعايرة. - لاحظ أي فيديو مسجل يحتوي على جزيئات كبيرة جدا مرئية مثل النقط البيضاء الكبيرة وغير المنتظمة. إزالة مقاطع الفيديو هذه من المعالجة في الخطوة 7.3.
7. معالجة البيانات المكتسبة
- عندما تظهر مطالبة تفيد بأنه تم تسجيل مقاطع الفيديو، انقر فوق موافق لإكمال التسجيل. ثم حدد علامة التبويب عملية.
ملاحظة: يمكن إيقاف البروتوكول هنا. يمكن إعادة تشغيل معالجة البيانات المكتسبة لاحقا بالانتقال مباشرة إلى علامة التبويب Process بعد فتح برنامج أداة تتبع الجسيمات وتحديد الدليل الذي يتم حفظ مقاطع الفيديو المسجلة فيه. - عند تحليل المركبات الكهربائية، حدد المربع تعطيل تجاوز الكشف التلقائي وتعيين قطر الميزة إلى 30. انقر فوق عملية. (انظر الجدول 2 للاطلاع على إعدادات المعالجة والشكل التكميلي 2 لعرض المعالجة). سيتم عرض رسم بياني للتوزيع المباشر بحيث يمكن للمستخدم عرض المعالجة في الوقت الفعلي.
- بالنسبة للاكسوسومات، قم بمعالجة مع تعيين عتبة الكشف إلى نموذج Polydisperseالافتراضي . معالجة البيانات مع دليل عتبة الكشف تعيين إلى 0.8 بدلا من عتبة قياسية من 0.99 فقط للحلول مع اختلافات كبيرة جدا في أحجام الجسيمات.
- إذا كان لأي مقاطع فيديو جزيئات كبيرة جدا مرئية بشكل ملحوظ (انظر الخطوة 6.4) ، فانتقل إلى دليل مقاطع الفيديو المسجلة وأزل الفيديو الإشكالي. بعد تحرير قائمة ملفات الفيديو، قم بتغيير عدد مقاطع الفيديو المسجلة في سجلات أخرى يحتفظ بها المستخدم.
- بعد اكتمال المعالجة، انقر فوق موافق. ثم حدد علامة التبويب رسم. بالنسبة للمركبات الكهربائية، اعرض المخطط الرئيسي على أنه LogBinSilica.
ملاحظة: هنا في علامة التبويب رسم، يمكن للمستخدم تخصيص ميزات أخرى من الرسم البياني، مثل تحديد نطاق محور س (قطر الجسيمات، نانومتر) لتعيين منطقة للتكامل للشخصية المنتجة.
8. عرض وتفسير النتائج
- لإنشاء تقرير PDF، انقر فوق الزر تقرير. وقد اكتمل القياس الآن، ويمكن الاطلاع على النتائج.
ملاحظة: تذكر لتسجيل ومعالجة فارغة أولا بحيث يمكن تصحيح تركيز الخلفية من العينات اللاحقة. إذا تم نسيان هذه الخطوة، يمكن تسجيل الفراغ بعد العينات وتصحيح تركيز الجسيمات العينة يدويا. - فحص تقرير PDF الذي يعرض متوسط ومتوسط وحجم الوضع وكذلك التركيز المعدل لعامل التخفيف وتصحيحه عن طريق طرح تركيز الجسيمات في الذوبان. كما يظهر عرض التوزيع (الانحراف المعياري).
ملاحظة: هناك تطبيقات قليلة جدا حيث قيمة مفردة مناسبة وممثل. وبالتالي، يوصى بوصف توزيع الحجم بالكامل والإبلاغ عن عرض التوزيع لأي عينة تم تحليلها (كما هو موضح في الجدول 3 على سبيل المثال). - تسجيل إعدادات الأداة التالية المستخدمة لإنشاء البيانات التي يجب ذكرها عند الإبلاغ عن النتائج: Diluent، قوة الليزر لكل ليزر [mW]، التعرض [ms]، Gain [dB]، معدل الإطار [fps]، الإطارات لكل فيديو، عدد مقاطع الفيديو المسجلة، إعداد المعالجة (على سبيل المثال، LogBinSilica)، نطاق التكامل [min nm، max nm] (يوصى بتعيين الحد الأدنى إلى 50 نانومتر) وعدد الجسيمات المتعقبة (من المستحسن تحليل ما لا يقل عن ~ 150 جسيما لكل فيديو؛ الحد الأدنى 3,750 المسارات الإجمالية لكل عينة يوصى بتجنب الارتفاعات الملموسة في توزيع حجم الجسيمات وتوليد بيانات ذات دلالة إحصائية).
9. تنظيف cuvettes
- تنظيف cuvettes يدويا بين العينات. أولا، إفراغ ال(كوفيت)
ملاحظة: يمكن استرداد العينة من cuvette وحفظها أو تجاهلها. - مرة واحدة في cuvette فارغة، وتنظيف cuvette عن طريق الشطف 10-15 مرات مع المياه دي المؤينة (DI). ثم، شطف 3 مرات مع الإيثانول (70-100٪). عند القيام بذلك، تأكد من ملء cuvette بالكامل مع المذيبات.
- جفف الجزء الخارجي من الكوفيت بقطعة قماش خالية من الألياف الدقيقة. تجنب اللطخات على الأسطح. الهواء الجاف داخل cuvette أو الجافة باستخدام منفضة الهواء المضغوط.
ملاحظة: يجب استخدام ورق تنظيف العدسة أو قماش الألياف الدقيقة الخالي من الوبر فقط لمسح الأسطح البصرية للكوفيت ، حيث تحتوي معظم المنتجات الورقية على ألياف خشبية صغيرة قد تخدش سطح cuvette أو تلحق به الضرر. - إعداد قنينتين التألق الزجاج: واحدة مليئة 70-100٪ الإيثانول والآخر مع المياه DI. شطف إدراج واثارة القضبان في الإيثانول أولا (ثم DI المياه) عن طريق وضع إدراج / اثارة شريط في قارورة التلألؤ المناسبة ويهز القارورة بقوة. جفف العوارض وحرك القضبان باستخدام أقمشة خالية من الوبر أو منافض الهواء المضغوطة.
ملاحظة: يمكن أيضا تنظيف cuvette وإدراج باستخدام حمام مائي sonicating. للقيام بذلك، تأكد أولا وحدة sonicating يحتوي على ما يكفي من الماء (على الأقل 5 سم عمق). ثم ضع الكوفيت وأدخله داخل كوب زجاجي (50 مل أو أكبر) ، واملأ الكأس بالكحول إلى نفس مستوى حمام الماء ، وضع الكأس في الماء ، والتبديل على الطاقة. Sonicate لمدة أقصاها 5 دقائق في وقت واحد، مما يسمح للجهاز للراحة >5 دقيقة بين كل انفجار 5 دقائق إذا لزم الأمر أوقات أطول. - عند الانتهاء، وضع على الفور جميع المكونات النظيفة والمجففة بعيدا للتخزين.
Access restricted. Please log in or start a trial to view this content.
النتائج
قبل هذا العرض التوضيحي، تم اختبار معايرة الجهاز لأول مرة لضمان صحة البيانات المكتسبة من خلال قياس توزيع حجم معايير حبة البوليسترين. اختبرنا حجم توزيع 100 نانومتر و 400 نانومتر الخرز باستخدام معلمات التسجيل الافتراضية وإعدادات المعالجة الموصى بها في هذا البروتوكول(الشكل 8).
Access restricted. Please log in or start a trial to view this content.
Discussion
هنا، ونحن نثبت بروتوكول لNTA من المركبات الكهربائية لقياس توزيع حجم مجموعة واسعة من أحجام الجسيمات في وقت واحد وقياس تركيز EV الكلي في عينة متعددة الأضلاع. في هذه الدراسة، استخدمت الأنسجة الدهنية بيريغودال الماوس والبلازما البشرية كمصدر للمركبات الكهربائية. ومع ذلك، يمكن أيضا استخدام المر...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وأعلن جميع المؤلفين أنه لا يوجد تضارب في المصالح.
Acknowledgements
وقد دعم هذا العمل المعاهد الوطنية للصحة (ES030973-01A1، R01ES025225، R01DK066525، P30DK026687، P30DK063608). ونحن نعترف جيفري Bodycomb، دكتوراه من هوريبا الصكوك المدمجة لمساعدته في معايرة الصك.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021(2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, San Diego, California. 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569(2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421(2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , Clifton, N.J. 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016(2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. Absorption and Scattering of Light by Small Particles. , John Wiley & Sons. (1983).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved