Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Análisis de seguimiento de nanopartículas para la cuantificación y determinación del tamaño de vesículas extracelulares
En este artículo
Resumen
Demostramos cómo utilizar un nuevo instrumento de análisis de seguimiento de nanopartículas para estimar la distribución del tamaño y la concentración total de partículas de vesículas extracelulares aisladas de tejido adiposo perigonadal de ratón y plasma humano.
Resumen
Los roles fisiológicos y fisiopatológicos de las vesículas extracelulares (EV) se han vuelto cada vez más reconocidos, lo que hace que el campo EV sea un área de investigación en rápida evolución. Existen muchos métodos diferentes para el aislamiento de vehículos eléctricos, cada uno con ventajas y desventajas distintas que afectan el rendimiento y la pureza posteriores de los vehículos eléctricos. Por lo tanto, la caracterización de la preparación ev aislada de una fuente dada por un método elegido es importante para la interpretación de los resultados posteriores y la comparación de los resultados entre laboratorios. Existen varios métodos para determinar el tamaño y la cantidad de vehículos eléctricos, que pueden verse alterados por estados de enfermedad o en respuesta a afecciones externas. El análisis de seguimiento de nanopartículas (NTA) es una de las tecnologías prominentes utilizadas para el análisis de alto rendimiento de vehículos eléctricos individuales. Aquí, presentamos un protocolo detallado para la cuantificación y determinación del tamaño de los vehículos eléctricos aislados del tejido adiposo perigonadal de ratón y el plasma humano utilizando una tecnología innovadora para NTA que representa importantes avances en el campo. Los resultados demuestran que este método puede proporcionar datos reproducibles y válidos de concentración total de partículas y distribución de tamaño para vehículos eléctricos aislados de diferentes fuentes utilizando diferentes métodos, como lo confirma la microscopía electrónica de transmisión. La adaptación de este instrumento para NTA abordará la necesidad de estandarización en los métodos de NTA para aumentar el rigor y la reproducibilidad en la investigación de EV.
Introducción
Las vesículas extracelulares (VE) son pequeñas (0,03-2 μm) vesículas unidas a la membrana secretadas por casi todos los tipos de células1. A menudo se les conoce como "exosomas", "microvesículas" o "cuerpos apoptóticos" dependiendo de su mecanismo de liberación y tamaño2. Si bien inicialmente se pensó que los VEHÍCULOS eléctricos eran simplemente un medio para eliminar los desechos de la célula para mantener la homeostasis3,ahora sabemos que también pueden participar en la comunicación intercelular a través de la transferencia de material molecular, incluido el ADN, el ARN (ARNm, microARN), los lípidos y las proteínas4,5, y que son importantes reguladores de la fisiología normal, así como de los procesos patológicos1, 5,6,7,8.
Hay muchos métodos diferentes para aislar y cuantificar los vehículos eléctricos, que se han descrito en otra parte9,10,11,12. El protocolo de aislamiento utilizado, así como la fuente de los vehículos eléctricos, pueden afectar en gran medida el rendimiento y la pureza de los vehículos eléctricos. Incluso la centrifugación diferencial, considerada durante mucho tiempo el enfoque "estándar de oro" para el aislamiento de exosomas, puede estar sujeta a una variabilidad sustancial que posteriormente afecta a la población de EV obtenida y a los análisis posteriores13. Por lo tanto, las diversas metodologías diferentes para el aislamiento y cuantificación de EV dificultan la comparación, reproducción e interpretación de los resultados de los experimentos reportados en la literatura14. Además, la liberación de EV puede ser regulada por condiciones celulares o varios factores externos. Se ha sugerido que los EV desempeñan un papel en el mantenimiento de la homeostasis celular al proteger a las células contra el estrés intracelular15,ya que varios estudios han demostrado que el estrés celular estimula la secreción de EV. Por ejemplo, se ha reportado un aumento de la liberación de EV después de la exposición celular a la hipoxia, el estrés del retículo endoplásmico, el estrés oxidativo, el estrés mecánico, el extracto de humo de cigarrillo y lacontaminacióndel aire por partículas16,17,18 , 19,20,21,22. También se ha demostrado que la liberación de EV se modifica in vivo; los ratones sometidos a una dieta alta en grasas o en ayunas durante dieciséis horas liberaron más vehículos eléctricos de adipocitos23. Para investigar si un tratamiento o afección específica altera la liberación de EV, el número de EV debe determinarse con precisión. La evaluación de la distribución del tamaño de ev también puede indicar el origen subcelular predominante de los EV (por ejemplo, fusión de endosomas tardíos/cuerpos multivesiculares con la membrana plasmática frente a la brotación de la membrana plasmática)24. Por lo tanto, existe la necesidad de métodos robustos para medir con precisión la concentración total y la distribución de tamaño de la preparación EV que se está estudiando.
Un método rápido y altamente sensible para la visualización y caracterización de vehículos eléctricos en solución es el análisis de seguimiento de nanopartículas (NTA). Una explicación detallada de los principios de este método y la comparación con métodos alternativos para la evaluación del tamaño y la concentración de EV se han descrito previamente25,26,27,28. Brevemente, durante la medición NTA, los vehículos eléctricos son visualizados por la luz dispersada cuando se irradian con un rayo láser. La luz dispersa es enfocada por un microscopio en una cámara que registra el movimiento de las partículas. El software NTA rastrea el movimiento térmico aleatorio de cada partícula, conocido como movimiento browniano, para determinar el coeficiente de difusión que se utiliza para calcular el tamaño de cada partícula utilizando la ecuación de Stokes-Einstein. NTA se aplicó por primera vez a la medición de vehículos eléctricos en una muestra biológica en 201125. Hasta hace poco, solo había dos compañías principales que ofrecían instrumentos NTA comerciales29 hasta la introducción del ViewSizer 3000 (en adelante, el instrumento de seguimiento de partículas) que utiliza una combinación de nuevas soluciones de hardware y software para superar las limitaciones significativas de otras técnicas NTA.
El instrumento de seguimiento de partículas caracteriza las nanopartículas en muestras líquidas mediante el análisis de su movimiento browniano y caracteriza partículas más grandes del tamaño de micras mediante el análisis de la sedimentación gravitacional. El sistema óptico único de este instrumento, que incluye iluminación multiespectral con tres fuentes de luz láser (a 450 nm, 520 nm y 635 nm), permite a los investigadores analizar una amplia gama de tamaños de partículas (por ejemplo, exosomas, microvesículas) simultáneamente. En la Figura 1se muestra un esquema de la configuración del instrumento.
Aquí, demostramos cómo realizar mediciones de distribución y concentración del tamaño de partícula de vehículos eléctricos aislados de ratones y humanos utilizando un nuevo instrumento NTA.
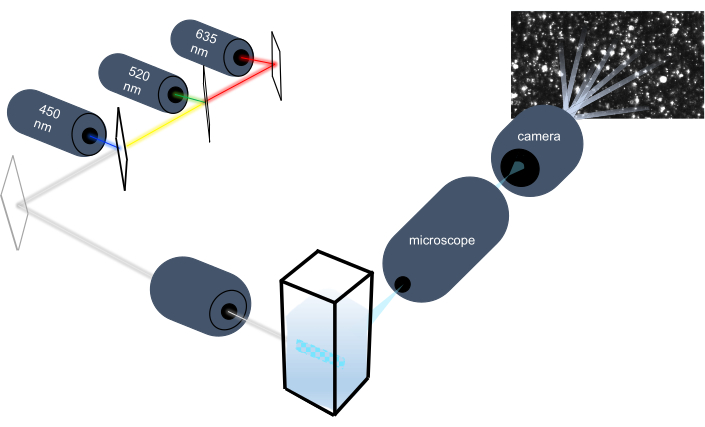
Figura 1: Sistema óptico del instrumento de seguimiento de partículas. El instrumento NTA ilumina partículas utilizando tres láseres con las siguientes longitudes de onda: 450 nm, 520 nm, 635 nm. La grabación de video de la luz dispersa de partículas individuales es detectada y rastreada por una cámara de video digital orientada a 90 ° desde la cubeta. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todo el trabajo con estas muestras se realizó de conformidad con las directrices del Comité Institucional de Cuidado y Uso de Animales y de la Junta de Revisión Institucional. En la figura 2se muestra una descripción general esquemática del método NTA.
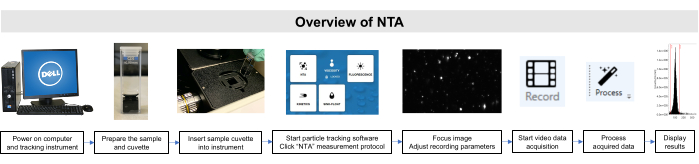
Figura 2: Descripción general del método NTA utilizando el instrumento de seguimiento de partículas. La muestra se prepara y se inserta en el instrumento. Se abre el software NTA, se ajustan los parámetros de grabación y se enfoca la muestra. A continuación, los datos se registran, procesan y muestran. Haga clic aquí para ver una versión más grande de esta figura.
1. Aislamiento de vesículas extracelulares
NOTA: Los EVs de tejido adiposo perigonadal de ratón fueron aislados como se describió anteriormente23. Los VEHÍCULOS eléctricos plasmáticos se aislaron de 1 ml de plasma humano utilizando el siguiente protocolo:
- Recoge el plasma y la centrífuga a 3.000 x g durante 15 min para eliminar los desechos celulares. Transfiera el sobrenadante a un tubo nuevo.
NOTA: Si los desechos adicionales permanecen detectables, centrifupe el sobrenadante durante 10 minutos adicionales a 12,000 x g y transfiera el sobrenadante a un nuevo tubo. - Añadir 67 μL del reactivo de aislamiento de exosomas por 250 μL de plasma. Mezclar bien invirtiendo o moviendo el tubo.
- Incubar en hielo en posición vertical durante 30 min.
- Centrifugar la mezcla de reactivo/plasma de aislamiento de exosomas a 3.000 x g durante 10 min a 4 °C.
NOTA: La centrifugación se puede realizar a temperatura ambiente o 4 °C con resultados similares, pero se prefiere 4 °C. Después de la centrifugación, los vehículos eléctricos pueden aparecer como una bolita beige o blanca en la parte inferior del tubo. - Aspire con cuidado el sobrenadante. Haga girar cualquier solución de aislamiento de exosomas residuales y elimine todos los rastros de líquido por aspiración, teniendo mucho cuidado de no perturbar los vehículos eléctricos precipitados en el pellet.
- Resuspend el pellet en 200 μL de Buffer B (proporcionado por el fabricante). Mida y registre la concentración de proteínas de la muestra (para el paso 2.8) utilizando un espectrofotómetro, fluorómetro, ensayo de Bradford u otro método preferido.
2. Purificación de vehículos eléctricos aislados
- Agregue 200 μL de búfer A (proporcionado por el fabricante) a los vehículos eléctricos res suspendidos.
- Saque la columna de purificación (provista), afloje el tapón de rosca y cierre el cierre inferior. Coloque la columna en un tubo de recolección.
NOTA: Guarde el cierre inferior para los pasos 2.7-2.9. - Centrifugar a 1.000 x g durante 30 s para eliminar el búfer de almacenamiento.
- Deseche el flujo y vuelva a colocar la columna en el tubo de recogida.
- Para lavar la columna, retire la tapa y aplique 500 μL de Buffer B sobre la resina y centrífuga a 1.000 x g durante 30 s. Descarta el flujo a través. Guarde el límite para los pasos 2.7-2.9.
- Repita los pasos 2.4-2.5 una vez más para lavar la columna.
- Enchufe la parte inferior de la columna con el cierre inferior (del paso 2.2). Aplique 100 μL de Tampón B sobre la resina para prepararla para la carga de la muestra.
- Agregue todo el contenido del paso 1.6 (o hasta el volumen equivalente de 4 mg de proteína total) a la resina. Coloque el tapón de rosca en la parte superior de la columna.
- Mezclar a temperatura ambiente en un agitador giratorio durante no más de 5 min.
3. Elución de la muestra
- Afloje la tapa de rosca y retire el cierre inferior, y transfiera inmediatamente a un tubo de microcentrífuga de 2 ml.
NOTA: La muestra comenzará a eluyular tan pronto como se retire el cierre inferior. Asegúrese de que los tubos de microcentrífuga de 2 ml estén listos para recibir eluidos para minimizar la pérdida de muestras. - Centrifugar a 1.000 x g durante 30 s para obtener EVs purificados. Descarte la columna.
4. Preparación de muestras para el análisis de seguimiento de nanopartículas
- Use un material sin pelusa como un paño de microfibra para cubrir el espacio de trabajo y evitar que las fibras entren en las cubetas.
- Usando guantes, coloque la cubeta sobre la plantilla de cubeta magnética, luego coloque la barra de agitación en la cubeta. Siempre manipule las cubetas con guantes para evitar que aparezcan huellas dactilares y manchas en la superficie de la cubeta.
- Utilice la herramienta de gancho para colocar el inserto en la cubeta como se muestra en la Figura 3. Es importante tener en cuenta la orientación del inserto para más adelante (Paso 5.4).

Figura 3: Orientación adecuada del inserto dentro de la cubeta de cuarzo. La "muesca" del inserto debe ser visible desde la parte frontal de la cubeta. Esto debe insertarse en el instrumento frente a la cámara. Haga clic aquí para ver una versión más grande de esta figura.
- Usando una pipeta, agregue lentamente 400-500 μL de la muestra diluyente o diluida a temperatura ambiente a la cubeta a través del orificio en el inserto. Pipete suavemente hacia arriba y hacia abajo para mezclar. Evite introducir burbujas de aire.
- Primero prepare una cubeta cargada con el diluyente elegido (en blanco) para medir la concentración de partículas del diluyente. Esto debe hacerse antes de medir la muestra para que se pueda corregir la concentración de fondo de la muestra.
NOTA: Un buen espacio en blanco (solución salina tamponada con fosfato [PBS] en este caso) tendrá una concentración <9 x10 6 (dependiendo del diluyente) y mostrará 1-10 partículas por pantalla en la vista en vivo(Figura 4). Se recomienda que la concentración real de partículas de la muestra sea al menos 3 veces la concentración de fondo. - Opcionalmente, antes de registrar la muestra, cebar la cubeta con 400-500 μL del diluyente o la muestra diluida antes de medir. Para hacerlo, cargue 400-500 μL de la muestra diluida en la cubeta, deseche la solución y luego agregue 400-500 μL más de la muestra para la medición. Esto puede ayudar a eliminar los residuos dentro de la cubeta.
- Primero prepare una cubeta cargada con el diluyente elegido (en blanco) para medir la concentración de partículas del diluyente. Esto debe hacerse antes de medir la muestra para que se pueda corregir la concentración de fondo de la muestra.

Figura 4: Vista representativa de transmisión en vivo de un diluyente dentro del rango de concentración adecuado de un espacio en blanco. Preparaciones EV diluidas en PBS filtrado (0.02 μm o 3 kDa, preferido). Un buen espacio en blanco mostrará ~ 1-10 partículas por pantalla en la vista en vivo, produciendo una concentración dentro del rango 105-106. Haga clic aquí para ver una versión más grande de esta figura.
- Tapa la cubeta y comprueba si hay burbujas. Toca las burbujas si es necesario. Use un paño sin pelusa para limpiar las caras exteriores de la cubeta.
5. Procedimiento de arranque del instrumento de seguimiento de partículas
- Encienda la estación de trabajo y el instrumento de la computadora, espere unos minutos antes de ejecutar la primera muestra e inicie el programa haciendo clic en el icono del software. Cuando se le solicite, haga clic en NTA en la pantalla para realizar el análisis de seguimiento de nanopartículas. Comience en la pestaña Grabación y haga clic en las diversas pestañas de software(Grabar, Procesar, Trazar)para cambiar entre ellas a lo largo del protocolo. Registre la muestra (preparación de diluyente o EV) primero, luego procese las grabaciones y finalmente trace los resultados.
- Siga las instrucciones en pantalla para completar toda la información necesaria sobre la muestra. Verifique que todos los campos necesarios estén completados y sean precisos, es decir, Nombre de la muestra, Descripción, Preparación de la muestra, Factor de dilución [1000], Temperatura objetivo (Establecida en 22 ° C) y Diluyente: Seleccione el diluyente en el menú desplegable y use PBS como diluyente para los vehículos eléctricos. Al seleccionar PBS en el menú desplegable, se rellenará automáticamente la salinidad al 9%. Esta información es necesaria para determinar la viscosidad dinámica del líquido.
NOTA: La temperatura puede tardar hasta 3 minutos en equilibrarse dentro de la cubeta, incluso si la sonda ya muestra la temperatura deseada (es decir, el punto verde se vuelve estable). Las lecturas de la muestra podrían variar considerablemente si no se establece la temperatura objetivo, ya que las diferencias de temperatura de la muestra podrían alterar en gran medida el movimiento browniano de las partículas. - Abra la tapa del instrumento y retire la tapa protectora que cubre la cuvette donde se colocará la cubeta.
PRECAUCIÓN: El instrumento de seguimiento de partículas está certificado como un producto láser de Clase 1 (21 CFR Ch. I parte 1040), que contiene láseres que pueden ser peligrosos y podrían causar lesiones graves, como quemaduras y / o daños permanentes a la vista. Para evitar accidentes o lesiones, no retire la cubierta del instrumento desenroscando los pernos de un lado. Tenga en cuenta que durante la operación, los rayos láser están completamente cerrados, lo que no representa una amenaza para los usuarios. Además, un enclavamiento de seguridad magnético está integrado en el soporte de muestra del instrumento para evitar que los láseres funcionen cuando se retira la tapa del soporte de muestra. - Coloque la cubeta (del paso 4.3) dentro del instrumento en la orientación correcta (ver Figura 5). Reemplace la tapa sobre la cubeta y cierre la tapa del instrumento. Siempre opere el instrumento con la tapa en su lugar sobre el soporte de la muestra. No deshabilite ni intente eludir la función de enclavamiento de seguridad.

Figura 5: Orientación adecuada de la cubeta dentro del instrumento de seguimiento de partículas. La cara de la cubeta (con la "muesca" del inserto visible) debe estar frente a la cámara. Haga clic aquí para ver una versión más grande de esta figura.
- Encienda la cámara haciendo clic en la flecha sobre Streaming.
- Haga clic en la flecha chevron para expandir la configuración de registro. Establezca la potencia de ganancia y láser en valores apropiados para la aplicación. Consulte la Tabla 1 (y la Figura Suplementaria 1)para conocer los parámetros utilizados para el NTA de vehículos eléctricos pequeños (100 nm).
NOTA: Esta configuración avanzada a la que se accede haciendo clic en la flecha chevron puede estar protegida por contraseña. Utilice la misma configuración para el registro y procesamiento del diluyente (en blanco) que la utilizada para las muestras posteriores. - Ajuste el enfoque hasta que las partículas estén correctamente enfocadas. El enfoque debe hacerse en partículas relativamente pequeñas(Figura 6). Para la cuantificación de EV pequeños (consistente con exosomas), se recomiendan los siguientes ajustes de grabación: Velocidad de fotogramas: 30 fps, Exposición: 15 ms, Tiempo de agitación: 5 s, Tiempo de espera: 3 s, Potencia del láser - Azul: 210 mW, Verde: 12 mW, Rojo: 8 mW, Fotogramas por video: 300 cuadros y Ganancia: 30 dB.
NOTA: El usuario puede aumentar el Zoom a 1x y/o aumentar la Ganancia para ayudar con el enfoque. Recuerde restablecer estos parámetros a los valores recomendados antes de grabar videos.
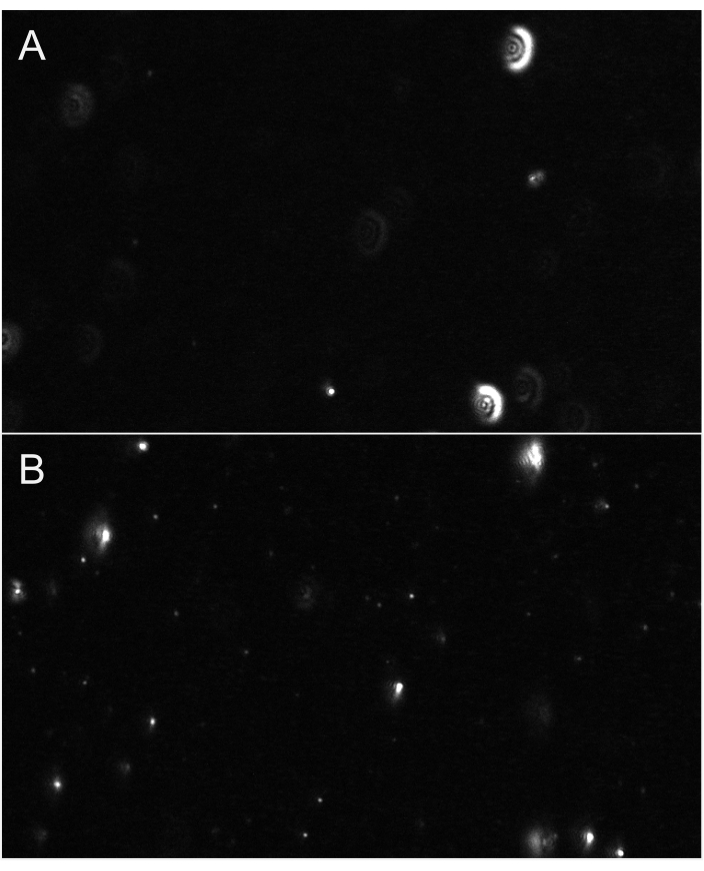
Figura 6:Vistas representativas de transmisión en vivo que muestran el enfoque de partículas. (A) Un ejemplo de vista de transmisión en vivo de partículas no enfocadas. Las partículas tienen un halo similar al resplandor o aparecen borrosas. Ajustar el enfoque. (B) Un ejemplo de vista de transmisión en vivo de partículas en el enfoque adecuado. Las partículas más pequeñas están enfocadas. Comience a grabar. Haga clic aquí para ver una versión más grande de esta figura.
- Realice un control de calidad visual para asegurarse de que la muestra está correctamente diluida. Si la muestra está demasiado concentrada, retire la cubeta del instrumento y diluya la muestra secuencialmente. Repita hasta que la muestra se diluya correctamente antes de continuar con el Paso 6.
NOTA: ¡No diluya demasiado la muestra! Siempre haga diluciones secuencialmente. El espacio en blanco ideal mostrará solo unas pocas partículas en la pantalla (1-4) como se muestra en la Figura 4. Con respecto a las muestras EV, una muestra adecuadamente diluida tendrá aproximadamente 20-100 partículas visibles en la pantalla, sin imágenes brillantes o turbias en el fondo (ver Figura 7 como ejemplo). Esto debería dar como resultado una concentración óptima de partículas en el rango de 5 x 106 a 2 x 108 partículas por ml (sin ajustar el factor de dilución).
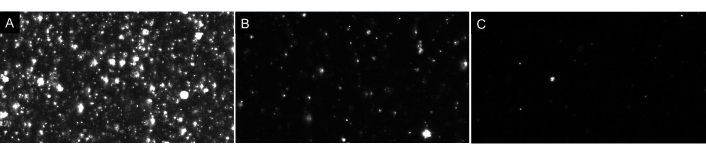
Figura 7: Vistas representativas de transmisión en vivo que representan diferentes diluciones de partículas. (A) Una vista de transmisión en vivo de ejemplo de una muestra que está demasiado concentrada. Registrar una muestra que está demasiado concentrada producirá resultados inexactos. (B) Un ejemplo de vista de transmisión en vivo de una muestra correctamente diluida. Hay 60-100 partículas visibles en la pantalla y la grabación da como resultado una concentración bruta de 5 x10 6- 2 x 108 partículas / ml. (C) Un ejemplo de vista de transmisión en vivo de una muestra que está demasiado diluida. Si una muestra está tan diluida, no habrá suficientes partículas rastreadas, disminuyendo el tamaño de la muestra y, por lo tanto, los resultados serán estadísticamente inválidos. En este caso, se recomienda aumentar el número de videos grabados. Haga clic aquí para ver una versión más grande de esta figura.
6. Adquisición de datos de vídeo
- (Opcional) Establezca la configuración de zoom en 0.5x para ahorrar ancho de banda y evitar la pérdida de fotogramas.
- Comience a grabar los videos haciendo clic en Grabar (consulte la Tabla 1 para conocer los parámetros de grabación recomendados).
NOTA: De forma predeterminada, el instrumento agitará la muestra durante 5 s, esperará 3 s y, a continuación, grabará durante 10 s antes de repetir este proceso. El tiempo de medición típico para 50 videos es de ~ 15 minutos para grabar y ~ 13 minutos para procesar. - No toque el instrumento mientras graba videos. Asegúrese de que la superficie del banco de laboratorio no esté vibrando.
NOTA: Es preferible que el instrumento se configure en una plataforma o mesa antivibración para reducir cualquier perturbación de vibración del equipo cercano que interfiera con la determinación del movimiento de las nanopartículas. Evite operar centrífugas, mezcladores de vórtice u otros dispositivos potenciales generadores de vibraciones en el mismo banco que el instrumento de seguimiento de partículas. Las vibraciones son fácilmente visibles en la pantalla como el alargamiento de partículas generalmente redondas. Si se expone a vibraciones vigorosas, el instrumento puede requerir la realineación de elementos ópticos. El instrumento no fue diseñado para ser reparado o calibrado por el cliente; póngase en contacto con el fabricante para el mantenimiento, el servicio y la calibración. - Tenga en cuenta cualquier video grabado que tenga partículas muy grandes visibles como manchas blancas grandes e irregulares. Elimine estos videos del procesamiento en el paso 7.3.
7. Tratar los datos adquiridos
- Cuando aparezca un mensaje que indique que se han grabado vídeos, haga clic en Aceptar para completar la grabación. A continuación, seleccione la pestaña Proceso.
NOTA: El protocolo se puede detener aquí. El procesamiento de los datos adquiridos se puede reiniciar más tarde moviéndose directamente a la pestaña Proceso después de abrir el software del instrumento de seguimiento de partículas y especificar el directorio donde se guardan los videos grabados. - Al analizar los vehículos eléctricos, marque la casilla Deshabilitar la anulación de detección automática y establezca el diámetro de la función en 30. Haga clic en Proceso. (Consulte la Tabla 2 para la configuración de procesamiento y la Figura suplementaria 2 para la visualización de procesamiento). Se mostrará un gráfico de distribución en vivo para que el usuario pueda ver el procesamiento en tiempo real.
- Para los exosomas, procese con el umbral de detección establecido en el ejemplo de polidispersopredeterminado . Procese los datos con el Manual de umbral de detección establecido en 0,8 en lugar de un umbral estándar de 0,99 solo para soluciones con diferencias muy grandes en los tamaños de partícula.
- Si algún video tenía partículas notablemente muy grandes visibles (consulte el Paso 6.4), navegue hasta el directorio de videos grabados y elimine el video problemático. Después de editar la lista de archivos de video, cambie el número de videos grabados en otros registros mantenidos por el usuario.
- Una vez finalizado el procesamiento, haga clic en Aceptar. A continuación, seleccione la pestaña Trazar. Para los vehículos eléctricos, muestre el gráfico principal como LogBinSilica.
NOTA: Aquí, en la pestaña Trazar, el usuario puede personalizar otras características del gráfico, como definir el rango del eje x (diámetro de partícula, nm) para establecer el área de integración de la figura producida.
8. Mostrar e interpretar los resultados
- Para crear un informe PDF, haga clic en el botón Informe. La medición ya está completa y se pueden ver los resultados.
NOTA: Recuerde registrar y procesar primero el espacio en blanco para que se pueda corregir la concentración de fondo de las muestras posteriores. Si se olvida este paso, el espacio en blanco se puede registrar después de las muestras y la concentración de partículas de la muestra se corrige manualmente. - Examine el informe PDF que muestra la media, la mediana y el tamaño del modo, así como la concentración ajustada para el factor de dilución y corregida restando la concentración de partículas del diluyente. También se muestra el ancho de distribución (desviación estándar).
NOTA: Hay muy pocas aplicaciones en las que un solo valor sea apropiado y representativo. Por lo tanto, se recomienda describir toda la distribución de tamaño e informar el ancho de la distribución para cualquier muestra analizada (como se muestra en la Tabla 3, por ejemplo). - Registre los siguientes ajustes del instrumento utilizados para generar los datos que deben indicarse al informar los resultados: Diluyente, Potencia láser de cada láser [mW], Exposición [ms], Ganancia [dB], Velocidad de fotogramas [fps], Fotogramas por video, Número de videos grabados, Configuración de procesamiento (por ejemplo, LogBinSilica), Rango de integración [min nm, max nm] (recomendado para establecer min a 50 nm) y Número de partículas rastreadas (deseable para analizar al menos ~ 150 partículas por video; mínimo 3,750 pistas totales por muestra recomendado para evitar picos artificiosos en la distribución del tamaño de partícula y generar datos estadísticamente significativos).
9. Limpieza de las cubetas
- Limpie las cubetas manualmente entre muestras. Primero, vacía la cubeta.
NOTA: La muestra se puede recuperar de la cubeta y guardar o descartar. - Una vez que la cubeta esté vacía, limpie la cubeta enjuagándola 10-15 veces con agua desionización (DI). Luego, enjuague 3 veces con etanol (70-100%). Al hacer esto, asegúrese de llenar completamente la cubeta con disolvente.
- Seque el exterior de la cubeta con un paño de microfibra sin pelusa. Evite las manchas en las superficies. Seque al aire el interior de la cubeta o séquelo con un plumero de aire comprimido.
NOTA: Solo se debe usar papel de limpieza de lentes o paño de microfibra sin pelusa para limpiar las superficies ópticas de la cubeta, ya que la mayoría de los productos de papel contienen pequeñas fibras de madera que pueden rayar o dañar la superficie de la cubeta. - Prepare dos viales de centelleo de vidrio: uno lleno de etanol 70-100% y el otro con agua DI. Enjuague los insertos y revuelva las barras en el etanol primero (luego agua DI) colocando el inserto / barra de agitación en el vial de centelleo apropiado y agitando el vial vigorosamente. Seque los insertos y revuelva las barras con paños sin pelusa o plumeros de aire comprimido.
NOTA: La cubeta y el inserto también se pueden limpiar con un baño de agua sonicante. Para hacerlo, primero asegúrese de que la unidad sonicante contenga suficiente agua (al menos 5 cm de profundidad). Luego coloque la cubeta e insértela dentro de un vaso de precipitados de vidrio (50 ml o más), llene el vaso de precipitados con alcohol al mismo nivel que el baño de agua, coloque el vaso de precipitados en el agua y encienda la alimentación. Sonicar durante un máximo de 5 minutos a la vez, lo que permite que la máquina descanse >5 minutos entre cada ráfaga de 5 minutos si se requieren tiempos más largos. - Cuando termine, coloque inmediatamente todos los componentes limpios y secos para su almacenamiento.
Access restricted. Please log in or start a trial to view this content.
Resultados
Antes de esta demostración, la calibración del instrumento se probó por primera vez para garantizar la validez de los datos adquiridos mediante la medición de la distribución de tamaño de los estándares de perlas de poliestireno. Probamos la distribución de tamaño de cuentas de 100 nm y 400 nm utilizando los parámetros de grabación predeterminados y la configuración de procesamiento recomendada en este protocolo (Figura 8).
Para el estándar de perlas ...
Access restricted. Please log in or start a trial to view this content.
Discusión
Aquí, demostramos un protocolo para NTA de EV para medir la distribución de tamaño de una amplia gama de tamaños de partículas simultáneamente y medir la concentración total de EV en una muestra polidispersa. En este estudio, se utilizó tejido adiposo perigonadal de ratón y plasma humano como fuente de vehículos eléctricos. Sin embargo, los VEHÍCULOS eléctricos aislados de otros tejidos o fluidos biológicos como suero, orina, saliva, leche materna, líquido amniótico y sobrenadante de cultivo celular tambi...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Todos los autores declararon que no hay conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Salud (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Reconocemos a Jeffrey Bodycomb, Ph.D. de HORIBA Instruments Incorporated por su ayuda en la calibración del instrumento.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
Referencias
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021(2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, San Diego, California. 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569(2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421(2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , Clifton, N.J. 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016(2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. Absorption and Scattering of Light by Small Particles. , John Wiley & Sons. (1983).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados