Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Nanopartikel-Tracking-Analyse zur Quantifizierung und Größenbestimmung extrazellulärer Vesikel
In diesem Artikel
Zusammenfassung
Wir zeigen, wie man ein neuartiges Nanopartikel-Tracking-Analyseinstrument verwendet, um die Größenverteilung und Gesamtpartikelkonzentration von extrazellulären Vesikeln abzuschätzen, die aus dem periigonadalen Fettgewebe der Maus und dem menschlichen Plasma isoliert wurden.
Zusammenfassung
Die physiologischen und pathophysiologischen Rollen extrazellulärer Vesikel (EVs) werden zunehmend anerkannt, was das EV-Feld zu einem sich schnell entwickelnden Forschungsgebiet macht. Es gibt viele verschiedene Methoden zur Isolierung von Elektrofahrzeugen, die jeweils unterschiedliche Vor- und Nachteile haben, die sich auf die nachgelagerte Ausbeute und Reinheit von Elektrofahrzeugen auswirken. Daher ist die Charakterisierung der EV-Vorbereitung, die aus einer bestimmten Quelle durch eine gewählte Methode isoliert wurde, wichtig für die Interpretation der nachgelagerten Ergebnisse und den Vergleich der Ergebnisse zwischen Labors. Es gibt verschiedene Methoden zur Bestimmung der Größe und Menge von Elektrofahrzeugen, die durch Krankheitszustände oder als Reaktion auf äußere Bedingungen verändert werden können. Die Nanopartikel-Tracking-Analyse (NTA) ist eine der führenden Technologien für die Hochdurchsatzanalyse einzelner Elektrofahrzeuge. Hier präsentieren wir ein detailliertes Protokoll zur Quantifizierung und Größenbestimmung von EVs, die aus periguronadalem Fettgewebe und menschlichem Plasma der Maus isoliert wurden, wobei eine bahnbrechende Technologie für NTA verwendet wurde, die große Fortschritte auf diesem Gebiet darstellt. Die Ergebnisse zeigen, dass diese Methode reproduzierbare und valide Daten zur Gesamtpartikelkonzentration und -größenverteilung für EVs liefern kann, die mit verschiedenen Methoden aus verschiedenen Quellen isoliert wurden, wie durch die Transmissionselektronenmikroskopie bestätigt. Die Anpassung dieses Instruments an NTA wird die Notwendigkeit einer Standardisierung von NTA-Methoden adressieren, um die Strenge und Reproduzierbarkeit in der EV-Forschung zu erhöhen.
Einleitung
Extrazelluläre Vesikel (EVs) sind kleine (0,03-2 μm) membrangebundene Vesikel, die von fast allen Zelltypen abgesondert werden1. Sie werden oft als "Exosomen", "Mikrovesikel" oder "apoptotische Körper" bezeichnet, abhängig von ihrem Freisetzungsmechanismus und ihrer Größe2. Während man anfangs dachte, dass EVs nur ein Mittel sind, um Abfälle aus der Zelle zu entfernen, um die Homöostaseaufrechtzuerhalten 3,wissen wir jetzt, dass sie auch an der interzellulären Kommunikation durch Transfer von molekularem Material - einschließlich DNA, RNA (mRNA, microRNA), Lipiden und Proteinen4,5 - teilnehmen können und dass sie wichtige Regulatoren der normalen Physiologie sowie pathologischer Prozesse sind1. 5,6,7,8.
Es gibt viele verschiedene Methoden zur Isolierung und Quantifizierung von EVs, die an anderer Stelle beschrieben wurden9,10,11,12. Das verwendete Isolationsprotokoll sowie die Quelle von Elektrofahrzeugen können die EV-Ausbeute und -Reinheit stark beeinflussen. Selbst die differentielle Zentrifugation, die lange als "Goldstandard" -Ansatz für die Exosomenisolierung galt, kann einer erheblichen Variabilität unterliegen, die sich anschließend auf die erhaltene EV-Population und die nachgelagerten Analysen auswirkt13. Daher erschweren die verschiedenen Methoden zur Isolierung und Quantifizierung von Elektrofahrzeugen den Vergleich, die Reproduktion und die Interpretation der Ergebnisse von Experimenten, die in der Literaturberichtet wurden 14. Darüber hinaus kann die EV-Freisetzung durch zelluläre Bedingungen oder verschiedene externe Faktoren reguliert werden. Es wurde vorgeschlagen, dass EVs eine Rolle bei der Aufrechterhaltung der zellulären Homöostase spielen, indem sie Zellen vor intrazellulärem Stressschützen 15, da mehrere Studien gezeigt haben, dass zellulärer Stress die EV-Sekretion stimuliert. Zum Beispiel wurde eine erhöhte EV-Freisetzung nach zellulärer Exposition gegenüber Hypoxie, endoplasmatischem Retikulumstress, oxidativem Stress, mechanischem Stress, Zigarettenrauchextrakt und Feinstaubluftverschmutzung berichtet16,17,18,19,20,21,22. Es wurde auch gezeigt, dass die EV-Freisetzung in vivo modifiziert wurde; Mäuse, die sechzehn Stunden lang einer fettreichen Diät oder einem Fasten unterzogen wurden, setzten mehr Adipozyten-EVsfrei 23. Um zu untersuchen, ob eine bestimmte Behandlung oder bedingung die Ev-Freisetzung verändert, muss die Anzahl der EVs genau bestimmt werden. Die Beurteilung der EV-Größenverteilung kann auch auf den vorherrschenden subzellulären Ursprung von EVs hinweisen (z. B. Fusion von späten Endosomen / multivesikulären Körpern mit der Plasmamembran vs. Knospung der Plasmamembran)24. Daher besteht ein Bedarf an robusten Methoden, um die Gesamtkonzentration und die Größenverteilung des untersuchten EV-Preps genau zu messen.
Eine schnelle und hochempfindliche Methode zur Visualisierung und Charakterisierung von Elektrofahrzeugen in Lösung ist die Nanopartikel-Tracking-Analyse (NTA). Eine detaillierte Erläuterung der Prinzipien dieser Methode und der Vergleich mit alternativen Methoden zur Beurteilung der EV-Größe und -Konzentration wurden zuvor beschrieben25,26,27,28. Kurz gesagt, während der NTA-Messung werden EVs durch das Licht visualisiert, das gestreut wird, wenn sie mit einem Laserstrahl bestrahlt werden. Das Streulicht wird von einem Mikroskop auf eine Kamera fokussiert, die die Partikelbewegung aufzeichnet. Die NTA-Software verfolgt die zufällige thermische Bewegung jedes Teilchens, bekannt als Brownsche Bewegung, um den Diffusionskoeffizienten zu bestimmen, der verwendet wird, um die Größe jedes Teilchens mit der Stokes-Einstein-Gleichung zu berechnen. NTA wurde erstmals 2011 zur Messung von Elektrofahrzeugen in einer biologischen Probe angewendet25. Bis vor kurzem gab es nur zwei Mainstream-Unternehmen, die kommerzielle NTA-Instrumente29 anboten, bis zur Einführung des ViewSizer 3000 (im Folgenden als Partikelverfolgungsinstrument bezeichnet), das eine Kombination aus neuartigen Hardware- und Softwarelösungen verwendet, um erhebliche Einschränkungen anderer NTA-Techniken zu überwinden.
Das Partikelverfolgungsinstrument charakterisiert Nanopartikel in flüssigen Proben durch Analyse ihrer Brownschen Bewegung und charakterisiert größere mikrometergroße Partikel durch Analyse der Gravitationsablagerung. Das einzigartige optische System dieses Instruments, das eine multispektrale Beleuchtung mit drei Laserlichtquellen (bei 450 nm, 520 nm und 635 nm) umfasst, ermöglicht es den Forschern, eine Vielzahl von Partikelgrößen (z. B. Exosomen, Mikrovesikel) gleichzeitig zu analysieren. Ein Schema des Geräteaufbaus ist in Abbildung 1 dargestellt.
Hier zeigen wir, wie man Partikelgrößenverteilungs- und Konzentrationsmessungen von isolierten Maus- und Human-EVs mit einem neuartigen NTA-Instrument durchführt.
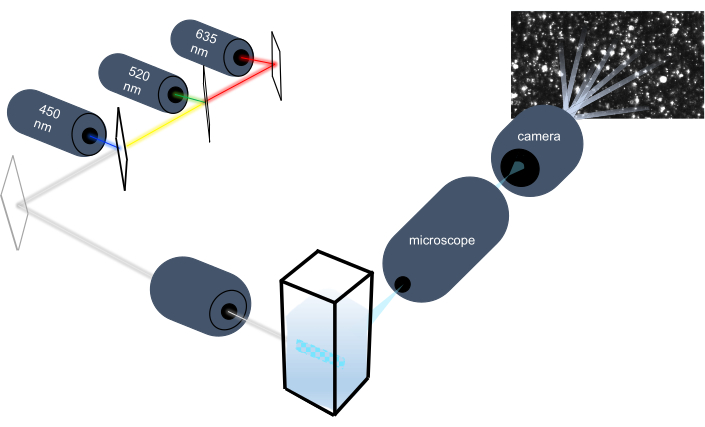
Abbildung 1:Optisches System des Partikelverfolgungsinstruments. Das NTA-Instrument beleuchtet Partikel mit drei Lasern mit folgenden Wellenlängen: 450 nm, 520 nm, 635 nm. Die Videoaufzeichnung des Streulichts einzelner Partikel wird von einer digitalen Videokamera, die 90° von der Küvette ausgerichtet ist, detektiert und verfolgt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Arbeiten mit diesen Proben wurden in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee und des Institutional Review Board durchgeführt. Eine schematische Übersicht über die NTA-Methode ist in Abbildung 2dargestellt.
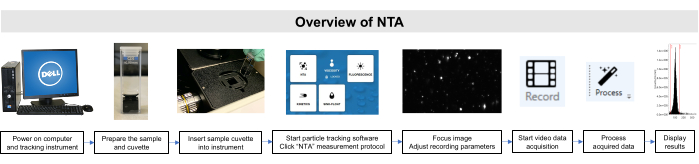
Abbildung 2: Überblick über die NTA-Methode mit dem Partikelverfolgungsinstrument. Die Probe wird vorbereitet und in das Instrument eingelegt. Die NTA-Software wird geöffnet, die Aufnahmeparameter werden angepasst und die Probe wird fokussiert. Anschließend werden die Daten erfasst, verarbeitet und angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Extrazelluläre Vesikelisolation
HINWEIS: Maus periigonadale Fettgewebe EVs wurden wie zuvor beschrieben isoliert23. Plasma-EVs wurden aus 1 ml menschlichem Plasma mit dem folgenden Protokoll isoliert:
- Sammeln Sie das Plasma und die Zentrifuge bei 3.000 x g für 15 Minuten, um Zelltrümmer zu entfernen. Übertragen Sie den Überstand in ein neues Rohr.
HINWEIS: Wenn zusätzliche Ablagerungen nachweisbar bleiben, zentrifugieren Sie den Überstand für weitere 10 minuten bei 12.000 x g und übertragen Sie den Überstand in ein neues Röhrchen. - Pro 250 μL Plasma werden 67 μL des Exosomen-Isolationsreagens hinzugefügt. Mischen Sie gut, indem Sie die Röhre invertieren oder streichen.
- Auf Eis aufrecht für 30 min inkubieren.
- Zentrifugieren Sie das Exosom-Isolationsreagenz/Plasma-Gemisch bei 3.000 x g für 10 min bei 4 °C.
HINWEIS: Die Zentrifugation kann bei Raumtemperatur oder 4 °C mit ähnlichen Ergebnissen durchgeführt werden, aber 4 °C wird bevorzugt. Nach der Zentrifugation können die EVs als beige oder weißes Pellet am Boden des Rohrs erscheinen. - Saugen Sie den Überstand vorsichtig ab. Spinnen Sie alle verbleibenden Exosomen-Isolationslösungen herunter und entfernen Sie alle Flüssigkeitsspuren durch Aspiration, wobei Sie sehr darauf achten, die gefällten EVs im Pellet nicht zu stören.
- Das Pellet wird in 200 μL Puffer B (vom Hersteller bereitgestellt) wieder aufgebraucht. Messen und aufzeichnen Sie die Proteinkonzentration der Probe (für Schritt 2.8) mit einem Spektralphotometer, Fluorometer, Bradford-Assay oder einer anderen bevorzugten Methode.
2. Reinigung isolierter Elektrofahrzeuge
- Fügen Sie 200 μL Puffer A (vom Hersteller zur Verfügung gestellt) zu wieder suspendierten Elektrofahrzeugen hinzu.
- Nehmen Sie die Reinigungssäule (im Lieferumfang enthalten) heraus, lösen Sie den Schraubverschluss und schnappen Sie den Bodenverschluss ab. Legen Sie die Säule in ein Auffangrohr.
HINWEIS: Speichern Sie den unteren Verschluss für die Schritte 2.7-2.9. - Zentrifuge bei 1.000 x g für 30 s, um den Speicherpuffer zu entfernen.
- Verwerfen Sie den Durchfluss und setzen Sie die Säule wieder in das Auffangrohr ein.
- Um die Säule zu waschen, entfernen Sie die Kappe und tragen Sie 500 μL Puffer B auf das Harz und die Zentrifuge bei 1.000 x g für 30 s auf. Verwerfen Sie den Durchfluss. Speichern Sie die Obergrenze für die Schritte 2.7-2.9.
- Wiederholen Sie die Schritte 2.4-2.5 noch einmal, um die Säule zu waschen.
- Stecken Sie die Unterseite der Säule mit dem unteren Verschluss (ab Schritt 2.2). Tragen Sie 100 μL Puffer B auf das Harz auf, um es für die Probenbeladung vorzubereiten.
- Fügen Sie den gesamten Inhalt aus Schritt 1.6 (oder bis zu einem Volumenäquivalent von 4 mg Gesamtprotein) zum Harz hinzu. Setzen Sie den Schraubverschluss auf die Oberseite der Säule.
- Bei Raumtemperatur auf einem rotierenden Shaker für nicht mehr als 5 min mischen.
3. Probenelution
- Lösen Sie den Schraubverschluss und entfernen Sie den Bodenverschluss und geben Sie ihn sofort in ein 2-ml-Mikrozentrifugenrohr über.
HINWEIS: Die Probe beginnt zu eluieren, sobald der Bodenverschluss entfernt wird. Bitte stellen Sie sicher, dass 2 ml Mikrozentrifugenröhrchen bereit sind, Eluat zu erhalten, um den Probenverlust zu minimieren. - Zentrifuge bei 1.000 x g für 30 s, um gereinigte EVs zu erhalten. Verwerfen Sie die Spalte.
4. Probenvorbereitung für die Nanopartikel-Tracking-Analyse
- Verwenden Sie ein fusselfreies Material wie ein Mikrofasertuch, um den Arbeitsbereich abzudecken und zu verhindern, dass Fasern in Küvetten gelangen.
- Legen Sie die Küvette mit Handschuhen auf die magnetische Küvettenvorrichtung und legen Sie dann die Rührstange in die Küvette. Behandeln Sie die Küvetten immer mit Handschuhen, um zu verhindern, dass Fingerabdrücke und Flecken auf der Oberfläche der Küvette erscheinen.
- Verwenden Sie das Hakenwerkzeug, um den Einsatz in die Küvette einzulegen, wie in Abbildung 3dargestellt. Es ist wichtig, die Ausrichtung des Einsatzes für später zu beachten (Schritt 5.4).

Abbildung 3: Richtige Ausrichtung des Einsatzes innerhalb der Quarzküvette. Die "Notch" des Einsatzes sollte von der Vorderseite der Küvette sichtbar sein. Dieser sollte in das der Kamera zugewandte Instrument eingesetzt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Mit einer Pipette langsam 400-500 μL des Verdünnungsmittels oder der verdünnten Probe bei Raumtemperatur durch das Loch im Einsatz in die Küvette geben. Vorsichtig auf und ab pipetten, um zu mischen. Vermeiden Sie das Einbringen von Luftblasen.
- Bereiten Sie zunächst eine Küvette vor, die mit dem gewählten Verdünnungssstoff (Rohling) beladen ist, um die Partikelkonzentration des Verdünnungssstoffs zu messen. Dies sollte vor der Messung der Probe erfolgen, damit die Hintergrundkonzentration der Probe korrigiert werden kann.
HINWEIS: Ein guter Rohling (in diesem Fall phosphatgepufferte Kochsalzlösung [PBS]) hat eine Konzentration <9 x10 6 (abhängig vom Verdünnungssalstoff) und zeigt 1-10 Partikel pro Bildschirm in der Live-Ansicht an (Abbildung 4). Es wird empfohlen, dass die tatsächliche Probenpartikelkonzentration mindestens das 3-fache der Hintergrundkonzentration beträgt. - Optional wird vor der Aufzeichnung der Probenprimierung die Küvette mit 400-500 μL der Verdünnungs- oder verdünnten Probe vor der Messung aufgezäßt. Laden Sie dazu 400-500 μL der verdünnten Probe in die Küvette, entsorgen Sie die Lösung und fügen Sie dann 400-500 μL mehr von der Probe für die Messung hinzu. Dies kann beim Auswaschen von Rückständen in der Küvette helfen.
- Bereiten Sie zunächst eine Küvette vor, die mit dem gewählten Verdünnungssstoff (Rohling) beladen ist, um die Partikelkonzentration des Verdünnungssstoffs zu messen. Dies sollte vor der Messung der Probe erfolgen, damit die Hintergrundkonzentration der Probe korrigiert werden kann.

Abbildung 4: Repräsentative Live-Stream-Ansicht eines Verdünnungssstoffs im richtigen Konzentrationsbereich eines Rohlings. Verdünnen Sie EV-Preps in gefilterten (0,02 μm oder 3 kDa, bevorzugt) PBS. Ein guter Rohling zeigt ~ 1-10 Partikel pro Bildschirm in der Live-Ansicht an, was eine Konzentration im Bereich von 105-106ergibt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Verschließen Sie die Küvette und prüfen Sie auf Blasen. Tippen Sie bei Bedarf Blasen aus. Verwenden Sie ein fusselfreies Tuch, um die Außenflächen der Küvette abzuwischen.
5. Inbetriebnahme des Partikelverfolgungsinstruments
- Schalten Sie die Computerarbeitsstation und das Instrument ein, warten Sie einige Minuten, bevor Sie das erste Beispiel ausführen, und starten Sie das Programm, indem Sie auf das Softwaresymbol klicken. Wenn Sie dazu aufgefordert werden, klicken Sie auf dem Bildschirm auf NTA, um die Nanopartikel-Tracking-Analyse durchzuführen. Beginnen Sie auf der Registerkarte Aufzeichnung und klicken Sie auf die verschiedenen Softwareregisterkarten (Aufzeichnung, Prozess, Plot), um zwischen ihnen im gesamten Protokoll zu wechseln. Nehmen Sie zuerst die Probe (Verdünnungssalm oder EV-Vorbereitung) auf, verarbeiten Sie dann die Aufnahmen und zeichnen Sie schließlich die Ergebnisse auf.
- Folgen Sie den Anweisungen auf dem Bildschirm, um alle erforderlichen Informationen über die Probe auszufüllen. Überprüfen Sie, ob alle erforderlichen Felder ausgefüllt und korrekt sind, z. B. Probenname, Beschreibung, Probenvorbereitung, Verdünnungsfaktor [1000], Zieltemperatur (auf 22 °C eingestellt) und Verdünnungsmittel: Wählen Sie Verdünnungsmittel aus dem Dropdown-Menü aus und verwenden Sie PBS als Verdünnungsmittel für Elektrofahrzeuge. Wenn Sie PBS aus dem Dropdown-Menü auswählen, wird der Salzgehalt automatisch auf 9% aufgefüllt. Diese Informationen sind notwendig, um die dynamische Viskosität der Flüssigkeit zu bestimmen.
HINWEIS: Es kann bis zu 3 Minuten dauern, bis sich die Temperatur in der Küvette ausgleicht, auch wenn die Sonde bereits die gewünschte Temperatur anzeigt (dh der grüne Punkt wird stabil). Die Probenauslesungen können erheblich variieren, wenn die Zieltemperatur nicht eingestellt wird, da Die Temperaturunterschiede der Proben die Brownsche Bewegung der Partikel stark verändern können. - Öffnen Sie den Instrumentendeckel und entfernen Sie die Schutzkappe, auf der die Küvette platziert wird.
ACHTUNG: Das Partikelverfolgungsinstrument ist als Laserprodukt der Klasse 1 (21 CFR Ch. I Teil 1040), die Laser enthalten, die gefährlich sein können und schwere Verletzungen wie Verbrennungen und / oder dauerhafte Schäden des Sehvermögens verursachen können. Um Unfälle oder Verletzungen zu vermeiden, entfernen Sie die Instrumentenabdeckung nicht, indem Sie die Schrauben von der Seite abschrauben. Beachten Sie, dass die Laserstrahlen während des Betriebs vollständig eingeschlossen sind und keine Gefahr für den Benutzer darstellen. Außerdem ist eine magnetische Sicherheitsverriegelung in den Probenhalter des Instruments integriert, um zu verhindern, dass die Laser funktionieren, wenn die Kappe des Probenhalters entfernt wird. - Legen Sie die Küvette (ab Schritt 4.3) in der richtigen Ausrichtung in das Gerät (siehe Abbildung 5). Setzen Sie die Kappe über die Küvette und schließen Sie den Instrumentendeckel. Bedienen Sie das Instrument immer mit der Kappe über dem Probenhalter. Deaktivieren Sie die Sicherheitsverriegelungsfunktion nicht und versuchen Sie nicht, sie zu umgehen.

Abbildung 5: Richtige Ausrichtung der Küvette im Partikelverfolgungsinstrument. Das Gesicht der Küvette (mit der "Notch" des Einsatzes sichtbar) sollte der Kamera zugewandt sein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Schalten Sie die Kamera ein, indem Sie auf den Pfeil über Streamingklicken.
- Klicken Sie auf den Chevron-Pfeil, um die Datensatzeinstellungen zu erweitern. Stellen Sie Verstärkung und Laserleistung auf die für die Anwendung geeigneten Werte ein. Siehe Tabelle 1 (und ergänzende Abbildung 1)für Parameter, die für NTA von kleinen (100 nm) EVs verwendet werden.
HINWEIS: Diese erweiterten Einstellungen, auf die Sie durch Klicken auf den Chevron-Pfeil zugreifen, sind möglicherweise kennwortgeschützt. Verwenden Sie für die Aufzeichnung und Verarbeitung des Verdünnungsmittels (Leer) die gleichen Einstellungen wie für die nachfolgenden Proben. - Stellen Sie den Fokus ein, bis die Partikel richtig fokussiert sind. Die Fokussierung sollte auf relativ kleinen Partikeln erfolgen (Abbildung 6). Für kleine EV-Quantifizierungen (konsistent mit Exosomen) werden die folgenden Aufnahmeeinstellungen empfohlen: Bildrate: 30 fps, Belichtung: 15 ms, Rührzeit: 5 s, Wartezeit: 3 s, Laserleistung - Blau: 210 mW, Grün: 12 mW, Rot: 8 mW, Bilder pro Video: 300 Bilder und Verstärkung: 30 dB.
HINWEIS: Der Benutzer kann den Zoom auf das 1-fache erhöhen und/oder die Verstärkung erhöhen, um die Fokussierung zu unterstützen. Denken Sie daran, diese Parameter vor dem Aufnehmen von Videos auf empfohlene Werte zurückzustellen.
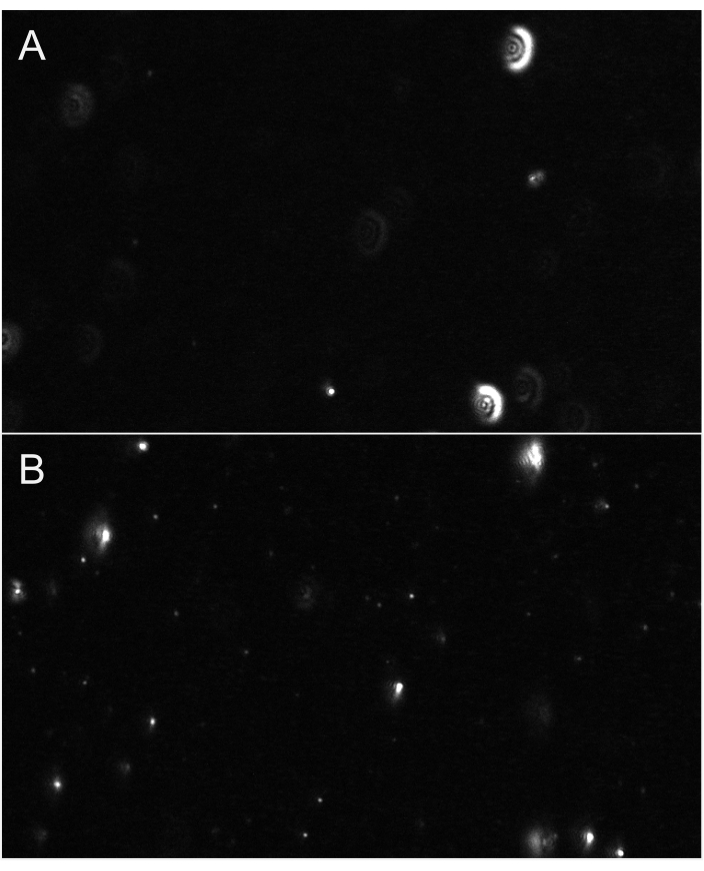
Abbildung 6: Repräsentative Livestream-Ansichten mit Partikelfokus. (A) Ein Beispiel für eine Livestream-Ansicht von Partikeln, die nicht im Fokus sind. Partikel haben einen glühenden Halo oder erscheinen verschwommen. Passen Sie den Fokus an. (B) Ein Beispiel für eine Livestream-Ansicht von Partikeln im richtigen Fokus. Die kleinsten Partikel sind im Fokus. Beginnen Sie mit der Aufnahme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Führen Sie eine visuelle Qualitätsprüfung durch, um sicherzustellen, dass die Probe ordnungsgemäß verdünnt wird. Wenn die Probe zu konzentriert ist, entfernen Sie die Küvette aus dem Instrument und verdünnen Sie die Probe nacheinander. Wiederholen Sie diesen Vorgang, bis die Probe ordnungsgemäß verdünnt ist, bevor Sie mit Schritt 6 fortfahren.
HINWEIS: Verdünnen Sie die Probe nicht zu viel! Verdünnungen immer nacheinander vornehmen. Das ideale Leerzeichen zeigt nur wenige Partikel auf dem Bildschirm (1-4) an, wie in Abbildung 4 dargestellt. In Bezug auf EV-Proben sind in einer ordnungsgemäß verdünnten Probe etwa 20-100 Partikel auf dem Bildschirm sichtbar, ohne glühende oder trübe Bilder im Hintergrund (siehe Abbildung 7 als Beispiel). Dies sollte zu einer optimalen Partikelkonzentration im Bereich von 5 x 106 bis 2 x 108 Partikeln pro ml führen (ohne Anpassung an den Verdünnungsfaktor).
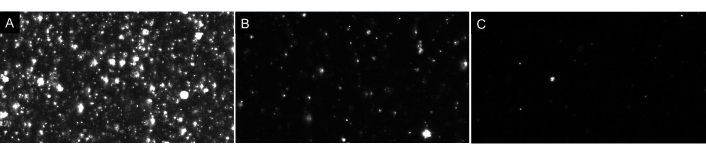
Abbildung 7: Repräsentative Livestream-Ansichten, die verschiedene Partikelverdünnungen darstellen. (A) Eine Beispiel-Livestream-Ansicht einer zu konzentrierten Probe. Die Aufzeichnung einer zu konzentrierten Probe führt zu ungenauen Ergebnissen. (B) Eine Beispiel-Livestream-Ansicht einer ordnungsgemäß verdünnten Probe. Es sind 60-100 Partikel auf dem Bildschirm sichtbar und die Aufnahme ergibt eine Rohkonzentration von 5 x 106- 2 x 108 Partikeln / ml. (C) Eine Beispiel-Livestream-Ansicht einer zu verdünnten Probe. Wenn eine Probe so verdünnt ist, werden nicht genügend Partikel verfolgt, was die Probengröße verringert und daher die Ergebnisse statistisch ungültig sind. In diesem Fall wird empfohlen, die Anzahl der aufgenommenen Videos zu erhöhen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Videodatenerfassung
- (Optional) Stellen Sie die Zoomeinstellung auf 0,5x ein, um Bandbreite zu sparen und verlorene Frames zu vermeiden.
- Beginnen Sie mit der Aufnahme der Videos, indem Sie auf Aufnahme klicken (siehe Tabelle 1 für empfohlene Aufnahmeparameter).
HINWEIS: Standardmäßig rührt das Instrument die Probe für 5 s, wartet 3 s und zeichnet dann für 10 s auf, bevor dieser Vorgang wiederholt wird. Die typische Messzeit für 50 Videos beträgt ~ 15 minuten für die Aufnahme und ~ 13 minuten für die Verarbeitung. - Berühren Sie das Instrument nicht, während Sie Videos aufnehmen. Stellen Sie sicher, dass die Oberfläche des Labortischs nicht vibriert.
HINWEIS: Es wird bevorzugt, dass das Instrument auf einer Anti-Vibrationsplattform oder einem Tisch aufgestellt wird, um Vibrationsstörungen von nahe gelegenen Geräten zu reduzieren, die die Bestimmung der Nanopartikelbewegung stören. Vermeiden Sie den Betrieb von Zentrifugen, Wirbelmischern oder anderen potenziell schwingungserzeugenden Geräten auf demselben Prüfstand wie das Partikelverfolgungsinstrument. Vibrationen sind auf dem Bildschirm als Dehnung von meist runden Partikeln gut sichtbar. Wenn das Instrument starken Vibrationen ausgesetzt ist, kann eine Neuausrichtung der optischen Elemente erforderlich sein. Das Gerät wurde nicht für die Gewartete oder Kalibrierung durch den Kunden entwickelt; Wenden Sie sich für Wartung, Service und Kalibrierung an den Hersteller. - Notieren Sie sich jedes aufgezeichnete Video mit sehr großen Partikeln, die als große, unregelmäßige weiße Blobs sichtbar sind. Entfernen Sie diese Videos aus der Verarbeitung in Schritt 7.3.
7. Erfasste Daten verarbeiten
- Wenn eine Eingabeaufforderung angezeigt wird, dass Videos aufgezeichnet wurden, klicken Sie auf OK, um die Aufnahme abzuschließen. Wählen Sie dann die Registerkarte Prozess.
HINWEIS: Das Protokoll kann hier gestoppt werden. Die Verarbeitung der erfassten Daten kann später neu gestartet werden, indem Sie direkt auf die Registerkarte Prozess wechseln, nachdem Sie die Software des Partikelverfolgungsinstruments geöffnet und das Verzeichnis angegeben haben, in dem die aufgezeichneten Videos gespeichert werden. - Aktivieren Sie bei der Analyse von EVs das Kontrollkästchen Automatische Erkennungsüberschreibung deaktivieren und legen Sie den Feature-Durchmesser auf 30fest. Klicken Sie auf Verarbeiten. (Siehe Tabelle 2 für Verarbeitungseinstellungen und ergänzende Abbildung 2 für die Verarbeitungsanzeige). Ein Live-Verteilungsdiagramm wird angezeigt, sodass der Benutzer die Verarbeitung in Echtzeit anzeigen kann.
- Für Exosomen ist der Nachweisschwellenwert auf die Standard-Polydisperse Probefestgelegt. Verarbeiten Sie die Daten mit einem Detection Threshold Manual, der auf 0,8 anstelle eines Standardschwellenwerts von 0,99 eingestellt ist, nur für Lösungen mit sehr großen Unterschieden in der Partikelgröße.
- Wenn bei Videos auffällig sehr große Partikel sichtbar waren (siehe Schritt 6.4), navigieren Sie zum Verzeichnis der aufgenommenen Videos und entfernen Sie das problematische Video. Nachdem Sie die Liste der Videodateien bearbeitet haben, ändern Sie die Anzahl der aufgezeichneten Videos in anderen vom Benutzer geführten Protokollen.
- Klicken Sie nach Abschluss der Verarbeitung auf OK. Wählen Sie dann die Registerkarte Plot aus. Zeigen Sie für EVs das Hauptdiagramm als LogBinSilicaan.
HINWEIS: Hier auf der Registerkarte Diagramm kann der Benutzer andere Funktionen des Diagramms anpassen, z. B. den Bereich der x-Achse (Partikeldurchmesser, nm) definieren, um den Bereich für die Integration für die erzeugte Figur festzulegen.
8. Ergebnisse anzeigen und interpretieren
- Um einen PDF-Bericht zu erstellen, klicken Sie auf die Schaltfläche Bericht. Die Messung ist nun abgeschlossen und die Ergebnisse können eingesehen werden.
HINWEIS: Denken Sie daran, den Rohling zuerst aufzuzeichnen und zu verarbeiten, damit die Hintergrundkonzentration der nachfolgenden Proben korrigiert werden kann. Wird dieser Schritt vergessen, kann der Rohling nach Proben erfasst und die Probenpartikelkonzentration manuell korrigiert werden. - Untersuchen Sie den PDF-Bericht, der den Mittelwert, den Median und die Modusgröße sowie die konzentration anzeigt, die für den Verdünnungsfaktor angepasst und durch Subtrahieren der Partikelkonzentration des Verdünnungsmittels korrigiert wurde. Die Verteilungsbreite (Standardabweichung) wird ebenfalls angezeigt.
HINWEIS: Es gibt nur sehr wenige Anwendungen, bei denen ein einzelner Wert angemessen und repräsentativ ist. Daher wird empfohlen, die gesamte Größenverteilung zu beschreiben und die Breite der Verteilung für jede analysierte Probe zu melden (wie z. B. in Tabelle 3 gezeigt). - Zeichnen Sie die folgenden Geräteeinstellungen auf, die zur Generierung der Daten verwendet werden, die bei der Meldung der Ergebnisse angegeben werden sollten: Verdünnung, Laserleistung jedes Lasers [mW], Belichtung [ms], Verstärkung [dB], Bildrate [fps], Frames pro Video, Anzahl der aufgenommenen Videos, Verarbeitungseinstellung (z. B. LogBinSilica), Integrationsbereich [min nm, max nm] (empfohlen, min bis 50 nm einzustellen) und Anzahl der verfolgten Partikel (wünschenswert, um mindestens ~ 150 Partikel pro Video zu analysieren; mindestens 3.750 Gesamtspuren pro Probe empfohlen, um künstliche Spitzen in der Partikelgrößenverteilung zu vermeiden und statistisch signifikante Daten zu generieren).
9. Reinigung der Küvetten
- Reinigen Sie küvetten manuell zwischen den Proben. Leeren Sie zuerst die Küvette.
HINWEIS: Die Probe kann entweder aus der Küvette geborgen und gespeichert oder entsorgt werden. - Sobald die Küvette leer ist, reinigen Sie die Küvette, indem Sie sie 10-15 Mal mit deionisiertem (DI) Wasser spülen. Dann 3 mal mit Ethanol abspülen (70-100%). Achten Sie dabei darauf, die Küvette vollständig mit Lösungsmittel zu füllen.
- Trocknen Sie die Außenseite der Küvette mit einem fusselfreien Mikrofasertuch. Vermeiden Sie Flecken auf den Oberflächen. Trocknen Sie die Innenseite der Küvette an der Luft oder trocknen Sie sie mit einem Druckluftstaubwedel.
HINWEIS: Zum Abwischen der optischen Oberflächen der Küvette sollten nur Linsenreinigungspapier oder fusselfreies Mikrofasertuch verwendet werden, da die meisten Papierprodukte kleine Holzfasern enthalten, die die Oberfläche der Küvette zerkratzen oder beschädigen können. - Bereiten Sie zwei Glasszintillationsfläschchen vor: eine mit 70-100% Ethanol und die andere mit DI-Wasser. Spülen Sie die Einsätze und Rührstäbe zuerst im Ethanol (dann DI-Wasser) aus, indem Sie den Einlege-/Rührstab in die entsprechende Szintillationsfläschchen geben und die Durchstechflasche kräftig schütteln. Trocknen Sie die Einsätze und Rührstangen mit fusselfreien Tüchern oder Druckluftstaubtüchern.
HINWEIS: Die Küvette und der Einsatz können auch mit einem Beschallungswasserbad gereinigt werden. Stellen Sie dazu zunächst sicher, dass die Beschallungseinheit genügend Wasser enthält (mindestens 5 cm Tiefe). Dann legen Sie die Küvette und setzen Sie sie in ein Glasbecherglas (50 ml oder größer) ein, füllen Sie das Becherglas mit Alkohol auf dem gleichen Niveau wie das Wasserbad, legen Sie das Becherglas in das Wasser und schalten Sie die Stromversorgung ein. Beschallen Sie maximal 5 Minuten auf einmal, so dass die Maschine zwischen jedem 5-minütigen Burst >5 Minuten ruhen kann, wenn längere Zeiten erforderlich sind. - Wenn Sie fertig sind, legen Sie sofort alle gereinigten und getrockneten Komponenten zur Lagerung weg.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Vor dieser Demonstration wurde zunächst die Kalibrierung des Instruments getestet, um die Gültigkeit der erfassten Daten durch Messung der Größenverteilung von Polystyrolperlenstandards sicherzustellen. Wir haben die Größenverteilung von 100 nm und 400 nm Perlen mit den Standardaufzeichnungsparametern und den in diesem Protokoll empfohlenen Verarbeitungseinstellungen getestet (Abbildung 8).
Für den 100 nm Polystyrolperlenstandard wurde eine Konzentration vo...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Hier demonstrieren wir ein Protokoll für NTA von Elektrofahrzeugen, um die Größenverteilung eines breiten Spektrums von Partikelgrößen gleichzeitig zu messen und die Gesamtkonzentration von Elektrofahrzeugen in einer polydispersen Probe zu messen. In dieser Studie wurden periguronadales Fettgewebe und menschliches Plasma der Maus als Quelle für EVs verwendet. EVs, die aus anderen Geweben oder biologischen Flüssigkeiten wie Serum, Urin, Speichel, Muttermilch, Fruchtwasser und Zellkulturüberstand isoliert wurden, k...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Alle Autoren erklärten, dass es keine Interessenkonflikte gibt.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608) unterstützt. Wir danken Jeffrey Bodycomb, Ph.D. von HORIBA Instruments Incorporated für seine Hilfe bei der Kalibrierung des Instruments.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
Referenzen
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021(2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, San Diego, California. 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569(2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421(2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , Clifton, N.J. 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016(2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. Absorption and Scattering of Light by Small Particles. , John Wiley & Sons. (1983).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten