Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre Dışı Veziklinlerin Nicelleştirilmesi ve Boyut Tayini için Nanopartikül Takip Analizi
Bu Makalede
Özet
Fare perigonadal yağ dokusundan ve insan plazmasından izole edilmiş hücre dışı veznelerin boyut dağılımını ve toplam partikül konsantrasyonu tahmin etmek için yeni bir nanopartikül izleme analiz aracının nasıl kullanılacağını gösteriyoruz.
Özet
Hücre dışı veziküllerin (EV) fizyolojik ve patofizyolojik rolleri giderek daha fazla tanınmaya devam ederek EV alanını hızla gelişen bir araştırma alanı haline getirmektedir. EV izolasyonu için, her biri EV'lerin aşağı akış verimini ve saflığını etkileyen farklı avantajlara ve dezavantajlara sahip birçok farklı yöntem vardır. Bu nedenle, belirli bir kaynaktan izole edilen EV hazırlığının seçilen bir yöntemle karakterize etmek, aşağı akış sonuçlarının yorumlanması ve sonuçların laboratuvarlar arasında karşılaştırılması için önemlidir. Hastalık durumlarıyla veya dış koşullara yanıt olarak değiştirilebilen EV'lerin boyutunu ve miktarını belirlemek için çeşitli yöntemler mevcuttur. Nanopartikül izleme analizi (NTA), bireysel EV'lerin yüksek verimli analizi için kullanılan önemli teknolojilerden biridir. Burada, NTA için alandaki büyük ilerlemeleri temsil eden çığır açan bir teknoloji kullanarak fare perigonadal yağ dokusundan ve insan plazmasından izole edilen EV'lerin nicelleştirilmesi ve boyut tespiti için ayrıntılı bir protokol sunuyoruz. Sonuçlar, bu yöntemin iletim elektron mikroskopisi ile doğrulanan farklı yöntemler kullanarak farklı kaynaklardan izole edilen EV'ler için tekrarlanabilir ve geçerli toplam parçacık konsantrasyonu ve boyut dağılımı verileri sunabileceğini göstermektedir. Bu enstrümanın NTA için uyarlanması, EV araştırmalarında titizliği ve tekrarlanabilirliği artırmak için NTA yöntemlerinde standardizasyon ihtiyacını giderecektir.
Giriş
Hücre dışı veziklinler (EV' ler) hemen hemen tüm hücre tipleri tarafından salgılanan küçük (0,03-2 μm) membran bağlı veziküllerdir1. Serbest bırakma mekanizmalarına ve boyut2'yebağlı olarak genellikle "ekzozomlar", "mikrovesiküller" veya "apoptotik cisimler" olarak adlandırılırlar. Başlangıçta EV'lerin homeostaz3'ükorumak için hücredeki atıkları ortadan kaldırmanın bir aracı olduğu düşünülürken, artık DNA, RNA (mRNA, mikroRNA), lipitler ve proteinler4,5 dahil olmak üzere moleküler materyal transferi yoluyla hücreler arası iletişime de katılabileceklerini ve normal fizyolojinin yanı sıra patolojik süreçlerin önemli düzenleyicileri olduklarını biliyoruz1. 5,6,7,8.
Başka bir yerde açıklananEV'leriizole etmek ve ölçmek için birçok farklı yöntem vardır 9,10,11,12. Kullanılan izolasyon protokolü ve EV'lerin kaynağı EV verimini ve saflığını büyük ölçüde etkileyebilir. Uzun zamandır eksozom izolasyonu için "altın standart" yaklaşımı olarak kabul edilen diferansiyel santrifüjleme bile, elde edilen EV popülasyonunu ve aşağı akış analizlerini etkileyen önemli değişkenliğe maruz kalabilir13. Bu nedenle, EV izolasyonu ve nicelleştirme için çeşitli farklı metodolojiler, literatürde bildirilen deneylerin sonuçlarını karşılaştırmayı, çoğaltmayı ve yorumlamayı zorlaştırır14. Ayrıca, EV salınımı hücresel koşullar veya çeşitli dış faktörler tarafından düzenlenebilir. EV'lerin hücreleri hücre içi strese karşı koruyarak hücresel homeostazın korunmasında rol oynadığı öne sürülüyor15Hücresel stresin EV salgısını uyardığını gösteren çeşitli çalışmalar. Örneğin, hipoksi, endoplazmik retikülum stresi, oksidatif stres, mekanik stres, sigara dumanı özü ve partikül madde hava kirliliği 16 , 17 , 18,19, 20,21,22'ye hücresel maruziyet sonrası artan EV salınımı bildirilmiştir. EV sürümünün de vivo olarak değiştirildiği gösterilmiştir; on altı saat boyunca yüksek yağlı bir diyete veya oruç tutmaya maruz kalan fareler daha fazla adipositEV'si serbest bırakıldı 23. Belirli bir tedavinin veya durumun EV salınımını değiştirip değiştirmediğini araştırmak için EV sayısı doğru bir şekilde belirlenmelidir. EV boyut dağılımının değerlendirilmesi, EV'lerin baskın hücre altı kökenini de gösterebilir (örneğin, geç endozomların / multivesiküler cisimlerin plazma zarı ile füzyonu ve plazma zarının tomurcuklanmaları)24. Bu nedenle, çalışılan EV hazırlığının toplam konsantrasyonu ve boyut dağılımını doğru bir şekilde ölçmek için sağlam yöntemlere ihtiyaç vardır.
Çözeltideki EV'lerin görselleştirilmesi ve karakterizasyonu için hızlı ve son derece hassas bir yöntem nanopartikül izleme analizidir (NTA). Bu yöntemin ilkelerinin ayrıntılı bir açıklaması ve EV büyüklüğü ve konsantrasyonunun değerlendirilmesi için alternatif yöntemlerle karşılaştırılması daha önceaçıklanmıştır 25,26,27,28. Kısaca, NTA ölçümü sırasında, EV'ler bir lazer ışını ile ışınlandıklarında saçılan ışık tarafından görselleştirilir. Dağınık ışık, parçacık hareketini kaydeden bir kameraya mikroskopla odaklanır. NTA yazılımı, Stokes-Einstein denklemini kullanarak her parçacığın boyutunu hesaplamak için kullanılan difüzyon katsayısını belirlemek için Brownian hareketi olarak bilinen her parçacığın rastgele termal hareketini izler. NTA ilk olarak 2011 yılında biyolojik bir örneklemde EV ölçümüne uygulanmıştır25. Yakın zamana kadar, diğer NTA tekniklerinin önemli sınırlamalarını aşmak için yeni donanım ve yazılım çözümlerinin bir kombinasyonunu kullanan ViewSizer 3000'in (bundan böyle parçacık izleme cihazı olarak anılacaktır) tanıtımına kadar ticari NTA enstrümanları29 sunan sadece iki ana akım şirket vardı.
Parçacık izleme cihazı, Brownian hareketlerini analiz ederek sıvı numunelerdeki nanopartikülleri karakterize eder ve yerçekimsel çökeltme analiz ederek daha büyük mikron boyutlu parçacıkları karakterize eder. Üç lazer ışık kaynağına (450 nm, 520 nm ve 635 nm'de) sahip multispektral aydınlatma içeren bu cihazın benzersiz optik sistemi, araştırmacıların çok çeşitli parçacık boyutlarını (örneğin, ekzozomlar, mikrovesiküller) aynı anda analiz etmelerini sağlar. Cihaz kurulumunun şeması Şekil 1'de gösterilmiştir.
Burada, yeni bir NTA cihazı kullanarak izole fare ve insan EV'lerinin parçacık boyutu dağılımı ve konsantrasyon ölçümlerinin nasıl gerçekleştirildiğini gösteriyoruz.
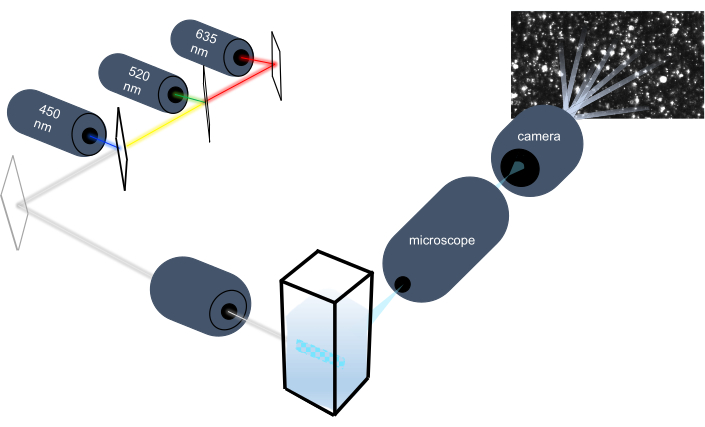
Şekil 1: Parçacık izleme cihazı optik sistemi. NTA cihazı, aşağıdaki dalga boylarına sahip üç lazer kullanarak parçacıkları aydınlatır: 450 nm, 520 nm, 635 nm. Tek tek parçacıklardan gelen dağınık ışığın video kaydı, cuvette'den 90° odaklı bir dijital video kamera tarafından algılanır ve izlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu numunelerle yapılan tüm çalışmalar Kurumsal Hayvan Bakım ve Kullanım Komitesi ve Kurumsal İnceleme Kurulu yönergelerine uygun olarak gerçek gerçekleştirildi. Şekil 2'de NTA yöntemine şematik bir genel bakış resmedilmiştir.
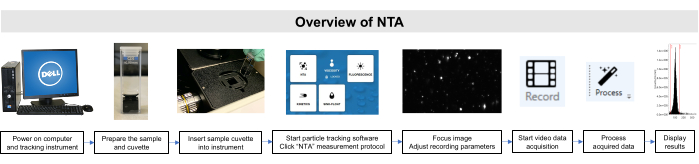
Şekil 2: Parçacık izleme aletini kullanarak NTA yöntemine genel bakış. Numune hazırlanır ve cihaza yerleştirilir. NTA yazılımı açılır, kayıt parametreleri ayarlanır ve örnek odaklanır. Daha sonra veriler kaydedilir, işlenir ve görüntülenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Hücre dışı veziklin izolasyonu
NOT: Fare perigonadal yağ dokusu EV'leri daha önce açıklandığı gibi izole edildi23. Plazma EV'leri aşağıdaki protokol kullanılarak 1 mL insan plazmasından izole edildi:
- Hücresel kalıntıları gidermek için plazmayı ve santrifüjü 15 dakika boyunca 3.000 x g'da toplayın. Süpernatant'ı yeni bir tüpe aktarın.
NOT: Ek enkaz tespit edilebilir kalırsa, süpernatantı 12.000 x g'da 10 dakika daha santrifüj edin ve süpernatantı yeni bir tüpe aktarın. - 250 μL plazma başına 67 μL ekzozom izolasyon reaktifi ekleyin. Tüpü ters çevirerek veya hareket ettirerek iyice karıştırın.
- 30 dakika boyunca buz üzerinde dik olarak kuluçkaya yaslanın.
- Eksozom izolasyon reaktifi/plazma karışımını 3.000 x g'da 4 °C'de 10 dakika santrifüjleyin.
NOT: Santrifüjleme oda sıcaklığında veya benzer sonuçlarla 4 °C'de yapılabilir, ancak 4 °C tercih edilir. Santrifüjlemeden sonra, EV'ler tüpün dibinde bej veya beyaz bir pelet olarak görünebilir. - Üstten dikkatlice emişli. Herhangi bir artık eksozom izolasyon çözeltisini aşağı çevirin ve topaktaki çökelmiş EV'leri rahatsız etmemeye büyük özen harcayarak aspirasyonla tüm sıvı izlerini giderin.
- Peletin 200 μL Tampon B'de (üretici tarafından sağlanır) yeniden süzülür. Spektrofotometre, florometre, Bradford tahlil veya tercih edilen diğer yöntemi kullanarak numunenin protein konsantrasyonunu (adım 2.8 için) ölçün ve kaydedin.
2. İzole EV'lerin saflaştırılması
- Yeniden askıya alınan EV'lere 200 μL Tampon A (üretici tarafından sağlanır) ekleyin.
- Arıtma kolonunu (sağlanan) çıkar, vida kapağını gevşet ve alt kapağı kopar. Sütunu bir toplama tüpüne yerleştirin.
NOT: Alt kapanışı 2.7-2.9 adımlarına kaydedin. - Depolama tamponu çıkarmak için 30 s için 1.000 x g'da santrifüj.
- Akış içini atın ve sütunu toplama tüpüne geri yerleştirin.
- Sütunu yıkamak için kapağı çıkarın ve reçinenin üzerine 500 μL Tampon B uygulayın ve 30 s için 1.000 x g'da santrifüj uygulayın. Akışı atın. Kapağı 2.7-2.9 adımları için sakla.
- Sütunu yıkamak için 2.4-2.5 adımlarını bir kez daha yineleyin.
- Sütunun altını alt kapayıpla takın (adım 2.2'den itibaren). Numune yüklemesine hazırlamak için reçinenin üzerine 100 μL Tampon B uygulayın.
- 1.6 adımından (veya toplam proteinin 4 mg'ına eşdeğer hacme kadar) tüm içeriği reçineye ekleyin. Vida kapağını sütunun üstüne yerleştirin.
- Oda sıcaklığında dönen bir çalkalayıcıda en fazla 5 dakika karıştırın.
3. Örnek elution
- Vida kapağını gevşetin ve alt kapağı çıkarın ve hemen 2 mL mikrosantrifüj tüpüne aktarın.
NOT: Alt kapama çıkarılır çıkarılmaz numune elüte olmaya başlayacaktır. Numune kaybını en aza indirmek için lütfen 2 mL mikrosantrifüj tüplerin elüat almaya hazır olduğundan emin olun. - Saflaştırılmış EV'ler elde etmek için 30 s için 1.000 x g'da santrifüj. Sütunu atın.
4. Nanopartikül izleme analizi için numune hazırlığı
- Çalışma alanını kaplamak ve liflerin cuvettes'e girmesini önlemek için mikrofiber bez gibi tüy bırakmayan bir malzeme kullanın.
- Eldiven takın, cuvette'i manyetik cuvette jig üzerine yerleştirin, ardından karıştırma çubuğunu cuvette'e yerleştirin. Cuvette yüzeyinde parmak izi ve lekelerin görünmesini önlemek için cuvette'leri her zaman eldivenle kullanın.
- Kesici ucu Şekil 3'tegösterildiği gibi cuvette içine yerleştirmek için kanca aracını kullanın. Kesici ucun daha sonrası için yönünü not etmek önemlidir (Adım 5.4).

Şekil 3: Kuvars cuvette içindeki kesici ucun doğru yönlendirilerek yönlendirilir. Kesici ucun "çentiği" cuvette'in önünden görülmelidir. Bu, kameraya bakan cihaza yerleştirilmelidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Bir pipet kullanarak, oda sıcaklığında seyreltici veya seyreltilmiş numunenin 400-500 μL'lik kısmını yavaşça kesici uçtaki delikten cuvette'e ekleyin. Karıştırmak için yavaşça yukarı ve aşağı pipet. Hava kabarcıklarını tanıtmaktan kaçının.
- İlk önce seyrelticinin parçacık konsantrasyonu ölçmek için seçilen seyreltici (boş) ile yüklü bir cuvette hazırlayın. Bu, numuneyi ölçmeden önce yapılmalıdır, böylece numunenin arka plan konsantrasyonu düzeltilebilir.
NOT: İyi bir boşluk (bu durumda fosfat tamponlu salin [PBS] <9 x 106 (seyrelticiye bağlı olarak) konsantrasyona sahip olacak ve canlı görüntüde ekran başına 1-10 parçacık gösterecektir (Şekil 4). Gerçek numune partikül konsantrasyonu en az 3 kat arka plan konsantrasyonu olması önerilir. - İsteğe bağlı olarak, numuneyi kaydetmeden önce cuvette'i ölçümden önce seyreltici veya seyreltilmiş numunenin 400-500 μL'si ile astarlar. Bunu yapmak için, seyreltilmiş numunenin 400-500 μL'yi cuvette'e yükleyin, çözeltiyi atın ve ardından ölçüm için numuneden 400-500 μL daha ekleyin. Bu, cuvette içindeki kalıntıların yıkanmasında yardımcı olabilir.
- İlk önce seyrelticinin parçacık konsantrasyonu ölçmek için seçilen seyreltici (boş) ile yüklü bir cuvette hazırlayın. Bu, numuneyi ölçmeden önce yapılmalıdır, böylece numunenin arka plan konsantrasyonu düzeltilebilir.

Şekil 4: Bir boşluğun uygun konsantrasyon aralığındaki bir seyrelticinin temsili canlı akış görünümü. EV preps'i filtrelenmiş (0,02 μm veya 3 kDa, tercih edilir) PBS'de seyreltin. İyi bir boşluk, canlı görüntüde ekran başına ~1-10 parçacık görüntüler ve 105 -106aralığında bir konsantrasyon sağlar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Cuvette kapla ve kabarcıkları kontrol et. Gerekirse kabarcıklara dokunun. Cuvette'in dış yüzlerini silmek için tüy bırakmayan bir bez kullanın.
5. Parçacık izleme aletinin başlangıç prosedürü
- Bilgisayar iş istasyonunu ve enstrümanı açın, ilk örneği çalıştırmadan önce birkaç dakika bekleyin ve yazılım simgesine tıklayarak programı başlatın. İstendiğinde, Nanopartikül İzleme Analizi yapmak için ekranda NTA'yı tıklatın. Kayıt sekmesinden başlayın ve protokol boyunca aralarında geçiş yapmak için çeşitli yazılım sekmelerine(Kayıt, İşlem, Çizim)tıklayın. Önce örneği kaydedin (seyreltici veya EV hazırlığı), sonra kayıtları işleyin ve son olarak sonuçları çizin.
- Örnek hakkında gerekli tüm bilgileri doldurmak için ekrandaki yönergeleri izleyin. Gerekli tüm alanların tamamlanmış ve doğru olup olmadığını kontrol edin, örneğin Örnek adı, Açıklama, Örnek hazırlama, Seyreltme faktörü [1000], Hedef sıcaklık (22 °C olarak ayarlanmış) ve Seyreltici: Açılır menüden seyreltici seçin ve PBS'yi EV'ler için seyreltici olarak kullanın. Açılır menüden PBS'yi seçmek tuzluluğu otomatik olarak %9'a doldurur. Bu bilgi, sıvının dinamik viskozitesini belirlemek için gereklidir.
NOT: Prob zaten istenen sıcaklığı gösterse bile sıcaklığın cuvette içinde eşit olması 3 dakika kadar sürebilir (yani, yeşil nokta kararlı hale gelir). Örnek sıcaklık farklılıkları parçacıkların Brownian hareketini büyük ölçüde değiştirebileceğinden, hedef sıcaklık ayarlı değilse örnek okumaları önemli ölçüde değişebilir. - Cihazın kapağını açın ve cuvette'in yerleştirileceği koruyucu kapak kaplamasını çıkarın.
DİkKAT: Parçacık izleme cihazı Sınıf 1 lazer ürünü (21 CFR Ch. Ben bölüm 1040), tehlikeli olabilecek ve yanıklar ve / veya görmede kalıcı hasar gibi ciddi yaralanmalara neden olabilecek lazerler içerir. Kaza veya yaralanmayı önlemek için cıvataları yandan sökerek alet kapağını çıkarmayın. Çalışma sırasında lazer ışınlarının tamamen kapalı olduğunu ve kullanıcılar için hiçbir tehdit oluşturmadığını unutmayın. Ayrıca, numune tutucunun kapağı çıkarıldığında lazerlerin çalışmasını önlemek için cihazın numune tutucusuna manyetik bir emniyet kilidi yerleştirilmiştir. - Cuvette'i (Adım 4.3'ten itibaren) cihazın içine doğru yönde yerleştirin (bkz. Şekil 5). Kapağı cuvette'in üzerine değiştirin ve cihazın kapağını kapatın. Cihazı her zaman numune tutucunun üzerinde kapağı yerinde olacak şekilde çalıştırın. Emniyet kilitleme özelliğini devre dışı bırakmayın veya atlatmaya çalışmayın.

Şekil 5: Parçacık izleme cihazı içinde cuvette'in doğru yönlendirilir. Cuvette'in yüzü (kesici ucun "çentiği" görünürken) kameraya bakmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Akış 'ın üstündeki oka tıklayarak kamerayıaçın.
- Kayıt ayarlarını genişletmek için köşeli çift ayraç okını tıklatın. Kazanç ve Lazer gücünü uygulamaya uygun değerlere ayarlayın. Küçük (100 nm) EV'lerinNTA'sı için kullanılan parametreler için Tablo 1'e (ve Ek Şekil 1) bakın.
NOT: Köşeli çift ayraç oku tıklatılarak erişilen bu gelişmiş ayarlar parola korumalı olabilir. Seyreltici (boş) için kayıt ve işleme için sonraki örnekler için kullanılanlarla aynı ayarları kullanın. - Parçacıklar düzgün bir şekilde odaklanana kadar odağı ayarlayın. Odaklama nispeten küçük parçacıklar üzerinde yapılmalıdır(Şekil 6). Küçük EV nicelemesi için (ekzozomlarla tutarlı) aşağıdaki kayıt ayarları önerilir: Kare hızı: 30 fps, Pozlama: 15 ms, Karıştırma süresi: 5 s, Bekleme süresi: 3 s, Lazer gücü - Mavi: 210 mW, Yeşil: 12 mW, Kırmızı: 8 mW, Video başına kareler: 300 kare ve Kazanç: 30 dB.
NOT: Kullanıcı, odaklama konusunda yardımcı olmak için Yakınlaştırmayı 1x'e ve/veya Kazancı artırabilir. Video kaydetmeden önce bu parametreleri önerilen değerlere yeniden ayarlamayı unutmayın.
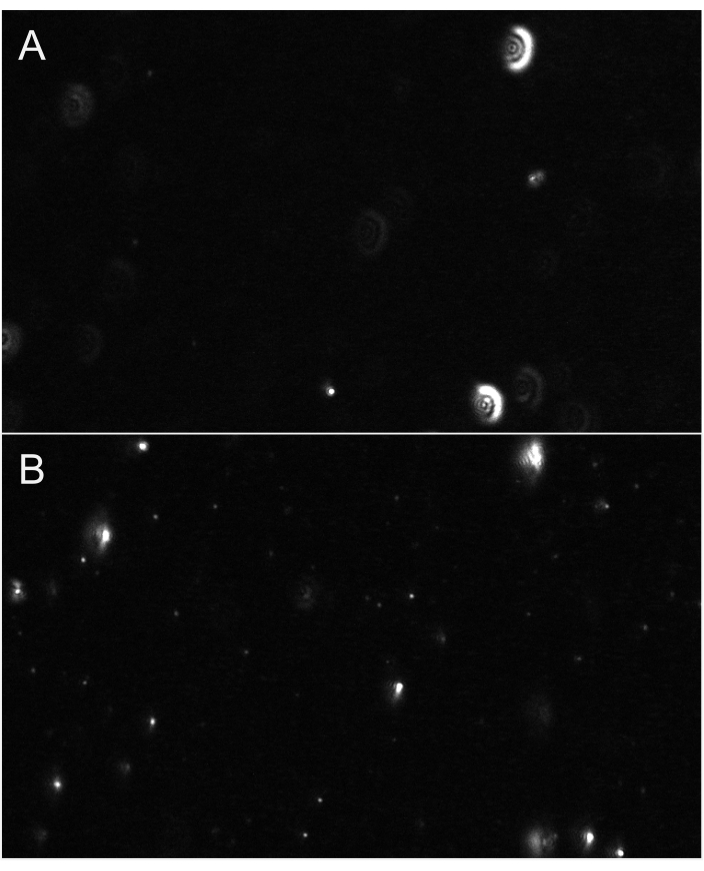
Şekil 6: Parçacık odağını gösteren temsili canlı yayın görünümleri. (A) Odakta olmayan parçacıkların örnek bir canlı akış görünümü. Parçacıklar parıltı benzeri haleye sahiptir veya bulanık görünür. Odağı ayarlayın. (B) Uygun odaktaki parçacıkların örnek bir canlı akış görünümü. En küçük parçacıklar odakta. Kayda başlayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Numunenin düzgün seyreltilmiş olduğundan emin olmak için görsel bir kalite kontrolü gerçekleştirin. Numune çok konsantreyse, cuvette'i aletten çıkarın ve numuneyi sırayla seyreltin. Adım 6'ya geçmeden önce örnek düzgün bir şekilde seyreltilene kadar tekrarlayın.
NOT: Numuneyi fazla seyreltmeyin! Seyreltmeleri her zaman sırayla yapın. İdeal boşluk, Şekil 4'tegösterildiği gibi ekranda (1-4) yalnızca birkaç parçacık görüntüler. EV örnekleriyle ilgili olarak, düzgün seyreltilmiş bir numune, arka planda parıltı benzeri veya bulutlu görüntüler olmadan ekranda yaklaşık 20-100 parçacık görünür olacaktır (örnek olarak Bkz. Şekil 7). Bu, mL başına 5 x 10 6 ila2 x 108 partikül aralığında optimum parçacık konsantrasyonuna neden olmalıdır (seyreltme faktörü için ayarlanmamalıdır).
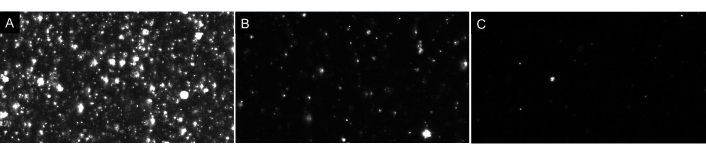
Şekil 7: Farklı parçacık seyreltmelerini gösteren temsili canlı akış görünümleri. (A) Çok konsantre bir örneğin canlı yayın görünümü. Çok konsantre bir örnek kaydetmek yanlış sonuçlar verecektir. (B) Düzgün seyreltilmiş bir numunenin örnek bir canlı yayın görünümü. Ekranda görülebilen 60-100 parçacık vardır ve kayıt sonuçları 5 x 10 6 -2x 108 parçacık / mL ham konsantrasyondadır. (C) Çok seyreltilmiş bir örneğin canlı yayın görünümü. Bir örnek bu kadar seyreltilmişse, izlenen yeterli parçacık olmayacak, numune boyutunu düşürecek ve bu nedenle sonuçlar istatistiksel olarak geçersiz olacaktır. Bu durumda, kaydedilen video sayısının artırılması önerilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Video veri toplama
- (İsteğe bağlı) Bant genişliğinden tasarruf etmek ve kayıp kareleri önlemek için yakınlaştırma ayarını 0,5x olarak ayarlayın.
- Kayıt'a tıklayarak videoları kaydetmeye başlayın (önerilen kayıt parametreleri için Tablo 1'e bakın).
NOT: Varsayılan olarak, cihaz numuneyi 5 sn karıştırır, 3 s bekler ve ardından bu işlemi tekrarlamadan önce 10 sn kaydeder. 50 video için tipik ölçüm süresi kaydetmek için ~ 15 dakika ve işlemek için ~ 13 dakikadır. - Video kaydederken cihaza dokunmayın. Laboratuvar tezgahının yüzeyinin titreşmediğinden emin olun.
NOT: Aletin, yakındaki ekipmandan gelen ve nanopartikül hareketinin belirlenmesini kesintiye uğratacak titreşim bozukluklarını azaltmak için titreşim önleyici bir platforma veya masaya ayarlı olması tercih edilir. Parçacık izleme cihazıyla aynı tezgahta santrifüjleri, girdap karıştırıcıları veya diğer potansiyel titreşim üreten cihazları çalıştırmaktan kaçının. Titreşimler, genellikle yuvarlak parçacıkların uzaması olarak ekranda kolayca görülebilir. Güçlü titreşimlere maruz kalırsa, cihaz optik elemanların yeniden düzenlenmesini gerektirebilir. Cihaz müşteri tarafından servis veya kalibre edilecek şekilde tasarlanmamıştır; bakım, servis ve kalibrasyon için üreticiye başvurun. - Büyük, düzensiz beyaz bloblar olarak görülebilen çok büyük parçacıklara sahip kaydedilmiş videolara dikkat edin. Adım 7.3'te bu videoları işlemekten kaldırın.
7. Elde edilen verileri işleme
- Videoların kaydedildiğini belirten bir istem göründüğünde, kaydı tamamlamak için Tamam'ı tıklatın. Ardından İşlem sekmesini seçin.
NOT: Protokol burada durdurulabilir. Alınan verilerin işlenmesi, parçacık izleme aracının yazılımını açtıktan ve kaydedilen videoların kaydedildiği dizini belirttikten sonra doğrudan İşlem sekmesine taşınarak yeniden başlatılabilir. - EV'leri analiz ederken, Otomatik algılama geçersiz kılmayı devre dışı bırak kutusunu işaretleyin ve Özellik Çapı'nı 30olarak ayarlayın. İşlem 'itıklatın. (İşlem ayarları için Tablo 2'ye ve görüntülemeyi işlemek için Ek Şekil 2'ye bakın). Kullanıcının işlemeyi gerçek zamanlı olarak görüntüleyebilebilmesi için canlı bir dağıtım grafiği görüntülenir.
- Eksozomlar için Algılama Eşiği varsayılan Polidisperse Örneğineayarlanmış olarak işleyin. Verileri algılama eşiği el kitabıyla, yalnızca parçacık boyutlarında çok büyük farklılıklara sahip çözümler için standart eşik yerine 0,99 olarak 0,8 olarak işleyin.
- Herhangi bir videonun görünür gözle görülür şekilde çok büyük parçacıkları varsa (bkz. Adım 6.4), kaydedilen videoların dizinine gidin ve sorunlu videoyu kaldırın. Video dosyalarının listesini düzenledikten sonra, kullanıcı tarafından tutulan diğer günlüklerdeki kaydedilen video sayısını değiştirin.
- İşlem tamamlandıktan sonra Tamam 'ıtıklatın. Ardından, Çiz sekmesini seçin. EV'ler için, Ana grafiği LogBinSilicaolarak görüntüleyin.
NOT: Burada Çizim sekmesinde, kullanıcı, üretilen şekil için tümleştirme alanını ayarlamak üzere x ekseninin aralığını (parçacık çapı, nm) tanımlamak gibi grafiğin diğer özelliklerini özelleştirebilir.
8. Sonuçları görüntüleme ve yorumlama
- PDF raporu oluşturmak için Rapor düğmesini tıklatın. Ölçüm tamamlandı ve sonuçlar görüntülenebilir.
NOT: Sonraki örneklerin arka plan konsantrasyonunun düzeltilebilmesi için önce boşluğu kaydetmeyi ve işlemeyi unutmayın. Bu adım unutulursa, boşluk numunelerden ve numune parçacık konsantrasyonu manuel olarak düzeltildikten sonra kaydedilebilir. - Seyreltme faktörü için ayarlanan ve seyrelticinin parçacık konsantrasyonu çıkarılarak düzeltilen konsantrasyonun yanı sıra ortalama, ortanca ve mod boyutunu görüntüleyen PDF raporunu inceleyin. Dağılım genişliği (standart sapma) da gösterilir.
NOT: Tek bir değerin uygun ve temsili olduğu çok az uygulama vardır. Bu nedenle, tüm boyut dağılımının açıklanarak analiz edilen herhangi bir örnek için dağılımın genişliğinin raporlunun raporlunun bildirilmesi önerilir (örneğin Tablo 3'te gösterildiği gibi). - Sonuçları bildirirken belirtilmesi gereken verileri oluşturmak için kullanılan aşağıdaki cihaz ayarlarını kaydedin: Seyreltici, Her lazerin lazer gücü [mW], Pozlama [ms], Kazanç [dB], Kare hızı [fps], Video başına kare sayısı, Kaydedilen video sayısı, İşleme ayarı (örneğin, LogBinSilica), Entegrasyon aralığı [min nm, max nm] (min 50 nm olarak ayarlanması önerilir) ve İzlenen parçacık sayısı (video başına en az ~150 parçacık analiz edilmesi istenir; örnek başına en az 3.750 toplam parça parçacık boyutu dağılımındaki artektüs artışlarını önlemek ve istatistiksel olarak anlamlı veriler oluşturmak için önerilir).
9. Cuvettes temizleme
- Cuvettes'i numuneler arasında manuel olarak temizleyin. Önce cuvette'i boşaltın.
NOT: Örnek cuvette'den kurtarılabilir ve kaydedilebilir veya atılabilir. - Cuvette boşaldıktan sonra, cuvette'i iyonize (DI) suyla 10-15 kez durulayarak temizleyin. Daha sonra, etanol ile 3 kez durulayın (%70-100). Bunu yaparken, cuvette'i tamamen çözücü ile doldurduğunuzdan emin olun.
- Cuvette'in dışını tüy bırakmayan bir mikrofiber bezle kurulayın. Yüzeylerdeki lekelerden kaçının. Cuvette'in içini havayla kurulayın veya basınçlı hava tozlayıcı kullanarak kurutun.
NOT: Çoğu kağıt ürünü cuvette'in yüzeyini çizebilecek veya zarar verebilecek küçük ahşap lifler içerdiğinden, cuvette'in optik yüzeylerini silmek için sadece lens temizleme kağıdı veya tüy bırakmayan mikrofiber bez kullanılmalıdır. - İki cam scintillation şişesi hazırlayın: biri% 70-100 etanol ve diğeri DI suyu ile doldurulur. Kesici uçları durulayın ve çubukları önce etanolde (sonra DI suyu) karıştırın, kesici uç/karıştırma çubuğunu uygun scintillation şişesine yerleştirin ve şişeyi kuvvetlice sallayın. Uçları kurutun ve tiftiksiz bezler veya basınçlı hava tozlayıcıları kullanarak çubukları karıştırın.
NOT: Cuvette ve kesici uç, sonicating su banyosu kullanılarak da temizlenebilir. Bunu yapmak için, önce sonicating ünitesinin yeterli su içerdiğiden emin olun (en az 5 cm derinlik). Daha sonra cuvette yerleştirin ve bir cam kabın içine (50 mL veya daha büyük) yerleştirin, kabı su banyosuyla aynı seviyeye kadar alkolle doldurun, kabı suya yerleştirin ve gücü kapatın. Bir seferde en fazla 5 dakika sonicate, daha uzun süre gerekirse makinenin her 5 dakikalık patlama arasında >5 dakika dinlenmesini sağlar. - Bittiğinde, tüm temizlenmiş ve kurutulmuş bileşenleri depolama için hemen yerine koyun.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu gösteriden önce, polistiren boncuk standartlarının boyut dağılımını ölçerek elde edilen verilerin geçerliliğini sağlamak için cihazın kalibrasyonu ilk kez test edildi. Varsayılan kayıt parametrelerini ve bu protokolde önerilen işleme ayarlarını kullanarak 100 nm ve 400 nm boncukların boyut dağılımını test ettik (Şekil 8).
100 nm polistiren boncuk standardı için 4.205 x 107 partikül/mL konsantrasyon ölçüldü. Ortalam...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada, çok çeşitli parçacık boyutlarının boyut dağılımını aynı anda ölçmek ve bir polidisperz örneğinde toplam EV konsantrasyonu ölçmek için EV'lerin NTA'sı için bir protokol gösteriyoruz. Bu çalışmada EV'lerin kaynağı olarak fare perigonadal yağ dokusu ve insan plazması kullanılmıştır. Bununla birlikte, diğer dokulardan izole edilen EV'ler veya serum, idrar, tükürük, anne sütü, amniyotik sıvı ve hücre kültürü süpernatantı gibi biyolojik sıvılar da NTA için kullanılabi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Tüm yazarlar çıkar çatışması olmadığını açıkladı.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608) tarafından desteklenmiştir. Jeffrey Bodycomb'u, HORIBA Instruments Incorporated'ın doktorasını, cihazı kalibre etmedeki yardımı için kabul ediyoruz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
Referanslar
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021(2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, San Diego, California. 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569(2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421(2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , Clifton, N.J. 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016(2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. Absorption and Scattering of Light by Small Particles. , John Wiley & Sons. (1983).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır