Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ отслеживания наночастиц для количественной оценки и определения размера внеклеточных везикул
В этой статье
Резюме
Мы демонстрируем, как использовать новый инструмент для анализа отслеживания наночастиц для оценки распределения по размеру и общей концентрации частиц внеклеточных везикул, выделенных из перигонадной жировой ткани мыши и плазмы человека.
Аннотация
Физиологические и патофизиологические роли внеклеточных везикул (EV) становятся все более признанными, что делает область EV быстро развивающейся областью исследований. Существует множество различных методов изоляции электромобилей, каждый из которых имеет свои преимущества и недостатки, которые влияют на выход и чистоту электромобилей. Таким образом, характеристика подготовки EV, изолированной от заданного источника выбранным методом, важна для интерпретации последующих результатов и сравнения результатов в разных лабораториях. Существуют различные методы определения размера и количества EV, которые могут быть изменены болезненными состояниями или в ответ на внешние условия. Анализ отслеживания наночастиц (NTA) является одной из выдающихся технологий, используемых для высокопроизводительного анализа отдельных электромобилей. Здесь мы представляем подробный протокол количественной оценки и определения размера EV, выделенных из перигонадной жировой ткани мыши и плазмы человека, с использованием прорывной технологии для NTA, представляющей основные достижения в этой области. Результаты показывают, что этот метод может предоставлять воспроизводимые и достоверные данные об общей концентрации частиц и распределении по размеру для электромобилей, выделенных из разных источников с использованием различных методов, что подтверждается просвечиваюрной электронной микроскопией. Адаптация этого инструмента для NTA позволит рассмотреть необходимость стандартизации методов NTA для повышения строгости и воспроизводимости в исследованиях EV.
Введение
Внеклеточные везикулы (EV) представляют собой небольшие (0,03-2 мкм) связанные с мембраной везикулы, секретируемые почти всеми типами клеток1. Их часто называют «экзосомами», «микровезикулами» или «апоптотическими телами» в зависимости от их механизма высвобождения и размера2. Хотя первоначально считалось, что электромобили были просто средством устранения отходов из клетки для поддержания гомеостаза3,теперь мы знаем, что они также могут участвовать в межклеточной коммуникации посредством переноса молекулярного материала, включая ДНК, РНК (мРНК, микроРНК), липиды и белки4,5, и что они являются важными регуляторами нормальной физиологии, а также патологических процессов1, 5,6,7,8.
Существует множество различных методов выделения и количественной оценки электромобилей, которые были описаны в других разделах9,10,11,12. Используемый протокол изоляции, а также источник электромобилей могут сильно повлиять на выход и чистоту электромобилей. Даже дифференциальное центрифугирование, долгое время считавшийся подходом «золотого стандарта» для выделения экзосом, может подвергаться существенной изменчивости, впоследствии влияющей на популяцию электромобилей, полученную и последующий анализ13. Таким образом, различные методологии изоляции и количественной оценки электромобилей затрудняют сравнение, воспроизведение и интерпретацию результатов экспериментов, о которых сообщается в литературе14. Кроме того, высвобождение EV может регулироваться клеточными условиями или различными внешними факторами. Было высказано предположение, что EV играют роль в поддержании клеточного гомеостаза, защищая клетки от внутриклеточного стресса15,поскольку несколько исследований показали, что клеточный стресс стимулирует секрецию EV. Например, сообщалось об увеличении высвобождения EV после клеточного воздействия гипоксии, эндоплазматического стресса риткулума, окислительного стресса, механического стресса, экстракта сигаретного дыма и загрязнения воздуха твердыми частицами16,17,18,19,20,21,22. Также было показано, что релиз EV модифицируется in vivo; мыши, подвергаемые диете с высоким содержанием жиров или голодания в течение шестнадцати часов, высвобождали больше адипоцитарных EV23. Чтобы выяснить, изменяет ли конкретное лечение или состояние высвобождение EV, количество EV должно быть точно определено. Оценка распределения EV по размерам может также указывать на преобладающее субклеточное происхождение EV (например, слияние поздних эндосом/мультивезикулярных тел с плазматической мембраной против почкоделения плазматической мембраны)24. Таким образом, существует потребность в надежных методах для точного измерения общей концентрации и распределения по размерам изучаемого ev prep.
Быстрым и высокочувствительным методом визуализации и характеристики электромобилей в растворе является анализ отслеживания наночастиц (NTA). Подробное объяснение принципов применения данного метода и сравнение с альтернативными методами оценки размера и концентрации ЭВ были описаныранее 25,26,27,28. Вкратце, во время измерения NTA электромобили визуализируются светом, рассеянным при их облучении лазерным лучом. Рассеянный свет фокусируется микроскопом на камере, которая записывает движение частиц. Программное обеспечение NTA отслеживает случайное тепловое движение каждой частицы, известное как броуновское движение, чтобы определить коэффициент диффузии, который используется для расчета размера каждой частицы с использованием уравнения Стокса-Эйнштейна. NTA был впервые применен для измерения EV в биологическом образце в 2011году25. До недавнего времени существовало только две основные компании, предлагающие коммерческие инструменты NTA29 до появления ViewSizer 3000 (далее именуемого инструментом отслеживания частиц), который использует комбинацию новых аппаратных и программных решений для преодоления значительных ограничений других методов NTA.
Инструмент отслеживания частиц характеризует наночастицы в жидких образцах путем анализа их броуновского движения и характеризует более крупные частицы микронный размером, анализируя гравитационное оседание. Уникальная оптическая система этого прибора, которая включает в себя мультиспектральное освещение с тремя лазерными источниками света (при 450 нм, 520 нм и 635 нм), позволяет исследователям анализировать широкий диапазон размеров частиц (например, экзосомы, микровезикулы) одновременно. Схема установки прибора показана на рисунке 1.
Здесь мы демонстрируем, как выполнять измерения размера частиц и концентрации изолированных электромобилей мышей и человека с помощью нового инструмента NTA.
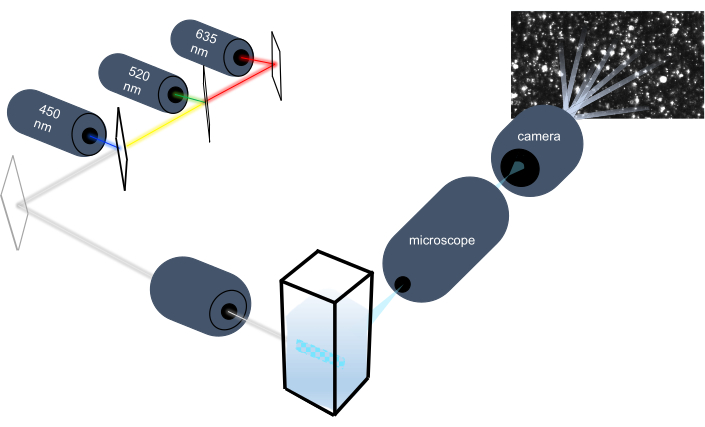
Рисунок 1:Оптическая система прибора слежения за частицами. Прибор NTA освещает частицы с помощью трех лазеров со следующими длинами волн: 450 нм, 520 нм, 635 нм. Видеозапись рассеянного света от отдельных частиц обнаруживается и отслеживается цифровой видеокамерой, ориентированной на 90° от кюветы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Вся работа с этими образцами проводилась в соответствии с руководящими принципами Институционального комитета по уходу за животными и их использованию и Совета по институциональному обзору. Схематический обзор метода NTA показан на рисунке 2.
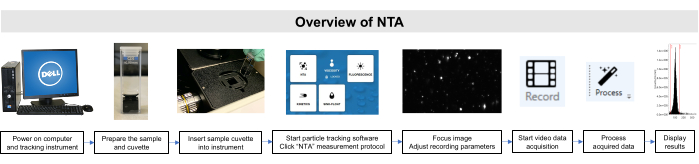
Рисунок 2:Обзор метода NTA с использованием прибора слежения за частицами. Образец подготавливается и вставляется в инструмент. Программное обеспечение NTA открывается, параметры записи настраиваются, и образец фокусируется. Затем данные записываются, обрабатываются и отображаются. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Изоляция внеклеточных везикул
ПРИМЕЧАНИЕ: ЭV перигонадальной жировой ткани мыши были выделены, какописано ранее 23. Плазменные EV были выделены из 1 мл плазмы человека с использованием следующего протокола:
- Соберите плазму и центрифугу при 3000 х г в течение 15 мин для удаления клеточного мусора. Перенесите супернатант в новую трубку.
ПРИМЕЧАНИЕ: Если дополнительный мусор остается обнаруживаемым, центрифугируют супернатант в течение дополнительных 10 мин при 12 000 х г и перекладывайте супернатант в новую трубку. - Добавьте 67 мкл реагента выделения экзосом на 250 мкл плазмы. Хорошо перемешать, перевернув или щелкнув трубкой.
- Инкубировать на льду вертикально в течение 30 мин.
- Центрифугировать смесь экзосомного реагента/плазмы при 3000 х г в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: Центрифугирование может быть выполнено при комнатной температуре или 4 °C с аналогичными результатами, но предпочтительно 4 °C. После центрифугирования EV могут выглядеть в виде бежевой или белой гранулы в нижней части трубки. - Осторожно аспирировать супернатант. Раскрутите любой остаточный раствор для выделения экзосом и удалите все следы жидкости путем аспирации, проявляя большую осторожность, чтобы не нарушить осажденные EV в грануле.
- Повторно суспендируют гранулу в 200 мкл буфера В (предоставлено производителем). Измерьте и запишите концентрацию белка в образце (для этапа 2.8) с использованием спектрофотометра, флуорометра, анализа Брэдфорда или другого предпочтительного метода.
2. Очистка изолированных электромобилей
- Добавить 200 мкл буфера А (предоставленного заводом-изготовителем) к повторно подвешенным электромобилям.
- Выньте очистителю колонну (при условии), ослабьте крышку винта и защелкнуть нижнюю застежку. Поместите столбец в коллекционную трубку.
ПРИМЕЧАНИЕ: Сохраните нижнюю замыкание для шагов 2.7-2.9. - Центрифуга при 1 000 х г в течение 30 с для удаления буфера хранения.
- Отбросьте проточную трубу и поместите колонну обратно в коллекторную трубку.
- Чтобы промыть колонну, снимите колпачок и нанесите 500 мкл буфера B поверх смолы и центрифуги при 1000 х г в течение 30 с. Отбросьте поток. Сохраните колпачок для шагов 2.7-2.9.
- Повторите шаги 2.4-2.5 еще раз, чтобы промыть колонну.
- Заткнуть нижнюю часть колонны нижним затвором (из шага 2.2). Нанесите 100 мкл буфера B поверх смолы, чтобы подготовить ее к загрузке образца.
- Добавьте все содержимое со шага 1.6 (или до объема, эквивалентного 4 мг общего белка) к смоле. Поместите винтовой колпачок в верхнюю часть колонны.
- Перемешивать при комнатной температуре на вращающемся шейкере не более 5 мин.
3. Элюляция образца
- Ослабьте крышку винта и снимите нижнюю застежку, и немедленно переложите на микроцентрифужную трубку 2 мл.
ПРИМЕЧАНИЕ: Образец начнет элюироваться, как только нижняя крышка будет удалена. Пожалуйста, убедитесь, что микроцентрифужные трубки 2 мл готовы к приему элюата, чтобы свести к минимуму потери образца. - Центрифуга при 1000 х г в течение 30 с для получения очищенных электромобилей. Отменить столбец.
4. Пробоподготовка к анализу отслеживания наночастиц
- Используйте безворсовый материал, такой как ткань из микрофибры, чтобы покрыть рабочее пространство и предотвратить попадание волокон в кюветы.
- Надев перчатки, поместите кювету на магнитный джиг кюветы, затем поместите перемешиватель в кювету. Всегда обрабатывайте кюветы перчатками, чтобы предотвратить появление отпечатков пальцев и пятен на поверхности кюветы.
- Используйте инструмент «Крючок», чтобы поместить вставку в кювету, как показано на рисунке 3. Важно отметить ориентацию вставки на более поздний срок (Шаг 5.4).

Рисунок 3:Правильная ориентация вставки внутри кварцевой кюветы. "Выемка" вкладыша должна быть видна с передней части кюветы. Он должен быть вставлен в прибор, обращенный к камере. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Используя пипетку, медленно добавляйте 400-500 мкл разбавителяя или разбавленный образец при комнатной температуре в кювету через отверстие во вставке. Аккуратно пипетку вверх и вниз, чтобы перемешать. Избегайте введения пузырьков воздуха.
- Сначала подготовьте кювету, загруженную выбранным разлучителем (заготовкой), чтобы измерить концентрацию частиц разжижаемого. Это следует сделать перед измерением образца, чтобы можно было скорректировать фоновую концентрацию образца.
ПРИМЕЧАНИЕ: Хорошая заготовка (в данном случае фосфатно-буферный физиологический раствор [PBS]) будет иметь концентрацию <9 x 106 (в зависимости от разбавителяющего) и будет отображать 1-10 частиц на экране в режиме реальноговремени (рисунок 4). Рекомендуется, чтобы фактическая концентрация частиц образца по меньшей мере в 3 раза превышала фоновую концентрацию. - Необязательно, перед записью образца загрунтуют кювету с 400-500 мкл разбавителяющей или разбавленной пробы перед измерением. Для этого загрузите в кювету 400-500 мкл разбавленного образца, выбросьте раствор, а затем добавьте еще 400-500 мкл образца для измерения. Это может помочь с вымыванием остатков в кювете.
- Сначала подготовьте кювету, загруженную выбранным разлучителем (заготовкой), чтобы измерить концентрацию частиц разжижаемого. Это следует сделать перед измерением образца, чтобы можно было скорректировать фоновую концентрацию образца.

Рисунок 4:Репрезентативный вид в реальном времени размывая в пределах надлежащего диапазона концентрации заготовки. Разбавляйте препараты EV в фильтрованном (0,02 мкм или 3 кДа, предпочтительно) PBS. Хорошая заготовка будет отображать ~ 1-10 частиц на экране в режиме реального времени, давая концентрацию в диапазоне 105-106. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Заткните кювету крышкой и проверьте наличие пузырьков. При необходимости выжмите пузырьки. Используйте безворсовую ткань, чтобы протереть внешние грани кюветы.
5. Процедура запуска прибора слежения за частицами
- Включите компьютерную рабочую станцию и прибор, подождите несколько минут до запуска первого образца и запустите программу, нажав на значок программного обеспечения. При появлении запроса нажмите NTA на экране, чтобы провести анализ отслеживания наночастиц. Начните с вкладки Запись и нажмите на различные вкладки программного обеспечения(Запись, Процесс, График),чтобы переключаться между ними по всему протоколу. Сначала запишите образец (разбок или подготовку к EV), затем обработайте записи и, наконец, настройте график результатов.
- Следуйте инструкциям на экране, чтобы заполнить всю необходимую информацию о образце. Убедитесь, что все необходимые поля заполнены и точны, например, название образца, описание, подготовка образца, коэффициент разбавления [1000], целевая температура (установлено на 22 °C) и разбавитель: выберите разбавитель из раскрывающегося меню и используйте PBS в качестве разбавителя для электромобилей. Выбор PBS из раскрывающегося меню автоматически заполнит соленость до 9%. Эта информация необходима для определения динамической вязкости жидкости.
ПРИМЕЧАНИЕ: Может потребоваться до 3 минут, чтобы температура уравновешивалась внутри кюветы, даже если зонд уже показывает желаемую температуру (т. Е. Зеленая точка становится стабильной). Показания образцов могут значительно варьироваться, если целевая температура не установлена, поскольку разница температур образца может значительно изменить броуновское движение частиц. - Откройте крышку инструмента и снимите защитное покрытие колпачка, где будет размещена кювета.
ВНИМАНИЕ: Прибор для отслеживания частиц сертифицирован как лазерный продукт класса 1 (21 CFR Ch. I часть 1040), содержащие лазеры, которые могут быть опасными и могут привести к серьезным травмам, таким как ожоги и / или необратимые повреждения зрения. Чтобы предотвратить несчастный случай или травму, не снимайте крышку прибора, откручивая болты сбоку. Отметим, что во время работы лазерные лучи полностью закрыты, не представляя угрозы для пользователей. Кроме того, магнитная предохранительная блокировка встроена в держатель образца прибора, чтобы предотвратить работу лазеров при снятии крышки держателя образца. - Поместите кювету (из шага 4.3) внутрь инструмента в правильной ориентации (см. рисунок 5). Установите колпачок на кювету и закройте крышку прибора. Всегда управляйте прибором с колпачком на месте над держателем образца. Не отключайте и не пытайтесь обойти функцию блокировки безопасности.

Рисунок 5:Правильная ориентация кюветы в приборе слежения за частицами. Лицевая часть кюветы (с видимой «выемкой» вставки) должна быть обращена к камере. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Включите камеру, щелкнув стрелку над Streaming.
- Щелкните стрелку шеврона, чтобы развернуть параметры записи. Установите значение коэффициента усиления и мощности лазера, соответствующего приложению. См. таблицу 1 (и дополнительный рисунок 1)для параметров, используемых для NTA малых (100 нм) электромобилей.
ПРИМЕЧАНИЕ: Эти дополнительные настройки, доступные нажатием стрелки шеврона, могут быть защищены паролем. Используйте те же настройки для записи и обработки для разбойного (пустого), что и для последующих образцов. - Отрегулируйте фокус до тех пор, пока частицы не будут правильно сфокусированы. Фокусировка должна быть выполнена на относительно небольших частицах(рисунок 6). Для количественной оценки небольших EV (в соответствии с экзосомами) рекомендуются следующие настройки записи: Частота кадров: 30 кадров в секунду, Экспозиция: 15 мс, Время перемешивания: 5 с, Время ожидания: 3 с, Мощность лазера - синий: 210 мВт, Зеленый: 12 мВт, Красный: 8 мВт, Кадры на видео: 300 кадров и Усиление: 30 дБ.
ПРИМЕЧАНИЕ: Пользователь может увеличить масштаб до 1x и / или увеличить усиление, чтобы помочь с фокусировкой. Не забудьте переуступить эти параметры на рекомендуемые значения перед записью видео.
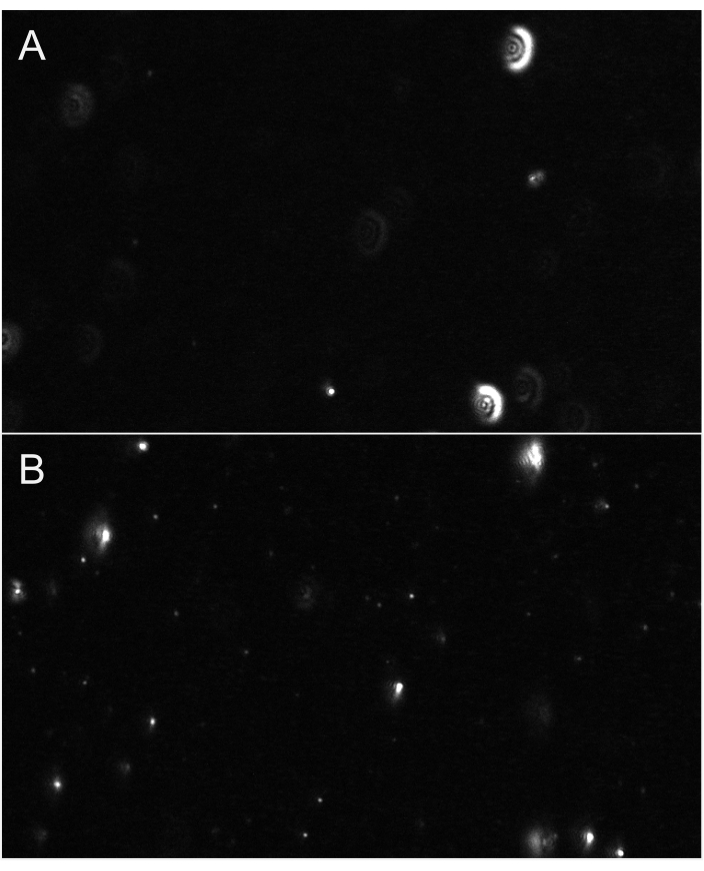
Рисунок 6:Репрезентативные виды потокового потока, показывающие фокус частиц. (A) Пример просмотра в реальном времени частиц, не намечающихся в фокусе. Частицы имеют светящийся гало или кажутся размытыми. Отрегулируйте фокус. (B) Пример просмотра частиц в правильном фокусе в реальном времени. Мельчайшие частицы находятся в фокусе. Начните запись. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Выполните визуальную проверку качества, чтобы убедиться, что образец правильно разбавлен. Если образец слишком концентрирован, извлеките кювету из инструмента и последовательно разбавьте образец. Повторяйте до тех пор, пока образец не будет должным образом разбавлен, прежде чем перейти к шагу 6.
ПРИМЕЧАНИЕ: Не разбавляйте образец чрезмерно! Всегда делайте разведения последовательно. Идеальная заготовка будет отображать на экране только несколько частиц (1-4), как показано на рисунке 4. Что касается образцов EV, правильно разбавленный образец будет иметь примерно 20-100 частиц, видимых на экране, без светящихся или мутных изображений на заднем плане (см. Рисунок 7 в качестве примера). Это должно привести к оптимальной концентрации частиц в диапазоне от 5 х 106 до 2 х 108 частиц на мл (без поправки на коэффициент разрежения).
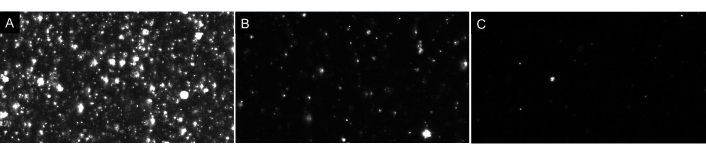
Рисунок 7:Репрезентативные представления потоков в реальном времени, изображающие различные разбавления частиц. (A) Пример просмотра в реальном времени слишком концентрированного образца. Запись слишком концентрированного образца даст неточные результаты. (B)Пример просмотра в реальном времени правильно разбавленного образца. На экране видно 60-100 частиц, и запись приводит к сырой концентрации 5 x 106- 2 x 108 частиц / мл. (C) Пример просмотра в реальном времени слишком разбавленного образца. Если образец настолько разбавлен, то не будет отслежено достаточное количество частиц, что уменьшит размер выборки и, следовательно, результаты будут статистически недействительными. В этом случае рекомендуется увеличить количество записанных видео. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Сбор видеоданных
- (Необязательно) Установите значение масштаба 0,5x, чтобы сэкономить пропускную способность и предотвратить потерю кадров.
- Начните запись видео, нажав кнопку Запись (рекомендуемые параметры записи см. в таблице 1).
ПРИМЕЧАНИЕ: По умолчанию инструмент будет перемешивать образец в течение 5 с, ждать 3 с, а затем записывать в течение 10 с, прежде чем повторить этот процесс. Типичное время измерения для 50 видео составляет ~ 15 минут для записи и ~ 13 минут для обработки. - Не прикасайтесь к инструменту во время записи видео. Убедитесь, что поверхность лабораторного стенда не вибрирует.
ПРИМЕЧАНИЕ: Предпочтительно, чтобы прибор устанавливался на антивибрационную платформу или стол для уменьшения любых вибрационных возмущений от близлежащего оборудования, которые будут мешать определению движения наночастиц. Избегайте работы центрифуг, вихревых смесителей или других потенциально виброгенерирующих устройств на том же стенде, что и прибор для отслеживания частиц. Вибрации легко видны на экране как удлинение обычно круглых частиц. При воздействии сильных вибраций прибор может потребовать перенастройки оптических элементов. Прибор не был предназначен для обслуживания или калибровки заказчиком; свяжитесь с производителем для технического обслуживания, обслуживания и калибровки. - Обратите внимание на любое записанное видео, в которое очень крупные частицы видны в виде больших, нерегулярных белых пятен. Удалите эти видео из обработки на шаге 7.3.
7. Обработка полученных данных
- Когда появится запрос о том, что видео было записано, нажмите кнопку ОК, чтобы завершить запись. Затем перейдите на вкладку Процесс.
ПРИМЕЧАНИЕ: Протокол может быть остановлен здесь. Обработку полученных данных можно перезапустить позже, перейдя непосредственно на вкладку Процесс после открытия программного обеспечения прибора отслеживания частиц и указания каталога, в котором сохраняются записанные видео. - При анализе электромобилей установите флажок Отключить переопределение автоматического обнаружения и установите для параметра Диаметр компонента значение 30. Щелкните Обработать. (См. таблицу 2 для обработки настроек и дополнительный рисунок 2 для обработки дисплея). Отобразится график распределения в реальном времени, чтобы пользователь мог просматривать обработку в режиме реального времени.
- Для экзосом процесс с пороговым значением обнаружения, установленным на полидисперсный образецпо умолчанию. Обрабатывайте данные с помощью Руководства по порогу обнаружения, установленного на уровне 0,8 вместо стандартного порога 0,99, только для решений с очень большими различиями в размерах частиц.
- Если на каком-либо видео были видны заметно очень крупные частицы (см. Шаг 6.4), перейдите в каталог записанных видео и удалите проблемное видео. После редактирования списка видеофайлов измените количество записанных видео в других журналах, хранящихся у пользователя.
- После завершения обработки нажмите кнопку ОК. Затем выберите вкладку График. Для электромобилей отобразите основную диаграмму как LogBinSilica.
ПРИМЕЧАНИЕ: Здесь, на вкладке «График», пользователь может настроить другие функции графика, такие как определение диапазона оси x (диаметр частиц, нм), чтобы задать область интеграции для полученного рисунка.
8. Отображение и интерпретация результатов
- Чтобы создать отчет в формате PDF, нажмите кнопку Отчет. Теперь измерение завершено, и результаты можно просмотреть.
ПРИМЕЧАНИЕ: Не забудьте сначала записать и обработать пустой, чтобы можно было скорректировать фоновую концентрацию последующих образцов. Если этот этап забыт, заготовка может быть записана после образцов, а концентрация частиц образца скорректирована вручную. - Изучите отчет в формате PDF, в котором отображаются средний, медианный и режимный размер, а также концентрация, скорректированная на коэффициент разрежения и скорректированная путем вычитания концентрации частиц разбавителяющего фактора. Также показана ширина распределения (стандартное отклонение).
ПРИМЕЧАНИЕ: Существует очень мало приложений, в которых одно значение является уместным и репрезентативным. Таким образом, рекомендуется описывать все распределение размеров и сообщать о ширине распределения для любой анализируемой выборки (как показано в таблице 3, например). - Запишите следующие настройки прибора, используемые для генерации данных, которые должны быть указаны при представлении результатов: Разбавлятель, мощность лазера каждого лазера [мВт], экспозиция [мс], усиление [дБ], частота кадров [fps], количество записанных видео, настройка обработки (например, LogBinSilica), диапазон интеграции [мин нм, макс нм] (рекомендуется установить минимум до 50 нм) и количество отслеживаемых частиц (желательно проанализировать не менее ~ 150 частиц на видео; минимум 3 750 общих треков на образец рекомендуется избегать артефактных всплесков в распределении частиц по размерам и генерировать статистически значимые данные).
9. Чистка кювет
- Очищайте кюветы вручную между образцами. Во-первых, опустошите кювету.
ПРИМЕЧАНИЕ: Образец может быть извлечен из кюветы и сохранен или выброшен. - Как только кювета опустеет, очистите кювету, промыв ее 10-15 раз деионизированной (DI) водой. Затем промыть 3 раза этанолом (70-100%). При этом обязательно полностью заполните кювету растворителем.
- Высушите внешнюю сторону кюветы безворсовой салфеткой из микрофибры. Избегайте пятен на поверхностях. Высушите внутреннюю часть кюветы на воздухе или высушите с помощью пылесборника сжатого воздуха.
ПРИМЕЧАНИЕ: Для протирания оптических поверхностей кюветы следует использовать только бумагу для чистки линз или ткань из микрофибры без ворса, так как большинство бумажных изделий содержат небольшие древесные волокна, которые могут поцарапать или повредить поверхность кюветы. - Приготовьте два стеклянных сцинтилляционных флакона: один заполнен 70-100% этанолом, а другой водой DI. Сначала промойте вкладыши и перемешайте батончики в этаноле (затем в воде DI), поместив вставку/перемешиваемий батончик в соответствующий сцинтилляционный флакон и энергично встряхнув флакон. Высушите вставки и перемешиватели с помощью безворсовых тряпок или пылесосов для сжатого воздуха.
ПРИМЕЧАНИЕ: Кювету и вставку также можно очистить с помощью водяной бани с ультразвуком. Для этого сначала убедитесь, что блок ультразвука содержит достаточно воды (глубина не менее 5 см). Затем поместите кювету и вставьте внутрь стеклянный стакан (50 мл или больше), наполните стакан спиртом до того же уровня, что и водяная баня, поместите стакан в воду и включите питание. Соник в течение максимум 5 минут за раз, что позволяет машине отдыхать >5 минут между каждым 5-минутным всплеском, если требуется больше времени. - Когда закончите, немедленно уберите все очищенные и высушенные компоненты для хранения.
Access restricted. Please log in or start a trial to view this content.
Результаты
Перед этой демонстрацией калибровка прибора была сначала протестирована для обеспечения достоверности полученных данных путем измерения распределения по размерам стандартов полистирольных шариков. Мы протестировали распределение размеров бусин 100 нм и 400 нм с использованием параме...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Здесь мы демонстрируем протокол для NTA электромобилей для измерения распределения по размерам широкого диапазона размеров частиц одновременно и измерения общей концентрации EV в полидисперсном образце. В этом исследовании перигонадная жировая ткань мыши и плазма человека были исполь...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Все авторы заявили, что конфликта интересов нет.
Благодарности
Эта работа была поддержана Национальными институтами здравоохранения (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Мы благодарим Джеффри Бодикомба, доктора философии HORIBA Instruments Incorporated, за его помощь в калибровке прибора.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
Ссылки
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021(2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, San Diego, California. 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569(2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421(2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , Clifton, N.J. 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016(2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. Absorption and Scattering of Light by Small Particles. , John Wiley & Sons. (1983).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены