需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
细胞外囊泡的量化和尺寸测定纳米粒子跟踪分析
摘要
我们演示了如何使用新型纳米粒子跟踪分析仪器来估计从小鼠围产层组织和人类血浆中分离出来的细胞外囊泡的大小分布和总颗粒浓度。
摘要
细胞外囊泡(EV)的生理和病理生理作用已日益得到认可,使EV领域成为一个快速发展的研究领域。电动汽车隔离有许多不同的方法,每个方法都有明显的优缺点,影响电动汽车的下游产量和纯度。因此,通过选定的方法将EV准备从给定来源中分离出来,对于解释下游结果和比较实验室的结果非常重要。有各种方法来确定电动汽车的大小和数量,这些方法可以根据疾病状态或根据外部条件进行更改。纳米粒子跟踪分析 (NTA) 是用于单个 EV 的高通量分析的突出技术之一。在这里,我们提出了一个详细的协议,量化和大小确定EV从小鼠围产儿脂肪组织和人类血浆使用NTA的突破性技术,代表该领域的重大进展。结果表明,该方法可以提供可重复和有效的总粒子浓度和大小分布数据,用于使用不同方法从不同来源分离的电动汽车,如传输电子显微镜所证实的。该仪器的NTA改造将解决NTA方法标准化的需要,以提高电动汽车研究的严谨性和可重复性。
引言
细胞外囊泡 (EV) 是小 (0.03-2 μm) 膜绑定囊泡分泌几乎所有细胞类型1.它们通常被称为"外显子"、"微囊"或"凋形体",这取决于它们的释放机制和大小2。虽然最初认为电动汽车只是消除细胞废物以维持平衡3的一种手段,但现在我们知道,它们也可以通过分子物质的转移参与细胞际交流,包括DNA、RNA(mRNA、microRNA)、脂质和蛋白质4、5,它们是正常生理学和病理过程的重要调节器。 5,6,7,8。
有许多不同的方法来隔离和量化电动汽车,这在其他地方已经描述9,10,11,12。使用的隔离协议以及电动汽车的来源可以极大地影响电动汽车的产量和纯度。即使是差异离心,长期被认为是外体隔离的"黄金标准"方法,也可能受到巨大的变异性,随后影响获得的EV种群和下游分析13。因此,EV隔离和量化的各种不同方法使得比较、复制和解释文献14中报道的实验结果变得困难。此外,EV 释放可以由细胞条件或各种外部因素调节。研究表明,电动汽车通过保护细胞免受细胞内应激15在维持细胞平衡方面发挥作用,因为一些研究表明,细胞压力会刺激EV分泌。例如,在细胞接触缺氧、内质视网膜应激、氧化应激、机械应激、香烟烟雾提取物和颗粒物空气污染16、17、18、19、20、21、22之后,EV释放量增加。EV 版本也已显示在体内进行了修改:小鼠受高脂肪饮食或禁食16小时释放更多的脂肪细胞EV23。要调查特定的治疗或条件是否改变 EV 释放,必须准确确定电动汽车的数量。对EV尺寸分布的评估也可能表明电动汽车的主要亚细胞起源(例如,晚期内分泌体/多血管体与等离子体膜的融合与等离子膜的萌芽)24。因此,需要采用强有力的方法来准确测量正在研究的电动汽车准备的总浓度和尺寸分布。
纳米粒子跟踪分析 (NTA) 是解决方案中电动汽车可视化和定性快速和高度敏感的方法。详细解释这种方法的原则,并与评估EV尺寸和浓度的替代方法进行比较,先前已描述25,26,27,28。简言之,在 NTA 测量期间,当电动汽车被激光束照射时,它们会被散射的光线所可视化。散射光通过显微镜聚焦在记录粒子运动的相机上。NTA 软件跟踪每个粒子的随机热运动(称为布朗运动),以确定扩散系数,该扩散系数用于使用斯托克斯-爱因斯坦方程计算每个粒子的大小。NTA于2011年首次应用于生物样本中的电动汽车测量。直到最近,只有两家主流公司提供商用 NTA 仪器29,直到采用 ViewSizer 3000(以下简称粒子跟踪仪器),它使用新型硬件和软件解决方案的组合来克服其他 NTA 技术的巨大局限性。
粒子跟踪仪器通过分析液体样品中的纳米粒子,通过分析其布朗运动来描述纳米粒子的特征,并通过分析引力沉降来描述较大的微米大小的粒子。该仪器独特的光学系统包括三个激光光源(450纳米、520纳米和635纳米)的多光谱照明,使研究人员能够同时分析各种粒子大小(例如外显子、微囊)。图 1显示了仪器设置的示意图。
在这里,我们演示了如何使用新型的 NTA 仪器对孤立的鼠标和人类 EV 进行颗粒大小分布和浓度测量。
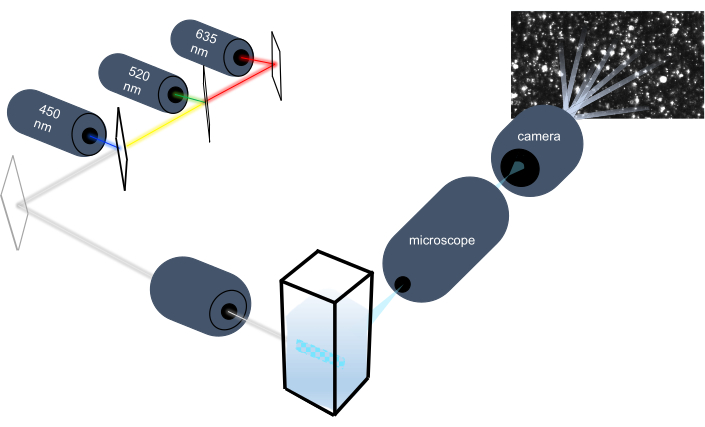
图1:粒子跟踪仪器光学系统。 NTA 仪器使用以下波长为 450 nm、520 nm、635 nm 的三种激光照明粒子。从单个粒子中检测和跟踪分散光的视频记录,由面向 90° 的数字摄像机从 cuvette 检测和跟踪。 请单击此处查看此图的较大版本。
研究方案
这些样本的所有工作均按照机构动物护理和使用委员会和机构审查委员会的准则进行。 图2描绘了NTA方法的示意图概述。
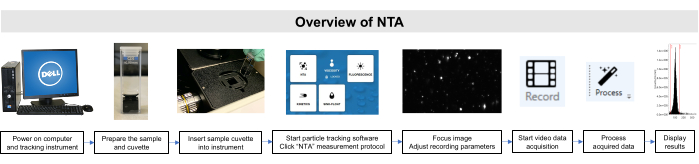
图2:使用粒子跟踪仪器的NTA方法概述。 样品已准备并插入仪器。打开 NTA 软件,调整记录参数,并集中示例。然后,记录、处理和显示数据。 请单击此处查看此图的较大版本。
1. 细胞外囊隔离
注:鼠标围产性脂肪组织EV被隔离,如前所述23。使用以下协议从 1 mL 的人类等离子体中分离出等离子 EV:
- 以 3,000 x g 收集等离子体和离心机 15 分钟,以清除细胞碎片。将超纳特转移到新管子上。
注:如果其他碎屑仍然可检测到,请以 12,000 x g 的速度将超高纳特离心 10 分钟,并将超纳特转移到新管中。 - 每 250 μL 等离子体添加 67 μL 的外体隔离试剂。通过倒置或轻拂管子混合均。
- 在冰上直立孵育30分钟。
- 在 3,000 x g 下将外体隔离试剂/等离子混合物离心,在 4 °C 下 10 分钟。
注意:离心可在室温下或 4 °C 下进行,结果类似,但首选 4 °C。离心后,电动汽车可能会在管子底部显示为米色或白色颗粒。 - 小心地吸走超高人。旋转任何残留的外体隔离溶液,通过吸入去除所有液体痕迹,非常小心,不要打扰颗粒中沉淀的 EV。
- 将颗粒重新悬浮在 200 μL 的缓冲 B 中(由制造商提供)。使用光谱光度计、荧光仪、布拉德福德测定或其他首选方法测量和记录样品的蛋白质浓度(第 2.8 步)。
2. 净化孤立的电动汽车
- 添加 200 μL 缓冲器 A(由制造商提供)以重新暂停 EV。
- 取出净化柱(提供),松开螺丝盖,并扣掉底部关闭。将柱子放入收集管中。
注意:为步骤 2.7-2.9 保存底部关闭。 - 离心机在 1,000 x g 30 s 以删除存储缓冲。
- 丢弃流过,将柱子放回收集管中。
- 要清洗柱子,请取下盖子,在树脂和离心机顶部涂抹 500 μL 缓冲 B,30s 为 1,000 x g。 丢弃流过。将上限保存为步骤 2.7-2.9。
- 重复步骤 2.4-2.5 再次洗涤列。
- 用底部关闭(从第 2.2 步开始)插入列的底部。在树脂顶部涂抹 100 μL 缓冲 B,为样品装载做好准备。
- 将第 1.6 步(或高达 4 毫克总蛋白质的体积等价物)中的全部内容添加到树脂中。将螺丝帽放在柱子顶部。
- 在室温下在旋转摇床上混合不超过 5 分钟。
3. 样本放样
- 松开螺丝盖,取下底部关闭,并立即转移到2mL微中心管。
注:一旦底部关闭被移除,样品将开始回移。请确保 2 mL 微中心管已准备好接收 eluate,以最大限度地减少样品损失。 - 离心机在 1,000 x g 30s 获得纯化 EV.丢弃列。
4. 纳米粒子跟踪分析的样品制备
- 使用无绒材料(如超细纤维布)覆盖工作空间,防止纤维进入库维特。
- 戴上手套,将小面包放在磁性小插曲夹具上,然后将搅拌棒放在小轮盘中。始终用手套处理幼崽,以防止指纹和污迹出现在库维特的表面。
- 使用钩形工具将插入到 图 3中描述的 cuvette 中。请务必注意以后插入的方向(步骤 5.4)。

图3:石英中插入的正确方向。 插入的"档次"应从库维特的正面可见。这应该插入到面向摄像机的仪器中。 请单击此处查看此图的较大版本。
- 使用移液器,通过插入孔缓慢地将室温下的稀释或稀释样品的 400-500 μL 添加到切口中。轻轻地上下移液器混合。避免引入气泡。
- 首先准备一个装有所选稀释剂(空白)的幼崽,以测量稀释物的颗粒浓度。在测量样品之前,应先进行此工作,以便更正样本的背景浓度。
注:一个好的空白(磷酸盐缓冲盐水[PBS]在这种情况下)将有一个浓度<9 x 106( 取决于稀释剂),并将显示1-10粒子每个屏幕在现场视图(图4)。建议实际样品颗粒浓度至少是背景浓度的 3 倍。 - 可选,在记录样品之前,在测量前先用 400-500 μL 的稀释或稀释样品为 cuvette 调色。为此,将 400-500 μL 的稀释样品加载到 cuvette 中,丢弃溶液,然后再添加 400-500 μL 的样品进行测量。这可能有助于洗掉库韦特体内的残留物。
- 首先准备一个装有所选稀释剂(空白)的幼崽,以测量稀释物的颗粒浓度。在测量样品之前,应先进行此工作,以便更正样本的背景浓度。

图4: 代表直播视图的稀释在适当的浓度范围内的空白。在过滤 (0.02 μm 或 3 kDa, 首选) PBS 中稀释 EV 准备。一个好的空白将显示+1-10粒子每个屏幕在现场视图,产生浓度范围内105-106。请单击此处查看此图的较大版本。
- 盖上小面包,检查气泡。如有必要,请抽出气泡。使用无绒布擦拭小面包的外脸。
5. 粒子跟踪仪器的启动程序
- 打开计算机工作站和仪器,在运行第一个示例前等待几分钟,然后单击软件图标启动程序。提示时,单击屏幕上的 NTA 进行纳米粒子跟踪分析。从 录制 选项卡开始,单击各种软件选项卡(记录、处理、绘图),在整个协议中切换它们。先记录样本(稀释剂或EV准备),然后处理录音,最后绘制结果。
- 按照屏幕上的说明填写有关示例的所有必要信息。检查所有必要的字段是否完成并准确,即样本名称、描述、示例制备、稀释因子 [1000]、目标温度(设置为 22 °C)和稀释度:从下拉菜单中选择稀释剂,并将 PBS 用作电动汽车的稀释剂。从下拉菜单中选择 PBS 将自动填充盐度到 9%。此信息对于确定液体的动态粘度是必要的。
注:即使探测器已经显示所需的温度(即绿点变得稳定),温度在库维特内部平衡也可能需要长达 3 分钟的时间。如果不设定目标温度,样本读数可能会有很大差异,因为样品温度差异可能会极大地改变颗粒的布朗运动。 - 打开仪表盖,取下将放置护罩的位置。
警告:粒子跟踪仪器被认证为 1 类激光产品(21 CFR Ch.我第1040部分),含有激光,可能是危险的,可能会导致严重的伤害,如烧伤和/或视力永久性损伤。为防止意外或受伤,请不要通过拧开侧面的螺栓来拆下仪器盖。请注意,在操作过程中,激光束完全封闭,不会对用户造成威胁。此外,仪器的样品支架内置了磁性安全联锁,以防止在取下样品支架盖时激光工作。 - 将 cuvette(从第 4.3 步开始)放在仪器内,方向正确(见 图 5)。更换库维特的盖子并关闭仪表盖。始终操作仪表,在样品支架上放置盖子。不要禁用或试图绕过安全联锁功能。

图5:粒子跟踪仪器内的cuvette正确定位。 cuvette 的面部(插入的"档次"可见)应面向摄像机。 请单击此处查看此图的较大版本。
- 单击 流上方的箭头,打开相机。
- 单击雪佛龙箭头以扩展 记录 设置。将增益和激光功率设置为适合应用程序的值。有关用于小型 (100 nm)EV 的 NTA 的参数,请参阅表 1(和 补充图1)。
注:通过单击雪佛龙箭头访问的这些高级设置可能受密码保护。使用与后续样品相同的设置来记录和处理稀释剂(空白)。 - 调整对焦,直到粒子正确聚焦。重点应放在相对较小的粒子上(图6)。对于小型EV量化(与外显子一致),建议设置以下录制设置:帧速率:30 fps,曝光:15 ms,搅拌时间:5秒,等待时间:3秒,激光功率 - 蓝色:210mW,绿色:12mW,红色:8mW,每个视频的帧:300帧,增益:30分B。
注:用户可以将缩放增加到 1 倍和/或增加增益以帮助对焦。请记住,在录制视频之前,请将这些参数重新设置为推荐值。
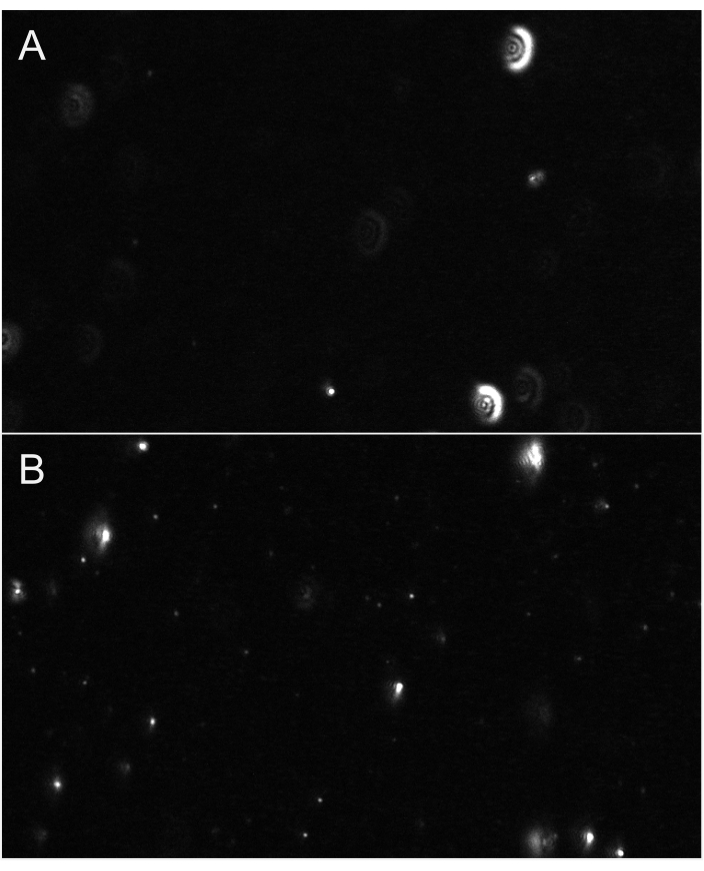
图6:显示粒子聚焦的代表性直播视图。 (A) 不聚焦粒子的实景图示例。粒子有发光般的光环或显得模糊。调整对焦。(B) 适当聚焦粒子的实时流视图示例。最小的粒子是焦点。开始录制。 请单击此处查看此图的较大版本。
- 执行视觉质量检查,以确保样品被正确稀释。如果样品过于集中,请从仪器中取出小面包,并按顺序稀释样品。重复,直到样品被适当稀释,然后再继续到第 6 步。
注意:不要过度稀释样品!始终按顺序进行稀释。理想的空白将只显示屏幕上的几个粒子(1-4),如图 4所示。关于EV样品,经过适当稀释的样品屏幕上将看到大约20-100个粒子,背景中没有发光或多云图像(以 图7 为例)。这应导致每 mL 5 x 106 至 2 x 108 粒子(不调整稀释因子)范围内的最佳颗粒浓度。
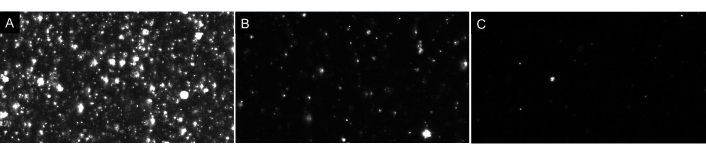
图7:代表描述不同粒子稀释的直播视图。 (A) 过于集中的样本的实景图。记录过于集中的样本会产生不准确的结果。(B) 适当稀释的样品的实况直播视图。屏幕上可以看到 60-100 个颗粒,记录结果原始浓度为 5 x 106- 2 x 108 粒子/mL。(C) 过于稀释的样品的实况直播视图。如果样品是稀释的,将没有足够的粒子跟踪,降低样本大小,因此,结果将在统计上无效。在这种情况下,建议增加录制的视频数量。 请单击此处查看此图的较大版本。
6. 视频数据采集
- (可选)将变焦设置设置为 0.5 倍,以节省带宽并防止帧丢失。
- 通过单击"录制"开始录制视频(有关推荐的录制参数,请参阅表 1)。
注:默认情况下,仪器将搅拌样品 5s,等待 3 s,然后记录为 10s,然后重复此过程。50 个视频的典型测量时间为 15 分钟录制和 13 分钟处理。 - 录制视频时不要触摸仪器。确保实验室长凳的表面不会振动。
注:最好将仪器设置在防振动平台或桌子上,以减少附近设备的任何振动干扰,这些干扰会干扰纳米粒子运动的确定。避免与粒子跟踪仪器在同一长凳上操作离心机、涡流搅拌机或其他潜在的振动产生装置。振动在屏幕上很容易看到,因为通常圆形颗粒的拉长。如果暴露在剧烈的振动中,仪器可能需要重新调整光学元件。仪器的设计不是由客户提供服务或校准的:联系制造商进行维护、服务和校准。 - 请注意任何录制的视频,这些视频具有非常大的颗粒,可见大而不规则的白色斑点。从第 7.3 步处理中删除这些视频。
7. 过程获取数据
- 当提示显示已录制视频时,单击 "确定 "以完成录制。然后选择 过程 选项卡。
注意:协议可以在此处停止。在打开粒子跟踪仪器的软件并指定保存录制视频的目录后,可直接转到 "过程 "选项卡,从而重新启动已获取数据的处理。 - 分析电动汽车时,请检查框 禁用自动检测覆盖, 并将功能直径设置为 30。单击 过程。(请参阅 表 2 用于处理设置,请参阅用于处理显示 的补充图 2)。 实时分布图将显示,以便用户可以实时查看处理。
- 对于外显子,将检测阈值设置为默认 多散样进行处理。将 检测阈值手册 设置为 0.8 而不是 0.99 的标准阈值处理数据,仅针对颗粒大小差异非常大的解决方案。
- 如果任何视频有明显非常大的颗粒可见(参见第 6.4 步),请导航到录制的视频目录并删除有问题的视频。编辑视频文件列表后,更改其他用户保留的日志中录制的视频数量。
- 处理完成后,单击 "确定"。然后,选择 情节 选项卡。对于电动汽车,显示主图表为 日志宾西利卡。
注:在 "绘图" 选项卡中,用户可以自定义图形的其他功能,例如定义 x 轴的范围(粒子直径,nm),以设置用于为生成的数字集成的区域。
8. 显示和解释结果
- 要创建 PDF 报告,请单击 "报告" 按钮。测量现已完成,结果可以查看。
注:请记住首先记录和处理空白,以便可以更正后续样品的背景浓度。如果忘记此步骤,可以在样品和手动校正样品颗粒浓度后记录空白。 - 检查显示平均值、中位数和模式大小的 PDF 报告,以及根据稀释因子调整的浓度,并通过减去稀释物的颗粒浓度进行更正。还显示了分布宽度(标准偏差)。
注:只有极少数应用程序具有适当的和代表性的单一值。因此,建议描述整个尺寸分布并报告所分析任何样本的分布宽度(例如 表 3 所示)。 - 记录用于生成报告结果时应说明的数据的以下仪器设置:每台激光的稀释度激光功率 [mW], 曝光 [ms], 增益 [dB], 帧速率 [fps], 每个视频的帧数, 录制的视频数量, 处理设置 (例如, LogBinsilica), 集成范围 [最小 nm, 最大 nm] (建议设置分钟到 50 nm) 和跟踪的粒子数量 (希望分析每个视频至少 +150 粒子; 每个样本至少 3,750 个总轨道建议避免粒子大小分布中的人工峰值并生成具有统计学意义的数据)。
9. 清洁小面包
- 在样品之间手动清洁小面包。首先,清空小面包。
注:样品可以从小轮库中回收,保存或丢弃。 - 一旦库维特是空的,清洁cuvette冲洗10-15次与去电离(DI)水。然后,用乙醇冲洗3次(70-100%)。这样做时,请务必用溶剂完全填充库维特。
- 用无绒毛的超细纤维布干燥库维特的外部。避免表面有污迹。使用压缩空气除尘器干燥库维特内部或干燥。
注:只应使用透镜清洁纸或无绒毛超细纤维布擦拭小纸片的光学表面,因为大多数纸制品都含有小木纤维,可能会划伤或损坏 cuvette 的表面。 - 准备两个玻璃闪烁瓶:一个装满70-100%乙醇,另一个装满DI水。首先冲洗乙醇中的插入物和搅拌棒(然后是DI水),将插入/搅拌杆放入适当的闪烁小瓶中,并大力摇动小瓶。使用无绒布或压缩空气除尘器干燥插入物和搅拌条。
注:还可以使用声波水浴清洁小轮机和插件。为此,首先确保声波装置包含足够的水(至少 5 厘米深度)。然后将烧杯放入玻璃烧杯(50 毫升或更大),将烧杯中的酒精填充到与水浴相同的水平,将烧杯放入水中,然后打开电源。一次最多 5 分钟的声波,如果需要更长的时间,机器可以休息> 5 分钟。 - 完成后,立即将所有清洁和干燥的组件收起来存放。
结果
在此演示之前,首先测试了仪器的校准,通过测量聚苯乙烯珠标准的大小分布来确保获得数据的有效性。我们使用默认记录参数和本协议中建议的处理设置(图 8)测试了 100 nm 和 400 nm 珠的大小分布。
对于 100 nm 聚苯乙烯珠标准,测量了 4.205 x 107 颗粒/mL 的浓度。平均值(标准偏差,SD)大小为102(±17)nm,变异系数(CV)为0.16。D10/D50/D90 值为 76...
讨论
在这里,我们演示了电动汽车 NTA 的协议,以同时测量各种颗粒大小的大小分布,并测量多分散样品中的总 EV 浓度。在这项研究中,小鼠围产层脂肪组织和人类血浆被用作电动汽车的来源。然而,从其他组织或生物液体(如血清、尿液、唾液、母乳、羊水和细胞培养超高纳特)中分离出来的EV也可用于NTA。聚苯乙烯珠标准的测量确保了仪器得到适当校准,并证明该 NTA 仪器能够正确测量纳米粒子的...
披露声明
所有作者都宣称没有利益冲突。
致谢
这项工作得到了国家卫生研究院(ES030973-01A1,R01ES025225,R01DK066525,P30DK026687,P30DK063608)的支持。我们感谢霍里巴仪器公司博士杰弗里·博德科姆帮助校准仪器。
材料
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
参考文献
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。