È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Analisi di tracciamento delle nanoparticelle per la quantificazione e la determinazione delle dimensioni delle vescicole extracellulari
In questo articolo
Riepilogo
Dimostriamo come utilizzare un nuovo strumento di analisi del tracciamento delle nanoparticelle per stimare la distribuzione dimensionale e la concentrazione totale di particelle di vescicole extracellulari isolate dal tessuto adiposo perigonadale di topo e dal plasma umano.
Abstract
I ruoli fisiologici e fisiopatologici delle vescicole extracellulari (EV) sono diventati sempre più riconosciuti, rendendo il campo EV un'area di ricerca in rapida evoluzione. Esistono molti metodi diversi per l'isolamento dei veicoli elettrici, ognuno con vantaggi e svantaggi distinti che influenzano la resa a valle e la purezza dei veicoli elettrici. Pertanto, caratterizzare la preparazione EV isolata da una determinata fonte con un metodo scelto è importante per l'interpretazione dei risultati a valle e il confronto dei risultati tra i laboratori. Esistono vari metodi per determinare le dimensioni e la quantità di veicoli elettrici, che possono essere alterati da stati patologici o in risposta a condizioni esterne. L'analisi di tracciamento delle nanoparticelle (NTA) è una delle tecnologie di spicco utilizzate per l'analisi ad alto rendimento di singoli veicoli elettrici. Qui, presentiamo un protocollo dettagliato per la quantificazione e la determinazione delle dimensioni dei veicoli elettrici isolati dal tessuto adiposo perigonadale del topo e dal plasma umano utilizzando una tecnologia rivoluzionaria per NTA che rappresenta i principali progressi nel campo. I risultati dimostrano che questo metodo può fornire dati riproducibili e validi sulla concentrazione totale di particelle e sulla distribuzione delle dimensioni per veicoli elettrici isolati da fonti diverse utilizzando metodi diversi, come confermato dalla microscopia elettronica a trasmissione. L'adattamento di questo strumento per NTA affronterà la necessità di standardizzazione nei metodi NTA per aumentare il rigore e la riproducibilità nella ricerca EV.
Introduzione
Le vescicole extracellulari (EV) sono piccole (0,03-2 μm) vescicole legate alla membrana secrete da quasi tutti i tipi di cellule1. Sono spesso indicati come "esosomi", "microvescicole" o "corpi apoptotici" a seconda del loro meccanismo di rilascio e della dimensione2. Mentre inizialmente si pensava che gli EV fossero semplicemente un mezzo per eliminare i rifiuti dalla cellula per mantenere l'omeostasi3, ora sappiamo che possono anche partecipare alla comunicazione intercellulare tramite il trasferimento di materiale molecolare - tra cui DNA, RNA (mRNA, microRNA), lipidi e proteine4,5 - e che sono importanti regolatori della normale fisiologia e dei processi patologici1, 5,6,7,8.
Esistono molti metodi diversi per isolare e quantificare i veicoli elettrici, che sono stati descritti altrove9,10,11,12. Il protocollo di isolamento utilizzato e la fonte dei veicoli elettrici possono influire notevolmente sulla resa e sulla purezza dei veicoli elettrici. Anche la centrifugazione differenziale, a lungo considerata l'approccio "gold standard" per l'isolamento degli esosomi, può essere soggetta a una sostanziale variabilità che successivamente influisce sulla popolazione EV ottenuta e sulle analisi a valle13. Pertanto, le varie metodologie diverse per l'isolamento e la quantificazione dei veicoli elettrici rendono difficile confrontare, riprodurre e interpretare i risultati degli esperimenti riportati nella letteratura14. Inoltre, il rilascio di EV può essere regolato da condizioni cellulari o vari fattori esterni. È stato suggerito che gli EV svolgono un ruolo nel mantenimento dell'omeostasi cellulare proteggendo le cellule dallo stress intracellulare15, poiché diversi studi hanno dimostrato che lo stress cellulare stimola la secrezione ev. Ad esempio, è stato riportato un aumento del rilascio di EV dopo l'esposizione cellulare a ipossia, stress del reticolo endoplasmatico, stress ossidativo, stress meccanico, estratto di fumo di sigaretta e inquinamento atmosferico da particolato16,17, 18,19,20,21,22. Il rilascio di EV ha anche dimostrato di essere modificato in vivo; topi sottoposti a una dieta ricca di grassi o a digiuno per sedici ore hanno rilasciato più EV di adipociti23. Per indagare se un trattamento o una condizione specifica altera il rilascio di veicoli elettrici, il numero di veicoli elettrici deve essere determinato con precisione. La valutazione della distribuzione delle dimensioni dei veicoli elettrici può anche indicare l'origine subcellulare predominante dei veicoli elettrici (ad esempio, fusione di endosomi tardivi/corpi multivesicolari con la membrana plasmatica rispetto al germogliamento della membrana plasmatica)24. Pertanto, vi è la necessità di metodi robusti per misurare con precisione la concentrazione totale e la distribuzione dimensionale della preparazione EV in fase di studio.
Un metodo rapido e altamente sensibile per la visualizzazione e la caratterizzazione dei veicoli elettrici in soluzione è l'analisi del tracciamento delle nanoparticelle (NTA). Una spiegazione dettagliata dei principi di questo metodo e il confronto con metodi alternativi per la valutazione delle dimensioni e della concentrazione dei veicoli elettrici sono stati descritti in precedenza25,26,27,28. In breve, durante la misurazione NTA, i veicoli elettrici vengono visualizzati dalla luce diffusa quando vengono irradiati con un raggio laser. La luce diffusa viene focalizzata da un microscopio su una fotocamera che registra il movimento delle particelle. Il software NTA tiene traccia del moto termico casuale di ogni particella, noto come moto browniano, per determinare il coefficiente di diffusione che viene utilizzato per calcolare la dimensione di ciascuna particella utilizzando l'equazione di Stokes-Einstein. NTA è stato applicato per la prima volta alla misurazione di veicoli elettrici in un campione biologico nel 201125. Fino a poco tempo fa, c'erano solo due aziende mainstream che offrivano strumenti NTA commerciali29 fino all'introduzione del ViewSizer 3000 (di seguito denominato strumento di tracciamento delle particelle) che utilizza una combinazione di nuove soluzioni hardware e software per superare i limiti significativi di altre tecniche NTA.
Lo strumento di tracciamento delle particelle caratterizza le nanoparticelle in campioni liquidi analizzando il loro moto browniano e caratterizza particelle più grandi di dimensioni micron analizzando l'assestamento gravitazionale. L'esclusivo sistema ottico di questo strumento, che include l'illuminazione multispettrale con tre sorgenti di luce laser (a 450 nm, 520 nm e 635 nm), consente ai ricercatori di analizzare contemporaneamente una vasta gamma di dimensioni delle particelle (ad esempio, esosomi, microvescicole). Uno schema della configurazione dello strumento è mostrato nella Figura 1.
Qui, dimostriamo come eseguire la distribuzione delle dimensioni delle particelle e le misurazioni della concentrazione di veicoli elettrici isolati di topi e umani utilizzando un nuovo strumento NTA.
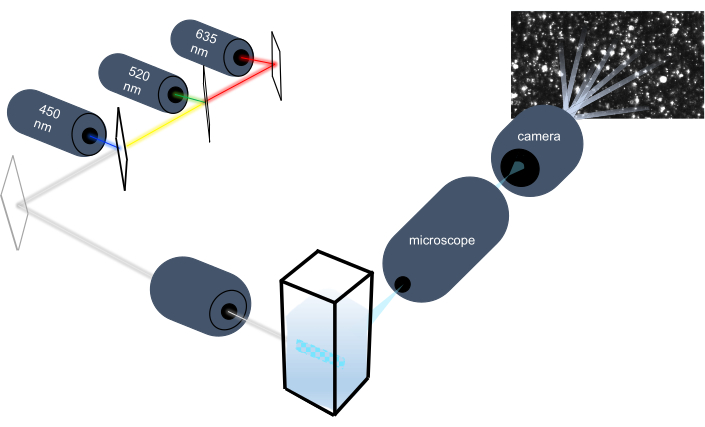
Figura 1: Sistema ottico dello strumento di tracciamento delle particelle. Lo strumento NTA illumina le particelle utilizzando tre laser con le seguenti lunghezze d'onda: 450 nm, 520 nm, 635 nm. La registrazione video della luce diffusa dalle singole particelle viene rilevata e tracciata da una videocamera digitale orientata a 90° dalla cuvetta. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutto il lavoro con questi campioni è stato eseguito in conformità con le linee guida del Comitato istituzionale per la cura e l'uso degli animali e del Comitato di revisione istituzionale. Una panoramica schematica del metodo NTA è illustrata nella Figura 2.
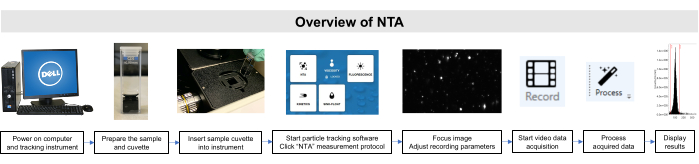
Figura 2: Panoramica del metodo NTA utilizzando lo strumento di tracciamento delle particelle. Il campione viene preparato e inserito nello strumento. Il software NTA viene aperto, i parametri di registrazione vengono regolati e il campione viene focalizzato. Quindi, i dati vengono registrati, elaborati e visualizzati. Fare clic qui per visualizzare una versione più grande di questa figura.
1. Isolamento delle vescicole extracellulari
NOTA: Gli EV del tessuto adiposo perigonadale del topo sono stati isolati come descritto in precedenza23. I veicoli elettrici al plasma sono stati isolati da 1 mL di plasma umano utilizzando il seguente protocollo:
- Raccogliere il plasma e la centrifuga a 3.000 x g per 15 minuti per rimuovere i detriti cellulari. Trasferire il surnatante in un nuovo tubo.
NOTA: se ulteriori detriti rimangono rilevabili, centrifugare il surnatante per ulteriori 10 minuti a 12.000 x g e trasferire il surnatante in un nuovo tubo. - Aggiungere 67 μL del reagente di isolamento dell'esosoma per 250 μL di plasma. Mescolare bene invertendo o facendo scorrere il tubo.
- Incubare su ghiaccio in posizione verticale per 30 min.
- Centrifugare la miscela reagente/plasma di isolamento dell'esosoma a 3.000 x g per 10 minuti a 4 °C.
NOTA: la centrifugazione può essere eseguita a temperatura ambiente o 4 °C con risultati simili, ma è preferibile 4 °C. Dopo la centrifugazione, i veicoli elettrici possono apparire come un pellet beige o bianco nella parte inferiore del tubo. - Aspirare accuratamente il surnatante. Girare verso il basso qualsiasi soluzione di isolamento dell'esosoma residuo e rimuovere tutte le tracce di fluido mediante aspirazione, facendo molta attenzione a non disturbare i veicoli elettrici precipitati nel pellet.
- Risuspendare il pellet in 200 μL di Buffer B (fornito dal produttore). Misurare e registrare la concentrazione proteica del campione (per il passaggio 2.8) utilizzando uno spettrofotometro, un fluorometro, un saggio di Bradford o un altro metodo preferito.
2. Purificazione di veicoli elettrici isolati
- Aggiungere 200 μL di Buffer A (fornito dal produttore) ai veicoli elettrici nuovamente sospesi.
- Togliere la colonna di purificazione (fornita), allentare il tappo a vite e staccare la chiusura inferiore. Posizionare la colonna in un tubo di raccolta.
NOTA: salvare la chiusura inferiore per i passaggi 2.7-2.9. - Centrifugare a 1.000 x g per 30 s per rimuovere il buffer di stoccaggio.
- Scartare il flusso passante e riporre la colonna nel tubo di raccolta.
- Per lavare la colonna, rimuovere il tappo e applicare 500 μL di Tampone B sulla parte superiore della resina e centrifugare a 1.000 x g per 30 s. Scartare il flusso attraverso. Salvare il limite per i passaggi 2.7-2.9.
- Ripetere i passaggi 2.4-2.5 ancora una volta per lavare la colonna.
- Collegare la parte inferiore della colonna con la chiusura inferiore (dal passaggio 2.2). Applicare 100 μL di Tampone B sulla parte superiore della resina per prepararla al carico del campione.
- Aggiungere l'intero contenuto dal punto 1.6 (o fino all'equivalente in volume di 4 mg di proteine totali) alla resina. Posizionare il tappo a vite sulla parte superiore della colonna.
- Mescolare a temperatura ambiente su uno shaker rotante per non più di 5 minuti.
3. Eluizione del campione
- Allentare il tappo a vite e rimuovere la chiusura inferiore e trasferire immediatamente in un tubo microcentrifuga da 2 ml.
NOTA: il campione inizierà a eluire non appena la chiusura inferiore viene rimossa. Assicurarsi che 2 mL di tubi microcentrifuga siano pronti a ricevere l'eluato per ridurre al minimo la perdita di campione. - Centrifuga a 1.000 x g per 30 s per ottenere veicoli elettrici purificati. Eliminare la colonna.
4. Preparazione del campione per l'analisi del tracciamento delle nanoparticelle
- Utilizzare un materiale privo di lanugine come un panno in microfibra per coprire lo spazio di lavoro e impedire alle fibre di entrare nelle cuvette.
- Indossando i guanti, posizionare la cuvetta sulla maschera magnetica a cuvetta, quindi posizionare la barra di agitazione nella cuvetta. Maneggiare sempre le cuvette con i guanti per evitare che impronte digitali e macchie appaiano sulla superficie della cuvetta.
- Utilizzare lo strumento gancio per posizionare l'inserto nella cuvetta come illustrato nella Figura 3. È importante notare l'orientamento dell'inserto per dopo (passaggio 5.4).

Figura 3: Corretto orientamento dell'inserto all'interno della cuvetta di quarzo. La "tacca" dell'inserto dovrebbe essere visibile dalla parte anteriore della cuvetta. Questo deve essere inserito nello strumento rivolto verso la fotocamera. Fare clic qui per visualizzare una versione più grande di questa figura.
- Utilizzando una pipetta, aggiungere lentamente 400-500 μL del campione diluente o diluito a temperatura ambiente alla cuvetta attraverso il foro nell'inserto. Pipettare delicatamente su e giù per mescolare. Evitare di introdurre bolle d'aria.
- Per prima cosa preparare una cuvetta caricata con il diluente scelto (bianco) per misurare la concentrazione di particelle del diluente. Questo dovrebbe essere fatto prima di misurare il campione in modo che la concentrazione di fondo del campione possa essere corretta.
NOTA: un buon bianco (soluzione salina tamponata con fosfato [PBS] in questo caso) avrà una concentrazione <9 x10 6 (a seconda del diluente) e visualizzerà 1-10 particelle per schermo nella vista dal vivo (Figura 4). Si raccomanda che la concentrazione effettiva di particelle del campione sia almeno 3 volte la concentrazione di fondo. - Facoltativamente, prima di registrare il campione innescare la cuvetta con 400-500 μL del campione diluente o diluito prima della misurazione. Per fare ciò, caricare 400-500 μL del campione diluito nella cuvetta, scartare la soluzione e quindi aggiungere 400-500 μL in più del campione per la misurazione. Questo può aiutare a lavare i residui all'interno della cuvetta.
- Per prima cosa preparare una cuvetta caricata con il diluente scelto (bianco) per misurare la concentrazione di particelle del diluente. Questo dovrebbe essere fatto prima di misurare il campione in modo che la concentrazione di fondo del campione possa essere corretta.

Figura 4: Visualizzazione rappresentativa in diretta streaming di un diluente all'interno del corretto intervallo di concentrazione di un bianco. Preparazioni EV diluite in PBS filtrato (0,02 μm o 3 kDa, preferibile). Un buon bianco visualizzerà ~ 1-10 particelle per schermo nella vista dal vivo, producendo una concentrazione nell'intervallo 105-106. Fare clic qui per visualizzare una versione più grande di questa figura.
- Tappare la cuvetta e verificare la presenza di bolle. Tocca le bolle se necessario. Utilizzare un panno privo di lanugine per pulire le facce esterne della cuvetta.
5. Procedura di avvio dello strumento di tracciamento delle particelle
- Accendere la postazione di lavoro e lo strumento del computer, attendere qualche minuto prima di eseguire il primo campione e avviare il programma facendo clic sull'icona del software. Quando richiesto, fare clic su NTA sullo schermo per eseguire l'analisi di tracciamento delle nanoparticelle. Inizia nella scheda Registrazione e fai clic sulle varie schede software(Registra, Elabora, Traccia)per passare da una all'altro in tutto il protocollo. Registrare prima il campione (diluente o preparazione EV), quindi elaborare le registrazioni e infine tracciare i risultati.
- Seguire le istruzioni visualizzate sullo schermo per compilare tutte le informazioni necessarie sul campione. Verificare che tutti i campi necessari siano compilati e accurati, ad esempio Nome campione, Descrizione, Preparazione del campione, Fattore di diluizione [1000], Temperatura target (impostata su 22 °C) e Diluente: selezionare il diluente dal menu a discesa e utilizzare PBS come diluente per i veicoli elettrici. Selezionando PBS dal menu a discesa, la salinità verrà popolata automaticamente al 9%. Queste informazioni sono necessarie per determinare la viscosità dinamica del liquido.
NOTA: possono essere necessari fino a 3 minuti prima che la temperatura si equilibra all'interno della cuvetta anche se la sonda mostra già la temperatura desiderata (ad esempio, il punto verde diventa stabile). Le lettura del campione potrebbero variare considerevolmente se la temperatura target non è impostata, poiché le differenze di temperatura del campione potrebbero alterare notevolmente il moto browniano delle particelle. - Aprire il coperchio dello strumento e rimuovere il cappuccio protettivo che copre il punto in cui verrà posizionata la cuvetta.
ATTENZIONE: Lo strumento di tracciamento delle particelle è certificato come prodotto laser di Classe 1 (21 CFR Ch. I parte 1040), contenente laser che possono essere pericolosi e potrebbero causare gravi lesioni come ustioni e/o danni permanenti alla vista. Per evitare incidenti o lesioni, non rimuovere il coperchio dello strumento svitando i bulloni dal lato. Si noti che durante il funzionamento, i raggi laser sono completamente chiusi, senza rappresentare una minaccia per gli utenti. Inoltre, un interblocco di sicurezza magnetico è integrato nel porta campioni dello strumento per impedire ai laser di funzionare quando viene rimosso il cappuccio del porta campioni. - Posizionare la cuvetta (dal punto 4.3) all'interno dello strumento con l'orientamento corretto (vedere figura 5). Sostituire il cappuccio sopra la cuvetta e chiudere il coperchio dello strumento. Azionare sempre lo strumento con il cappuccio in posizione sopra il porta campioni. Non disabilitare o tentare di aggirare la funzione di interblocco di sicurezza.

Figura 5: Corretto orientamento della cuvetta all'interno dello strumento di tracciamento delle particelle. La faccia della cuvetta (con la "tacca" dell'inserto visibile) dovrebbe essere rivolte verso la fotocamera. Fare clic qui per visualizzare una versione più grande di questa figura.
- Accendi la fotocamera facendo clic sulla freccia sopra Streaming.
- Fare clic sulla freccia chevron per espandere le impostazioni di registrazione. Impostare guadagno e potenza laser sui valori appropriati per l'applicazione. Vedere la Tabella 1 (e la Figura supplementare 1)per i parametri utilizzati per nTA di veicoli elettrici di piccole dimensioni (100 nm).
NOTA: queste impostazioni avanzate a cui si accede facendo clic sulla freccia chevron potrebbero essere protette da password. Utilizzare le stesse impostazioni per la registrazione e l'elaborazione per il diluente (vuoto) di quelle utilizzate per i campioni successivi. - Regolare la messa a fuoco fino a quando le particelle non sono correttamente focalizzate. La messa a fuoco dovrebbe essere fatta su particelle relativamente piccole (Figura 6). Per la piccola quantificazione EV (compatibile con gli esosomi), si consigliano le seguenti impostazioni di registrazione: Frame rate: 30 fps, Esposizione: 15 ms, Tempo di agitazione: 5 s, Tempo di attesa: 3 s, Potenza laser - Blu: 210 mW, Verde: 12 mW, Rosso: 8 mW, Fotogrammi per video: 300 fotogrammi e Guadagno: 30 dB.
NOTA: l'utente può aumentare lo zoom a 1x e/o aumentare il guadagno per aiutare con la messa a fuoco. Ricorda di reim impostare questi parametri sui valori consigliati prima di registrare video.
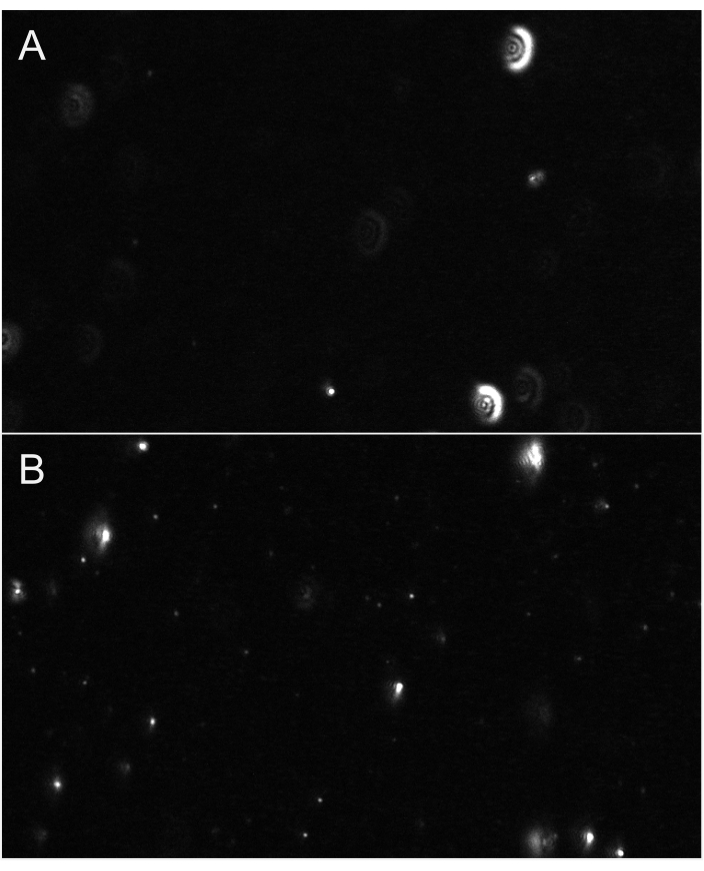
Figura 6: Viste rappresentative in live streaming che mostrano lo stato attivo delle particelle. (A) Un esempio di visualizzazione in live streaming di particelle non a fuoco. Le particelle hanno un alone luminoso o appaiono sfocate. Regola la messa a fuoco. (B) Un esempio di visualizzazione in live streaming di particelle a fuoco corretta. Le particelle più piccole sono a fuoco. Inizia la registrazione. Fare clic qui per visualizzare una versione più grande di questa figura.
- Eseguire un controllo di qualità visiva per garantire che il campione sia correttamente diluito. Se il campione è troppo concentrato, rimuovere la cuvetta dallo strumento e diluire il campione in sequenza. Ripetere l'operazione fino a quando il campione non è correttamente diluito prima di procedere al passaggio 6.
NOTA: non diluire eccessivamente il campione! Fai sempre diluizioni in sequenza. Lo spazio vuoto ideale visualizzerà solo poche particelle sullo schermo (1-4) come mostrato nella Figura 4. Per quanto riguarda i campioni EV, un campione correttamente diluito avrà circa 20-100 particelle visibili sullo schermo, senza immagini luminose o nuvolose sullo sfondo (vedere la Figura 7 come esempio). Ciò dovrebbe comportare una concentrazione ottimale di particelle nell'intervallo da 5 x 106 a 2 x 108 particelle per mL (senza aggiustamento per il fattore di diluizione).
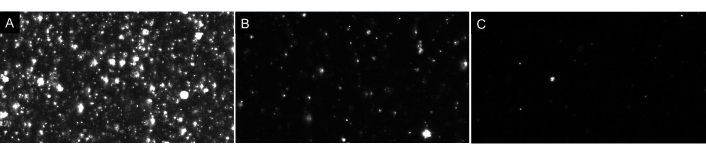
Figura 7: Viste rappresentative in diretta streaming che raffigurano diverse diluizioni di particelle. (A) Un esempio di visualizzazione in diretta streaming di un campione troppo concentrato. La registrazione di un campione troppo concentrato produrrà risultati imprecisi. (B) Un esempio di visualizzazione in diretta streaming di un campione correttamente diluito. Ci sono 60-100 particelle visibili sullo schermo e la registrazione si traduce in una concentrazione grezza di 5 x10 6- 2 x 108 particelle / mL. (C) Un esempio di visualizzazione in live streaming di un campione troppo diluito. Se un campione è questo diluito, non ci saranno abbastanza particelle tracciate, abbassando la dimensione del campione e, quindi, i risultati saranno statisticamente non validi. In questo caso, si consiglia di aumentare il numero di video registrati. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Acquisizione dati video
- (Facoltativo) Impostare l'impostazione dello zoom su 0,5x per risparmiare larghezza di banda ed evitare la perdita di fotogrammi.
- Inizia a registrare i video facendo clic su Registra (vedi Tabella 1 per i parametri di registrazione consigliati).
NOTA: per impostazione predefinita, lo strumento mescola il campione per 5 s, attende 3 s e quindi registra per 10 s prima di ripetere questo processo. Il tempo di misurazione tipico per 50 video è di ~ 15 minuti per registrare e ~ 13 minuti per elaborare. - Non toccare lo strumento durante la registrazione di video. Assicurarsi che la superficie del banco di laboratorio non vibri.
NOTA: Si preferisce che lo strumento sia impostato su una piattaforma o un tavolo antivibrante per ridurre eventuali disturbi vibrazionali provenienti da apparecchiature vicine che interferiranno con la determinazione del movimento delle nanoparticelle. Evitare di utilizzare centrifughe, miscelatori a vortice o altri potenziali dispositivi che generano vibrazioni sullo stesso banco dello strumento di tracciamento delle particelle. Le vibrazioni sono facilmente visibili sullo schermo come allungamento di particelle solitamente rotonde. Se esposto a vibrazioni vigorose, lo strumento può richiedere il riallineamento di elementi ottici. Lo strumento non è stato progettato per essere revisionato o tarato dal cliente; contattare il produttore per la manutenzione, l'assistenza e la calibrazione. - Nota qualsiasi video registrato con particelle molto grandi visibili come macchie bianche grandi e irregolari. Rimuovi questi video dall'elaborazione nel passaggio 7.3.
7. Trattamento dei dati acquisiti
- Quando viene visualizzato un messaggio che indica che i video sono stati registrati, fare clic su OK per completare la registrazione. Quindi selezionare la scheda Processo.
NOTA: il protocollo può essere interrotto qui. L'elaborazione dei dati acquisiti può essere riavviata in un secondo momento passando direttamente alla scheda Processo dopo aver aperto il software dello strumento di tracciamento delle particelle e specificando la directory in cui vengono salvati i video registrati. - Quando analizzate i veicoli elettrici, selezionare la casella Disattiva sostituzione rilevamento automatico e impostare il diametro della feature su 30. Fare clic su Elabora. (Vedere la Tabella 2 per le impostazioni di elaborazione e la Figura supplementare 2 per la visualizzazione dell'elaborazione). Verrà visualizzato un grafico di distribuzione in tempo reale in modo che l'utente possa visualizzare l'elaborazione in tempo reale.
- Per gli esosomi, elaborare con Soglia di rilevamento impostata sul campione polidisperso predefinito. Elaborare i dati con Detection Threshold Manual impostato su 0,8 invece di una soglia standard di 0,99 solo per soluzioni con differenze molto grandi nelle dimensioni delle particelle.
- Se alcuni video avevano particelle notevolmente molto grandi visibili (vedere il passaggio 6.4), passare alla directory dei video registrati e rimuovere il video problematico. Dopo aver modificato l'elenco dei file video, modificare il numero di video registrati in altri registri mantenuti dall'utente.
- Al termine dell'elaborazione, fare clic su OK. Quindi, selezionare la scheda Plot. Per i veicoli elettrici, visualizzare il grafico principale come LogBinSilica.
NOTA: nella scheda Plot, l'utente può personalizzare altre funzionalità del grafico, ad esempio la definizione dell'intervallo dell'asse x (diametro delle particelle, nm) per impostare l'area di integrazione per la figura prodotta.
8. Visualizzare e interpretare i risultati
- Per creare un report PDF, fare clic sul pulsante Report. La misurazione è ora completa e i risultati possono essere visualizzati.
NOTA: Ricordarsi di registrare ed elaborare prima lo spazio vuoto in modo che la concentrazione di fondo dei campioni successivi possa essere corretta. Se questo passaggio viene dimenticato, il bianco può essere registrato dopo i campioni e la concentrazione di particelle del campione corretta manualmente. - Esaminare il report PDF che visualizza la dimensione media, mediana e modale, nonché la concentrazione regolata per il fattore di diluizione e corretta sottraendo la concentrazione di particelle del diluente. Viene mostrata anche la larghezza di distribuzione (deviazione standard).
NOTA: esistono pochissime applicazioni in cui un singolo valore è appropriato e rappresentativo. Pertanto, si consiglia di descrivere l'intera distribuzione dimensionale e di riportare la larghezza della distribuzione per qualsiasi campione analizzato (come mostrato nella Tabella 3 per esempio). - Registrare le seguenti impostazioni dello strumento utilizzate per generare i dati che devono essere indicati quando si riportano i risultati: Diluente, Potenza laser di ciascun laser [mW], Esposizione [ms], Guadagno [dB], Frequenza fotogrammi [fps], Fotogrammi per video, Numero di video registrati, Impostazione di elaborazione (ad esempio, LogBinSilica), Intervallo di integrazione [min nm, nm massimo] (consigliato per impostare min a 50 nm) e Numero di particelle tracciate (desiderabile per analizzare almeno ~ 150 particelle per video; minimo 3.750 tracce totali per campione raccomandato per evitare picchi artefatti nella distribuzione granulometrica e generare dati statisticamente significativi).
9. Pulizia delle cuvette
- Pulire manualmente le cuvette tra i campioni. Per prima cosa, svuotare la cuvetta.
NOTA: il campione può essere recuperato dalla cuvetta e salvato o scartato. - Una volta che la cuvetta è vuota, pulire la cuvetta risciacquandola 10-15 volte con acqua deionabilizzata (DI). Quindi, risciacquare 3 volte con etanolo (70-100%). Quando lo fai, assicurati di riempire completamente la cuvetta con solvente.
- Asciugare l'esterno della cuvetta con un panno in microfibra privo di lanugine. Evitare sbavature sulle superfici. Asciugare all'aria l'interno della cuvetta o asciugare utilizzando uno spolverino ad aria compressa.
NOTA: per pulire le superfici ottiche della cuvetta, è necessario utilizzare solo carta per la pulizia delle lenti o panno in microfibra privo di lanugine, poiché la maggior parte dei prodotti di carta contiene piccole fibre di legno che possono graffiare o danneggiare la superficie della cuvetta. - Preparare due flaconcini di vetro scintillante: uno riempito con etanolo al 70-100% e l'altro con acqua DI. Risciacquare gli inserti e mescolare prima le barre nell'etanolo (poi nell'acqua DI) posizionando l'inserto/la barra di agitazione nell'apposito flaconcino a scintillazione e agitando vigorosamente il flaconcino. Asciugare gli inserti e mescolare le barre utilizzando panni privi di lanugine o spolveratori ad aria compressa.
NOTA: La cuvetta e l'inserto possono anche essere puliti utilizzando un bagno d'acqua sonicante. Per fare ciò, assicurarsi innanzitutto che l'unità sonicante contenga abbastanza acqua (almeno 5 cm di profondità). Quindi posizionare la cuvetta e inserire all'interno di un bicchiere di vetro (50 ml o superiore), riempire il becher con alcool allo stesso livello del bagno d'acqua, posizionare il becher nell'acqua e accendere l'alimentazione. Sonicare per un massimo di 5 minuti alla volta, consentendo alla macchina di riposare >5 minuti tra ogni raffica di 5 minuti se sono necessari tempi più lunghi. - Al termine, mettere immediatamente via tutti i componenti puliti e asciugati per la conservazione.
Access restricted. Please log in or start a trial to view this content.
Risultati
Prima di questa dimostrazione, la calibrazione dello strumento è stata prima testata per garantire la validità dei dati acquisiti misurando la distribuzione dimensionale degli standard di perline di polistirene. Abbiamo testato la distribuzione dimensionale di perle da 100 nm e 400 nm utilizzando i parametri di registrazione predefiniti e le impostazioni di elaborazione consigliate in questo protocollo (Figura 8).
Per lo standard di perline di polistirene da 100...
Access restricted. Please log in or start a trial to view this content.
Discussione
Qui, dimostriamo un protocollo per NTA di veicoli elettrici per misurare la distribuzione dimensionale di un'ampia gamma di dimensioni delle particelle contemporaneamente e misurare la concentrazione totale di EV in un campione polidisperso. In questo studio, il tessuto adiposo perigonadale di topo e il plasma umano sono stati utilizzati come fonte di veicoli elettrici. Tuttavia, gli EV isolati da altri tessuti o fluidi biologici come siero, urina, saliva, latte materno, liquido amniotico e surnatante di coltura cellular...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Tutti gli autori hanno dichiarato che non ci sono conflitti di interesse.
Riconoscimenti
Questo lavoro è stato supportato dal National Institutes of Health (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Riconosciamo Jeffrey Bodycomb, Ph.D. di HORIBA Instruments Incorporated per il suo aiuto nella calibrazione dello strumento.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
Riferimenti
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021(2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, San Diego, California. 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569(2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421(2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , Clifton, N.J. 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016(2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. Absorption and Scattering of Light by Small Particles. , John Wiley & Sons. (1983).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon