A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח מעקב חלקיקים לכימות וקביעת גודל של שלל חוץ-תאי
In This Article
Summary
אנו מדגימים כיצד להשתמש במכשיר ניתוח ננו-חלקיקים חדשני כדי להעריך את התפלגות הגודל ואת ריכוז החלקיקים הכולל של שלל חוץ תאי מבודד רקמת שומן perigonadal עכבר ופלזמה אנושית.
Abstract
התפקידים הפיזיולוגיים והפתופיזיולוגיים של שלשלות חוץ תאיות (EVs) הפכו מוכרים יותר ויותר, מה שהופך את שדה הרכב התגנבות לתחום מחקר המתפתח במהירות. ישנן שיטות רבות ושונות לבידוד EV, כל אחת עם יתרונות וחסרונות ברורים המשפיעים על התשואה במורד הזרם וטוהר של EVs. לכן, אפיון הכנת EV מבודד ממקור נתון על ידי שיטה שנבחרה חשוב לפרשנות של תוצאות במורד הזרם והשוואת תוצאות על פני מעבדות. קיימות שיטות שונות לקביעת הגודל והכמות של כלי עבודה אלקטרוניים, אשר ניתן לשנות על ידי מצבי מחלה או בתגובה לתנאים חיצוניים. ניתוח מעקב ננו-חלקיקים (NTA) היא אחת הטכנולוגיות הבולטות המשמשות לניתוח תפוקה גבוהה של EVs בודדים. כאן, אנו מציגים פרוטוקול מפורט לכימות וקביעת גודל של כלי עבודה אלקטרוניים מבודדים מרקמת שומן perigonadal עכבר ופלזמה אנושית באמצעות טכנולוגיה פורצת דרך עבור NTA המייצגת התקדמות משמעותית בתחום. התוצאות מראות כי שיטה זו יכולה לספק נתוני ריכוז חלקיקים כוללים וחלוקת חלקיקים חוקיים לשחזור עבור EVs המבודדים ממקורות שונים בשיטות שונות, כפי שאושר על ידי מיקרוסקופיית אלקטרונים שידור. ההתאמה של מכשיר זה עבור נת"ע תתייחס לצורך בתקינה בשיטות נת"ע להגברת ההקפדה והשחזור במחקרי EV.
Introduction
שלשלות חוץ-תאיות (EVs) הן שלשלות קטנות (0.03-2 מיקרומטר) הקשורות לקרום המופרשות על ידי כמעט כל סוגי התאים1. הם מכונים לעתים קרובות "exosomes", "microvesicles", או "גופים אפופוטוטיים" בהתאם למנגנון השחרור שלהם וגודל2. אמנם בתחילה חשבו כי EVs היו פשוט אמצעי לחיסול פסולת מהתא כדי לשמור על הומאוסטזיס3, עכשיו אנחנו יודעים שהם יכולים גם להשתתף בתקשורת בין תאית באמצעות העברת חומר מולקולרי - כולל DNA, RNA (mRNA, microRNA), שומנים, וחלבונים4,5 - וכי הם רגולטורים חשובים של פיזיולוגיה נורמלית, כמו גם תהליכים פתולוגיים1, 5,6,7,8.
ישנן שיטות רבות ושונות כדי לבודד ולכומת EVs, אשר תוארו במקומות אחרים9,10,11,12. פרוטוקול הבידוד המשמש, כמו גם את המקור של EVs יכול להשפיע מאוד על תשואה EV וטוהר. אפילו צנטריפוגה דיפרנציאלית, שנחשבה זה מכבר לגישת "תקן הזהב" לבידוד אקסוזום, יכולה להיות כפופה לשינויים משמעותיים המשפיעים לאחר מכן על אוכלוסיית EV שהושגה ובניתוחים במורד הזרם13. לכן, המתודולוגיות השונות לבידוד וכימות EV מקשות על השוואה, שחזור ופרשנות של תוצאות ניסויים שדווחו בספרות14. יתר על כן, שחרור EV יכול להיות מוסדר על ידי תנאים הסלולר או גורמים חיצוניים שונים. הוצע כי EVs לשחק תפקיד בשמירה על הומאוסטזיס הסלולר על ידי הגנה על תאים מפני מתח תאי15, כמו מספר מחקרים הראו כי מתח תאי מגרה הפרשת EV. לדוגמה, שחרור EV מוגבר דווח לאחר חשיפה תאית היפוקסיה, לחץ רשתית אנדופלסמי, עקה חמצונית, מתח מכני, תמצית עשן סיגריות, זיהום אוויר חומר חלקיקי16,17,18,19,20,21,22. גם שחרור EV הוכח להיות שונה ב vivo; עכברים נתונים לתזונה עתירת שומן או צום במשך 16 שעות שחררו יותר adipocyte EVs23. כדי לחקור אם טיפול או מצב ספציפיים משנים את שחרור EV, יש לקבוע במדויק את מספר ה- EVs. הערכת התפלגות גודל הרכב הרך EV עשויה גם להצביע על המקור התת-תאי השולט של רכבים לוויוניים (למשל, היתוך של אנדוזומים מאוחרים/גופים רב-תאיים עם קרום הפלזמה לעומת ניצנים של קרום הפלזמה)24. לכן, יש צורך בשיטות חזקות כדי למדוד במדויק את הריכוז הכולל ואת התפלגות הגודל של הכנת EV הנלמדת.
שיטה מהירה ורגישה מאוד להדמיה ואפיון של EVs בפתרון היא ניתוח מעקב ננו-חלקיקים (NTA). הסבר מפורט על עקרונות שיטה זו והשוואה עם שיטות חלופיות להערכת גודל EV וריכוז תוארו בעבר25,26,27,28. בקצרה, במהלך מדידת NTA, EVs דמיינו על ידי האור הפזור כאשר הם מוקרן עם קרן לייזר. האור המפוזר מתמקד במיקרוסקופ למצלמה המתעד את תנועת החלקיקים. תוכנת NTA עוקבת אחר התנועה התרמית האקראית של כל חלקיק, המכונה תנועה בראונית, כדי לקבוע את מקדם הדיפוזיה המשמש לחישוב הגודל של כל חלקיק באמצעות משוואת סטוקס-איינשטיין. NTA הוחל לראשונה על מדידת EVs במדגם ביולוגי בשנת 201125. עד לאחרונה, היו רק שתי חברות מיינסטרים המציעות מכשירים מסחריים של NTA29 עד כניסתו של ViewSizer 3000 (להלן מכשיר מעקב חלקיקים) המשתמש בשילוב של פתרונות חומרה ותוכנה חדשניים כדי להתגבר על מגבלות משמעותיות של טכניקות NTA אחרות.
מכשיר המעקב אחר חלקיקים מאפיין חלקיקים בדגימות נוזליות על ידי ניתוח התנועה הבראונית שלהם ומאפיין חלקיקים גדולים יותר בגודל מיקרון על ידי ניתוח התיישבות כבידה. המערכת האופטית הייחודית של מכשיר זה, הכוללת תאורה רב-ספקטרלית עם שלושה מקורות אור לייזר (ב-450 ננומטר, 520 ננומטר ו-635 ננומטר), מאפשרת לחוקרים לנתח מגוון רחב של גדלי חלקיקים (למשל אקסוזומים, מיקרו-vesicles) בו זמנית. תרשים של הגדרת המכשיר מוצג באיור 1.
כאן, אנו מדגימים כיצד לבצע התפלגות גודל חלקיקים ומדידות ריכוז של עכבר מבודד ו- EVs אנושי באמצעות מכשיר NTA חדשני.
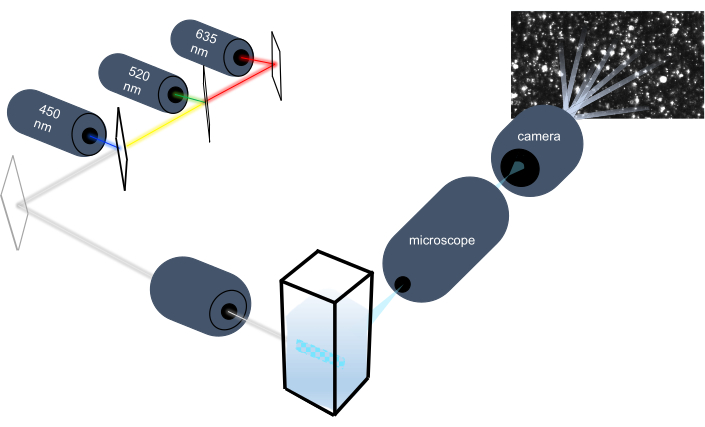
איור 1: מערכת אופטית של מכשיר מעקב חלקיקים. מכשיר NTA מאיר חלקיקים באמצעות שלושה לייזרים עם אורכי הגל הבאים: 450 ננומטר, 520 ננומטר, 635 ננומטר. הקלטת וידאו של האור המפוזר מחלקיקים בודדים מזוהה ומעקב על ידי מצלמת וידאו דיגיטלית מכוונת 90 ° מן cuvette. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל העבודה עם דגימות אלה בוצעה בהתאם להנחיות הוועדה המוסדית לטיפול בבעלי חיים ושימוש והנחיות הוועדה לביקורת מוסדית. סקירה סכמטית של שיטת NTA מתוארת באיור 2.
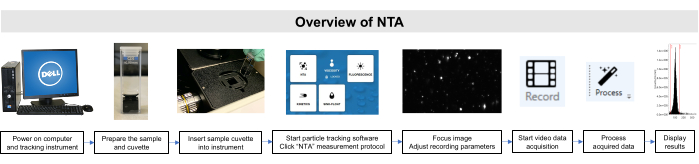
איור 2: סקירה כללית של שיטת NTA באמצעות מכשיר המעקב אחר חלקיקים. המדגם מוכן ומוכנס לתוך המכשיר. תוכנת NTA נפתחת, פרמטרי ההקלטה מותאמים, והדגימה ממוקדת. לאחר מכן, הנתונים נרשמים, מעובדים ומוצגים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
1. בידוד ארסיות חוץ-תאית
הערה: עכבר perigonadal רקמת שומן EVs היו מבודדים כפי שתואר בעבר23. פלזמה EVs היו מבודדים מ 1 מ"ל של פלזמה אנושית באמצעות הפרוטוקול הבא:
- לאסוף את הפלזמה ואת הצנטריפוגה ב 3,000 x g במשך 15 דקות כדי להסיר פסולת הסלולר. העבר את סופר-טבעי לצינור חדש.
הערה: אם פסולת נוספת נשארת ניתנת לזיהוי, צנטריפוגה supernatant במשך 10 דקות נוספות ב 12,000 x g ולהעביר את supernatant לצינור חדש. - הוסף 67 μL של ריאגנט בידוד exosome לכל 250 μL של פלזמה. מערבבים היטב על ידי היפוך או הבהוב הצינור.
- דגירה על קרח זקוף במשך 30 דקות.
- צנטריפוגה תערובת ריאגנט/פלזמה בידוד exosome ב 3,000 x גרם במשך 10 דקות ב 4 °C (70 °F).
הערה: צנטריפוגה עשויה להתבצע בטמפרטורת החדר או 4 °C (7 °F) עם תוצאות דומות, אבל 4 °C (70 °F) עדיפים. לאחר צנטריפוגה, EVs עשוי להופיע כמו בז 'או גלולה לבנה בתחתית הצינור. - שאף בזהירות את סופר-טבעי. ספין למטה כל פתרון בידוד exosome שיורית ולהסיר את כל עקבות של נוזל על ידי שאיפה, תוך דאגה רבה לא להפריע את EVs מזורזים הכדור.
- resuspend הכדור ב 200 μL של חוצץ B (מסופק על ידי היצרן). למדוד ולתעד את ריכוז החלבון של המדגם (לשלב 2.8) באמצעות ספקטרופוטומטר, פלואורומטר, ברדפורד או שיטה מועדפת אחרת.
2. טיהור של EVs מבודד
- הוסף 200 μL של מאגר A (שסופק על-ידי היצרן) ל- EVs מושעה מחדש.
- מוציאים את עמודת הטיהור (מסופקת), משחררים את מכסה הבורג ומנתקים את הסגירה התחתונה. מקם את העמודה בצינור איסוף.
הערה: שמור את הסגירה התחתונה לשלבים 2.7-2.9. - צנטריפוגה ב 1,000 x g עבור 30 s כדי להסיר את מאגר האחסון.
- השלך את הזרימה והחזר את העמודה לצינור האיסוף.
- כדי לשטוף את העמודה, הסר את המכסה והחל 500 μL של חוצץ B על גבי השרף וצנטריפוגה ב 1,000 x g עבור 30 s. זרוק את הזרימה דרכה. שמור את המכסה לשלבים 2.7-2.9.
- חזור על שלבים 2.4-2.5 פעם נוספת כדי לשטוף את העמודה.
- חבר את תחתית העמודה עם הסגירה התחתונה (מהשלב 2.2). החל 100 μL של מאגר B על גבי השרף כדי להכין אותו לטעינת מדגם.
- הוסיפו את כל התוכן החל בשלב 1.6 (או שווה ערך לנפח של 4 מ"ג חלבון כולל) לשרף. הנח את מכסה הבורג בחלק העליון של העמודה.
- מערבבים בטמפרטורת החדר על שייקר מסתובב לא יותר מ-5 דקות.
3. אלגנטיות דגימה
- שחררו את מכסה הבורג והסירו את הסגירה התחתונה, והעבירו מיד לצינור מיקרוצנטריפוגה 2 מ"ל.
הערה: המדגם יתחיל לחמוק ברגע שהסגירה התחתונה תוסר. נא ודא 2 mL צינורות microcentrifuge מוכנים לקבל eluate כדי למזער את אובדן מדגם. - צנטריפוגה ב 1,000 x g עבור 30 s כדי לקבל EVs מטוהר. בטל את העמודה.
4. הכנה לדוגמה לניתוח מעקב חלקיקים
- השתמש בחומר ללא מוך כמו בד microfiber כדי לכסות את סביבת העבודה ולמנוע סיבים מלהיכנס cuvettes.
- לובשים כפפות, מניחים את הקובט על הג'יג המגנטי, ואז מניחים את מוט הערבוב בקובט. תמיד להתמודד עם cuvettes עם כפפות כדי למנוע טביעות אצבעות וכתמים מלהופיע על פני השטח של cuvette.
- השתמשו בכלי hook כדי למקם את התוספת לתוך הקובט כמתואר באיור 3. חשוב לציין את כיוון ההוספה להמשך (שלב 5.4).

איור 3: כיוון נכון של הוספה בתוך קובט הקוורץ. "החרץ" של התוסף צריך להיות גלוי מחזית הקובט. זה צריך להיות מוכנס לתוך המכשיר מול המצלמה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- באמצעות פיפטה, לאט להוסיף 400-500 μL של המדגם מדולל או מדולל בטמפרטורת החדר כדי cuvette דרך החור בהוספה. מקטרים בעדינות למעלה ולמטה כדי לערבב. הימנעו מהכנסת בועות אוויר.
- ראשית להכין cuvette טעון עם דילול הנבחר (ריק) כדי למדוד את ריכוז החלקיקים של דילול. זה צריך להיעשות לפני מדידת המדגם, כך ריכוז הרקע של המדגם ניתן לתקן.
הערה: ריק טוב (תמיסת מלח חוצץ פוספט [PBS] במקרה זה) יהיה ריכוז <9 x 106 (בהתאם לדילול) ויציג 1-10 חלקיקים לכל מסך בתצוגה החיה(איור 4). מומלץ כי ריכוז חלקיקי המדגם בפועל הוא לפחות 3 פעמים את ריכוז הרקע. - לחלופין, לפני הקלטת הדגימה cuvette עם 400-500 μL של המדגם מדולל או מדולל לפני המדידה. כדי לעשות זאת, לטעון 400-500 μL של המדגם המדולל לתוך cuvette, להשליך את הפתרון, ולאחר מכן להוסיף 400-500 μL יותר של המדגם למדידה. זה עשוי לעזור בשטיפת שאריות בתוך cuvette.
- ראשית להכין cuvette טעון עם דילול הנבחר (ריק) כדי למדוד את ריכוז החלקיקים של דילול. זה צריך להיעשות לפני מדידת המדגם, כך ריכוז הרקע של המדגם ניתן לתקן.

איור 4: תצוגת זרם חי מייצגת של דילול בטווח הריכוז הנכון של ריק. דלל הכנות EV ב- PBS מסונן (0.02 מיקרומטר או 3 kDa, מועדף). ריק טוב יציג ~ 1-10 חלקיקים לכל מסך בתצוגה החיה, מניב ריכוז בטווח 105-106. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תכובע את הקובט ותבדוק אם יש בועות. הקש על בועות במידת הצורך. השתמש במטלית ללא מוך כדי לנגב את הפנים החיצוניות של הקובט.
5. הליך הפעלה של מכשיר מעקב החלקיקים
- הפעל את תחנת העבודה והמכשיר של המחשב, המתן מספר דקות לפני הפעלת המדגם הראשון והפעל את התוכנית על-ידי לחיצה על סמל התוכנה. כאשר תתבקש, לחץ על NTA על המסך כדי לבצע ניתוח מעקב חלקיקים. התחל בכרטיסיה הקלטה ולחץ על כרטיסיות התוכנה השונות(הקלט, תהליך, התוויה) כדי לעבור ביניהן לאורך הפרוטוקול. הקלט תחילה את המדגם (דילול או הכנה EV) ולאחר מכן עבד את ההקלטות ולבסוף התווה את התוצאות.
- בצע את ההוראות על המסך כדי למלא את כל המידע הדרוש אודות המדגם. ודא שכל השדות הדרושים הושלמו ומדויקים, כלומר שם לדוגמה, תיאור, הכנה לדוגמה, גורם דילול [1000], טמפרטורת היעד (מוגדרת ל- 22 °C) ודילול: בחר דילול מהתפריט הנפתח והשתמש ב- PBS כדילול עבור EVs. בחירת PBS מהתפריט הנפתח תאכלס אוטומטית את המליחות ל- 9%. מידע זה נחוץ כדי לקבוע את הצמיגות הדינמית של הנוזל.
הערה: זה יכול לקחת עד 3 דקות עבור הטמפרטורה כדי שיווי משקל בתוך cuvette גם אם הבדיקה כבר מראה את הטמפרטורה הרצויה (כלומר, נקודה ירוקה הופכת יציבה). קריאות מדגם עשויות להשתנות במידה ניכרת אם טמפרטורת היעד אינה מוגדרת, שכן הבדלי טמפרטורת המדגם יכולים לשנות מאוד את התנועה הבראונית של חלקיקים. - פתח את מכסה המכשיר והסר את מכסה המגן המכסה שבו יוצב הקובט.
זהירות: מכשיר מעקב החלקיקים מאושר כמוצר לייזר Class 1 (21 CFR Ch. אני חלק 1040), המכיל לייזרים שיכולים להיות מסוכנים ועלולים לגרום לפציעה חמורה כגון כוויות ו/או נזק בלתי הפיך לעיניים. כדי למנוע תאונה או פציעה, אין להסיר את כיסוי המכשיר על ידי הסרת הברגים מהצד. שים לב כי במהלך הפעולה, קרני הלייזר סגורות לחלוטין, ולא מהווה איום למשתמשים. כמו כן, שילוב בטיחות מגנטי מובנה במחזיק הדגימה של המכשיר כדי למנוע מהלייזר לפעול כאשר המכסה של מחזיק המדגם מוסרת. - מקם את הקובט (מתוך שלב 4.3) בתוך המכשיר בכיוון הנכון (ראו איור 5). החלף את המכסה מעל cuvette ולסגור את מכסה המכשיר. הפעל תמיד את המכשיר עם הכובע במקום מעל מחזיק המדגם. אל תהפוך ללא זמין או תנסה לעקוף את תכונת שילוב הבטיחות.

איור 5: כיוון נכון של cuvette בתוך מכשיר מעקב חלקיקים. הפנים של cuvette (עם "חריץ" של ההוספה גלוי) צריך להתמודד עם המצלמה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הפעל את המצלמה על-ידי לחיצה על החץ מעל הזרמה.
- לחץ על החץ הסוגר זוויתי כדי להרחיב את הגדרות הרשומה. הגדר את כוח ה-Gain ו- Laser לערכים המתאימים ליישום. ראה טבלה 1 (ואיור משלים 1) לקבלת פרמטרים המשמשים עבור NTA של כלי הרכב האלקטרוניים הקטנים (100 ננומטר).
הערה: ייתכן שהגדרות מתקדמות אלה אליהן ניגשת לחיצה על חץ הסוגריים הזוויתיים מוגנות באמצעות סיסמה. השתמש באותן הגדרות להקלטה ועיבוד עבור הדילול (הריק) כמו אלה המשמשות עבור הדוגמאות הבאות. - התאם את המוקד עד שהחלקיקים יתמקדו כראוי. ההתמקדות צריכה להיעשות על חלקיקים קטנים יחסית (איור 6). עבור כימות EV קטן (עולה בקנה אחד עם exosomes), הגדרות ההקלטה הבאות מומלצות: קצב פריימים: 30 fps, חשיפה: 15 ms, זמן ערבוב: 5 s, זמן המתנה: 3 s, כוח לייזר - כחול: 210 mW, ירוק: 12 mW, אדום: 8 mW, מסגרות לכל וידאו: 300 מסגרות, ורווח: 30 dB.
הערה: המשתמש יכול להגדיל את הזום ל- 1x ו / או להגדיל את הרווח כדי לעזור במיקוד. זכור להגדיר מחדש פרמטרים אלה לערכים מומלצים לפני הקלטת סרטוני וידאו.
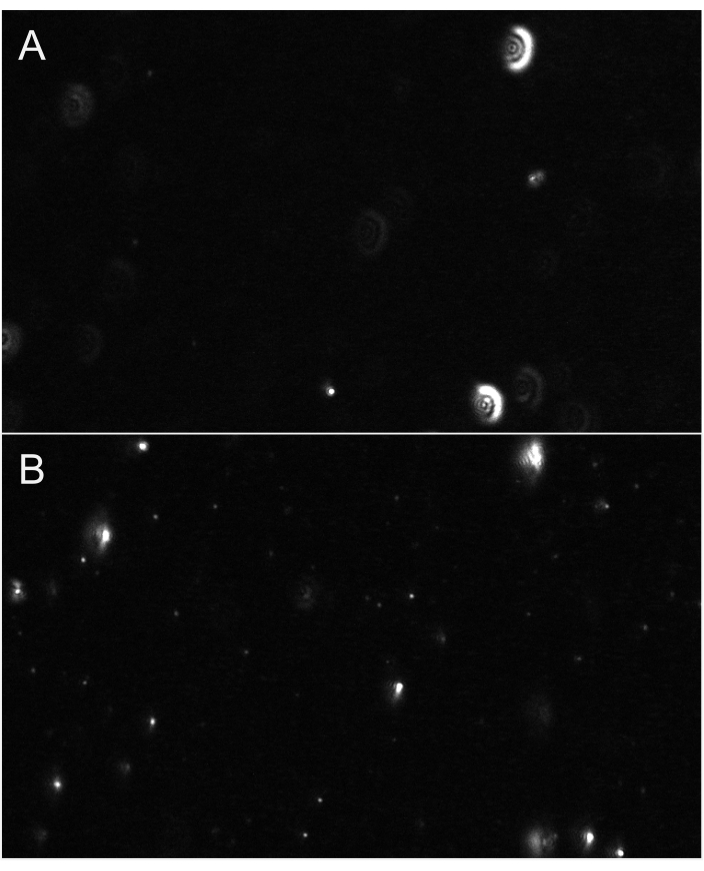
איור 6: תצוגות מייצגות של זרם חי המציגות מיקוד חלקיקים. (A)דוגמה לצפייה בשידור חי של חלקיקים שאינם בפוקוס. לחלקיקים יש הילה דמוית זוהר או שהם נראים מטושטשים. התאם את המיקוד. (B)דוגמה לצפייה בשידור חי של חלקיקים במיקוד הנכון. החלקיקים הקטנים ביותר נמצאים בפוקוס. התחל להקליט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- בצע בדיקת איכות חזותית כדי לוודא שהדגימה מדוללת כראוי. אם המדגם מרוכז מדי, הסר את cuvette מהמכשיר לדלל את המדגם ברצף. חזור על הפעולה עד המדגם מדולל כראוי לפני שתמשיך לשלב 6.
הערה: אל תדלל יתר על המידה את הדגימה! תמיד לעשות דילולים ברצף. הריק האידיאלי יציג רק חלקיקים מעטים על המסך (1.4) כפי שמוצג באיור 4. לגבי דגימות EV, במדגם מדולל כראוי יהיו בערך 20-100 חלקיקים גלויים על המסך, ללא תמונות זוהרות או מעוננות ברקע (ראו איור 7 כדוגמה). התוצאה היא ריכוז חלקיקים אופטימלי בטווח של 5 x 106 עד 2 x 108 חלקיקים לכל mL (לא להתאים לגורם דילול).
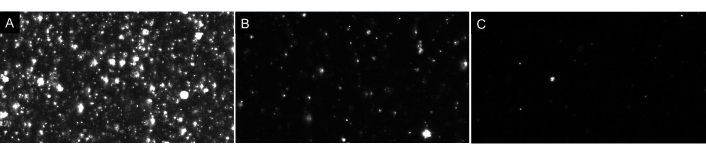
איור 7: תצוגות מייצגות של זרם חי המתארות דילול חלקיקים שונים. (A)תצוגה לדוגמה של זרם חי של מדגם מרוכז מדי. הקלטת מדגם מרוכז מדי תניב תוצאות לא מדויקות. (B)תצוגה לדוגמה של זרם חי של מדגם מדולל כראוי. ישנם 60-100 חלקיקים גלויים על המסך וההקלטה גורמת לריכוז גולמי של 5 x 106- 2 x 108 חלקיקים /mL. (ג)תצוגה לדוגמה של זרם חי של מדגם מדלל מדי. אם מדגם הוא לדלל זה, לא יהיו מספיק חלקיקים במעקב, הורדת גודל המדגם, ולכן, התוצאות יהיו לא חוקיות מבחינה סטטיסטית. במקרה זה, מומלץ להגדיל את מספר הסרטונים שהוקלטו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. רכישת נתוני וידאו
- (אופציונלי) הגדר את הגדרת גודל התצוגה לפי 0.5 כדי לחסוך רוחב פס ולמנוע אובדן מסגרות.
- התחל להקליט את קטעי הווידאו על-ידי לחיצה על הקלטה (ראה טבלה 1 עבור פרמטרי הקלטה מומלצים).
הערה: כברירת מחדל, המכשיר יערבב את המדגם עבור 5 s, ימתין ל- 3 s ולאחר מכן יקליט עבור 10 s לפני שיחזור על תהליך זה. זמן מדידה טיפוסי עבור 50 קטעי וידאו הוא ~ 15 דקות להקליט ~ 13 דקות לעיבוד. - אין לגעת בכלי בעת הקלטת סרטונים. ודא כי פני השטח של ספסל המעבדה אינו רוטט.
הערה: עדיף כי המכשיר מוגדר על פלטפורמה נגד רטט או שולחן כדי להפחית את כל הפרעות רטט מציוד סמוך שיפריע לקביעת תנועת ננו-חלקיקים. הימנע מהפעלת צנטריפוגות, מערבלי מערבולת או מכשירים פוטנציאליים אחרים ליצירת רטט על אותו ספסל כמו מכשיר המעקב אחר חלקיקים. תנודות נראות בקלות על המסך כהארכה של חלקיקים עגולים בדרך כלל. אם הוא נחשף לתנודות נמרצות, המכשיר עשוי לדרוש ארגון מחדש של אלמנטים אופטיים. המכשיר לא תוכנן להיות שירות או כיול על ידי הלקוח; פנה ליצרן לקבלת תחזוקה, שירות וכיול. - שים לב לכל סרטון מוקלט שיש בו חלקיקים גדולים מאוד הנראים ככתמים לבנים גדולים ולא סדירים. הסר סרטוני וידאו אלה מהעיבוד בשלב 7.3.
7. תהליך נתונים שנרכשו
- כאשר מופיעה בקשה המציינת כי קטעי וידאו הוקלטו, לחץ על אישור כדי להשלים את ההקלטה. לאחר מכן בחר בכרטיסיה תהליך.
הערה: ניתן לעצור את הפרוטוקול כאן. ניתן להפעיל מחדש את עיבוד הנתונים שנרכשו מאוחר יותר על-ידי מעבר ישירות לכרטיסיה תהליך לאחר פתיחת התוכנה של מכשיר המעקב אחר חלקיקים וציון הספריה שבה נשמרים סרטוני הווידאו המוקלטים. - בעת ניתוח רכבים הפעלה חוזרים, סמן את התיבה בטל עקיפת זיהוי אוטומטי והגדר את קוטר התכונות ל- 30. לחץ על עבד. (ראה טבלה 2 לקבלת הגדרות עיבוד ואיור 2 משלים לעיבוד תצוגה). גרף הפצה חי יוצג כדי שהמשתמש יוכל להציג את העיבוד בזמן אמת.
- עבור exosomes, תהליך עם סף זיהוי מוגדר לדגימת Polydisperseברירת המחדל . עבד את הנתונים עם מדריך סף זיהוי מוגדר 0.8 במקום סף סטנדרטי של 0.99 רק עבור פתרונות עם הבדלים גדולים מאוד בגדלי חלקיקים.
- אם לסרטונים היו חלקיקים גדולים מאוד גלויים (ראה שלב 6.4), נווטו לספריה של סרטונים מוקלטים והסירו את הסרטון הבעייתי. לאחר עריכת רשימת קבצי הווידאו, שנה את מספר סרטוני הווידאו המוקלטים ביומני רישום אחרים שנשמרו על-ידי המשתמש.
- לאחר השלמת העיבוד, לחץ על אישור. לאחר מכן, בחר בכרטיסיה התוויה. עבור כלי רטטוי, הצג את התרשים הראשי כ- LogBinSilica.
הערה: כאן בכרטיסיה התוויה, המשתמש יכול להתאים אישית תכונות אחרות של התרשים, כגון הגדרת הטווח של ציר x (קוטר חלקיקים, nm) כדי להגדיר את האזור לאינטגרציה עבור הדמות המיוצרת.
8. הצג ופרש תוצאות
- ליצירת דוח PDF, לחצו על הלחצן 'דוח'. המדידה הושלמה כעת וניתן להציג את התוצאות.
הערה: זכור להקליט ולעבד את הריק תחילה כך שניתן יהיה לתקן את ריכוז הרקע של הדגימות הבאות. אם שלב זה נשכח, ניתן לרשום את הריק לאחר דגימות וריכוז החלקיקים לדוגמה תוקן באופן ידני. - בדקו את דוח PDF המציג את גודל הממוצע, החציון והמצב וכן את הריכוז המותאם לגורם הדילול ותיקן על-ידי הפחתה של ריכוז החלקיקים של הדילול. רוחב ההתפלגות (סטיית תקן) מוצג גם הוא.
הערה: ישנם מעט מאוד יישומים שבהם ערך יחיד מתאים וייצוגי. לכן, תיאור התפלגות הגודל כולה ודיווח על רוחב ההתפלגות עבור כל מדגם שנותח מומלץ (כפי שמוצג בטבלה 3 למשל). - הקלט את הגדרות המכשיר הבאות המשמשות להפקת הנתונים שיש לציין בעת דיווח תוצאות: דילול, עוצמת לייזר של כל לייזר [mW], חשיפה [ms], רווח [dB], קצב פריימים [fps], מסגרות לסרטון, מספר קטעי וידאו שהוקלטו, הגדרת עיבוד (לדוגמה, LogBinSilica), טווח אינטגרציה [מינימום nm, מקסימום nm] (מומלץ להגדיר מינימום ל- 50 ננומטר) ומספר החלקיקים במעקב (רצוי לנתח לפחות ~ 150 חלקיקים לסרטון; מינימום 3,750 רצועות סה"כ לכל מדגם מומלץ להימנע קוצים artifactual בהתפלגות גודל החלקיקים וליצור נתונים משמעותיים סטטיסטית).
9. ניקוי הקובטות
- נקה cuvettes באופן ידני בין דגימות. ראשית, לרוקן את הקובט.
הערה: ניתן לשחזר את המדגם מהקובט ושמר או להשליך אותה. - ברגע שהקובט ריק, נקה את הקובט על ידי שטיפה 10-15 פעמים עם מים דה מיוננים (DI). לאחר מכן, לשטוף 3 פעמים עם אתנול (70-100%). כאשר עושים זאת, הקפד למלא לחלוטין את cuvette עם ממס.
- יבש את החלק החיצוני של cuvette עם מטלית microfiber ללא מוך. הימנע כתמים על המשטחים. אוויר לייבש את החלק הפנימי של cuvette או יבש באמצעות מטלית אוויר דחוסה.
הערה: יש להשתמש בנייר ניקוי עדשות בלבד או בד מיקרופייבר ללא מוך כדי לנגב את המשטחים האופטיים של הקובט, שכן רוב מוצרי הנייר מכילים סיבי עץ קטנים שעלולים לגרד או לפגוע בפני השטח של הקובט. - הכן שני בקבוקוני ניקוד זכוכית: אחד מלא 70-100% אתנול והשני עם מים DI. לשטוף את התוספות ומערבבים את הסורגים באתנול תחילה (ואז מים DI) על ידי הצבת בר הכנס / ערבוב בנגיחה נוצץ המתאים ומנער את הקרביה במרץ. יבשו את התוספות וערברו את הסורגים באמצעות מטליות ללא מוך או אבק אוויר דחוס.
הערה: ניתן לנקות את ה- cuvette וההוספה גם באמצעות אמבט מים sonicating. כדי לעשות זאת, תחילה להבטיח את יחידת sonicating מכיל מספיק מים (לפחות 5 ס"מ עומק). לאחר מכן מניחים את הקובט ומכניסים לתוך זכוכית (50 מל ומעלה), ממלאים את הכוס באלכוהול באותה רמה כמו אמבט המים, מניחים את הכוס במים ומפעילים את הכוח. סוניקאט לכל היותר 5 דקות בכל פעם, ומאפשר למכונה לנוח >5 דקות בין כל פרץ של 5 דקות אם נדרשים זמנים ארוכים יותר. - בסיום, מיד לשים את כל נקי וייבש רכיבים משם לאחסון.
Access restricted. Please log in or start a trial to view this content.
תוצאות
לפני הדגמה זו, הכיול של המכשיר נבדק לראשונה כדי להבטיח את תוקפם של הנתונים שנרכשו על ידי מדידת התפלגות הגודל של תקני חרוזים פוליסטירן. בדקנו את התפלגות הגודל של חרוזים של 100 ננומטר ו- 400 ננומטר באמצעות פרמטרי ההקלטה המוגדרים כברירת מחדל והגדרות העיבוד המומלצות בפרוטוקול זה (איור...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן, אנו מדגימים פרוטוקול עבור NTA של EVs כדי למדוד את התפלגות הגודל של מגוון רחב של גדלי חלקיקים בו זמנית ולמדוד את הריכוז הכולל של EV במדגם polydisperse. במחקר זה, רקמת השומן perigonadal עכבר ופלזמה אנושית שימשו כמקור של כלי עבודה אלקטרוניים. עם זאת, EVs מבודד מרקמות אחרות או נוזלים ביולוגיים כגון סרום, שתן...
Access restricted. Please log in or start a trial to view this content.
Disclosures
כל המחברים הצהירו כי אין ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). אנו מכירים את ג'פרי בודיקומב, Ph.D. של HORIBA מכשירים בע"מ על עזרתו בכיול המכשיר.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066(2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021(2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, San Diego, California. 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569(2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421(2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , Clifton, N.J. 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016(2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. Absorption and Scattering of Light by Small Particles. , John Wiley & Sons. (1983).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved