このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞外小胞の定量とサイズ決定のためのナノ粒子追跡解析
要約
我々は、新しいナノ粒子追跡解析装置を用いて、マウスの骨膜脂肪組織およびヒト血漿から分離された細胞外小胞のサイズ分布および総粒子濃度を推定する方法を示す。
要約
細胞外小胞(EV)の生理学的および病的な役割はますます認識され、EV分野は急速に進化する研究分野となっています。EVの分離には多くの異なる方法があり、それぞれ、EVの下流の収率と純度に影響を与える明確な長所と短所があります。したがって、選択した方法によって所定のソースから分離されたEV準備を特徴付けることは、下流の結果の解釈および実験室間での結果の比較にとって重要である。病気の状態や外部の状態に応じて変化させることができるEVのサイズと量を決定するための様々な方法が存在します。ナノ粒子追跡解析(NTA)は、個々のEVのハイスループット分析に使用される顕著な技術の1つです。ここでは、この分野における大きな進歩を代表するNTAの画期的な技術を用いて、マウスの脂肪組織およびヒト血漿から分離されたEVの定量とサイズ決定のための詳細なプロトコルを提示する。この方法は、透過電子顕微鏡で確認された異なる方法で異なるソースから分離されたEVに対して、再現可能で有効な総粒子濃度およびサイズ分布データを提供できることを実証した。このNTA機器の適応は、EV研究における厳格化と再現性を高めるためのNTA手法における標準化の必要性に対応する。
概要
細胞外小胞(EV)は、ほぼ全ての細胞タイプ1によって分泌される小さな(0.03〜2 μm)膜結合小胞である。放出のメカニズムとサイズ2に応じて、「エキソソーム」、「微小胞」、「アポトーシス体」と呼ばれることがよくあります。当初は、EVは単に細胞から廃棄物を除去して恒常性3を維持する手段であると考えられていたが、DNA、RNA(mRNA、マイクロRNA)、脂質、タンパク質4、5を含む分子物質の伝達を介した細胞間コミュニケーションにも参加することができ、正常な生理学の重要な調節因子であり、病理学的プロセス1である。 5、6、7、8.
EV を分離および定量化する方法は多数ありますが、これは他の場所で説明されている 9 、 10、11、12です。EVの供給源と同様に使用される絶縁プロトコルは、EVの歩留まりと純度に大きな影響を与える可能性があります。微分遠心分離でさえ、長い間エキソソーム単離のための「ゴールドスタンダード」アプローチと考えられ、その後得られたEV集団および下流分析13に影響を与える大きな変動を受けうる。したがって、EVの分離および定量化のための様々な異なる方法論は、文献14で報告された実験の結果を比較、再現、および解釈することを困難にする。さらに、EV放出は、細胞状態または種々の外的要因によって調節することができる。細胞内ストレス15から細胞を保護することによって細胞恒常性を維持する役割を果たすEVが示唆されている。例えば、低酸素、小胞体ストレス、酸化ストレス、機械的ストレス、タバコの煙抽出物、および粒子状物質の大気汚染16、17、18、19、20、21、22への細胞暴露後にEV放出の増加が報告されている。EV放出はまた、生体内で変更することが示されている;高脂肪食や断食を16時間受けたマウスは、より多くの脂肪細胞EV23を放出した。特定の治療や状態がEV放出を変えるかどうかを調べるには、EVの数を正確に特定する必要があります。EVサイズ分布の評価はまた、EVの主要な細胞内起源(例えば、後期子宮体/多面体と原形質膜の芽出との融合)24を示す。したがって、研究されているEV準備の総濃度とサイズ分布を正確に測定するための堅牢な方法が必要です。
ソリューションにおけるEVの可視化と特性評価のための迅速かつ高感度な方法は、ナノ粒子追跡解析(NTA)です。この方法の原理の詳細な説明とEVサイズと濃度の評価のための代替方法との比較は、前に説明された25、26、27、28。簡単に言えば、NTA測定中に、EVはレーザー光を照射したときに散乱する光によって視覚化されます。散乱光は、粒子の動きを記録するカメラに顕微鏡で焦点を当てます。NTA ソフトウェアは、各パーティクルのランダムな熱運動を追跡し、ストークス-アインシュタイン方程式を使用して各粒子のサイズを計算するために使用される拡散係数を決定します。NTAは201125年に初めて生体試料中のEV測定に適用された。最近まで、商用NTA機器29を提供する主流企業は、他のNTA技術の大幅な制限を克服するために新しいハードウェアとソフトウェアソリューションの組み合わせを使用するViewSizer 3000(以下、粒子追跡機器と呼ばれる)の導入までしかありませんでした。
粒子追跡装置はブラウン運動を分析することによって液体サンプル中のナノ粒子を特徴付け、重力沈降を分析することによってより大きいミクロンサイズの粒子を特徴付ける。この装置独自の光学系は、3つのレーザー光源(450 nm、520 nm、635 nm)を備えたマルチスペクトル照明を含み、研究者は幅広い粒子サイズ(例えば、エキソソーム、マイクロベシクル)を同時に分析することを可能にします。機器のセットアップの概略を図 1に示します。
ここでは、新しいNTA機器を用いて、単離したマウスやヒトEVの粒子径分布と濃度測定を行う方法を示す。
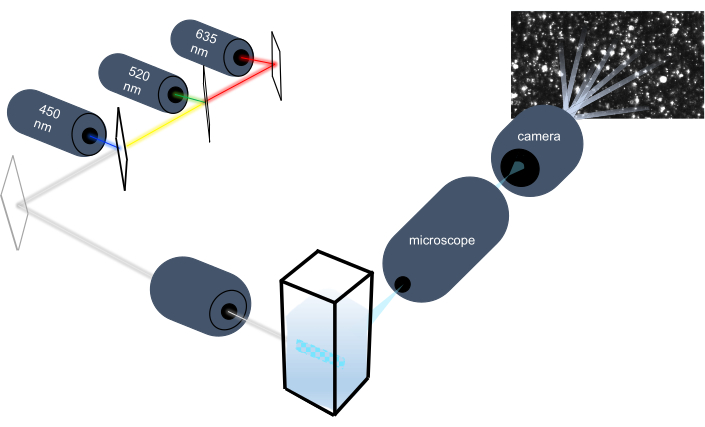
図1:粒子追跡計光学系 NTAの器械は次の波長の3つのレーザーを使用して粒子を照らす:450 nm、520 nm、635 nm。個々の粒子からの散乱光のビデオ録画は、キュベットから90°指向のデジタルビデオカメラによって検出され、追跡されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
これらのサンプルのすべての作業は、制度的動物ケアと使用委員会と制度審査委員会のガイドラインに従って行われました。図 2に、NTA メソッドの概略図を示します。
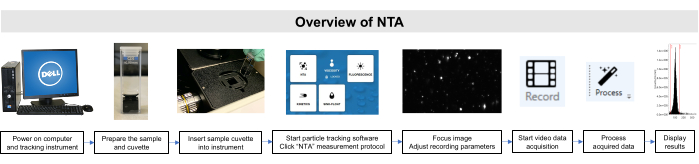
図2: 粒子追跡機器を用いたNTA法の概要 サンプルが準備され、計器に挿入されます。NTAソフトウェアが開かれ、記録パラメータが調整され、サンプルがフォーカスされます。その後、データが記録され、処理され、表示されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
1. 細胞外小胞の分離
注:マウスのペリゴナダル脂肪組織EVは、前述の23と同じ方法で単離した。プラズマEVは、次のプロトコルを使用して、1 mLのヒトプラズマから分離されました。
- プラズマと遠心分離機を3,000 x g で15分間回収し、細胞の破片を除去します。上清を新しいチューブに移します。
注:追加の破片が検出可能なままである場合は、12,000 x g で追加の10分間上清を遠心分離し、上清を新しいチューブに移します。 - プラズマ250μLあたり67μLのエキソソーム分離試薬を加えます。チューブを反転またはフリックすることによってよく混ぜます。
- 氷の上で30分間インキュベートします。
- 遠心分離試薬/プラズマ混合物を3,000 x g で4°Cで10分間遠心分離します。
注:遠心分離は、同様の結果を室温または4°Cで行ってもよいが、4°Cが好ましい。遠心分離後、EVはチューブの底部にベージュまたは白色ペレットとして現れる。 - 上清を慎重に吸引する。残留エキソソーム分離溶液をスピンダウンし、吸引によって流体のすべての痕跡を取り除き、ペレット内の沈殿したEVを邪魔しないように細心の注意を払います。
- 200 μL のバッファー B (製造元が提供) のペレットを再中断します。分光光度計、蛍光計、ブラッドフォードアッセイ、または他の好ましい方法を使用して、サンプルのタンパク質濃度(ステップ2.8の場合)を測定し、記録します。
2. 分離されたEVの浄化
- 200 μL のバッファ A (メーカーが提供) を追加して、再中断したEVを使用します。
- 精製カラム(用意)を取り出し、ねじキャップを緩め、底部の閉鎖を取り除きます。列をコレクション チューブに配置します。
注: 手順 2.7 から 2.9 の下部の閉じを保存します。 - 遠心分離機は1,000 x g で30sで記憶バッファーを取り除く。
- フロースルーを破棄し、列をコレクション チューブに戻します。
- カラムを洗浄するには、キャップを取り外し、バッファBの500 μLを樹脂の上に、遠心分離機を1,000 x g で30s塗布します。フローを破棄します。ステップ 2.7 から 2.9 の上限を保存します。
- ステップ 2.4 ~ 2.5 をもう一度繰り返して、柱を洗います。
- 下部の閉じ込めで列の下部を接続します(ステップ 2.2 から)。樹脂の上にバッファBの100 μLを塗布し、サンプルローディングに備えます。
- ステップ1.6(または全タンパク質の4mg相当の体積まで)の全含有量を樹脂に加えます。柱の上部にねじキャップを置きます。
- 回転シェーカーの室温で5分以上混ぜます。
3. サンプル溶出
- スクリューキャップを緩めて底部を取り外し、すぐに2 mLマイクロ遠心チューブに移します。
注: 下部のクロージャが削除されるとすぐにサンプルが溶け出し始めます。サンプルロスを最小限に抑えるために、2 mLマイクロ遠心チューブが溶出性を受ける準備ができていることを確認してください。 - 遠心分離機は 30s の1,000xgで精製されたEVを得る。列を破棄します。
4. ナノ粒子追跡解析用のサンプル調製
- マイクロファイバー布のような糸くず素材を使用して、作業スペースをカバーし、キュベットに繊維が入らないようにします。
- 手袋を着用し、マグネットキュベットのジグの上にキュヴェットを置き、キュベットにかき混ぜるバーを置きます。必ず手袋でキュベットを扱い、キュベットの表面に指紋や汚れが現れないようにしてください。
- 図 3に示すように、フック ツールを使用して、挿入物をキュベットに配置します。後で挿入する方向に注意することが重要です(ステップ 5.4)。

図3:クオーツキュベット内の挿入物の適切な向き。 インサートの「ノッチ」は、キュベットの前面から見えるはずです。これは、カメラに向かって計器に挿入する必要があります。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- ピペットを使用して、インサートの穴を通してキュベットに室温で希釈または希釈したサンプルの400〜500 μLをゆっくりと加えます。ピペットを上下に軽く混ぜます。気泡の導入は避けてください。
- まず、選択した希釈剤(ブランク)を積んだキュベットを準備し、希釈剤の粒子濃度を測定する。これは、サンプルの背景濃度を補正できるように、サンプルを測定する前に行う必要があります。
注: 良好な空白(この場合はリン酸緩衝生理食塩分 [PBS]) は濃度 < 9 x 106 (希釈剤に応じて) を持ち、ライブ ビューで画面ごとに 1 ~ 10 個のパーティクルを表示します (図 4)。実際のサンプル粒子濃度は、バックグラウンド濃度の3倍以上にすることをお勧めします。 - 必要に応じて、サンプルを記録する前に、測定前に、希釈または希釈したサンプルの400〜500 μLでキュベットをプライムします。これを行うには、希釈したサンプルの400〜500 μLをキュベットにロードし、溶液を廃棄し、さらに400~500 μLのサンプルを追加して測定します。これは、キュベット内の残留物を洗い流すのに役立つ可能性があります。
- まず、選択した希釈剤(ブランク)を積んだキュベットを準備し、希釈剤の粒子濃度を測定する。これは、サンプルの背景濃度を補正できるように、サンプルを測定する前に行う必要があります。

図4:ブランクの適切な濃度範囲内の希釈剤の代表的なライブストリームビュー。 濾過された(0.02 μmまたは3 kDa、好ましい)PBSで希釈されたEV準備。良好な空白は、ライブビューで画面ごとに〜1〜10個の粒子を表示し、105-106の範囲内の濃度を得る。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- キュベットをキャップし、気泡を確認します。必要に応じて、泡をタップします。糸くずフリーの布を使用して、キュベットの外面を拭きます。
5. 粒子追跡機器の起動手順
- コンピュータのワークステーションと計器の電源を入れ、最初のサンプルを実行する前に数分待ち、ソフトウェアアイコンをクリックしてプログラムを起動します。プロンプトが表示されたら、画面で [NTA] をクリックしてナノ粒子トラッキング解析を実行します。 [記録 ]タブで開始し、さまざまなソフトウェアタブ(レコード、プロセス、プロット)をクリックして、プロトコル全体でそれらのタブを切り替えます。サンプルを記録 (希釈または EV 準備) 最初に記録し、次に記録を処理し、最後に結果をプロットします。
- 画面の指示に従って、サンプルに関する必要な情報をすべて入力します。必要なフィールドがすべて完成し、正確であること、すなわち、サンプル名、説明、サンプル調製、希釈率[1000]、目標温度(22°Cに設定)、希釈剤:ドロップダウンメニューから希釈剤を選択し、EVの希釈剤としてPBSを使用します。ドロップダウンメニューからPBSを選択すると、9%にサリンが自動入力されます。この情報は、液体の動的粘度を決定するために必要である。
注:プローブがすでに所望の温度を示している場合でも、キュベット内で温度が平衡化するのに最大3分かかることがあります(すなわち、緑色の点が安定します)。サンプルの温度差がパーティクルのブラウン運動を大きく変える可能性があるため、目標温度が設定されていない場合、サンプルの読み出しは大きく異なる可能性があります。 - 楽器の蓋を開け、キュベットが置かれる保護キャップを取り外します。
注意: 粒子追跡機器はクラス1レーザー製品(21 CFR Ch.私はパート1040)、危険であり、火傷や視力への永久的な損傷などの重傷を引き起こす可能性のあるレーザーを含む。事故や怪我を防ぐために、側面からボルトを外して器具カバーを取り外さないようにしてください。動作中、レーザービームは完全に囲まれておらず、ユーザーに脅威を与えなくなります。また、磁気安全インターロックは、サンプルホルダーのキャップが取り外されたときにレーザーが動作するのを防ぐために、機器のサンプルホルダーに組み込まれています。 - (ステップ 4.3 から) キュベットを、正しい向きで器具の内側に配置します ( 図 5を参照)。キャップをキュベットの上に置き換え、楽器の蓋を閉じます。サンプルホルダーの上にキャップを置いて、常に楽器を操作してください。安全インターロック機能を無効にしたり、回避したりしないでください。

図5:粒子追跡機器内のキュベットの適切な向き キュベットの面(インサートの「ノッチ」が表示されている)は、カメラに向かう必要があります。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- カメラの電源を入れるには、上の矢印をクリックします。
- 山形の矢印をクリックして 、[レコード ] 設定を展開します。ゲインとレーザーのパワーをアプリケーションに適した値に設定します。小型 (100 nm)のEVのNTAに使用されるパラメータについては、表 1(および補足図1)を参照してください。
注: シェブロンの矢印をクリックしてアクセスするこれらの詳細設定は、パスワードで保護されている場合があります。希釈液(ブランク)の記録と処理には、後続のサンプルに使用されるものと同じ設定を使用します。 - パーティクルが適切に焦点を合わせるまで、フォーカスを調整します。焦点を合わせるのは比較的小さい粒子に対して行う必要があります(図6)。小さなEV定量(エキソソームと一致)については、フレームレート:30fps、露出:15ms、攪拌時間:5秒、待ち時間:3秒、レーザーパワー - ブルー:210mW、緑:12mW、赤:8mW、ビデオあたりのフレーム:300フレーム、ゲイン:30dB。
注:ユーザーはズームを1倍に増やしたり、ゲインを増やしてフォーカスを助けることができます。ビデオを録画する前に、これらのパラメータを推奨値に再設定してください。
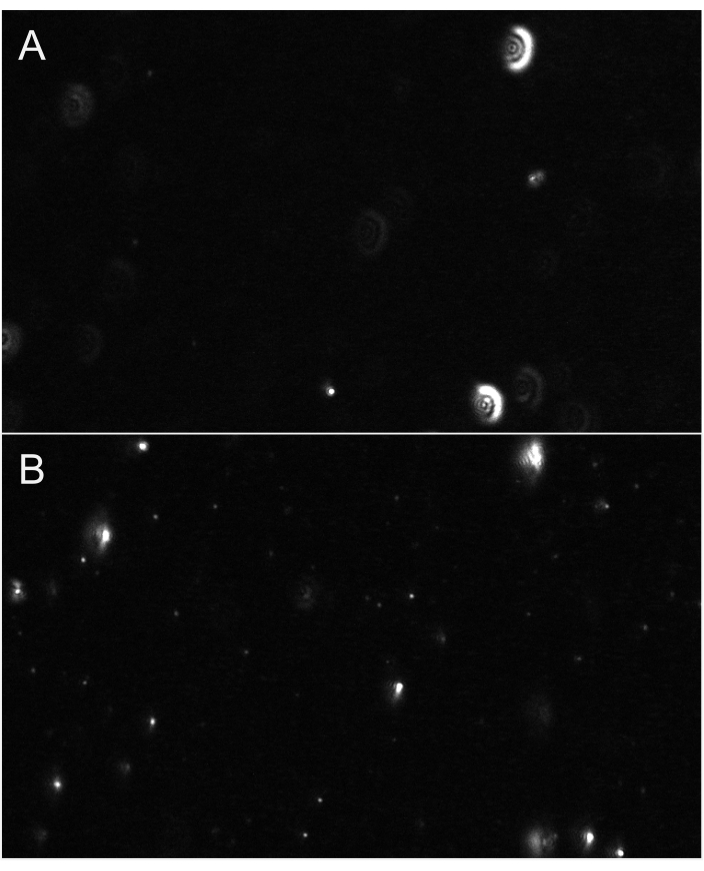
図6:粒子フォーカスを示す代表的なライブストリームビュー( A)焦点を合わせていない粒子のライブストリームビューの例。パーティクルはグローのようなハローを持っているか、ぼやけて見えます。フォーカスを調整します。(B) 適切な焦点を当てたパーティクルのライブ ストリーム ビューの例。最小のパーティクルが焦点を合わせている。録音を開始します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- サンプルが適切に希釈されていることを確認するために、画質チェックを実行します。サンプルが濃縮しすぎる場合は、器具からキュベットを取り出し、サンプルを順次希釈します。ステップ6に進む前に、サンプルが適切に希釈されるまで繰り返します。
注:サンプルを過剰に希釈しないでください!常に希釈を連続的に行います。 図 4に示すように、理想的な空白は、画面上に少数のパーティクル (1 -4) しか表示されません。EV サンプルに関しては、適切に希釈されたサンプルは、グロー状または曇りの画像を背景に表示しない、画面上に約 20 ~ 100 個のパーティクルを表示します (例として 図 7 を参照)。これは、mLあたり5 x 106〜2 x 108 粒子の範囲で最適な粒子濃度をもたらすはずです(希釈係数に合わせて調整しません)。
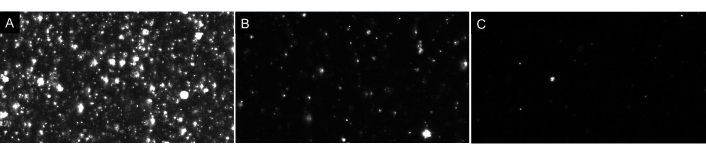
図7:異なる粒子希釈を描写した代表的なライブストリームビュー。 集中度の高すぎるサンプルを記録すると、不正確な結果が得られます。(B) 適切に希釈されたサンプルのライブストリームビューの例。60~100個のパーティクルが画面に表示され、記録結果として生濃度は5 x 106~ 2 x 108 粒子/mL です。(C) 希薄すぎるサンプルのライブストリームビューの例。サンプルがこの希薄な場合、十分な粒子が追跡されないため、サンプルサイズが小さくなり、結果は統計的に無効になります。この場合、録画する動画の数を増やすことをお勧めします。この図の大きなバージョンを表示するには、ここをクリックしてください。
6. 映像データ取得
- (オプション)ズーム設定を 0.5 倍に設定して、帯域幅を節約し、フレームの損失を防ぎます。
- [録音] をクリックしてビデオの録画を開始します (推奨される記録パラメータについては表 1を参照)。
メモ:デフォルトでは、この装置はサンプルを5 sでかき混ぜ、3 sを待ってから、このプロセスを繰り返す前に10 sを記録します。50動画の典型的な測定時間は、記録する〜15分、処理する〜13分です。 - ビデオを録画中は楽器に触れないでください。実験室のベンチの表面が振動していないことを確認します。
注:機器は、ナノ粒子の動きの決定を妨げる近くの機器からの振動障害を軽減するために、防振プラットフォームまたはテーブルに設定することが好ましいです。粒子追跡機器と同じベンチで遠心分離機、渦ミキサー、またはその他の潜在的な振動発生装置を操作しないでください。振動は、通常丸い粒子の伸びとして画面上で容易に見ることができます。激しい振動にさらされる場合、機器は光学要素の再調整を必要とすることがあります。この機器は、お客様がサービスを提供したり校正したりするように設計されていません。保守、保守、および校正については、製造元に問い合わせてください。 - 大きな不規則な白いブロブとして非常に大きなパーティクルが表示される録画ビデオに注意してください。ステップ 7.3 でこれらのビデオを処理から削除します。
7. 取得したデータの処理
- ビデオが録画されたことを示すプロンプトが表示されたら 、[OK] を クリックして録画を完了します。次に、[ プロセス ] タブを選択します。
注: プロトコルはここで停止することができます。取得したデータの処理は、後で、パーティクルトラッキング機器のソフトウェアを開いて、記録されたビデオが保存されるディレクトリを指定した後で [処理 ]タブに移動することで再開できます。 - EV を解析する場合は、[ 自動検出のオーバーライドを無効 にする] チェック ボックスをオンにし、[フィーチャの直径] を [30]に設定します。[ プロセス] をクリックします。(処理設定については 表2、 処理用 の図2 を参照)。ライブ分布グラフが表示され、ユーザーはリアルタイムで処理を表示できます。
- エキソソームの場合、検出しきい値がデフォルトの 多分散サンプルに設定されたプロセス。パーティクル サイズの差が非常に大きいソリューションの場合にのみ、0.99 の標準しきい値ではなく 0.8 に設定された [ 検出しきい値マニュアル ] でデータを処理します。
- 非常に大きなパーティクルが目立って見える場合(ステップ 6.4 を参照)、録画したビデオのディレクトリに移動し、問題のあるビデオを削除します。ビデオファイルのリストを編集した後、他のユーザーが記録したログに記録されたビデオの数を変更します。
- 処理が完了したら 、[OK]をクリックします。次に、[ 印刷 ]タブを選択します。EV の場合は、メイン チャートを LogBinSilica として表示します。
注: [ プロット ]タブでは、X 軸(パーティクル径、nm)の範囲を定義して、生成された図形の統合領域を設定するなど、グラフの他の機能をカスタマイズできます。
8. 結果の表示と解釈
- PDF レポートを作成するには、「 レポート 」ボタンをクリックします。これで測定が完了し、結果が表示されます。
注: 後のサンプルの背景濃度を修正できるように、最初に空白を記録して処理してください。このステップを忘れた場合、空の部分はサンプル後に記録され、サンプル粒子濃度は手動で補正されます。 - 平均値、中央値、モードサイズ、希釈係数に合わせて調整された濃度を表示し、希釈剤の粒子濃度を差し引いて補正したPDFレポートを調べます。分布幅(標準偏差)も表示されます。
注: 単一の値が適切で代表的なアプリケーションはほとんどありません。したがって、分析されたサンプルの全体のサイズ分布を記述し、分布の幅を報告することが推奨されます( 例えば表3 に示すように)。 - 結果を報告するときに記述する必要があるデータを生成するために使用される次の計器設定を記録します。 各レーザー[mW]、露出[ms]、ゲイン[dB]、フレームレート[fps]、ビデオあたりのフレーム数、録画されたビデオ数、処理設定(例えば、LogBinSilica)、統合範囲[最小nm、最大nm](最小を50nmに設定することをお勧めします)および追跡された粒子の数(ビデオあたり少なくとも〜150粒子を分析することが望ましい)の合計3,750トラック粒子サイズ分布の実際のスパイクを避け、統計的に有意なデータを生成することを推奨)。
9. キュベットのクリーニング
- サンプル間のキュベットを手動できれいにする。まず、キュベットを空にします。
注:サンプルはキュベットから回収し、保存または廃棄することができます。 - キュベットが空になったら、脱イオン(DI)水で10〜15回洗い流してキュベットを洗浄します。次いで、エタノール(70〜100%)で3回リンスする。これを行う際は、キュベットに溶剤を完全に充填してください。
- キュベットの外側を、糸くずのないマイクロファイバー布で乾かします。サーフェスの汚れを避けてください。空気は、キュベットの内側を乾燥させるか、圧縮空気ダスターを使用して乾燥させます。
注:ほとんどの紙製品には、キュベットの表面に傷や損傷を与える可能性のある小さな木の繊維が含まれているので、レンズクリーニングペーパーまたはリントフリーマイクロファイバークロスのみを使用してキュベットの光学表面を拭いてください。 - 2つのガラスシンチレーションバイアルを準備します:1つは70〜100%エタノールで満たされ、もう1つはDI水で満たされています。インサートをリンスし、最初にエタノールのバー(次にDI水)を適切なシンチレーションバイアルに挿入/攪拌バーを配置し、バイアルを激しく振ります。インサートを乾燥させ、糸くずのない布または圧縮空気ダスターを使用してバーをかき混ぜます。
注:キュヴェットとインサートは、超音波付き水浴を使用して清掃することもできます。これを行うには、まず、超音波処理ユニットが十分な水(少なくとも5センチの深さ)が含まれていることを確認してください。次に、キュベットを置き、ガラスビーカー(50mL以上)の中に挿入し、水浴と同じレベルまでアルコールでビーカーを満たし、ビーカーを水に入れ、電源を入れます。一度に最大5分間超音波処理し、長い時間が必要な場合は、マシンが各5分バーストの間に>5分を休ませることができます。 - 完了したら、すぐにすべての洗浄し、乾燥したコンポーネントを保管のために離れて置きます。
結果
このデモンストレーションの前に、器具の較正は、ポリスチレンビーズ規格のサイズ分布を測定することによって取得したデータの妥当性を確認するために最初にテストされました。デフォルトの記録パラメータと、このプロトコルで推奨される処理設定を使用して、100 nm および 400 nm のビーズのサイズ分布をテストしました (図 8)。
100 nmポリスチ...
ディスカッション
ここでは、幅広い粒子サイズのサイズ分布を同時に測定し、多分散サンプル中の全EV濃度を測定するためのプロトコルを示す。本研究では、マウスのペリゴナリ脂肪組織およびヒト血漿をEVの供給源として使用した。しかし、血清、尿、唾液、母乳、羊水、細胞培養上清などの他の組織または生物学的液体から隔離されたEVもNTAに使用され得る。ポリスチレンビーズ規格の測定により、装置が?...
開示事項
すべての著者は、利益相反はないと宣言しました。
謝辞
この研究は、国立衛生研究所(ES030973-01A1、R01ES025225、R01DK066525、P30DK026687、P30DK063608)によってサポートされました。私たちは、HORIBAインスツルメンツ株式会社のジェフリー・ボディコム博士が楽器の校正を支援した場合に認めます。
資料
| Name | Company | Catalog Number | Comments |
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | - | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | - | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | - | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | - | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | - | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | - | Nanoparticle tracking instrument |
参考文献
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution - a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved