A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفينوتينوبينج المناعي وفرز الخلايا من MKs الإنسان من المصادر الأولية البشرية أو المتمايزة في المختبر من السلف الهيماتوبويات
In This Article
Summary
هنا، نقدم استراتيجية مناعة لتوصيف تمايز الخلايا العملاقة، ونظهر كيف تسمح تلك الاستراتيجية بفرز الخلايا الضخمة في مراحل مختلفة مع مفرز خلايا مضان. يمكن تطبيق المنهجية على الأنسجة الأولية البشرية ، ولكن أيضا على الخلايا الضخمة المتولدة في الثقافة في المختبر.
Abstract
التمايز Megakaryocyte (MK) يشمل عددا من الدورات البطينية التي تؤدي إلى متعدد الأضلاع للغاية (تصل حتى >64N) وخلية كبيرة للغاية (40-60 ميكرومتر). على عكس المعرفة المتزايدة بسرعة في megakaryopoiesis على بيولوجيا الخلية والمستوى الجزيئي ، يقتصر توصيف megakaryopoiesis عن طريق قياس التدفق الخلوي على تحديد MKs الناضجة باستخدام علامات سطحية خاصة بالنسب ، في حين أن مراحل التمايز السابقة MK لا تزال غير مستكشفة. هنا، نقدم استراتيجية مناعة تسمح بتحديد مراحل التمايز MK المتعاقبة، مع زيادة حالة الحيلة، في المصادر الأولية البشرية أو في الثقافات المختبرية مع لوحة دمج MK علامات سطح محددة وغير محددة. على الرغم من حجمها وهشاشتها، يمكن أن تكون MKs مناعية باستخدام اللوحة المذكورة أعلاه ومثرية بفرز الخلايا المنشطة بالفلورسينس في ظل ظروف محددة من الضغط وقطر الفوهة. يسهل هذا النهج الدراسات متعددة الوميك ، بهدف فهم أفضل لتعقيد megakaryopoiesis وإنتاج الصفائح الدموية في البشر. قد يشكل التوصيف الأفضل للأورام الضخمة أمرا أساسيا في تشخيص أو تشخيص الأمراض المرتبطة بالنسب والخبيثة.
Introduction
تتطور الخلايا الضخمة (MKs) من الخلايا الجذعية الدموية (HSCs) بعد عملية معقدة تسمى megakaryopoiesis ، والتي يتم تنظيمها بشكل رئيسي من خلال هرمون thrombopoietin (TPO). تصف الرؤية الكلاسيكية ل megakaryopoiesis الرحلة الخلوية من HSCs من خلال سلسلة من المراحل الهرمية للأسلاف الملتزمين والخلايا السليفة ، مما يؤدي في نهاية المطاف إلى عضو الكنيست الناضج. أثناء النضج ، تواجه MKs جولات متعددة من بطانة الرحم ، وتطوير نظام غشاء ترسيم معقد داخل الخلايا (DMS) ، والذي يوفر مساحة غشاء كافية لإنتاج الصفائح الدموية ، وإنتاج وتعبئة عدد كبير من العوامل الموجودة في الحبيبات المختلفة الموروثة من الصفائح الدموية الناضجة1و2و3. ونتيجة لذلك، فإن MKs الناضجة هي خلايا كبيرة (40-60 ميكرومتر) تتميز ب نواة متعددة الأضلاع للغاية (تصل حتى إلى >64N). تشير الدراسات الحديثة إلى طرق بديلة تفرق بها HSCs إلى MKs متجاوزة نقاط التفتيش التقليدية للالتزام بالنسب استجابة لبعض الحالات المرضية الفيزيائية4و5و6و7و8و9و 10و11. وتسلط هذه النتائج الضوء على أن التمايز الدموي تجاه عضو الكنيست الناضج هو عملية متصلة ومتكيفة تستجيب للاحتياجات البيولوجية.
مع زيادة المعرفة حول بيولوجيا الخلية والجوانب الجزيئية التي تميز megakaryopoiesis12، فإن معظم الأبحاث المخصصة لدراسة العملية عن طريق قياس التدفق الخلوي تقتصر على تحديد MKs الناضجة باستخدام علامات سطحية خاصة بالنسب(أي CD42A /B ، CD41/CD61) ، في حين أن مراحل التمايز السابقة MK لا تزال غير مستكشفة. ونحن وثقت سابقا استراتيجية لمرحلة megakaryopoiesis في نخاع العظام الماوس والعظام المستمدة من نخاع MK الثقافات13،14، والتي قمنا بتكييفها وتطبيقها على البشر15. في هذه المقالة نعرض استراتيجية مناعة تسمح بتحديد خصائص megakaryopoiesis ، من HSCs إلى MKs الناضجة ، في المصادر الأولية البشرية (نخاع العظام - BM - والدم المحيطي - PB - ) أو في الثقافات المختبرية باستخدام لوحة دمج علامات سطح محددة وغير محددة MK (CD61 ، CD42B ، CD49B ، CD31 ، KIT و CD71 ، من بين أمور أخرى). على الرغم من حجمها الكبير وهشاشتها ، يمكن أن تكون MKs مناعية باستخدام علامات سطح الخلية المذكورة أعلاه ومثرية بفرز الخلايا المنشطة بالفلورسينس في ظل ظروف محددة من الضغط وقطر الفوهة لتقليل تمزق الخلايا و / أو الضرر. هذه التقنية تسهل النهج متعددة Omics، بهدف فهم أفضل لتعقيد megakaryopoiesis وإنتاج الصفائح الدموية في صحة الإنسان والمرض. والجدير بالذكر، أنها سوف تشكل أداة مفيدة للمساعدة في التشخيص والتكهن في سياق سريري من الطلب المتزايد.
في هذه المخطوطة نوثق استراتيجية لتنظيم الهياكل الضخمة البشرية مع لوحة دمج علامات سطح MK محددة وغير محددة من المصادر الأولية أو ولدت في المختبر. بالإضافة إلى ذلك، نحن نقدم بروتوكول لفرز، مع مضان تنشيط خلية الفرز، والكسور المفضلة و MKs ناضجة(الشكل 1). هذه الخطوة ليست شعبية، كما أنها صعبة من الناحية الفنية نظرا لحجم وهشاشة كبيرة من MKs. ومع ذلك، فقد تم استخدامه في كل من الماوس وعينات نخاع العظم البشري سابقا، ونظرا للتقدم التكنولوجي، مع نتيجة أفضل في كل مرة16،17،18. المصادر الأساسية البشرية حيث يمكن دراسة MKs أو MK السلائف تشمل نخاع العظام ودم الحبل السري والدم المحيطي، من بين أمور أخرى. معالجة عينة المناسبة لعزل كسر الخلية ذات الصلة للتحليل على كل عينة من الأهمية. يتم دمج الإجراءات القياسية ، مع بعض الاعتبارات التي يجب مراعاتها عند استهداف دراسة megakaryopoiesis.
Access restricted. Please log in or start a trial to view this content.
Protocol
وتم الحصول على عينات كاملة من الدم ونخاع العظم ومعالجتها وفقا لإعلان هلسنكي لعام 1964. تم الحصول على عينات دم كاملة من متبرعين أصحاء بعد إعطاء موافقة مستنيرة (ISPA) ، ضمن دراسة وافقت عليها لجنتنا الأخلاقية الطبية المؤسسية (مستشفى يونيفرسيتياريو سنترال دي أستورياس - HUCA-). تم الحصول على عينات نخاع العظم من نخاع العظم يستنشق المواد المهملة من المرضى الذين تدار في قسم أمراض الدم في مستشفى كلينيكو سان كارلوس (HCSC).
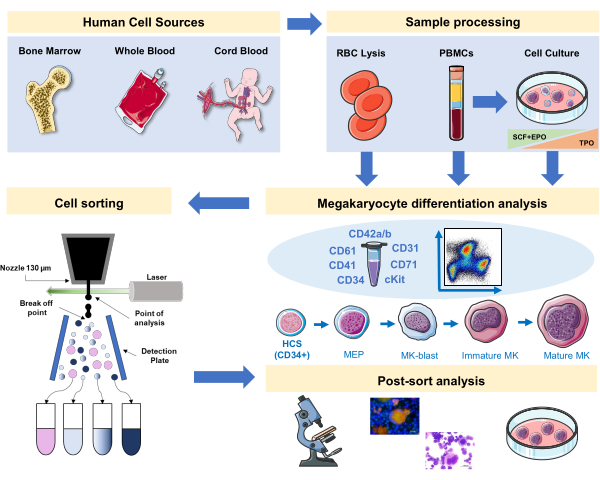
الشكل 1:التمثيل التخطيطي للبروتوكول الموثق في هذه المخطوطة. يشار إلى المصادر البشرية الأساسية أو الثقافات الأولية حيث يمكن تنظيم تمايز MK باستخدام الفينوتينات المناعية. يمكن تطبيق استراتيجية التشتيت المناعي هذه على دراسة العملية في الأمراض المختلفة المرتبطة بالنسب أو الأورام الخبيثة في المصادر الأولية. وبالإضافة إلى ذلك، فإنه يجعل من الممكن فرز الخلية من MKs والسلائف مع مفرز الخلية المضان تنشيط، والذي يسمح بمزيد من التحليل للكسور المخصب. الصور المستخدمة هي جزء من الفن الطبي سيرفييه (SMART) من قبل سيرفييه ومرخصة بموجب CC BY 3.0. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. معالجة الدم الكامل ونخاع العظام قبل إجراء الفينوتينات المناعية
- عند استخدام الدم الكامل (البنك الدولي) من التبرعات كمصدر أساسي، قم بعزل مكون الخلية أحادية النووية في الدم المحيطي (PBMC) اختياريا. ويمكن تحقيق ذلك باستخدام الطرد المركزي التفاضلي القياسي جنبا إلى جنب مع فصل الخلايا المتدرجة الكثافة، كما هو موضح سابقا15.
- باختصار، دم الطرد المركزي عند 193 × ز لمدة 15 دقيقة (الفرامل 3) في درجة حرارة الغرفة. تجاهل كسر البلازما العلوي وجمع حلقة بافي. تمييع 1:1 مع الفوسفات العازلة المالحة (PBS) / تريصوديوم سيترات ديهيدرات (38 غرام / لتر، درجة الحموضة 7) العازلة وماصة بعناية حجم 25 مل على رأس 15 مل من محلول الانحدار الكثافة (1.076 غرام / مل) في أنابيب 50 مل.
- جهاز طرد مركزي لمدة 20 دقيقة عند 1114 × ز (مسرع 3، فرامل 3، درجة حرارة الغرفة). تجاهل كسر البلازما وجمع حلقة بافي التي تحتوي على PBMCs. غسل عن طريق إضافة نفس الحجم من برنامج تلفزيوني، والطرد المركزي في 435 × ز لمدة 5 دقائق، وإعادة الإنفاق في برنامج تلفزيوني لمزيد من الاستخدام.
- بدلا من ذلك، استخدم عينة البنك الدولي (حوالي 100 ميكرولتر) للكتابة المناعية بعد جرف خلايا الدم الحمراء (RBCs) والغسيل الشامل.
- باختصار، تمييع 1:1 في الجليد البارد RBC lysing العازلة (4.15 غرام من NH4Cl، 0.5 غرام من KHCO3 و 18.5 ملغ من EDTA (الثلاثي الثالث) إلى 500 مل من H2O، pH 7.1-7.4). انتظر حتى يصبح تعليق الخلية أحمر متحول (3-5 دقائق).
- جهاز الطرد المركزي في 435 س ز لمدة 5 دقائق، في 4 درجة مئوية، وإعادة إنفاق الخلايا في برنامج تلفزيوني. كرر الإجراء عدة مرات حسب الضرورة للحصول على بيليه خلية بيضاء.
- وبالمثل، معالجة مباشرة العينات التي تم الحصول عليها من نخاع العظام (الطموح) مع RBC lysing العازلة (انظر النقطة 1.2) وغسل شامل، لتبدأ مع تعليق واضح خلية واحدة (الشكل 1).
- تجنب استخدام الدوامة لخلط العينات أثناء المعالجة ، لأنها قد تضر MKs الهشة.
ملاحظة: قد يؤدي تدرج الكثافة للحصول على PBMCs إلى كسر خلية أكثر ثراء وأنظف بالمقارنة مع RBC-lysed WB. ومع ذلك ، ينبغي أن نضع في اعتبارنا أن عالية الكثافة ، قد تضيع MKs ناضجة في كسر "العدلات". وسيناقش هذا الأمر في النتائج التمثيلية.
- تجنب استخدام الدوامة لخلط العينات أثناء المعالجة ، لأنها قد تضر MKs الهشة.
2. في المختبر MK التمايز من PBMCs
ملاحظة: يمكن تمييز الحيوانات المبرومة في المختبر عن السلائف السابقة، مثل الخلايا CD34+ الموجودة في مصادر أولية مختلفة(أي البنك الدولي/PBMCs، دم الحبل السري، نخاع العظم) ومن iPSCs. هناك بروتوكولات مختلفة تم تطبيقها لهذه الغاية. هنا، نستخدم أسلوب ثقافة التي وضعتها لنا أن يسمح MK التمايز من PBMCs، دون الحاجة إلى إثراء لCD34+ السلائف15،19،20،21،22.
- يتكون هذا البروتوكول من ثلاث مراحل ثقافية ، حيث يزداد تركيز الجلطات الدموية (TPO) تدريجيا على حساب عوامل النمو التي تفضل انتشار السلائف السابقة(أيSCF و EPO) ، والتي تنخفض تدريجيا(الشكل 2)15.
- للوسط الأساس, استخدام StemSpan SFEM تكملها مع 0.4٪ من مزيج الدهون الغنية بالكوليسترول و 1٪ البنسلين / ستريبتوميسين.
- بالنسبة للمرحلة الأولى المتوسطة، استخدم وسيط الأساس المكمل ب SCF (100 نانوغرام/مل)، والإريثروبويتين (EPO، 0.5 U/mL) وثرومبوبوتين (TPO، 30 نانوغرام/مل). المرحلة الثانية المتوسطة هي الأساس المتوسطة تكملها مع SCF (50 نانوغرام / مل) ، EPO (0.25 U / مل) و TPO (50 نانوغرام / مل). بالنسبة للمرحلة الثالثة المتوسطة، استخدم الوسيطة الأساسية المكملة ب TPO (100 نانوغرام/مل).
- PBMCs الثقافة في المرحلة الأولى المتوسطة. في اليوم 6-8، ضع PBMCs في المرحلة الثانية المتوسطة، وفي اليوم 9-12 وضع PBMCs في المرحلة الثالثة المتوسطة.
- استبدل الخلايا المتوسطة بخلايا الطرد المركزي عند 435 × ز لمدة 5 دقائق في درجة حرارة الغرفة من المرحلة الأولى إلى المرحلة الثانية، وعلى 95 × ز لمدة 5 دقائق في درجة حرارة الغرفة من المرحلة الثانية إلى المرحلة الثالثة، وإعادة تعليقها في وسط جديد.
- خلايا الثقافة في حاضنة عند 37 درجة مئوية، 5٪ CO2. في هذه الثقافات الأولية، يستمر تمايز MK من 10 إلى 14 يوما، ويمكن سحب العينات في نقاط زمنية مختلفة طوال فترة الثقافة، وذلك لمتابعة تمايز MK.
- للوسط الأساس, استخدام StemSpan SFEM تكملها مع 0.4٪ من مزيج الدهون الغنية بالكوليسترول و 1٪ البنسلين / ستريبتوميسين.
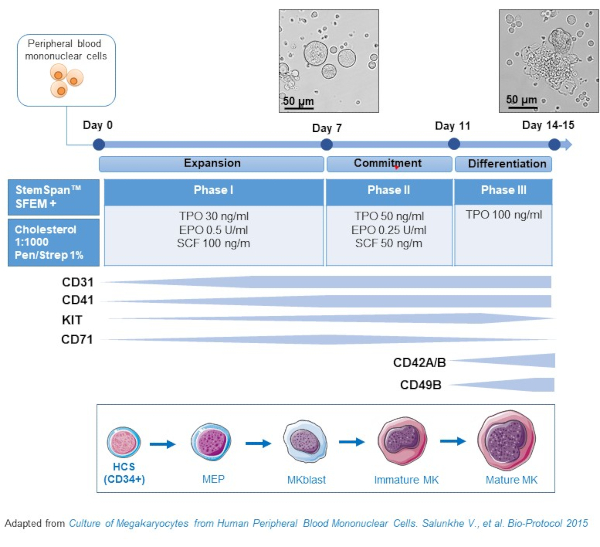
الشكل 2: تمثيل تخطيطي لأسلوب ثقافة MK المشتقة من PBMC. وقد تم استزراع مركبات PBMCs من المتبرعين الأصحاء وفقا للبروتوكول الثلاثي المرحلة الذي طورناه لتوليد MK في المختبر (مخطط مقتبس من Salunkhe وآخرون). 15 يتم عرض الصور التي التقطت في اليوم 10 واليوم 13 من الثقافة. يتم التقاط الصور مع هدف 20X. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- جمع العينات: غسل الخلايا عن طريق تطبيق الطرد المركزي منخفض السرعة لمدة 5 دقائق (95 × ز) وإعادة إنفاقها في PBS أو PBS التي تحتوي على 1٪ من ألبوم مصل البقر (BSA). بالنسبة للتشكيل المناعي، تبلغ الكثافة المثالية 105-10 خلايا 6/100 ميكرولتر (انظر النقطة 3.1). اعتمادا على حالة الثقافات(أي وجود خلايا ميتة، والحطام، وما إلى ذلك)، قد تكون هناك حاجة إلى 1 أو 2 يغسل. جمع الخلايا الخاصة بك في الوقت نقطة الاهتمام أثناء الثقافة.
3. Immunophenotyping من التمايز MK - الحضانة مع لوحة من الأجسام المضادة الموسومة
- احتضان عينات الخلية بلوحة من الأجسام المضادة الموسومة باتباع الإجراءات القياسية ، مع الانتباه إلى أجهزة الطرد المركزي بسرعة منخفضة (95 × ز) عند معالجة الخلايا الضخمة. نحن عادة احتضان العينات مع 1٪ BSA في برنامج تلفزيوني في أحجام 100 ميكرولتر في 4 درجة مئوية، 20 دقيقة، مع مجموعة من 105-106 خلايا.
- توسيع نطاق عند الضرورة.
- بعد الحضانة، أضف 5 مل من 1٪ BSA في PBS، والطرد المركزي بسرعة منخفضة (95 × ز)، ونسيخ الفائق وإعادة إنفاق العينة في 2٪ BSA في PBS للحفاظ على صلاحية MK (2 مل). إضافة 1-5 mM EDTA لتعطيل المجاميع الخلية الخلية (التي ينظر إليها بشكل طبيعي في الثقافات MK).
- نقل العينات إلى أنبوب قاع مستدير 12 × 75 مم (أنبوب FACS) أو لوحة ، وإبقائها في الظلام حتى تحليل قياس التدفق الخلوي أو فرز الخلايا.
- إعداد الأجسام المضادة واحد ويمزج لوحة الأجسام المضادة؛ إعداد مقياس التدفق الخلوي:
- يتجدد الأجسام المضادة قبل استخدامها لتحديد التركيز الأمثل في لوحات الأجسام المضادة. التركيز الأمثل للأجسام المضادة هو أدنى تركيز يفصل بشكل واضح إيجابي عن الخلايا السلبية (ويسمح بامتياز المستويات المتوسطة للتعبير). على سبيل المثال، تستخدم معظم الأجسام المضادة في تخفيف 1:200 (المخزون 100 ميكروغرام / مل) ما لم يتم ثدي خلاف ذلك أو الإشارة إليها من قبل الشركة المصنعة.
- بمجرد تحديد المعايرة المضادة ، قم بإعداد تخفيف 10x لكل الأجسام المضادة. وتستخدم هذه التخفيفات لضوابط لون واحد ولإعداد يمزج لوحة. المخففات ويمزج لوحة على ما يرام للاستخدام حتى بعد شهر من التحضير (المخزنة في 4 درجة مئوية، ما لم تمنع مؤشرات الشركة المصنعة هذه الظروف التخزين). وهذا يسمح تلطيخ العينات مع نفس اللوحة خلال فترة زمنية.
- استخدم 10 ميكرولتر لكل 100 ميكرولتر من تخفيف 10x لكل من عناصر التحكم أحادية اللون ولمزيج اللوحة.
- بالنسبة لعناصر التحكم أحادية اللون، استخدم حبات تقارب الأجسام المضادة، والتي يمكن قياسها مباشرة بعد إضافة الأجسام المضادة. وينبغي قياس عناصر التحكم أحادية اللون مع كل تجربة، للسماح بتعديل التعويض المناسب (وصقل ما بعد القياس مع برنامج التحليل).
- بدلا من ذلك، قم بتنفيذ عناصر التحكم أحادية اللون مع عينات الخلية. ومع ذلك ، فإن الخرز تسمح للقياس السريع لعدد معين من الأحداث ، والتي ، اعتمادا على الأجسام المضادة / علامة السطح ، قد لا يكون من الممكن الحصول على مصادر الخلايا الأولية أو المستزرعة المعقدة. كما ننصح بتشغيل عينات الخلايا الملطخة بمزيج لوحة "Fluorescence Minus One" (FMO) لإعداد إعدادات التعويض المناسبة (قبل تشغيل التجارب). هذا هو ذات الصلة لتحديد بعناية مشاكل التعويض، وخاصة، في MKs مثقف، لتحديد التداخل autofluorescence (والتي سوف تكون موجودة إذا باستخدام ثقافة المتوسطة التي تحتوي على الفينول الأحمر).
- إعداد ما يكفي من حجم مزيج لوحة، اعتمادا على عدد من العينات، التي تحتوي على الأجسام المضادة من لوحة مصممة. معظم لوحات لدينا تشمل ستة أجسام مضادة (لوحات 6 ألوان، انظر الجداول 1-2).
- لهذه اللوحات، استخدم الليزر 488 نانومتر و 633 نانومتر من مقياس التدفق الخلوي، ومع ذلك، يمكن تكييف لوحات لسيناريوهات تقنية أخرى. وعلاوة على ذلك، يمكن تجنب اعتبارات التعويض عند استخدام قياس الخلايا التدفقي القائم على الطيف الكتلي أو مقاييس الخلايا باستخدام تكنولوجيا التركيز الصوتي.
- الأصباغ لقياس الجدوى قد تعطي معلومات خاطئة بشأن MKs، وخصوصا عندما تنضج. MKs هي خلايا نشطة جدا، والإيجابية مع Hoechst، 7-AAD أو PE، قد لا تعكس دائما الموت الفعلي للخلايا. بديل (إذا كان قياس موت الخلية مطلوبا) قد يكون استخدام بقع الميتوكوندريا (CMX Ros) أو الأصباغ التفاعلية أمين (غيبوبة أو الأصباغ الشبح).
الجدول 1: ملاحظات على علامات سطح الخلية من النسب megakaryocytic الرجاء انقر هنا لتحميل هذا الجدول.
الجدول 2: لوحات الأجسام المضادة يرجى النقر هنا لتحميل هذا الجدول.
4. تحليل Ploidy جنبا إلى جنب مع لوحات 6 ألوان
- لتحليل ploidy، بالاشتراك مع لوحة الأجسام المضادة 6 ألوان، والمضي قدما في تثبيت و permeabilization من الخلايا بعد الحضانة مع لوحة الأجسام المضادة. ستسمح هذه الاستراتيجية بالحفاظ على تلطيخ علامة السطح ، مع السماح بتلطيخ الحمض النووي للخلايا. نحن نستخدم Hoechst 33342 لتلطخ الحمض النووي ، حيث يمكن تصوره باستخدام الليزر البنفسجي 405 نانومتر المتاح.
- ل105-106 خلايا، بعد الحضانة مع لوحة الأجسام المضادة، وخلايا الطرد المركزي (95 × ز لمدة 5 دقائق)، وإعادة الإنفاق في 200 ميكروغرام من العازلة التثبيت واحتضان 10 دقيقة في درجة حرارة الغرفة (RT).
- خلايا الطرد المركزي كما هو مبين أعلاه، أعيد إنفاقها للمرة الثانية في 200 ميكرولتر تثبيت العازلة، واحتضان آخر 10 دقيقة في RT.
- إعداد permeabilization العازلة، التي تحتوي على 0.1٪ تريتون X-100، 200 ملغم / مل RNase و 20 ملغم / مل Hoechst 33342 (permeabilization Hoechst MIX).
- خلايا الطرد المركزي على النحو الوارد أعلاه، وإعادة إنفاقها في 300 ميكرولتر من permeabilization Hoechst MIX واحتضان 30 دقيقة في 37 درجة مئوية. هذه الخطوة مهمة جدا، لأنه من أجل الحصول على قياس حيلة نظيفة، الجيش الملكي النيبالي يجب أن تتحلل.
- بعد وقت الحضانة، قم بقياس العينات مباشرة باستخدام مقياس التدفق الخلوي. وإلا، احتفظ بالعينات عند درجة حرارة 4 درجات مئوية، في الظلام. قياسها على الفور. ومع ذلك ، نظرا لأن هذه العينات ثابتة ، يمكن تأخير القياس حتى 24-48 ساعة. تأكد من أن العينة يتم النقر عليها جيدا قبل القياس ، أو تمريرها من خلال مصفاة الخلية ، لضمان تعليق خلية واحدة.
- لا يتم الاحتفاظ المعلمات Morphometric مثل الأمام وجانب مبعثر بعد تثبيت الخلية. سوف تظهر مؤامرة إلى الأمام / الجانب مبعثر انكماش توزيع الخلية بعد التثبيت. ومع ذلك ، يتم الحفاظ على تلطيخ علامة السطح في الغالب ، وبالكاد يتم تغيير استراتيجية اللغات ، مما يسمح بتحليل حالة الحيلة في المراحل المختلفة من التمايز التي تحددها تركيبات علامات السطح.
5. تحليل التمايز MK
ملاحظة: لقد رأينا أن الجمع بين CD31/CD71 يسمح لتعيين عدد من البوابات التي تتوافق مع مراحل مختلفة من التمايز MK. مزيد من الظهر gating مع علامات MK محددة يسمح الفصل بين MKs ناضجة وغير ناضجة. وعلاوة على ذلك، في عينات جديدة، العودة إلى gating للتحقق من وجود علامات أخرى تستخدم، أو لوضع السكان في محاور مبعثر إلى الأمام / الجانب، وصقل تقييم مراحل التمايز MK ويسمح لتجاهل أنواع الخلايا الأخرى التي يمكن أن تكون موجودة على نفس المجموعات السكانية.
- استخدم لوحة من الأجسام المضادة التي تتضمن علامات السلائف المبكرة (KIT، CD34)، وعلامات السلائف الشائعة (CD31، CD71)، وعلامات النسب، وبعضها محدد (CD42A/CD42B، CD49B، CD41/CD61، CLEC2، GPVI، إلخ) (انظر الجداول 1-2). استخدام النسب (لين) كوكتيل (CD3، CD14، CD16، CD19، CD20، وCD56)، كما يسمح ل "تصفية" خلايا الدم الناضجة التي قد تضيف ضجيجا إلى التحليل (عند اختيار لين- السكان). وكمثال على ذلك، سنمر بتحليل مك في مركبات ثنائي الفينيل متعدد الكلور ونخاع العظام ومن خلال ثقافات الخلايا المشتقة من PBMC في النتائج التمثيلية.
6. MK و MK فرز الخلايا السليفة
ملاحظة: تم تحليل الخلايا الملطخة وفرزها على مضان تنشيط خلية فرز FACS Aria IIu مجهزة 488 نانومتر و 633 نانومتر معيار ليزر الحالة الصلبة باستخدام برنامج FACSDiva; بالإضافة إلى ذلك تم تحليل البيانات وعرضها باستخدام برنامج FlowJo و Cytobank (تحليل viSNE). تم تأكيد نقاء الكسور المفرزة من خلال تحليل قياس التدفق الخلوي لكل جزء من الكسور المفرزة (النقاء فوق 85٪).
- إجراء فرز الخلايا في أقرب وقت ممكن أو في غضون ساعة واحدة بعد حضانة الأجسام المضادة من أجل تجنب تدهور الخلايا.
- تصفية العينة مع مصفاة الخلية 100 ميكرومتر لضمان تعليق خلية واحدة وسلامة MK كبيرة.
- استخدم فوهة خزفية 130 ميكرومتر، وضغط غمد تم ضبطه على 11 رطلا لكل بوصة مربعة (PSI) وتردد محرك الأقراص المنسدل الذي تم ضبطه على 12 كيلوهرتز لكسر التيار إلى قطرات.
- قبل الفرز، قم بتعقيم الفوهة، الغمد، وخطوط العينة من خلال إجراء عملية استحواذ 30 دقيقة مع البنسلين / ستريبتومايسين المخفف 1:5 في الماء العقيم، يليه اكتساب 10 دقيقة مع الماء العقيم لإزالة إزالة التلوث المتبقية.
- بمجرد استقرار الدفق ، قم بضبط تأخير الإسقاط مع الخرز الموصى به من أجل الفرز في وضع الضبط الدقيق أكثر من 97.5٪ من الانخفاضات المنعكسة بمعدل تدفق 400-1200 حدث في الثانية.
- إعداد أنابيب FACS جمع مع 500 ميكرولتر من 2٪ BSA في برنامج تلفزيوني. يمكن زيادة نسبة BSA إلى 5-10٪.
- إنشاء قالب التجربة مع معلمات مصفوفة التعويض المناسبة.
- تحميل أنبوب FACS في مقياس الخلايا.
- إجراء قياس للعينة لتعيين البوابات المطلوبة ونقاء مجموعات الخلايا المستهدفة. الاحتفاظ السجل تنشيط لإظهار الأحداث حتى 200,000 في بوابات السكان المحددة أثناء فرز الخلية.
- يسمح FACS Aria IIu بفصل ما يصل إلى 4 مجموعات خلايا مختلفة في نفس الوقت. إنشاء تخطيط فرز جديد وحدد جهاز جمع (4 أنابيب) ووضع الدقة المناسبة (ينصح قناع وسيطة من النقاء والاسترداد). وأخيرا، أضف السكان (السكان) ذات الأهمية لكل حقل موقع فرز(الشكل 3).

الشكل 3:التمثيل التخطيطي لمبدأ فرز الخلايا المنشطة بالفلور (FACS). تمر الجسيمات عبر فوهة 130 ميكرومتر وتضطر إلى التفكك إلى تيار من القطرات العادية بسبب تطبيق الاهتزاز على الفوهة. بعد ذلك ، يتم استجواب القطرات بواسطة الليزر (نقطة التحليل) وتتم معالجة الإشارات لإعطاء قرار الفرز "" عن طريق تطبيق شحنة على تلك القطرات. عندما تمر قطرة شحن عبر حقل كهربائي عالي الجهد (لوحة الكشف) ، يتم تحويلها وجمعها في أنبوب التجميع المقابل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحميل أنابيب جمع والبدء في فرز السكان المستهدفة.
- الطرد المركزي أنابيب جمع لمدة 5 دقائق في 95 × ز وإعادة إنفاق بيليه الخلية في الحجم المناسب من 2٪ BSA في برنامج تلفزيوني.
- قياس مرة أخرى جزء صغير من كل عينة فرزها، لحساب النقاء.
- تخزين الخلايا بشكل مناسب لمزيد من الاستخدام. يمكن استخدام الخلايا المفرزة للتحليلات الخلوية والجزيئية، أو يمكن إعادة استزراعها بهدف دراسة عملية التفريق بين مجموعة مختارة من الخلايا.
7. إعداد عينة ما بعد الفرز
- إعداد السيتوسبينات للتحليل الخلوي باستخدام جهاز طرد خلوي
- جلب الخلايا المفرزة إلى حجم عمل سهل المعالجة من 100-200 ميكرولتر. خذ بعين الاعتبار أن كثافة الخلية ستعتمد على العائد السكاني المفرز في كل حالة.
- ضع شريحة نظيفة على حامل المعدن وضع أعلى فلتر. تذكر تسمية الشريحة والفلتر لتجنب خلط العينات.
- أضف 100 ميكرولتر من برنامج تلفزيوني على فتحة الفلتر مقابل الشريحة، بحيث يتم ترطيب الفلتر على حافة الثقب.
- ضع القمع، أغلق حامل المعدن وضعه على مكانه في جهاز الطرد المركزي.
- أضف العينة (100-200 ميكرولتر) داخل القمع.
- جهاز طرد مركزي عند 36 x g لمدة 5 دقائق. يمكن السماح لشرائح السيتوسبين بتجفيف الهواء في RT (مغطاة بشكل صحيح لمنع الغبار) ويمكن الاحتفاظ بها في RT لمدة أسبوع واحد قبل التصبغ المناعي أو الكيمياء الهستوكيميائية.
- لاحتواء المناعة
- إصلاح الشرائح في 2٪ بارافورمالديهايد (PFA) المخفف في برنامج تلفزيوني واحتضان خلال 5min.
- ويمكن استخدام مجموعة من 0.5-4٪ PFA في برنامج تلفزيوني. في أيدينا، ونحن نستخدم 4٪ للحصول على التثبيت السليم للأنسجة أو بعض أنواع الخلايا، و 0.5٪ PFA في برنامج تلفزيوني يكفي للصفائح الدموية. عند إعداد هذه التقنية، تتطلب النسبة المئوية الصحيحة من PFA التحسين لكل نوع/مصدر خلية.
- احتضان 5 دقائق في برنامج تلفزيوني.
- احتضان 5 دقائق في الإيثانول 50٪ (EtOH).
- احتضان 5 دقائق في 70٪ EtOH.
- يخزن في 70٪ EtOH عند -20 درجة مئوية.
- عند تنفيذ التأزيم المناعي، إعادة الترطيب، واتباع الإجراءات القياسية (permeabilization، وغسل، ومنع، والحضانات الأجسام المضادة الأولية والثانوية، والحفاظ على، الخ).
- إصلاح الشرائح في 2٪ بارافورمالديهايد (PFA) المخفف في برنامج تلفزيوني واحتضان خلال 5min.
- للكيمياء الخلوية:
ملاحظة: يمكن أن تكون ملطخة الشرائح مع May-Grünwald Giemsa تلطيخ أو تلطيخ مريحة لكل غرض. - لفحص مورفولوجيا فوري
- إضافة قطرة واحدة من تصاعد المتوسطة على بقعة تحتوي على الخلية من السيتوسبين ووضع غطاء.
- احتفظ بالشرائح عند 4 درجات مئوية لمدة لا تزيد عن أسبوع، ما لم تكن مختومة، مما يسمح بالتخزين طويل الأجل حتى في RT. يسمح التثبيت المتوسط المتصاعد بالتخزين طويل الأجل في RT.
Access restricted. Please log in or start a trial to view this content.
النتائج
نخاع العظم و بلويدي
في الشكل 4، نعرض تحليل مناعي تمثيلي ل megakaryopoiesis في عينات BM (الطموح) من المرضى. عند رسم كسر الخلوية ضد CD71 وCD31، لدينا بوابات ستة السكان الرئيسيين: CD31- CD71- (الأحمر)، CD31- CD71+ (الأزرق)، CD31+ CD71- (البرتقالي)، CD31
Access restricted. Please log in or start a trial to view this content.
Discussion
معظم البحوث التي تركز على دراسة megakaryopoiesis عن طريق قياس التدفق الخلوي يقتصر حتى الآن على تحديد مجموعات فرعية MK باستخدام علامات سطح النسب فقط محددة(أي، CD42A/CD42B ، CD41/CD61) ، في حين تم فحص مراحل التمايز MK في وقت سابق بشكل سيئ. في هذه المقالة نعرض استراتيجية مناعة لمعالجة توصيف التدفق الشامل لقي...
Access restricted. Please log in or start a trial to view this content.
Disclosures
تم دعم إنتاج المواد السمعية البصرية من قبل BD Biosciences.
Acknowledgements
ونشكر ماركوس بيريز باستريشيا ولورينا رودريغيز لورينزو وبغونا غارسيا منديز وبالوما سيريزو وألمودينا باييرو وماريا دي لا بوفيدا - كولومو على الدعم التقني. وقد دعم هذا العمل جزئيا من المنح الطبية (Roche SP200221001) إلى A.B، وهي زمالة RYC (RYC-2013-12587؛ الوزير دي إيكونوميا إي سيفيبيتفيداد، إسبانيا) ومنحة I+D 2017 (SAF2017-85489-P؛ الوزير دي سيينسيا، إنوفاسيون إي يونيفرسيدادس، إسبانيا وفودوس فيدر) إلى L.G. ، منحة سيفيرو أوتشوا (PA-20-PF-BP19-014؛ كونسيجيريا دي سيينسيا، إنوفاسيون إي يونيفرسيدادس ديل برينسيبيادو دي أستورياس، إسبانيا) إلى بي.M-ب. ومنحة ما بعد الدكتوراه داخل المنظمة لعام 2018 (Fundación para la Investigación y la Innovación Biosanitaria de Asturias - FINBA, Oviedo, Spain) إلى A.A.-H. نشكر رينييه فان دير ليندن لتقاسم معرفته (والوقت)، وخاصة نصيحته الحكيمة على متعدد الألوان الموسومة الأجسام المضادة لوحة مزيج ومتعددة اللون حبة التحكم إعداد.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 130 micron Nozzle | BD | 643943 | required for MK sorting |
| 5810R Centrifuge | Eppendorf | Cell isolation and washes | |
| A-4-62 Swing Bucket Rotor | Eppendorf | Cell isolation and washes | |
| Aerospray Pro Hematology Slide Stainer / Cytocentrifuge | ELITech Group | Automatized cytology devise, where slides are stained with Mat-Grünwald Giemsa | |
| CO2 Incubator Galaxy 170 S | Eppendorf | Cell Incubation | |
| Cytospin 4 Cytocentrifuge | Thermo Scientific | To prepare cytospins | |
| FACSAria IIu sorter | BD | Lasers 488-nm and 633-nm | |
| FACSCanto II flow cytometer | BD | Lasers 488-nm , 633-nm and 405-nm | |
| Olympus Microscope BX 41 | Olympus | Microphotographs | |
| Olympus Microscope BX 61 | Olympus | Microphotographs | |
| Zoe Fluorescent Cell Imager | BioRad | Microphotographs | |
| To obtain PBMCs | |||
| Lipids Cholesterol Rich from adult bovine serum | Sigma-Aldrich | L4646 | or similar |
| Lymphoprep | Stem Cell Technologies | #07801 | or similar |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | or similar |
| Recombinant human Erythropoietin (EPO) | R&D Systems | 287-TC-500 | or similar |
| Recombinant human stem cell factor (SCF) | Thermo Fisher Scientific, Gibco™ | PHC2115 | or similar |
| Recombinant human thrombopoietin (TPO) | Thermo Fisher Scientific, Gibco™ | PHC9514 | or TPO receptor agonists |
| StemSpan SFEM | Stem Cell Technologies | #09650 | |
| Flow Cytometry Analyses | |||
| Bovine Serum Albumin | Merck | A7906-100G | or similar |
| BD CompBead Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD | 552843 | Antibodies for human cells are generally from mouse. |
| BD Cytofix/Cytoperm | BD | 554714 | or similar |
| BD FACS Accudrop Beads | BD | 345249 | |
| CD31 AF-647 | BD | 561654 | Mouse anti-human |
| CD31 FITC | Immunostep | 31F-100T | |
| CD34 FITC | BD | 555821 | Mouse anti-human |
| CD41 PE | BD | 555467 | Mouse anti-human |
| CD41 PerCP-Cy5.5 | BD | 333148 | Mouse anti-human |
| CD42A APC | Immunostep | 42AA-100T | We observed unspecific binding... that needs to be assessed |
| CD42A PE | BD | 558819 | Mouse anti-human |
| CD42B PerCP | Biolegend | 303910 | Mouse anti-human |
| CD49B PE | BD | 555669 | Mouse anti-human |
| CD61 FITC | BD | 555753 | Mouse anti-human |
| CD71 APC-Cy7 | Biolegend | 334109 | Mouse anti-human |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Human BD Fc Block | BD | 564219 | Fc blocking - control |
| KIT PE-Cy7 | Biolegend | 313212 | Mouse anti-human |
| Lineage Cocktail 2 FITC | BD | 643397 | Mouse anti-human |
| RNAse | Merck | R6513 | or similar |
| Triton X-500 | Merck | 93443-500ML | or similar |
| Cell strainers for sorting | |||
| CellTrics Filters 100 micrometers | Sysmex | 04-004-2328 | Cell strainers |
| Note: we do not specify general reagents/chemicals (PBS, EDTA, etc) or disposables (tubes, etc), or reagents specified in previous published and standard protocols - unless otherwise specified. |
References
- Italiano, J. E. Unraveling Mechanisms That Control Platelet Production. Semin Thrombosis And Haemostasis. 39 (1), 15-24 (2013).
- Machlus, K. R., Italiano, J. E. The Incredible Journey: From Megakaryocyte Development To Platelet Formation. Journal Of Cell Biology. 201 (6), 785-796 (2013).
- Eckly, A., et al. Biogenesis Of The Demarcation Membrane System (DMS) In Megakaryocytes. Blood. 123 (6), 921-930 (2014).
- Couldwell, G., Machlus, K. R. Modulation Of Megakaryopoiesis And Platelet Production During Inflammation. Thrombosis Research. 179, 114-120 (2019).
- Kosaki, G. In Vivo Platelet Production From Mature Megakaryocytes: Does Platelet Release Occur Via Proplatelets. International Journal Of Hematology. 81 (3), 208-219 (2005).
- Lefrancais, E., Looney, M. R. Platelet Biogenesis In The Lung Circulation. Physiology (Bethesda). 34 (6), 392-401 (2019).
- Nieswandt, B., Stritt, S. Megakaryocyte Rupture For Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 327-328 (2015).
- Nishimura, S., et al. IL-1alpha Induces Thrombopoiesis Through Megakaryocyte Rupture In Response To Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 453-466 (2015).
- Sanjuan-Pla, A., et al. Platelet-Biased Stem Cells Reside At The Apex Of The Haematopoietic Stem-Cell Hierarchy. Nature. 502 (7470), 232-236 (2013).
- Notta, F., et al. Distinct Routes Of Lineage Development Reshape The Human Blood Hierarchy Across Ontogeny. Science. 351 (6269), 2116(2016).
- Yamamoto, R., et al. Clonal Analysis Unveils Self-Renewing Lineage-Restricted Progenitors Generated Directly From Hematopoietic Stem Cells. Cell. 154 (5), 1112-1126 (2013).
- Wang, H., et al. Decoding Human Megakaryocyte Development. Cell Stem Cell. , (2020).
- Meinders, M., et al. Repercussion Of Megakaryocyte-Specific Gata1 Loss On Megakaryopoiesis And The Hematopoietic Precursor Compartment. Plos One. 11 (5), 0154342(2016).
- Meinders, M., et al. Sp1/Sp3 Transcription Factors Regulate Hallmarks Of Megakaryocyte Maturation And Platelet Formation And Function. Blood. 125 (12), 1957-1967 (2015).
- Salunkhe, V. P., Gutiérrez, L. Culture Of Megakaryocytes From Human Peripheral Blood Mononuclear Cells. Bio-Protocol. 5 (21), 1639(2015).
- Choudry, F. A., et al. Transcriptional Characterization Of Human Megakaryocyte Polyploidization And Lineage Commitment. Journal Of Thrombosis And Haemostasis. , 15271(2021).
- Heazlewood, S. Y., Williams, B., Storan, M. J., Nilsson, S. K. The Prospective Isolation Of Viable, High Ploidy Megakaryocytes From Adult Murine Bone Marrow By Fluorescence Activated Cell Sorting. Methods In Molecular Biology. 1035, 121-133 (2013).
- Tomer, A., Harker, L. A., Burstein, S. A. Purification Of Human Megakaryocytes By Fluorescence-Activated Cell Sorting. Blood. 70 (6), 1735-1742 (1987).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. On The Quest For In Vitro Platelet Production By Re-Tailoring The Concepts Of Megakaryocyte Differentiation. Medicina. 56 (12), Kaunas. (2020).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. In Vitro Platelet Production For Transfusion Purposes: Where Are We Now. Transfusion And Apheresis Science. 59 (4), 102864(2020).
- Butov, K. R., et al. In Vitro Megakaryocyte Culture From Human Bone Marrow Aspirates As A Research And Diagnostic Tool. Platelets. , 1-8 (2020).
- Di Buduo, C. A., et al. A Gold Standard Protocol For Human Megakaryocyte Culture Based On The Analysis Of 1,500 Umbilical Cord Blood Samples. Thrombosis And Haemostasis. , (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved