このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒトの一次源または造血前駆体からの分化 インビトロ からのヒトMKの免疫フェノタイピングと細胞選別
要約
ここでは、巨核球分化の特徴付けに関する免疫型付け戦略を紹介し、その戦略が蛍光活性化細胞選別機を用いて異なる段階で巨核球を選別する方法を示す。この方法論はヒトの一次組織に適用できるが、 インビトロの培養で生成された巨核球にも適用できる。
要約
巨核球(MK)分化は、非常に多倍(>64Nに達する)および非常に大きな細胞(40-60 μm)をもたらす多くのエンドミトティックサイクルを包含する。細胞生物学と分子レベルでの巨核代の急速な知識とは対照的に、フローサイトメトリーによる巨核生物の特徴付けは、系統特異的な表面マーカーを用いた成熟したMCの同定に限定される一方、以前のMK分化段階は未踏のままである。ここでは、MK特異的および非特異的な表面マーカーを含むパネルを用いたヒトの一次源または インビトロ 培養において、連続したMK分化段階の同定を可能にする免疫フェノタイピング戦略を提示する。その大きさと脆弱性にもかかわらず、MKは上記のパネルを使用して免疫フェノタイプすることができ、圧力およびノズル直径の特定の条件下で蛍光活性化細胞選別によって濃縮される。このアプローチは、ヒトにおける巨核代と血小板産生の複雑性をよりよく理解することを目的として、マルチオミックス研究を促進する。巨核代の特徴付けが良いと、系統関連の病理や悪性腫瘍の診断や予後に根本的なものとなる可能性があります。
概要
巨核球(MC)は、主にホルモントロンボポエチン(TPO)によって調整される巨核球症と呼ばれる複雑なプロセスに続いて、造血幹細胞(HSC)から発症する。巨核代の古典的な見解は、HSCからの細胞の旅を、コミットされた前駆細胞および前駆細胞の階層的な段階の連続を通して記述し、最終的には成熟したMKにつながる。成熟の間、MKはエンドミドーシスの複数のラウンドを経験し、血小板産生のための十分な膜表面を提供する複雑な細胞内境界膜系(DMS)を開発し、成熟した血小板1、2、3によって受け継がれる異なる顆粒に含まれる多数の因子を効率的に生成し、パックする。その結果、成熟したMKは、高倍数核(>64Nにも達する)を特徴とする大細胞(40〜60μm)です。最近の研究では、HSCが特定の生理病理学的状態4、5、6、7、8、9、10、11に応答して従来の系統コミットメントチェックポイントをバイパスしてMKに分化する代替ルートを示唆している。これらの知見は、成熟したMKに対する造血性分化が生物学的ニーズに対応する連続的かつ適応的なプロセスであることを強調している。
細胞生物学に関する知識の増加と巨核代種症12の分子的側面に関する知識が高まる中、フローサイトメトリーによるプロセスの研究に特化した研究のほとんどは、系統特異的な表面マーカー(CD42A/B、CD41/CD61)を用いた成熟したMCの同定に限定されているが、MK分化段階は未踏のままである。我々は以前に、ヒト15に適応し、適用してきたマウス骨髄および骨髄由来MK培養13、14において巨核代を上演する戦略を文書化した。本稿では、ヒトの主要なソース(骨髄-BM-および末梢血-PB-)またはMK特異的および非特異的表面マーカー(CD61、CD42B、CD49B、CD31、CD71)を組み込んだパネルを用いたインビトロ培養物において、HSCから成熟したMCまで、巨核化の特徴を可能にする免疫フェノタイピング戦略を示す。MKは、大きなサイズと脆弱性にもかかわらず、上記の細胞表面マーカーを使用して免疫整形され、細胞の破裂や損傷を最小限に抑えるために、圧力とノズル径の特定の条件下で蛍光活性化細胞選別によって濃縮することができます。この技術は、人間の健康と病気における巨核代と血小板産生の複雑さをよりよく理解することを目的として、マルチオミクスのアプローチを促進する。注目に値する、それは需要の増大の臨床文脈で診断と予後を助けるために有用なツールとして提起する。
この原稿では、MK特異的および非特異的な表面マーカーを主要なソースまたは生成されたインビトロから統合したパネルを用いて、ヒト巨核代を上演する戦略を文書化する。さらに、蛍光活性化細胞選別機、好ましい分数および成熟したMKを用いて、並べ替えプロトコルを提供します(図1)。この手順は、サイズが大きく、また、MK の脆弱性が大きいため、技術的に難しいため、一般的ではありません。しかし、それは以前マウスとヒト骨髄サンプルの両方で採用されており、技術の進歩により、毎回16、17、18より良い結果が得られます。MCまたはMK前駆体を研究できるヒトの主要な情報源には、骨髄、臍帯血および末梢血などが含まれる。各サンプルの分析のために関連する細胞分数を分離するための適切なサンプル処理が重要です。標準的な手順を組み込み、巨大核代の研究を目指す際に考慮すべきいくつかの考慮事項があります。
プロトコル
全血および骨髄サンプルは、1964年のヘルシンキ宣言に従って取得され、処理された。全血サンプルは、私たちの機関医療倫理委員会(病院Universituniversitario Central deアストゥリアス-HUCA-)によって承認された研究の中で、インフォームド・コンセント(ISPA)を与えた後、健康なドナーから得られました。骨髄サンプルは、病院クリニコ・サン・カルロス(HCSC)の血液学部で管理された患者の骨髄吸入捨て物質から得られた。
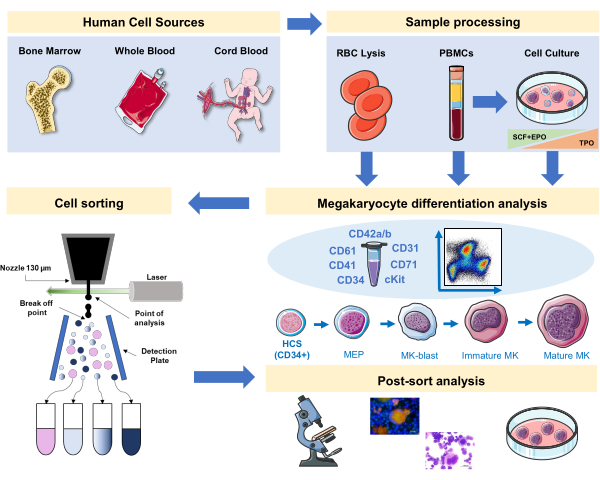
図1: 本稿に記載されているプロトコルの概略図 免疫フェノタイピングを用いてMK分化を行うことができる主要なヒト源または主要培養物が示されている。この免疫型付け戦略は、一次源における異なる系統関連病理または悪性腫瘍におけるプロセスの研究に適用することができる。さらに、蛍光活性化細胞選別機を用いたMKや前駆体の細胞分類が可能となり、濃縮された分画のさらなる分析が可能になる。使用されるイメージは、セルヴィエによるセルヴィエメディカルアート(SMART)の一部であり、CC BY 3.0の下でライセンスされています。 この図の大きなバージョンを表示するには、ここをクリックしてください。
1. 免疫原型入力前の全血および骨髄処理
- 寄付からの全血(WB)を主要な供給源として使用する場合、必要に応じて末梢血単核細胞(PBMC)成分を単離する。これは、前述の15のように、密度勾配細胞分離と組み合わせた標準微分遠心分離を使用することによって達成することができる。
- 簡単に言えば、遠心分離機の血液を室温で15分間193xg(ブレーキ3)で行う。上部のプラズマ分を捨てて、バフィーリングを収集します。リン酸緩衝塩水(PBS)/クエン酸二水和物三ナトリウム(38 g/L、pH 7)バッファーとピペットを50 mLチューブに15 mLの密度勾配溶液(1.076 g/mL)の上に慎重に25 mLの体積で希釈します。
- 1114 x gで20分間の遠心分離機(加速器3、ブレーキ3、室温)。プラズマの分数を捨ててPBMCを含むバフィーリングを回収し、同じ量のPBSを加えて洗浄し、435 x gで5分間遠心分離器を加え、さらに使用するためにPBSで再中断します。
- あるいは、赤血球(RBC)を洗浄し、徹底的に洗浄した後の免疫フェノタイピングには、WBサンプル(約100μL)を使用します。
- 簡単に言えば、氷冷RBCライジングバッファー(NH4Clの4.15 g、KHCO3 の0.5g、EDTA(トリプレックスIII)の18.5 mgをH2Oの500 mL、pH 7.1-7.4で1:1希釈する。細胞懸濁液が半透明になるまで待つ(3-5分)。
- 遠心分離機を5分間435xgで、4°Cで、PBS中の細胞を再懸濁した。白い細胞ペレットを得るために必要な回数だけ手順を繰り返します。
- 同様に、骨髄(吸引)から得られたサンプルをRBCのライジングバッファ(ポイント1.2を参照)と徹底的な洗浄で直接処理し、明確な単一細胞懸濁液で始まるように(図1)。
- それは壊れやすいMKを損傷する可能性があるため、処理中にサンプルを混合するために渦の使用を避けてください。
注: PBMCs を得るための密度勾配は、RBC-lysed WB と比較して、より豊かで、よりクリーンな細胞分画をもたらす可能性があります。しかし、高密度で成熟したMKは「好中球」の分数で失われる可能性があることを念頭に置く必要があります。これは代表結果で説明します。
- それは壊れやすいMKを損傷する可能性があるため、処理中にサンプルを混合するために渦の使用を避けてください。
2. PBMC からのインビトロ MK の分化
注:MCは、CD34+細胞などの以前の前駆体、異なる主要なソース(すなわち、WB/PBMCs、臍帯血、骨髄)およびiPSCとの間で分化することができる。このエンドに適用されているさまざまなプロトコルがあります。ここでは、CD34+前駆体15、19、20、21、22に対する濃縮を必要とせずに、PBMCとMKの分化を可能にする、私たちが開発した培養方法を使用します。
- このプロトコルは、トロンボポエチン(TPO)の濃度が徐々に増加する3つの培養相で構成され、以前の前駆体(すなわち、SCF、EPO)の増殖を支持する成長因子を犠牲にして徐々に増加する(図2)15。
- 基礎培地の場合は、コレステロール豊富な脂質ミックスの0.4%と1%ペニシリン/ストレプトマイシンを補ったStemSpan SFEMを使用してください。
- フェーズI培地では、SCF(100 ng/mL)、エリスロポエチン(EPO、0.5 U/mL)、トロンボポエチン(TPO、30 ng/mL)を添加したベーシス培地を使用してください。フェーズII培地は、SCF(50 ng/mL)、EPO(0.25 U/mL)およびTPO(50 ng/mL)を添加した基礎培地です。フェーズIII培地の場合は、TPO(100 ng/mL)を添加した基底媒体を使用します。
- 第I相培地中の培養PBMC。6~8日目に、PBMCをフェーズII培地に入れ、9~12日目には第III相培地にPBMCsを配置します。
- 培地は、第I相から第II相までの室温で435 x gの遠心分離機を室温で5分間、95 x gで第II相から第III相まで室温で5分間交換し、新鮮な培地で再懸濁します。
- 培養細胞は37°Cで培養器中、5%CO2.これらの主要な培養では、MK分化は10〜14日間続き、サンプルは、MK分化に従うように、培養期間を通じて異なる時点で描くことができる。
- 基礎培地の場合は、コレステロール豊富な脂質ミックスの0.4%と1%ペニシリン/ストレプトマイシンを補ったStemSpan SFEMを使用してください。
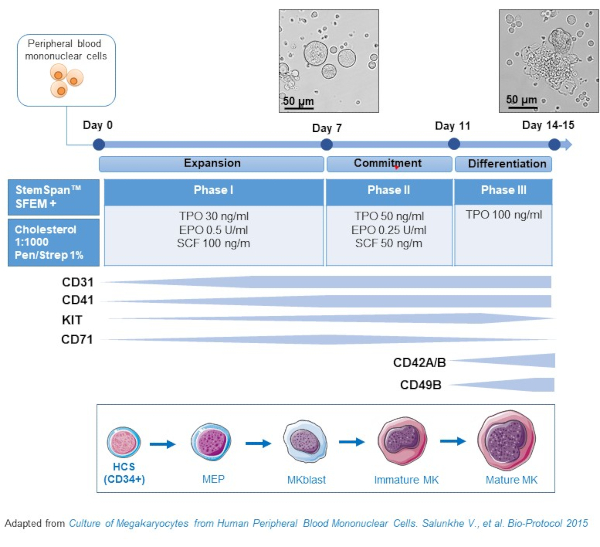
図2:PBMC由来MK培養法の概略図健常ドナーからのPBMCは、MK in vitro(Salunkheらから適応したスキーム)を生成するために開発された3相プロトコルに従って培養した。10日目と13日目の文化で撮影された15枚の写真が示されています。写真は20倍の目的で撮影されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
- サンプルコレクション:5分間(95 x g)の低速遠心を適用して細胞を洗浄し、1%のウシ血清アルブミン(BSA)を含むPBSまたはPBSで再中断します。免疫フェノタイピングの場合、理想的な密度は105-106細胞/100 μL(ポイント3.1参照)です。培養の状況(すなわち、死細胞、破片等の存在)によっては、1または2の開行が必要となる場合がある。培養中に関心のある時点でセルを収集します。
MK分化の免疫フェノタイピング - タグ付き抗体のパネルを用いたインキュベーション
- 標準的な手順に従ってタグ付き抗体のパネルで細胞サンプルをインキュベートし、巨核球を処理する際に低速(95 x g)で遠心分離機に注意を払います。我々は通常、105-106細胞の範囲で、4°C、20分で100 μLの体積でPBSで1%BSAでサンプルをインキュベートします。
- 必要に応じてスケールアップします。
- インキュベーション後、PBSに1%BSAの5mLを加え、低速(95xg)で遠心分離機、上清を吸引し、サンプルをPBSで2%BSAに再懸濁してMK生存率(2mL)を維持した。1-5 mM EDTA を加えて、細胞細胞凝集体を破壊します(これは当然MK培養で見られます)。
- サンプルを12 x 75 mmの丸底管(FACSチューブ)またはプレートに移し、フローサイトメトリー解析または細胞選別まで暗闇の中に保管します。
- 単一抗体と抗体パネルの混合物の調製;フローサイトメーターの設定:
- 抗体パネルの最適濃度を決定するために使用する前に抗体を活性化します。抗体の最適濃度は、明らかに陽性と陰性細胞を分離する最も低い濃度です(そして、中間レベルの発現の区別が可能です)。一例として、抗体のほとんどは、特に製造業者によって滴定または示されていない限り、1:200希釈(ストック100 μg/mL)で使用されます。
- 抗体滴定が決定されたら、各抗体の10x希釈を調製する。これらの希釈は、単色コントロールとパネルミックスの準備に使用されます。希釈剤およびパネルミックスは、製造後1ヶ月でも使用できます(メーカーの適応がこれらの貯蔵条件を妨げない限り、4°Cで保存)。これにより、同じパネルでサンプルを一定期間染色できます。
- シングルカラーコントロールとパネルミックスの両方に10x希釈100 μLあたり10μLを使用します。
- 単色コントロールでは、抗体アフィニティービーズを使用し、抗体を添加した後に直接測定することができます。適切な補正調整(および分析ソフトウェアによる後の測定の微調整)を可能にするために、単色コントロールは実験ごとに測定する必要があります。
- または、セルサンプルを使用して単色コントロールを実行します。しかし、ビーズは、抗体/表面マーカーによっては、複雑な一次または培養細胞源では得られない可能性がある、所定の数のイベントの迅速な測定を可能にする。また、「蛍光マイナス1」(FMO)パネルミックスで染色された細胞サンプルを実行して、適切な補正設定を設定することをお勧めします(実験を実行する前)。これは、補償の問題を慎重に特定すること、特に培養されたMKにおいて、自己蛍光干渉(フェノールレッドを含む培養培地を使用する場合に存在する)を同定するために関連する。
- サンプル数に応じて、設計されたパネルの抗体を含むパネルミックスの十分な量を準備する。私たちのパネルのほとんどは6つの抗体を含みます(6色パネル、 表1-2を参照)。
- これらのパネルでは、フローサイトメーターの488nmおよび633nmレーザーを使用しますが、パネルは他の技術的なシナリオに適応することができます。さらに、質量分析ベースのフローサイトメトリーまたは音響焦点技術を用いたサイトメーターを使用する場合、補償の考慮事項を回避することができます。
- 生存率を測定するための色素は、特に成熟した場合、MKに関する誤った情報を与える可能性があります。MKは非常に活性な取り込み細胞であり、Hoechst、7-AADまたはPEの陽性は、常に実際の細胞死を反映するとは限らないかもしれません。別の方法(細胞死測定が必要な場合)は、ミトコンドリア染色(CMX Ros)またはアミン反応性染料(ゾンビまたはゴースト染料)の使用である可能性があります。
表1:巨核細胞系の細胞表面マーカーに関する注意事項この表をダウンロードするには、ここをクリックしてください。
表2:抗体パネルこの 表をダウンロードするには、ここをクリックしてください。
4. 6色パネルと組み合わせたプロイディ分析
- 6色の抗体パネルと組み合わせて、プロイディ分析のために、抗体パネルでインキュベーションした後の細胞の固定および透過性を進めます。この戦略は、細胞のDNAの染色を可能にしながら、表面マーカー染色の保存を可能にする。私たちは、利用可能なバイオレット405nmレーザーで視覚化することができるので、DNAを染色するためにHoechst 33342を使用しています。
- 105-106細胞の場合、抗体パネルでインキュベーションした後、遠心分離細胞(95 x g 5分間)、200 μLの固定バッファーに再懸濁し、室温(RT)で10分間インキュベートする。
- 上記のように遠心分離細胞は、200 μL固定バッファーで2度目の再懸濁、RTで10分間インキュベートする。
- 0.1%トリトンX-100、200mg / mL RNaseおよび20 mg/mL Hoechst 33342(パーメアビライゼーションHoechst MIX)を含むパーメアビライゼーションバッファーを準備します。
- 上記のように遠心分離細胞は、透過性の300μLで再懸濁し、37°Cで30分間インキュベートする。 このステップは非常に重要であり、それ以来、クリーンな策略測定を得るためには、RNAを分解しなければならない。
- インキュベーション時間の後、フローサイトメーターで直接サンプルを測定します。それ以外の場合は、暗い状態で4°Cに保存してください。速やかに測定します。しかし、これらのサンプルは固定されているので、測定は24〜48時間でも遅れさせることができる。測定前にサンプルを十分にフリックするか、細胞ストレーナーを通過して、単一の細胞懸濁液を確実に確保してください。
- [前方]や[側面散布図]などのモーフォメトリック パラメータは、セルの固定後に維持されません。前方/側面散布図は、固定後の細胞分布の収縮を示します。しかし、表面マーカー染色はほとんど保存されており、格言戦略はほとんど変更されず、表面マーカーの組み合わせによって定義される異分化の異なる段階での策略状態の分析が可能になります。
5. MK分化分析
注:CD31/CD71の組み合わせにより、MKの異なるステージに対応するゲートを設定することができます。MK特異的マーカーを使用したさらにバックガッティングにより、成熟したMKと未熟なMKの分離が可能になります。さらに、新鮮なサンプルでは、使用される他のマーカーの存在を確認するためにバックゴーティング、または前方/側面散乱軸に母集団を配置するために、MK分化段階の評価を洗練し、同じ集団に存在する可能性のある他の細胞タイプを廃棄することができます。
- 初期前駆体マーカー(KIT、CD34)、一般的な前駆体マーカー(CD31、CD71)、および系統マーカーを含む抗体のパネルを使用し、それらのうちのいくつかは特異的である(CD42A/CD42B、CD49B、CD41/CD61、CLEC2、GPVIなど)( 表1-2を参照)。リネージュ(Lin)カクテル(CD3、CD14、CD16、CD19、CD20、およびCD56)の使用は、分析にノイズを追加する可能性のある成熟した造血細胞を「フィルタリング」することを可能にします(Lin- Populationを選択する場合)。例として、代表的な結果においてPBMC、骨髄、PBMC由来細胞培養を通じてのMCの分析を行います。
6. MKおよびMK前駆細胞分類
注:染色された細胞は、FACSDivaソフトウェアを使用して488 nmおよび633nm標準固体レーザーを搭載した蛍光活性化細胞選別機FACS Aria IIuで分析され、ソートされました。データは、FlowJo ソフトウェアとサイトバンク (viSNE 分析) を使用して、さらに分析および提示されました。ソートされた分画の純度は、各ソートされた分画(純度85%以上)のフローサイトメトリー分析によって確認された。
- 細胞の劣化を避けるために、抗体インキュベーション後、できるだけ早く、または1時間以内に細胞の選別を行います。
- 100 μmのセルストレーナーでサンプルをフィルターし、単一セルの懸濁液と大きなMKの完全性を保証します。
- 130μmのセラミックノズル、1平方インチあたり11ポンド(PSI)に設定されたシース圧力、ドロップ駆動周波数を12 kHzに設定して、流れを滴に分解します。
- 選別する前に、ペニシリン/ストレプトマイシンを滅菌水で1:5希釈して30分の取得を行い、続いて滅菌水で10分取得して残りのデコンタミン剤を除去し、ノズル、シース、およびサンプルラインを殺菌します。
- ストリームが安定したら、推奨されるビーズでドロップ遅延を調整し、反射されたドロップの 97.5% 以上を 1 秒あたり 400 ~ 1200 イベントの流量で微調整モードで並べ替えます。
- PBSで2%BSAの500 μLのコレクションFACSチューブを準備します。BSAの割合は5-10%まで増加させることができる。
- 適切な補正マトリックス パラメータを使用して実験テンプレートを生成します。
- FACSチューブをサイトメーターにロードします。
- サンプルの測定を行い、目的の細胞集団の必要なゲートと純度を設定します。セルの並べ替え中に、選択した人口ゲートに最大 200,000 個のイベントを表示するためにアクティブ化されたレコードを維持します。
- FACSのアリアリIIuは同時に4つまでの異なった細胞集団の分離を可能にする。新しいソートレイアウトを作成し、収集装置(4チューブ)と適切な精度モード(純度と回復の中間マスクをお勧めします)を選択します。最後に、目的の母集団を各並べ替え場所フィールドに追加します (図 3)。

図3:蛍光活性化細胞選別(FACS)の原理の概略図 粒子は130 μmノズルを通過し、ノズルに振動を加えるために規則的な液滴の流れに分解することを余儀なくされる。次に、液滴はレーザー(分析ポイント)によって尋問され、信号はそれらの液滴に電荷を適用することによって「ソート決定」を与えるために処理されます。電荷液滴が高電圧静電場(検出プレート)を通過すると、それは偏向され、対応する回収管に集められます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- コレクション チューブをロードし、ターゲットの集団を並べ替え始めます。
- 95 x gで5分間の回収管を遠心分離し、PBS中の適切な体積2%BSAで細胞ペレットを再懸濁する。
- 再び各ソートされたサンプルの一部を測定し、純度を計算する。
- さらなる使用のために適切にセルを保存します。選別された細胞は、細胞学的および分子的分析に使用することができ、または選択した細胞集団の分化プロセスを研究することを目的として再培養することができる。
7. ソート後のサンプル準備
- 細胞遠心分離機による細胞分析のためのサイトスピンの準備
- 並べ替えられた細胞を、100~200 μLの扱いやすい作業量に持ち込みます。細胞密度は、それぞれの場合に分類された母集団収量に依存することを考慮に入れてください。
- 金属ホルダーにきれいなスライドを置き、フィルタートップを置きます。サンプルを混合しないように、スライドとフィルターにラベルを付けることを忘れないでください。
- フィルター穴に100 μL PBSをスライドに加え、ホールリムでフィルターを加湿します。
- 漏斗を置き、金属ホルダーを閉じて遠心分離機のその場所に置きます。
- 漏斗の中にサンプル(100-200 μL)を加えます。
- 遠心分離機は36 x gで5分間。細胞スピンスライドは、RTで空気乾燥(粉塵を防止するために適切に覆われている)にすることができ、免疫染色または細胞化学の前に1週間RTで保つことができます。
- 免疫染色用
- PBSで希釈した2%パラホルムアルデヒド(PFA)でスライドを固定し、5分間インキュベートします。
- PBS中の0.5〜4%のPFAの範囲が使用されてもよい。私たちの手では、組織またはいくつかの細胞タイプの適切な固定を得るために4%を使用し、PBSの0.5%PFAは血小板のために十分です。この手法を設定する場合、PFA の適切な割合では、セルの種類/ソースあたりの最適化が必要になります。
- PBSで5分インキュベート。
- 50%エタノール(EtOH)で5分間インキュベートします。
- 70%のEtOHで5分インキュベート。
- -20ºCで70%のEtOHで保管してください。
- 免疫染色を行う場合、水分補給、および標準的な手順(透過、洗浄、ブロッキング、一次および二次抗体インキュベーション、保存など)に従ってください。
- PBSで希釈した2%パラホルムアルデヒド(PFA)でスライドを固定し、5分間インキュベートします。
- 細胞化学の場合:
注:スライドは、May-Grünwald Giemsa染色または各目的に便利な染色で染色できます。 - 即時形態検査のため
- 細胞を含む細胞のスポットに取り付け媒体を1滴加え、カバースリップを置きます。
- 密封しない限り、スライドを1週間以上4°Cに保ち、RTでも長期保存が可能です。
結果
骨髄と策略
図4では、患者からのBMサンプル(吸引)における巨核代の代表的な免疫型解析を示す。CD71とCD31に対して細胞分数をプロットする際には、CD31- CD71- (赤)、CD31 - CD71+ (青)、CD31 + CD71- (オレンジ)、CD31+ CD71+ CD71+ CD71 + (濃い緑色) および CD31++ CD71ミッドクリー?...
ディスカッション
フローサイトメトリーによる巨核生物の研究に焦点を当てた研究のほとんどは、系統特異的な表面マーカー(すなわち、CD42A/CD42B、CD41/CD61)のみを使用したMKサブセットの同定に限定され、以前のMK分化段階は十分に検討されていません。本稿ではヒト巨核代の包括的なフローサイトメトリー特性解析に取り組む免疫フェノタイピング戦略を示す。全体として、MK特異的および非特異的な表...
開示事項
視聴覚材料の生産は、BDバイオサイエンスによってサポートされました。
謝辞
マルコス・ペレス・バステルレチェア、ロレナ・ロドリゲス・ロレンツォ、ベゴーニャ・ガルシア・メンデス(HUCA)、パロマ・セレッソ、アルムデナ・パエロ、マリア・デ・ラ・ポベダ=コロモ(HCSC)に技術サポートを感謝します。この研究は、A.B.、RYCフェローシップ(RYC-2013-12587)への医療助成金(ロシュSP200221001)によって部分的にサポートされました。デ・エコノミア・イ・コンペティティビダード、スペイン)とI +D 2017助成金(SAF2017-85489-P;シエンシア大臣、イノバシオン・イ・ウニバーシダーデス、スペイン、フォンドス・フェデエル)からセベロ・オチョア・グラント(PA-20-PF-BP19-014)までコンセヘリア・デ・シエンシア,イノバシオン・イ・ウニヴェルシダーデス・デル・プリンシパド・デ・アストゥリアス州)からP.M.-Bへ。そして、A.A.-Hへの壁内ポスドク助成金2018(フンダシオン・パラ・ラ・インベスティガシオン・イ・ラ・イノバシオン・ビバイサニタリア・デ・アストゥリアス - FINBA、オビエド、スペイン)。私たちは、彼の知識(と時間)、特にマルチカラータグ付き抗体パネルミックスと単色ビーズ制御製剤に関する彼の賢明なアドバイスを共有してくれたライニエ・ファン・デル・リンデンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 130 micron Nozzle | BD | 643943 | required for MK sorting |
| 5810R Centrifuge | Eppendorf | Cell isolation and washes | |
| A-4-62 Swing Bucket Rotor | Eppendorf | Cell isolation and washes | |
| Aerospray Pro Hematology Slide Stainer / Cytocentrifuge | ELITech Group | Automatized cytology devise, where slides are stained with Mat-Grünwald Giemsa | |
| CO2 Incubator Galaxy 170 S | Eppendorf | Cell Incubation | |
| Cytospin 4 Cytocentrifuge | Thermo Scientific | To prepare cytospins | |
| FACSAria IIu sorter | BD | Lasers 488-nm and 633-nm | |
| FACSCanto II flow cytometer | BD | Lasers 488-nm , 633-nm and 405-nm | |
| Olympus Microscope BX 41 | Olympus | Microphotographs | |
| Olympus Microscope BX 61 | Olympus | Microphotographs | |
| Zoe Fluorescent Cell Imager | BioRad | Microphotographs | |
| To obtain PBMCs | |||
| Lipids Cholesterol Rich from adult bovine serum | Sigma-Aldrich | L4646 | or similar |
| Lymphoprep | Stem Cell Technologies | #07801 | or similar |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | or similar |
| Recombinant human Erythropoietin (EPO) | R&D Systems | 287-TC-500 | or similar |
| Recombinant human stem cell factor (SCF) | Thermo Fisher Scientific, Gibco™ | PHC2115 | or similar |
| Recombinant human thrombopoietin (TPO) | Thermo Fisher Scientific, Gibco™ | PHC9514 | or TPO receptor agonists |
| StemSpan SFEM | Stem Cell Technologies | #09650 | |
| Flow Cytometry Analyses | |||
| Bovine Serum Albumin | Merck | A7906-100G | or similar |
| BD CompBead Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD | 552843 | Antibodies for human cells are generally from mouse. |
| BD Cytofix/Cytoperm | BD | 554714 | or similar |
| BD FACS Accudrop Beads | BD | 345249 | |
| CD31 AF-647 | BD | 561654 | Mouse anti-human |
| CD31 FITC | Immunostep | 31F-100T | |
| CD34 FITC | BD | 555821 | Mouse anti-human |
| CD41 PE | BD | 555467 | Mouse anti-human |
| CD41 PerCP-Cy5.5 | BD | 333148 | Mouse anti-human |
| CD42A APC | Immunostep | 42AA-100T | We observed unspecific binding... that needs to be assessed |
| CD42A PE | BD | 558819 | Mouse anti-human |
| CD42B PerCP | Biolegend | 303910 | Mouse anti-human |
| CD49B PE | BD | 555669 | Mouse anti-human |
| CD61 FITC | BD | 555753 | Mouse anti-human |
| CD71 APC-Cy7 | Biolegend | 334109 | Mouse anti-human |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Human BD Fc Block | BD | 564219 | Fc blocking - control |
| KIT PE-Cy7 | Biolegend | 313212 | Mouse anti-human |
| Lineage Cocktail 2 FITC | BD | 643397 | Mouse anti-human |
| RNAse | Merck | R6513 | or similar |
| Triton X-500 | Merck | 93443-500ML | or similar |
| Cell strainers for sorting | |||
| CellTrics Filters 100 micrometers | Sysmex | 04-004-2328 | Cell strainers |
| Note: we do not specify general reagents/chemicals (PBS, EDTA, etc) or disposables (tubes, etc), or reagents specified in previous published and standard protocols - unless otherwise specified. |
参考文献
- Italiano, J. E. Unraveling Mechanisms That Control Platelet Production. Semin Thrombosis And Haemostasis. 39 (1), 15-24 (2013).
- Machlus, K. R., Italiano, J. E. The Incredible Journey: From Megakaryocyte Development To Platelet Formation. Journal Of Cell Biology. 201 (6), 785-796 (2013).
- Eckly, A., et al. Biogenesis Of The Demarcation Membrane System (DMS) In Megakaryocytes. Blood. 123 (6), 921-930 (2014).
- Couldwell, G., Machlus, K. R. Modulation Of Megakaryopoiesis And Platelet Production During Inflammation. Thrombosis Research. 179, 114-120 (2019).
- Kosaki, G. In Vivo Platelet Production From Mature Megakaryocytes: Does Platelet Release Occur Via Proplatelets. International Journal Of Hematology. 81 (3), 208-219 (2005).
- Lefrancais, E., Looney, M. R. Platelet Biogenesis In The Lung Circulation. Physiology (Bethesda). 34 (6), 392-401 (2019).
- Nieswandt, B., Stritt, S. Megakaryocyte Rupture For Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 327-328 (2015).
- Nishimura, S., et al. IL-1alpha Induces Thrombopoiesis Through Megakaryocyte Rupture In Response To Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 453-466 (2015).
- Sanjuan-Pla, A., et al. Platelet-Biased Stem Cells Reside At The Apex Of The Haematopoietic Stem-Cell Hierarchy. Nature. 502 (7470), 232-236 (2013).
- Notta, F., et al. Distinct Routes Of Lineage Development Reshape The Human Blood Hierarchy Across Ontogeny. Science. 351 (6269), 2116 (2016).
- Yamamoto, R., et al. Clonal Analysis Unveils Self-Renewing Lineage-Restricted Progenitors Generated Directly From Hematopoietic Stem Cells. Cell. 154 (5), 1112-1126 (2013).
- Wang, H., et al. Decoding Human Megakaryocyte Development. Cell Stem Cell. , (2020).
- Meinders, M., et al. Repercussion Of Megakaryocyte-Specific Gata1 Loss On Megakaryopoiesis And The Hematopoietic Precursor Compartment. Plos One. 11 (5), 0154342 (2016).
- Meinders, M., et al. Sp1/Sp3 Transcription Factors Regulate Hallmarks Of Megakaryocyte Maturation And Platelet Formation And Function. Blood. 125 (12), 1957-1967 (2015).
- Salunkhe, V. P., Gutiérrez, L. Culture Of Megakaryocytes From Human Peripheral Blood Mononuclear Cells. Bio-Protocol. 5 (21), 1639 (2015).
- Choudry, F. A., et al. Transcriptional Characterization Of Human Megakaryocyte Polyploidization And Lineage Commitment. Journal Of Thrombosis And Haemostasis. , 15271 (2021).
- Heazlewood, S. Y., Williams, B., Storan, M. J., Nilsson, S. K. The Prospective Isolation Of Viable, High Ploidy Megakaryocytes From Adult Murine Bone Marrow By Fluorescence Activated Cell Sorting. Methods In Molecular Biology. 1035, 121-133 (2013).
- Tomer, A., Harker, L. A., Burstein, S. A. Purification Of Human Megakaryocytes By Fluorescence-Activated Cell Sorting. Blood. 70 (6), 1735-1742 (1987).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. On The Quest For In Vitro Platelet Production By Re-Tailoring The Concepts Of Megakaryocyte Differentiation. Medicina. 56 (12), (2020).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. In Vitro Platelet Production For Transfusion Purposes: Where Are We Now. Transfusion And Apheresis Science. 59 (4), 102864 (2020).
- Butov, K. R., et al. In Vitro Megakaryocyte Culture From Human Bone Marrow Aspirates As A Research And Diagnostic Tool. Platelets. , 1-8 (2020).
- Di Buduo, C. A., et al. A Gold Standard Protocol For Human Megakaryocyte Culture Based On The Analysis Of 1,500 Umbilical Cord Blood Samples. Thrombosis And Haemostasis. , (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved