Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Birincil Kaynaklarından veya Hematopoetik Progenitörlerden Farklılaştırılmış In Vitro'dan İnsan MK'larının İmmünofenoping ve Hücre Sıralama
Bu Makalede
Özet
Burada, megakaryosit farklılaşmasının karakterizasyonu için bir immünofenotyping stratejisi sunuyoruz ve bu stratejinin floresan ile aktive edilmiş bir hücre sıralayıcısı ile megakaryositlerin farklı aşamalarda sıralanmasına nasıl izin verdiğini gösteriyoruz. Metodoloji insan birincil dokularına uygulanabilir, aynı zamanda kültür in vitroundaüretilen megakaryositlere de uygulanabilir.
Özet
Megakaryosit (MK) farklılaşması, yüksek poliploid (hatta >64N'ye) ve son derece büyük bir hücreye (40-60 μm) neden olan bir dizi endomitotik döngüyü kapsar. Hücre biyolojisi ve moleküler düzeyde megakaryopoeziste hızla artan bilginin aksine, megakaryopoezisin akış sitometrisi ile karakterizasyonu, olgun MK'lerin soyuna özgü yüzey belirteçleri kullanılarak tanımlanmasıyla sınırlıdır, daha önceki MK farklılaşma aşamaları ise keşfedilmemiştir. Burada, insan birincil kaynaklarında veya in vitro kültürlerde art arda gelen MK farklılaşma aşamalarının, MK spesifik ve spesifik olmayan yüzey belirteçlerini entegre eden bir panelle tanımlanmasını sağlayan bir immünofenomileme stratejisi sunuyoruz. Boyutuna ve kırılganlığına rağmen, MK'ler yukarıda belirtilen panel kullanılarak immünofenotipe edilebilir ve belirli basınç ve nozül çapı koşulları altında floresan ile aktive edilmiş hücre sıralama ile zenginleştirilebilir. Bu yaklaşım, insanlarda megakaryopoez ve trombosit üretiminin karmaşıklığını daha iyi anlamak amacıyla çoklu Omics çalışmalarını kolaylaştırır. Megakaryopoezisin daha iyi nitelendirmesi, soyla ilgili patolojilerin ve malignitenin tanısında veya prognozunda temel teşkil edebilir.
Giriş
Megakaryositler (MKs), özellikle trombopoietin (TPO) hormonu tarafından düzenlenen megakaryopoezis adı verilen karmaşık bir sürecin ardından hematopoetik kök hücrelerden (HSC' ler) gelişir. Megakaryopoezis'in klasik görünümü, HSC'lerden, taahhüt edilen ataların ve öncü hücrelerin hiyerarşik aşamalarının ardışık olarak ardışık olarak hücresel yolculuğunu açıklar ve sonuçta olgun bir MK'ye yol açan. Olgunlaşma sırasında, MK'ler birden fazla endokatoz turu yaşar, trombosit üretimi için yeterli membran yüzeyi sağlayan karmaşık bir hücre içi sınır membran sistemi (DMS) geliştirir ve olguntrombositler1,2,3tarafından miras kalan farklı granüllerde bulunan faktörlerin bolluğunu verimli bir şekilde üretir ve paketler. Sonuç olarak, olgun MK'ler oldukça poliploid bir çekirdekle karakterize edilen büyük hücrelerdir (40-60 μm) (>64N'ye bile ulaşır). Son çalışmalar, HSC'lerin belirli fizyo-patolojik koşullara yanıt olarak geleneksel soy taahhüt kontrol noktalarını atlayarak MK'lere farklılık gösterdiği alternatif rotalar önermektedir4,5,6,7,8,9,10,11. Bu bulgular, olgun MK'ya karşı hematopoetik farklılaşmanın biyolojik ihtiyaçlara cevap veren sürekli ve uyarlanabilir bir süreç olduğunu vurgulamaktadır.
Hücre biyolojisi ve megakaryopoezis12'yikarakterize eden moleküler yönler hakkında artan bilgi ile, sürecin akış sitometrisi ile incelenmesine adanmış araştırmaların çoğu, olgun MK'lerin soyuna özgü yüzey belirteçleri (cd42A /B, CD41 / CD61) kullanılarak tanımlanmasıyla sınırlıdır, daha önceki MK farklılaşma aşamaları ise keşfedilmemiştir. Daha önce megakaryopoez'i fare kemik iliği ve kemik iliği türevi MK kültürlerinde sahneleme stratejisini belgeledik13,14, uyarladık ve insanlara uyguladık15. Bu yazıda megakaryopoezlerin karakterizasyonuna izin veren bir immünofenomipi stratejisi gösteriyoruz, HSC'lerden olgun MK'lere, insan birincil kaynaklarında (kemik iliği -BM- ve periferik kan -PB-) veya in vitro kültürlerde MK'ye özgü ve spesifik olmayan yüzey belirteçlerini (CD61, CD42B, CD49B, CD31, KIT ve CD71) entegre eden bir panel kullanarak. Büyük boyutuna ve kırılganlığına rağmen, MK'ler yukarıda belirtilen hücre yüzeyi belirteçleri kullanılarak immünofipotip edilebilir ve hücre yırtılmasını ve/veya hasarını en aza indirmek için belirli basınç ve nozül çapı koşullarında floresan ile aktive edilmiş hücre sıralama ile zenginleştirilebilir. Bu teknik, megakaryopoez ve trombosit üretiminin insan sağlığı ve hastalığındaki karmaşıklığını daha iyi anlamak amacıyla çoklu Omics yaklaşımlarını kolaylaştırır. Dikkat çekici, artan talebin klinik bağlamında tanı ve prognoza yardımcı olmak için yararlı bir araç olarak ortaya çıkacaktır.
Bu yazıda, birincil kaynaklardan MK'ya özgü ve spesifik olmayan yüzey belirteçlerini entegre eden veya in vitrooluşturulan bir panel ile insan megakaryopoezini sahneleme stratejisini belgeleyeceğiz. Ayrıca, floresanla etkinleştirilmiş bir hücre sıralayıcısı, tercih edilen kesirler ve olgun MK'ler ile sıralamak için bir protokol sağlıyoruz (Şekil 1). Bu adım popüler değildir, çünkü MK'lerin büyüklüğü ve kırılganlığı nedeniyle teknik olarak zordur. Bununla birlikte, daha önce hem fare hem de insan kemik iliği örneklerinde ve teknolojik ilerleme nedeniyle, her seferinde daha iyi bir sonuçla16,17,18. MK'lerin veya MK öncüllerinin çalışılabildiği insan birincil kaynakları arasında kemik iliği, kordon kanı ve periferik kan bulunur. Her numune üzerinde analiz için ilgili hücre fraksiyonunu izole etmek için uygun numune işleme önemlidir. Standart prosedürler, megakaryopoez çalışmasını hedeflerken dikkate alınması gereken bazı hususlarla dahil edilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1964 Helsinki Bildirgesi uyarınca tam kan ve kemik iliği örnekleri alınarak işlendi. Kurumsal tıbbi etik komitemiz (Hospital Universitario Central de Asturias -HUCA-) tarafından onaylanan bir çalışma dahilinde, bilinçli onay (ISPA) verildikten sonra sağlıklı donörlerden tam kan örnekleri alındı. Clínico San Carlos Hastanesi Hematoloji Bölümü'nde (HCSC) yönetilen hastaların kemik iliği aspirat atma materyalinden kemik iliği örnekleri alındı.
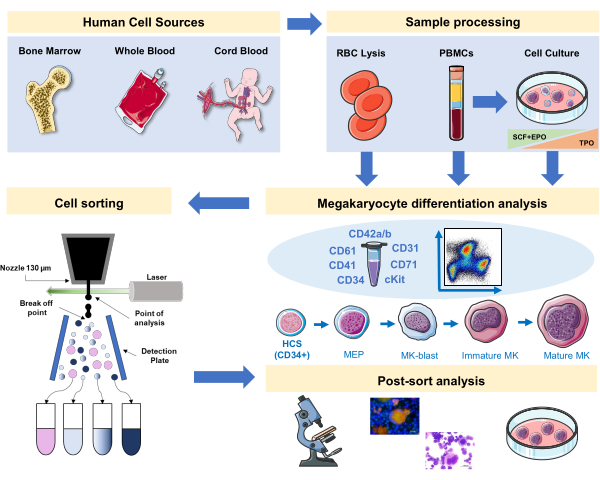
Şekil 1: Bu yazıda belgelenen protokolün şematik gösterimi. İmmünafotipleme kullanılarak MK farklılaşması yapılabilen birincil insan kaynakları veya birincil kültürler belirtilir. Bu immünofenoniping stratejisi, sürecin farklı soyla ilgili patolojilerde veya birincil kaynaklarda malignitede incelenmesine uygulanabilir. Ek olarak, zenginleştirilmiş fraksiyonların daha fazla analizini sağlayan floresan ile etkinleştirilmiş bir hücre sıralayıcısı ile MK'lerin ve öncüllerin hücre sıralamasını mümkün kılar. Kullanılan görüntüler Servier tarafından Servier Medical Art'ın (SMART) bir parçasıdır ve CC BY 3.0 altında lisanslanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. İmmünofenosipsiyondan önce tam kan ve kemik iliği işleme
- Bağışlardan elde edilen tam kanı (WB) birincil kaynak olarak kullanırken, isteğe bağlı olarak periferik kan mononükleer hücre (PBMC) bileşenini izole edin. Bu, daha önce açıklandığı gibi yoğunluk gradyan hücre ayrımı ile birlikte standart diferansiyel santrifüjleme kullanılarak elde edilebilir15.
- Kısacası, oda sıcaklığında 15 dakika (fren 3) için 193 x g'da santrifüj kanı. Üst plazma fraksiyonunu atın ve buffy halkasını toplayın. 1:1'i fosfat tampon salin (PBS)/Trisodium Sitrat Dihidrat (38 g/L, pH 7) tampon ve pipet ile 50 mL'lik tüplerde 15 mL yoğunluk gradyan çözeltisinin (1.076 g/mL) üzerine 25 mL'lik bir hacimle dikkatlice seyreltin.
- 1114 x g'da 20 dakika santrifüj (hızlandırıcı 3, fren 3, oda sıcaklığı). Plazma fraksiyonunu atın ve PBMC'leri içeren buffy halkayı toplayın.
- Alternatif olarak, kırmızı kan hücrelerini (RBC'ler) ve iyice yıkadıktan sonra immünofenotiping için bir WB örneği (yaklaşık 100 μL) kullanın.
- Kısacası, buz gibi RBC liz tamponunda 1:1 seyreltin (4.15 g NH4Cl, 0.5 g KHCO3 ve 18.5 mg EDTA (tripleks III) ila 500 mL H2O, pH 7.1-7.4). Hücre süspansiyonu yarı saydam kırmızı olana kadar bekleyin (3-5 dk).
- 5 dakika boyunca 435 x g'da, 4 °C'de santrifüj ve PBS'deki hücreleri yeniden biriktirin. Beyaz bir hücre peleli elde etmek için prosedürü gerektiği kadar tekrarlayın.
- Benzer şekilde, kemik iliğinden (aspirasyon) elde edilen örnekleri doğrudan RBC lising tamponu (bkz. nokta 1.2) ve net bir tek hücreli süspansiyonla başlamak üzere iyice yıkama ile işleyin (Şekil 1).
- Hassas MK'lere zarar verebileceğinden, işleme sırasında numuneleri karıştırmak için girdap kullanımından kaçının.
NOT: PBMC'leri elde etmek için yoğunluk gradyanı, RBC-lysed WB ile karşılaştırıldığında daha zengin ve daha temiz bir hücre fraksiyonu ile sonuçlanabilir. Bununla birlikte, yüksek yoğunluklu, olgun MK'lerin "nötrofil" fraksiyonunda kaybolabileceğini unutmamalıyız. Bu, temsili sonuçlarda tartışılacaktır.
- Hassas MK'lere zarar verebileceğinden, işleme sırasında numuneleri karıştırmak için girdap kullanımından kaçının.
2. PBMC'lerden in vitro MK farklılaşması
NOT: MK'ler in vitro olarak farklı birincil kaynaklarda (örneğin, WB/PBMC'ler, kordonkanı, kemik iliği) bulunan CD34+ hücreleri gibi önceki öncüllerden ve iPSC'lerden ayırt edilebilir. Bu amaçla uygulanan farklı protokoller vardır. Burada, CD34+ öncüller 15 , 19,20,21,22için zenginleştirmeye gerek kalmadan MK'lerin PBMC'lerden farklılaşmasına izin veren bizim geliştirdiğimiz bir kültür yöntemi kullanıyoruz.
- Bu protokol, trombopoietin (TPO) konsantrasyonunun, daha önceki öncüllerin(yaniSCF, EPO) çoğalmasını destekleyen büyüme faktörleri pahasına kademeli olarak arttığı üç kültür aşamasından oluşur ve bu aşama giderek azalır (Şekil 2)15.
- Temel ortam için, kolesterol zengin lipid karışımının% 0.4'ü ve% 1 Penisilin / Streptomisin ile desteklenmiş StemSpan SFEM kullanın.
- Faz I ortamı için SCF (100 ng/mL), Eritropoietin (EPO, 0,5 U/mL) ve Trombopoietin (TPO, 30 ng/mL) ile desteklenmiş temel ortamı kullanın. Faz II ortamı SCF (50 ng/mL), EPO (0,25 U/mL) ve TPO (50 ng/mL) ile desteklenmiş temel ortamdır. Faz III ortamı için, TPO (100 ng/mL) ile desteklenmiş temel ortamı kullanın.
- Aşama I ortamında Kültür PBMC'leri. 6-8. günde PBMC'leri Faz II ortamına, 9-12.
- Aşama I'den Faz II'ye kadar oda sıcaklığında 5 dakika boyunca 435 x g'da ve Faz II'den Faz III'e oda sıcaklığında 5 dakika boyunca 95 x g'da hücreleri santrifüj ederek ve taze ortamda yeniden depolayarak ortamı değiştirin.
- 37 °C'de bir inkübatörde kültür hücreleri, % 5 CO2. Bu birincil kültürlerde, MK farklılaşması 10-14 gün sürer ve MK farklılaşmasını takip etmek için kültür dönemi boyunca farklı zaman noktalarında örnekler çizilebilir.
- Temel ortam için, kolesterol zengin lipid karışımının% 0.4'ü ve% 1 Penisilin / Streptomisin ile desteklenmiş StemSpan SFEM kullanın.
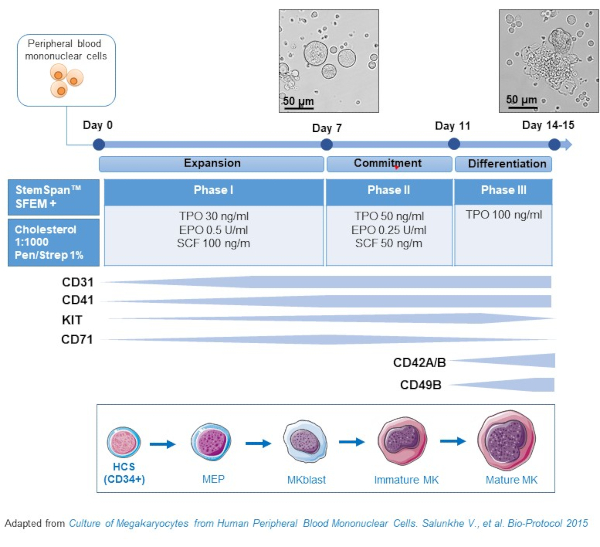
Şekil 2: PBMC türevi MK kültür yönteminin şematik gösterimi. Sağlıklı donörlerden pbmc'ler, MK in vitro (Salunkhe ve ark.'dan uyarlanan şema) oluşturmak için geliştirdiğimiz üç fazlı protokole göre kültürlendi. Kültürün 10. ve 13. gününde çekilen 15 fotoğraf gösterilmiştir. Fotoğraflar 20X hedefiyle çekilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Örnek toplama: Hücreleri 5 dakika (95 x g) düşük hızlı santrifüj uygulayarak yıkayın ve sığır serum albüminin (BSA) % 1'ini içeren PBS veya PBS'de yeniden uygulayın. İmmünafotipleme için ideal yoğunluk 105 -106 hücre/100 μL'dir (bkz. nokta 3.1). Kültürlerin durumuna bağlı olarak(yani ölü hücrelerin varlığı, döküntüler vb.), 1 veya 2 yıkama gerekebilir. Kültür sırasında ilgi çekici zaman noktalarında hücrelerinizi toplayın.
3. MK farklılaşması immünofenotiping - etiketli antikorlar paneli ile inkübasyon
- Hücre örneklerini standart prosedürleri takip eden bir etiketli antikor paneli ile kuluçkaya yatırarak, megakaryositleri işlerken düşük hızda (95 x g) santrifüje dikkat edin. Normalde PBS'de %1 BSA olan numuneleri 100 μL hacimlerde 4 °C, 20 dk, 105 -106 hücre aralığında kuluçkaya yatırıyoruz.
- Gerektiğinde ölçeği büyüt.
- İnkübasyondan sonra, PBS'de % 1 BSA'nın 5 mL'sini ekleyin, düşük hızda santrifüj (95 x g), süpernatantı aspire edin ve MK canlılığını (2 mL) korumak için örneği PBS'de% 2 BSA'da yeniden dirildi. Hücre-hücre agregalarını bozmak için 1-5 mM EDTA ekleyin (MK kültürlerinde doğal olarak görülür).
- Numuneleri 12 x 75 mm yuvarlak alt tüpe (FACS tüpü) veya plakaya aktarın, akış sitometri analizine veya hücre sıralamaya kadar karanlıkta tutun.
- Tek antikor ve antikor paneli karışımlarının hazırlanması; akış sitometresini ayarlama:
- Antikor panellerindeki en uygun konsantrasyonu belirlemek için kullanmadan önce antikorları titrat. Antikorların optimal konsantrasyonu, negatif hücrelerden açıkça pozitif ayıran (ve orta düzeyde ifadenin ayırt olmasına izin veren) en düşük konsantrasyondur. Örnek olarak, antikorların çoğu, üretici tarafından aksi belirtilmedikçe veya belirtilmedikçe 1:200 seyreltmede (stok 100 μg/ mL) kullanılır.
- Antikor titrasyonu belirlendikten sonra, her antikorun 10x seyreltilmesini hazırlayın. Bu seyreltmeler tek renkli kontroller ve panel karışımlarının hazırlanması için kullanılır. Seyreltmeler ve panel karışımları, hazırlık işleminden bir ay sonra bile kullanım için iyidir (üreticinin endikasyonları bu depolama koşullarını engellemediği sürece 4 °C'de saklanır). Bu, bir zaman dilimi boyunca aynı panele sahip örneklerin boyanmalarına izin verir.
- Hem tek renkli kontroller hem de panel karışımı için 10x seyreltmenin 100 μL'si başına 10 μL kullanın.
- Tek renkli kontroller için, antikor ekledikten sonra doğrudan ölçülebilen antikor benzeşim boncukları kullanın. Tek renkli kontroller, uygun kompanzasyon ayarına (ve analiz yazılımı ile ölçüm sonrası ince ayar yapılmasına) izin vermek için her denemede ölçülmelidir.
- Alternatif olarak, hücre örnekleriyle tek renkli denetimleri gerçekleştirin. Bununla birlikte, boncuklar, antikor/ yüzey işaretçisine bağlı olarak karmaşık birincil veya kültürlü hücre kaynaklarında elde edilmesi mümkün olmayabilecek belirli sayıda olayın hızlı bir şekilde ölçülmesine izin verir. Ayrıca, uygun telafi ayarlarını ayarlamak için (denemeleri çalıştırmadan önce) "Floresan Eksi Bir" (FMO) panel karışımları ile boyanmış hücre örneklerini çalıştırmanızı tavsiye ederiz. Bu, tazminat sorunlarını dikkatlice tanımlamak ve özellikle kültürlü MK'lerde otoflüoresans parazitlerini tanımlamak için geçerlidir (fenol kırmızısı içeren kültür ortamı kullanılsaydı mevcut olacaktır).
- Tasarlanan panelin antikorlarını içeren numune sayısına bağlı olarak panel karışımının yeterli hacmini hazırlayın. Panellerimizin çoğu altı antikor içerir (6 renkli paneller, bkz. Tablolar 1-2).
- Bu paneller için akış sitometresinin 488-nm ve 633-nm lazerlerini kullanın, ancak paneller diğer teknik senaryolara uyarlanabilir. Ayrıca, kütle spektrometresi bazlı akış sitometrisi veya akustik odaklama teknolojisine sahip sitometreler kullanılırken kompanzasyon hususları ortadan bırakılabilir.
- Uygulanabilirliği ölçmek için boyalar, özellikle olgunlaştıklarında MK'ler hakkında yanlış bilgi verebilir. MK'ler çok aktif alma hücreleridir ve Hoechst, 7-AAD veya PE ile pozitiflik her zaman gerçek hücre ölümünü yansıtmayabilir. Bir alternatif (hücre ölümü ölçümü gerekiyorsa) mitokondri lekelerinin (CMX Ros) veya amin reaktif boyalarının (Zombi veya Hayalet boyaları) kullanılması olabilir.
Tablo 1: Megakaryositik soyun hücre yüzeyi işaretleyicileri ile ilgili notlar Bu Tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Antikor panelleri Bu Tabloyu indirmek için lütfen tıklayınız.
4. Ploidy analizi 6 renkli panellerle birleştirildi
- Ploidy analizi için, 6 renkli bir antikor paneli ile birlikte, antikor paneli ile inkübasyondan sonra hücrelerin sabitlenmesi ve permeabilizasyonu ile devam edin. Bu strateji, yüzey işaretleyici lekelerinin korunmasına izin verirken, hücrelerin DNA'sının lekelenebilmesini sağlayacaktır. Mevcut menekşe 405-nm lazer ile görselleştirilebildiği için DNA'yı lekelemek için Hoechst 33342 kullanıyoruz.
- 105 -106 hücre için, antikor paneli ile inkübasyondan sonra, santrifüj hücreleri (5 dakika için 95 x g), 200 μL fiksasyon tamponunda yeniden depolayın ve oda sıcaklığında (RT) 10 dakika kuluçkalayın.
- Yukarıda belirtildiği gibi santrifüj hücreleri, 200 μL sabitleme tamponunda ikinci kez yeniden biriktirilir ve RT'de 10 dakika daha kuluçkaya yatırılabilir.
- %0,1 Triton X-100, 200 mg/mL RNaz ve 20 mg/mL Hoechst 33342 (permeabilizasyon Hoechst MIX) içeren permeabilizasyon tamponunu hazırlayın.
- Yukarıdaki gibi santrifüj hücreleri, permeabilizasyon Hoechst MIX'in 300 μL'sinde yeniden biriktirin ve 37 °C'de 30 dakika kuluçkaya yatırın. Bu adım çok önemlidir, çünkü temiz bir ploidy ölçümü elde etmek için RNA'nın bozulması gerekir.
- Kuluçka süresinden sonra, numuneleri doğrudan bir akış sitometresi ile ölçün. Aksi takdirde, numuneleri 4 °C'de, karanlıkta tutun. Bunları derhal ölçün. Ancak bu numuneler sabit olduğundan ölçüm 24-48 saat bile geciktirilebilir. Tek bir hücre süspansiyonu sağlamak için numunenin ölçümden önce iyice hareket ettirildiklerine veya bir hücre süzgecinden geçirildiklerine emin olun.
- hücre fiksasyonundan sonra İleri ve Yan Dağılım gibi morfometrik parametreler korunmaz. İleri/Yan Dağılım grafiği, sabitlemeden sonra hücre dağılımının büzüldüğünü gösterir. Bununla birlikte, yüzey işaretleyici lekeleme çoğunlukla korunur ve gating stratejisi zar zor değiştirilir ve yüzey işaretleyici kombinasyonları tarafından tanımlanan farklılaşma aşamalarında ploidy durumunun analizine izin verir.
5. MK farklılaşma analizi
NOT: CD31/CD71 kombinasyonunun MK farklılaşmanın farklı aşamalarına karşılık gelen bir dizi kapı ayarlamaya izin verdiğini gördük. MK'ya özgü işaretleyicilerle daha fazla geri geçiş, olgun ve olgunlaşmamış MK'lerin ayrılmasını sağlar. Ayrıca, taze örneklerde, kullanılan diğer belirteçlerin varlığını doğrulamak veya popülasyonları İleri/Yan Saçılma eksenlerine yerleştirmek için arka kapı, MK farklılaşma aşamalarının değerlendirilmesini iyileştirir ve aynı popülasyonlarda bulunabilecek diğer hücre türlerinin atılmasını sağlar.
- Erken öncü işaretleyiciler (KIT, CD34), ortak öncü işaretleyiciler (CD31, CD71) ve bazıları spesifik (CD42A/CD42B, CD49B, CD41/CD61, CLEC2, GPVI, vb.) içeren bir antikor paneli kullanın (bkz. Tablolar 1-2). Lineage (Lin) kokteylinin (CD3, CD14, CD16, CD19, CD20 ve CD56) kullanımı, analize gürültü ekleyebilecek olgun hematopoetik hücreleri "filtrelemeye" de izin verir (Lin- popülasyonu seçerken). Örnek olarak, PBMC'lerde, kemik iliğinde ve PBMC türevi hücre kültürlerinde MK'lerin analizini temsili sonuçlarda yapacağız.
6. MK ve MK öncü hücre sıralama
NOT: Lekeli hücreler, FACSDiva yazılımı kullanılarak 488-nm ve 633-nm standart katı hal lazerleri ile donatılmış floresanla etkinleştirilmiş bir hücre sıralayıcı facs Aria IIu üzerinde analiz edildi ve sıralandı; veriler ayrıca FlowJo yazılımı ve Cytobank (viSNE analizi) kullanılarak analiz edildi ve sunuldu. Sıralanmış fraksiyonların saflığı, sıralanmış fraksiyonların her birinin akış sitometri analizi ile doğrulandı (saflık% 85'in üzerinde).
- Hücre bozulmasını önlemek için hücre sıralamasını mümkün olan en kısa sürede veya antikor inkübasyonundan sonraki 1 saat içinde gerçekleştirin.
- Tek hücre süspansiyonunu ve büyük MK'nın bütünlüğünü sağlamak için numuneyi 100 μm hücre süzgeçle filtreleyin.
- 130-μm seramik nozulu, inç kare başına 11 pound (PSI) olarak ayarlanmış bir kılıfa basınca ve akışı damlalara bölmek için 12 kHz'e ayarlanmış damla sürücü frekansı kullanın.
- Sıralamadan önce, steril suda 1:5 seyreltilmiş Penisilin/ Streptomisin ile 30 dakikalık bir alım gerçekleştirerek nozül, kılıfta ve numune çizgilerini sterilize edin, ardından kalan dekontaminantları gidermek için steril su ile 10 dakikalık bir alım.
- Akış sabitlendikten sonra, saniyede 400-1200 olay akış hızında yansıyan düşüşlerin% 97,5'inden fazlasını ince ayar modunda sıralamak için damla gecikmesini önerilen boncuklarla ayarlayın.
- PBS'de %2 BSA'nın 500 μL'si ile toplama FACS tüpleri hazırlayın. BSA yüzdesi% 5-10'a kadar artırılabilir.
- Deneme şablonlarını uygun ücret matrisi parametreleriyle oluşturun.
- FACS tüpünü sitometreye yükleyin.
- Hedef hücre popülasyonlarının istenen kapılarını ve saflığını ayarlamak için numunenin ölçümünü gerçekleştirin. Hücre sıralama sırasında seçilen nüfus kapılarında 200.000'e kadar olayı göstermek için etkinleştirilen kaydı koruyun.
- FACS Aria IIu, aynı anda 4 farklı hücre popülasyonunun ayrılmasına izin verir. Yeni bir sıralama düzeni oluşturun ve toplama cihazını (4 tüp) ve uygun hassas modu seçin (ara saflık ve kurtarma maskesi önerilir). Son olarak, her sıralama konumu alanına ilgi alanlarını ekleyin (Şekil 3).

Şekil 3: Floresan ile aktive hücre sıralama (FACS) ilkesinin şematik gösterimi. Parçacıklar 130 μm-nozülden geçer ve nozüle titreşim uygulanması nedeniyle düzenli damlacık akışına ayrılmaya zorlanır. Daha sonra, damlacıklar lazer (analiz noktası) tarafından sorgulanır ve sinyaller bu damlacıklara bir yük uygulanarak ''sıralama kararı' vermek için işlenir. Bir yük damlası yüksek voltajlı bir elektrostatik alandan (algılama plakası) geçtiğinde, saptırılır ve ilgili toplama tüpüne toplanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Toplama tüplerini yükleyin ve hedef popülasyonları sıralamaya başlayın.
- Toplama tüplerini 95 x g'da 5 dakika santrifüjleyin ve hücre peletini PBS'de% 2 BSA'nın uygun hacminde yeniden dürtün.
- Saflığı hesaplamak için sıralanmış her örneğin bir kısmını yeniden ölçün.
- Hücreleri daha fazla kullanım için uygun şekilde depolayın. Sıralanmış hücreler sitolojik ve moleküler analizler için kullanılabilir veya seçilen bir hücre popülasyonunun farklılaşma sürecini incelemek amacıyla yeniden kültürlenebilir.
7. Sıra sonrası numune hazırlama
- Sitospinlerin sitosantrifüj ile sitolojik analize hazırlanması
- Sıralanmış hücreleri 100-200 μL'lik kullanımı kolay bir çalışma hacmine getirin. Hücre yoğunluğunun her durumda sıralanmış popülasyon verimine bağlı olacağını göz önünde bulundurun.
- Metal tutucuya temiz bir slayt yerleştirin ve bir filtre üst yerleştirin. Örneklerin karıştırılmasını önlemek için slaydı ve filtreyi etiketlemeyi unutmayın.
- Filtre deliğine slayda karşı 100 μL PBS ekleyin, böylece filtre delik kenarında nemlendirilir.
- Huniyi yerleştirin, metal tutucuyu kapatın ve santrifüjdeki yerine yerleştirin.
- Huninin içine numuneyi (100-200 μL) ekleyin.
- 5 dakika boyunca 36 x g'da santrifüjleyin. Sitospin slaytlarının RT'de havayla kurumasına izin verilebilir (tozu önlemek için uygun şekilde kaplanır) ve immünostainleme veya histokimyadan önce 1 hafta RT'de tutulabilir.
- İmmünasyon için
- Slaytları PBS'de seyreltilmiş %2 paraformaldehitte (PFA) sabitleyin ve 5 dakika boyunca kuluçkaya yatırın.
- PBS'de %0,5-4 PFA aralığı kullanılabilir. Elimizde, dokuların veya bazı hücre tiplerinin uygun şekilde sabitlenmesi için% 4 kullanıyoruz ve PBS'deki% 0.5 PFA trombositler için yeterlidir. Bu tekniği ayarlarken, DOĞRU PFA yüzdesi hücre türü/kaynağı başına iyileştirme gerektirir.
- PBS'de 5 dk kuluçkaya yaslanın.
- %50 etanolde (EtOH) 5 dk kuluçkaya yaslanın.
- %70 EtOH'da 5 dk kuluçkaya yaslanın.
- %70 EtOH'da -20ºC'de saklayın.
- İmmünasyon yaparken, yeniden sulandırma ve standart prosedürleri (permeabilizasyon, yıkama, blokaj, birincil ve ikincil antikor inkübasyonları, koruma vb.) uygulayın.
- Slaytları PBS'de seyreltilmiş %2 paraformaldehitte (PFA) sabitleyin ve 5 dakika boyunca kuluçkaya yatırın.
- Sitokimetri için:
NOT: Slaytlar May-Grünwald Giemsa boyama veya her amaç için uygun boyama ile boyanabilir. - Acil morfoloji incelemesi için
- Sitospin hücre içeren noktasına bir damla montaj ortamı ekleyin ve bir kapak parçası yerleştirin.
- Rt'de bile uzun süreli depolamaya izin veren sızdırmazlık olmadığı sürece slaytları bir haftadan uzun olmayan 4 °C'de tutun.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Kemik İliği ve Ploidy
Şekil 4'tehastalardan alınan BM örneklerinde (aspirasyon) megakaryopoezin temsili immünofenotiping analizini gösteriyoruz. Hücresel fraksiyonu CD71 ve CD31'e göre çizerken, altı ana popülasyonu eledik: CD31- CD71- (kırmızı), CD31- CD71+ (mavi), CD31+ CD71- (turuncu), CD31+ CD71orta (açık yeşil), CD31+ CD71+ ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Megakaryopoezisin akış sitometrisi ile incelenmesine odaklanan araştırmaların çoğu, bugüne kadar MK alt kümelerinin sadece soyunaözgü yüzey belirteçleri (cd42A/CD42B, CD41/CD61) kullanılarak tanımlanmasıyla sınırlıyken, daha önceki MK farklılaşma aşamaları kötü incelenmiştir. Bu makalede, insan megakaryopoezisinin kapsamlı bir akış sitometrisi nitelemesi ele almak için bir immünofenotipleme stratejisi gösteriyoruz. Genel olarak, megakaryopoezisin daha ayrıntılı bir şekilde in...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Görsel-işitsel malzeme üretimi BD Biosciences tarafından desteklenmiştir.
Teşekkürler
Teknik destek için Marcos Pérez Basterrechea, Lorena Rodríguez Lorenzo ve Begoña García Méndez (HUCA) ve Paloma Cerezo, Almudena Payero ve María de la Poveda-Colomo'ya (HCSC) teşekkür ederiz. Bu çalışma, RYC bursu olan A.B.'ye Tıbbi Hibeler (Roche SP200221001) tarafından kısmen desteklendi (RYC-2013-12587; Ministerio de Economía y Competitividad, İspanya) ve I+D 2017 hibesi (SAF2017-85489-P; Ministerio de Ciencia, Innovación y Universidades, İspanya ve Fondos FEDER) L.G.'ye, severo Ochoa Grant 'e (PA-20-PF-BP19-014; Consejería de Ciencia, Innovación y Universidades del Principado de Asturias, İspanya) p.M.-B. ve A.A.-H'ye intramural doktora sonrası hibe 2018 (Fundación para la Investigación y la Innovación Biosanitaria de Asturias - FINBA, Oviedo, İspanya). Reinier van der Linden'e bilgilerini (ve zamanını) paylaştığı için teşekkür ederiz, özellikle çok renkli etiketli antikor paneli karışımı ve tek renkli boncuk kontrolü hazırlığı hakkındaki bilge tavsiyeleri.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 130 micron Nozzle | BD | 643943 | required for MK sorting |
| 5810R Centrifuge | Eppendorf | Cell isolation and washes | |
| A-4-62 Swing Bucket Rotor | Eppendorf | Cell isolation and washes | |
| Aerospray Pro Hematology Slide Stainer / Cytocentrifuge | ELITech Group | Automatized cytology devise, where slides are stained with Mat-Grünwald Giemsa | |
| CO2 Incubator Galaxy 170 S | Eppendorf | Cell Incubation | |
| Cytospin 4 Cytocentrifuge | Thermo Scientific | To prepare cytospins | |
| FACSAria IIu sorter | BD | Lasers 488-nm and 633-nm | |
| FACSCanto II flow cytometer | BD | Lasers 488-nm , 633-nm and 405-nm | |
| Olympus Microscope BX 41 | Olympus | Microphotographs | |
| Olympus Microscope BX 61 | Olympus | Microphotographs | |
| Zoe Fluorescent Cell Imager | BioRad | Microphotographs | |
| To obtain PBMCs | |||
| Lipids Cholesterol Rich from adult bovine serum | Sigma-Aldrich | L4646 | or similar |
| Lymphoprep | Stem Cell Technologies | #07801 | or similar |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | or similar |
| Recombinant human Erythropoietin (EPO) | R&D Systems | 287-TC-500 | or similar |
| Recombinant human stem cell factor (SCF) | Thermo Fisher Scientific, Gibco™ | PHC2115 | or similar |
| Recombinant human thrombopoietin (TPO) | Thermo Fisher Scientific, Gibco™ | PHC9514 | or TPO receptor agonists |
| StemSpan SFEM | Stem Cell Technologies | #09650 | |
| Flow Cytometry Analyses | |||
| Bovine Serum Albumin | Merck | A7906-100G | or similar |
| BD CompBead Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD | 552843 | Antibodies for human cells are generally from mouse. |
| BD Cytofix/Cytoperm | BD | 554714 | or similar |
| BD FACS Accudrop Beads | BD | 345249 | |
| CD31 AF-647 | BD | 561654 | Mouse anti-human |
| CD31 FITC | Immunostep | 31F-100T | |
| CD34 FITC | BD | 555821 | Mouse anti-human |
| CD41 PE | BD | 555467 | Mouse anti-human |
| CD41 PerCP-Cy5.5 | BD | 333148 | Mouse anti-human |
| CD42A APC | Immunostep | 42AA-100T | We observed unspecific binding... that needs to be assessed |
| CD42A PE | BD | 558819 | Mouse anti-human |
| CD42B PerCP | Biolegend | 303910 | Mouse anti-human |
| CD49B PE | BD | 555669 | Mouse anti-human |
| CD61 FITC | BD | 555753 | Mouse anti-human |
| CD71 APC-Cy7 | Biolegend | 334109 | Mouse anti-human |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Human BD Fc Block | BD | 564219 | Fc blocking - control |
| KIT PE-Cy7 | Biolegend | 313212 | Mouse anti-human |
| Lineage Cocktail 2 FITC | BD | 643397 | Mouse anti-human |
| RNAse | Merck | R6513 | or similar |
| Triton X-500 | Merck | 93443-500ML | or similar |
| Cell strainers for sorting | |||
| CellTrics Filters 100 micrometers | Sysmex | 04-004-2328 | Cell strainers |
| Note: we do not specify general reagents/chemicals (PBS, EDTA, etc) or disposables (tubes, etc), or reagents specified in previous published and standard protocols - unless otherwise specified. |
Referanslar
- Italiano, J. E. Unraveling Mechanisms That Control Platelet Production. Semin Thrombosis And Haemostasis. 39 (1), 15-24 (2013).
- Machlus, K. R., Italiano, J. E. The Incredible Journey: From Megakaryocyte Development To Platelet Formation. Journal Of Cell Biology. 201 (6), 785-796 (2013).
- Eckly, A., et al. Biogenesis Of The Demarcation Membrane System (DMS) In Megakaryocytes. Blood. 123 (6), 921-930 (2014).
- Couldwell, G., Machlus, K. R. Modulation Of Megakaryopoiesis And Platelet Production During Inflammation. Thrombosis Research. 179, 114-120 (2019).
- Kosaki, G. In Vivo Platelet Production From Mature Megakaryocytes: Does Platelet Release Occur Via Proplatelets. International Journal Of Hematology. 81 (3), 208-219 (2005).
- Lefrancais, E., Looney, M. R. Platelet Biogenesis In The Lung Circulation. Physiology (Bethesda). 34 (6), 392-401 (2019).
- Nieswandt, B., Stritt, S. Megakaryocyte Rupture For Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 327-328 (2015).
- Nishimura, S., et al. IL-1alpha Induces Thrombopoiesis Through Megakaryocyte Rupture In Response To Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 453-466 (2015).
- Sanjuan-Pla, A., et al. Platelet-Biased Stem Cells Reside At The Apex Of The Haematopoietic Stem-Cell Hierarchy. Nature. 502 (7470), 232-236 (2013).
- Notta, F., et al. Distinct Routes Of Lineage Development Reshape The Human Blood Hierarchy Across Ontogeny. Science. 351 (6269), 2116(2016).
- Yamamoto, R., et al. Clonal Analysis Unveils Self-Renewing Lineage-Restricted Progenitors Generated Directly From Hematopoietic Stem Cells. Cell. 154 (5), 1112-1126 (2013).
- Wang, H., et al. Decoding Human Megakaryocyte Development. Cell Stem Cell. , (2020).
- Meinders, M., et al. Repercussion Of Megakaryocyte-Specific Gata1 Loss On Megakaryopoiesis And The Hematopoietic Precursor Compartment. Plos One. 11 (5), 0154342(2016).
- Meinders, M., et al. Sp1/Sp3 Transcription Factors Regulate Hallmarks Of Megakaryocyte Maturation And Platelet Formation And Function. Blood. 125 (12), 1957-1967 (2015).
- Salunkhe, V. P., Gutiérrez, L. Culture Of Megakaryocytes From Human Peripheral Blood Mononuclear Cells. Bio-Protocol. 5 (21), 1639(2015).
- Choudry, F. A., et al. Transcriptional Characterization Of Human Megakaryocyte Polyploidization And Lineage Commitment. Journal Of Thrombosis And Haemostasis. , 15271(2021).
- Heazlewood, S. Y., Williams, B., Storan, M. J., Nilsson, S. K. The Prospective Isolation Of Viable, High Ploidy Megakaryocytes From Adult Murine Bone Marrow By Fluorescence Activated Cell Sorting. Methods In Molecular Biology. 1035, 121-133 (2013).
- Tomer, A., Harker, L. A., Burstein, S. A. Purification Of Human Megakaryocytes By Fluorescence-Activated Cell Sorting. Blood. 70 (6), 1735-1742 (1987).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. On The Quest For In Vitro Platelet Production By Re-Tailoring The Concepts Of Megakaryocyte Differentiation. Medicina. 56 (12), Kaunas. (2020).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. In Vitro Platelet Production For Transfusion Purposes: Where Are We Now. Transfusion And Apheresis Science. 59 (4), 102864(2020).
- Butov, K. R., et al. In Vitro Megakaryocyte Culture From Human Bone Marrow Aspirates As A Research And Diagnostic Tool. Platelets. , 1-8 (2020).
- Di Buduo, C. A., et al. A Gold Standard Protocol For Human Megakaryocyte Culture Based On The Analysis Of 1,500 Umbilical Cord Blood Samples. Thrombosis And Haemostasis. , (2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır