A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אימונופנוטיפינג ומיון תאים של חברי כנסת אנושיים ממקורות ראשוניים אנושיים או מובחנים במבחנה מאבות ההמטופיאטיים
In This Article
Summary
כאן, אנו מציגים אסטרטגיית אימונופנוטיפינג לאפיון של בידול מגה-קריוציטים, ומראים כיצד אסטרטגיה זו מאפשרת מיון של מגה-קריוציטים בשלבים שונים באמצעות סדרן תאים המופעל על-ידי פלואורסצנטיות. המתודולוגיה יכולה להיות מיושמת על רקמות ראשוניות אנושיות, אלא גם על מגה-קריוציטים הנוצרים בתרבות במבחנה.
Abstract
התמיינות Megakaryocyte (MK) כוללת מספר מחזורים אנדומיטוטיים שתוצאתם פוליפלואידית מאוד (להגיע אפילו >64N) ותא גדול מאוד (40-60 מיקרומטר). בניגוד לידע הגדל במהירות במגה-קריופוסיס ברמה הביולוגית של התא וברמה המולקולרית, אפיון המגה-קריופוסיס על ידי ציטומטריית זרימה מוגבל לזיהוי חברי כנסת בוגרים באמצעות סמני פני שטח ספציפיים לשושלת, בעוד שלבי הבידול הח"כים המוקדמים עדיין לא נחקרו. כאן אנו מציגים אסטרטגיית אימונופנוטיפינג המאפשרת זיהוי שלבי בידול ח"כים עוקבים, עם מעמד של פלוידיה גוברת, במקורות ראשוניים אנושיים או בתרבויות במבחנה עם פאנל המשלב סמני שטח ספציפיים ולא ספציפיים של ח"כים. למרות גודלו ושבריריותו, חברי הכנסת יכולים להיות אימונופנוטיים באמצעות הפאנל הנ"ל ומועשרים על ידי מיון תאים המופעל על ידי פלואורסצנטיות בתנאים מסוימים של לחץ וקוטר זרבובית. גישה זו מקלה על מחקרים רב-אומיקים, במטרה להבין טוב יותר את המורכבות של מגה-קריופוזיס וייצור טסיות טיס פנים בבני אדם. אפיון טוב יותר של megakaryopoiesis עשוי להוות יסוד באבחון או פרוגנוזה של פתולוגיות הקשורות לשושלת וממאירות.
Introduction
Megakaryocytes (חברי כנסת) לפתח מתאי גזע hematopoietic (HSCs) בעקבות תהליך מורכב בשם megakaryopoiesis, אשר מתוזמר בעיקר על ידי ההורמון תרומבופויאטין (TPO). התפיסה הקלאסית של megakaryopoiesis מתארת את המסע התאי מ- HSCs דרך רצף של שלבים היררכיים של אבות מחויבים ותאי קודמן, המוביל בסופו של דבר לח"כ בוגר. במהלך ההבשלה, חברי הכנסת חווים סבבים מרובים של אנדומיטוזיס, מפתחים מערכת קרום תיחום תאית מורכבת (DMS), המספקת מספיק משטח ממברנה לייצור טסיות דם, ומייצרים ביעילות ואורזים את שפע הגורמים הכלולים בגרגרים השונים שירשו טסיות הדם הבוגרות1,2,3. כתוצאה מכך, חברי כנסת בוגרים הם תאים גדולים (40-60 מיקרומטר) המאופיינים בגרעין פוליפלואידי מאוד (המגיע אפילו >64N). מחקרים שנעשו לאחרונה מצביעים על דרכים חלופיות שבהן HSCs מבדילים בין חברי כנסת העוקפים את מחסומי המחויבות המסורתיים לשושלת בתגובה לתנאים פיזיו-פתולוגיים מסוימים4,5,6,7,8,9,10,11. ממצאים אלה מדגישים כי ההבחנה ההמטופובית כלפי הח"כ הבוגר היא רצף ותהליך הסתגלותי הנותן מענה לצרכים ביולוגיים.
עם הידע הגובר על ביולוגיה של התא וההיבטים המולקולריים המאפיינים את megakaryopoiesis12, רוב המחקר המוקדש לחקר התהליך על ידי cytometry זרימה מוגבלים לזיהוי של חברי כנסת בוגרים באמצעות סמני פני השטח ספציפיים לשושלת (כלומר, CD42A / B, CD41 / CD61), בעוד שלבי בידול ח"כים מוקדמים יותר נותרו לא נחקרו. תיעדנו בעבר אסטרטגיה לביים megakaryopoiesis במח עצם העכבר ומח העצם נגזר תרבויות MK13,14, אשר הסתגלנו והחלנו על בני אדם15. במאמר הנוכחי אנו מראים אסטרטגיית אימונופנוטיפינג המאפשרת אפיון של מגה-קרויף, מ- HSCs לחברי כנסת בוגרים, במקורות ראשוניים אנושיים (מח עצם - BM - ודם היקפי - PB-) או בתרבויות במבחנה באמצעות פאנל המשלב סמני משטח ספציפיים ולא ספציפיים של MK (CD61, CD42B, CD49B, CD31, KIT ו- CD71, בין היתר). למרות גודלו הגדול ושבריריותו, חברי הכנסת יכולים להיות אימונופנוטיים באמצעות סמני פני התא הנ"ל ומועשרים על ידי מיון תאים המופעל על ידי פלואורסצנטיות בתנאים מסוימים של לחץ וקוטר זרבובית כדי למזער את קרע התא ו /או נזק. טכניקה זו מקלה על גישות multi-Omics, במטרה להבין טוב יותר את המורכבות של megakaryopoiesis וייצור טסיות דם בבריאות האדם ומחלות. ראוי לציין, זה יהיה להוות כלי שימושי כדי לסייע אבחון ופרוגנוזה בהקשר קליני של ביקוש גובר.
בכתב יד זה אנו מתעדים אסטרטגיה לביים מגה-קריופוסיס אנושי עם פאנל המשלב סמני שטח ספציפיים ל- MK ולא ספציפיים ממקורות ראשוניים או שנוצרו במבחנה. בנוסף, אנו מספקים פרוטוקול למיון, עם סדרן תאים המופעל על ידי פלואורסצנטיות, השברים המועדפים וחברי הכנסת הבוגרים (איור 1). צעד זה אינו פופולרי, שכן מבחינה טכנית הוא קשה בשל גודלם הגדול ושבריריותם של חברי הכנסת. עם זאת, הוא הועסק הן בדגימות עכבר ומח עצם אנושי בעבר, והן בשל התקדמות טכנולוגית, עם תוצאה טובה יותר בכל פעם16,17,18. מקורות עיקריים אנושיים שבהם ניתן ללמוד חברי כנסת או ח"כים כוללים בין היתר מח עצם, דם טבורי ודם היקפי. העיבוד המדגם הנכון כדי לבודד את שבר התא הרלוונטי לניתוח על כל מדגם הוא בעל חשיבות. נהלים סטנדרטיים משולבים, עם כמה שיקולים לקחת בחשבון כאשר מכוונים לחקר megakaryopoiesis.
Protocol
דגימות שלמות של דם ומח עצם התקבלו וטופלו בהתאם להצהרת הלסינקי משנת 1964. דגימות דם שלמות התקבלו מתורמים בריאים לאחר מתן הסכמה מדעת (ISPA), במסגרת מחקר שאושר על ידי ועדת האתיקה הרפואית המוסדית שלנו (בית החולים יוניברסיטריו סנטרל דה אסטוריאס -HUCA-). דגימות מח עצם התקבלו מח עצם לשאוף להשליך חומר של חולים המנוהלים על המחלקה להמטולוגיה של בית החולים Clínico סן קרלוס (HCSC).
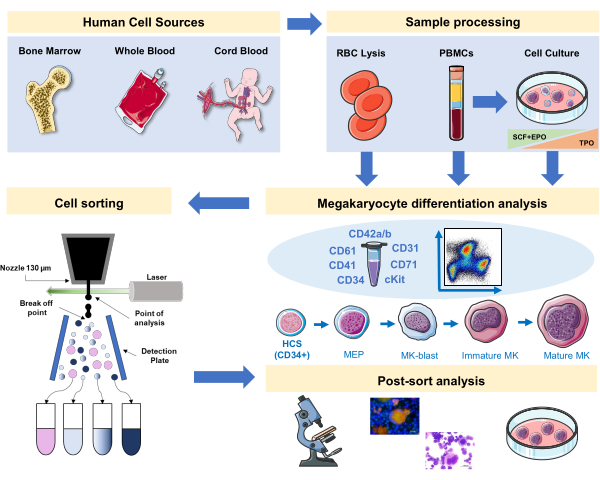
איור 1: ייצוג סכמטי של הפרוטוקול המתועד בכתב יד זה. המקורות האנושיים העיקריים או תרבויות ראשוניות שבהן ניתן לביים את הבידול של ח"כים באמצעות אימונופנוטיפינג מסומנים. אסטרטגיה אימונופנוטיפינג זו יכולה להיות מיושמת על חקר התהליך בפתולוגיות שונות הקשורות לשושלת או ממאירות במקורות ראשוניים. בנוסף, היא מאפשרת מיון תאים של חברי כנסת ומבשרים באמצעות סדרן תאים המופעל על ידי פלואורסצנטיות, המאפשר ניתוח נוסף של שברים מועשרים. תמונות המשמשות הן חלק מאמנות Servier Medical Art (SMART) של Servier ומורשה תחת CC BY 3.0. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
1. עיבוד מח דם ועצמות שלם לפני אימונופנוטיפינג
- בעת שימוש בדם שלם (WB) מתרומות כמקור עיקרי, באופן אופציונלי לבודד את המרכיב תא מונונוקולרי דם היקפי (PBMC). זה יכול להיות מושגת באמצעות צנטריפוגה דיפרנציאלית סטנדרטית בשילוב עם הפרדת תאים הדרגתית צפיפות, כפי שתואר קודם לכן15.
- בקצרה, דם צנטריפוגה ב 193 x g במשך 15 דקות (בלם 3) בטמפרטורת החדר. השלך את שבר הפלזמה העליון ולאסוף את טבעת באפי. לדלל 1:1 עם מלוחים חיץ פוספט (PBS)/טריסודיום ציטראט דיהידראט (38 g/L, pH 7) מאגר פיפטה בזהירות נפח של 25 מ"ל על גבי 15 מ"ל של פתרון הדרגתי צפיפות (1.076 g/mL) ב 50 צינורות mL.
- צנטריפוגה במשך 20 דקות ב 1114 x גרם (מאיץ 3, בלם 3, טמפרטורת החדר). השלך את שבר הפלזמה ולאסוף את טבעת באפי המכילה PBMCs. לשטוף על ידי הוספת נפח זהה של PBS, צנטריפוגה ב 435 x g במשך 5 דקות, ו resuspend ב- PBS לשימוש נוסף.
- לחלופין, השתמש מדגם WB (סביב 100 μL) עבור immunophenotyping לאחר lysing את כדוריות הדם האדומות (RBCs) ושטיפה יסודית.
- בקצרה, לדלל 1:1 במאגר קרח קר RBC lysing (4.15 גרם של NH4Cl, 0.5 גרם של KHCO3 ו 18.5 מ"ג של EDTA (טריפלקס III) כדי 500 מ"ל של H2O, pH 7.1-7.4). המתן עד שהשעיית התא תהפוך לאדום שקוף (3-5 דקות).
- צנטריפוגה ב 435 x g במשך 5 דקות, ב 4 מעלות צלזיוס, ו resuspend התאים PBS. חזור על ההליך פעמים רבות ככל הנדרש כדי לקבל גלולה תא לבן.
- באופן דומה, לעבד ישירות את הדגימות המתקבלות ממח העצם (שאיפה) עם חיץ lysing RBC (ראה נקודה 1.2) ושטיפה יסודית, כמו להתחיל עם השעיה ברורה של תא יחיד (איור 1).
- הימנעו משימוש במערבולת כדי לערבב דגימות במהלך העיבוד, שכן הדבר עלול לפגוע בחברי הכנסת השבירים.
הערה: מעבר צבע של צפיפות להשגת מחשבי PCBM עלול לגרום לשבר תא עשיר ונקי יותר בהשוואה ל- WB בעל תווי RBC. עם זאת, יש לזכור כי חברי כנסת בוגרים בצפיפות גבוהה עלולים ללכת לאיבוד בשבר ה"נויטרופילים". זה יידונו בתוצאות הייצוגיות.
- הימנעו משימוש במערבולת כדי לערבב דגימות במהלך העיבוד, שכן הדבר עלול לפגוע בחברי הכנסת השבירים.
2. בידול MK במבחנה ממחשבי PC
הערה: ניתן להבדיל בין חברי כנסת במבחנה לבין סימנים מקדימים קודמים, כגון CD34+ תאים, הקיימים במקורות ראשוניים שונים(כלומר, WB/PBMCs, דם טבורי, מח עצם) ומ- iPSCs. קיימים פרוטוקולים שונים שהוחלו על מטרה זו. כאן, אנו משתמשים בשיטת תרבות שפותחה על ידינו המאפשרת בידול MK ממחשבים אישיים, ללא צורך בהעשרה עבור CD34+ סימנים מקדימים15,19,20,21,22.
- פרוטוקול זה מורכב משלושה שלבי תרבות, שבהם ריכוז הטרומבופויאטין (TPO) גדל בהדרגה על חשבון גורמי גדילה המעדיפים את התפשטותם של סימנים מקדימים קודמים (כלומר,SCF, EPO), אשר יורדים בהדרגה (איור 2)15.
- למדיום הבסיס, השתמש StemSpan SFEM בתוספת 0.4% של תערובת השומנים עשירים בכולסטרול ו 1% פניצילין/סטרפטומיצין.
- למדיום שלב I, השתמש באמצעי הבסיס בתוספת SCF (100 ng/mL), אריתרופויאטין (EPO, 0.5 U/mL) וטרומבופיאטין (TPO, 30 ng/mL). המדיום שלב II הוא אמצעי הבסיס בתוספת SCF (50 ng/mL), EPO (0.25 U/mL) ו- TPO (50 ng/mL). למדיום שלב III, השתמש באמצעי הבסיס בתוספת TPO (100 ng/mL).
- מחשבי תרבות במדיום שלב I. ביום 6-8, מקם את המחשבים האישיים באמצעי שלב II וביום 9-12 מקם את המחשבים האישיים באמצעי שלב III.
- החלף בינוני על ידי תאים צנטריפוגה ב 435 x g במשך 5 דקות בטמפרטורת החדר משלב I לשלב II, ו ב 95 x g במשך 5 דקות בטמפרטורת החדר משלב II לשלב III, ו resuspending אותם במדיום טרי.
- תאי תרבות באינקובטור ב 37 °C (69 °F), 5% CO2. בתרבויות הפריימריז הללו, הבידול בין ח"כים נמשך 10-14 ימים, וניתן לצייר דגימות בנקודות זמן שונות לאורך כל תקופת התרבות, בהתאם לבידול הח"כים.
- למדיום הבסיס, השתמש StemSpan SFEM בתוספת 0.4% של תערובת השומנים עשירים בכולסטרול ו 1% פניצילין/סטרפטומיצין.
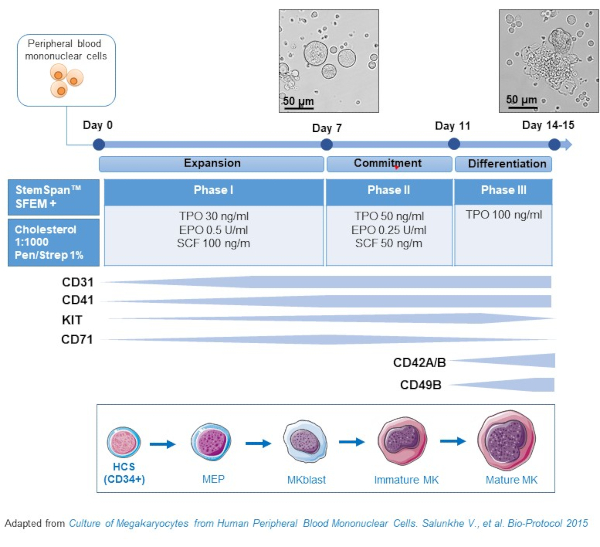
איור 2: ייצוג סכמטי של שיטת התרבות MK הנגזרת מ- PBMC. מחשבים אישיים מתורמים בריאים היו מתורבתים על פי הפרוטוקול התלת פאזי שפותח על ידינו כדי ליצור MK במבחנה (תוכנית המותאמת מ Salunkhe ואח '). 15 תמונות שצולמו ביום 10 וביום 13 של תרבות מוצגות. תמונות נלקחות עם מטרה 20X. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- אוסף לדוגמה: לשטוף תאים על ידי החלת צנטריפוגה במהירות נמוכה במשך 5 דקות (95 x g) ולהזרים אותם מחדש PBS או PBS המכיל 1% של אלבומין סרום שור (BSA). עבור אימונופנוטיפינג, הצפיפות האידיאלית היא 105-106 תאים / 100 μL (ראה נקודה 3.1). בהתאם למצב של התרבויות(כלומר, נוכחות של תאים מתים, פסולת, וכו '), 1 או 2 שטיפות עשוי להיות נחוץ. לאסוף את התאים שלך בנקודות הזמן של עניין במהלך התרבות.
3. אימונופנוטיפינג של בידול MK - דגירה עם פאנל של נוגדנים מתויגים
- דגירה דגימות התא עם פאנל של מתויגים-נוגדנים בעקבות נהלים סטנדרטיים, לשים לב צנטריפוגה במהירות נמוכה (95 x g) בעת עיבוד megakaryocytes. אנחנו בדרך כלל דגירה את הדגימות עם 1% BSA ב PBS בכמויות של 100 μL ב 4 מעלות צלזיוס, 20 דקות, עם טווח של 105-106 תאים.
- התאם את קנה המידה בעת הצורך.
- לאחר הדגירה, להוסיף 5 מ"ל של 1% BSA ב PBS, צנטריפוגה במהירות נמוכה (95 x g), לשאוף את supernatant ולהשתעלות מחדש את המדגם ב 2% BSA ב PBS כדי לשמר את הכדאיות MK (2 מ"ל). הוסף EDTA 1-5 mM כדי לשבש אגרגטים תאים (אשר נראים באופן טבעי בתרבויות MK).
- העבר דגימות לתוך צינור תחתון עגול 12 x 75 מ"מ (צינור FACS) או צלחת, שמירה אותם בחושך עד ניתוח cytometry זרימה או מיון תאים.
- הכנת הנוגדנים הבודדים ותערובות לוח הנוגדנים; הגדרת ציטומטר הזרימה:
- טיטר את הנוגדנים לפני השימוש בהם כדי לקבוע את הריכוז האופטימלי בלוחות הנוגדנים. הריכוז האופטימלי של נוגדנים הוא הריכוז הנמוך ביותר המפריד בין חיובי בבירור לתאים שליליים (ומאפשר הבחנה של רמות ביניים של ביטוי). לדוגמה, רוב הנוגדנים משמשים בדילול 1:200 (מלאי 100 מיקרוגרם / מ"ל) אלא אם כן צוין אחרת על ידי היצרן.
- לאחר שנקבעה טיטרציה הנוגדן, להכין דילול 10x של כל נוגדן. דילולים אלה משמשים לפקדים בצבע יחיד ולהכנת תערובות החלונית. הדילולים ותערובות החלונית הם בסדר לשימוש גם חודש לאחר ההכנה (מאוחסן ב 4 מעלות צלזיוס, אלא אם כן אינדיקציות היצרן למנוע תנאי אחסון אלה). זה מאפשר כתמים של דגימות עם אותו פאנל לאורך פרק זמן.
- השתמש 10 μL לכל 100 μL של דילול 10x הן עבור פקדים בצבע יחיד והן עבור תערובת הלוח.
- עבור פקדים בצבע יחיד, להשתמש חרוזי זיקה נוגדנים, אשר ניתן למדוד ישירות לאחר הוספת הנוגדן. יש למדוד את הפקדים בצבע יחיד בכל ניסוי, כדי לאפשר התאמת פיצוי נאותה (וכוונון עדין לאחר המדידה עם תוכנת הניתוח).
- לחלופין, בצע את הפקדים בצבע יחיד באמצעות דוגמאות תאים. עם זאת, החרוזים מאפשרים מדידה מהירה של מספר נתון של אירועים, אשר, בהתאם לסמן הנוגדן / פני השטח, לא ניתן להשיג על מקורות תאים ראשוניים או תרבותיים מורכבים. כמו כן, אנו ממליצים להפעיל דגימות תאים מוכתמות "פלואורסצנטיות מינוס אחד" (FMO) לוח מתערבב כדי להגדיר את הגדרות הפיצוי המתאימות (לפני הפעלת ניסויים). זה רלוונטי כדי לזהות בקפידה בעיות פיצוי, ובמיוחד, בחברי כנסת תרבותיים, כדי לזהות הפרעות שפעת אוטומטית (אשר יהיה נוכח אם באמצעות מדיום תרבות המכיל פנול אדום).
- הכינו מספיק נפח של תערובת הפאנלים, בהתאם למספר הדגימות, המכילות את הנוגדנים של הפאנל המתוכנן. רוב הלוחות שלנו כוללים שישה נוגדנים (לוחות 6 צבעים, ראה שולחנות 1-2).
- עבור לוחות אלה, להשתמש 488 ננומטר ו 633 ננומטר לייזרים של cytometer זרימה, עם זאת, לוחות ניתן להתאים תרחישים טכניים אחרים. יתר על כן, שיקולי הפיצוי ניתן לייתר בעת שימוש cytometry זרימה מבוססת ספקטרומטריה המונית או ציטומטרים עם טכנולוגיית מיקוד אקוסטית.
- צבעים למדידת כדאיות עשויים למסור מידע כוזב לגבי חברי הכנסת, במיוחד כאשר הם מתבגרים. חברי הכנסת הם תאים פעילים מאוד, וחיוביות עם הוכסט, 7-AAD או PE, לא תמיד משקפת מוות תאי בפועל. חלופה (אם נדרשת מדידת מוות של תאים) עשויה להיות שימוש בכתמי מיטוכונדריה (CMX Ros) או צבעים תגובתיים של אמין (צבעי זומבי או רוח רפאים).
טבלה 1: הערות על סמני פני התא של שושלת המגה-קריוציטי אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: לוחות נוגדנים אנא לחץ כאן כדי להוריד טבלה זו.
4. ניתוח Ploidy בשילוב עם לוחות 6 צבעים
- לניתוח ploidy, בשילוב עם פאנל נוגדנים 6 צבעים, להמשיך עם קיבוע וחמלה של תאים לאחר הדגירה עם פאנל הנוגדנים. אסטרטגיה זו תאפשר שימור של כתמי סמן פני השטח, תוך מתן הכתמת ה- DNA של התאים. אנו משתמשים Hoechst 33342 כדי להכתים DNA, כפי שניתן לדמיין עם לייזר סגול זמין 405 ננומטר.
- עבור 105-106 תאים, לאחר הדגירה עם לוח הנוגדנים, תאי צנטריפוגה (95 x g במשך 5 דקות), resuspend ב 200 μL של מאגר קיבוע דגירה 10 דקות בטמפרטורת החדר (RT).
- תאי צנטריפוגה כפי שצוין לעיל, resuspended בפעם השנייה ב 200 מאגר קיבוע μL, ולהדגיר עוד 10 דקות ב RT.
- הכן מאגר חדירות, המכיל 0.1% טריטון X-100, 200 מ"ג / מ"ל RNase ו 20 מ"ג / מ"ל Hoechst 33342 (ניקוב Hoechst MIX).
- תאים צנטריפוגה כאמור לעיל, resuspend אותם ב 300 μL של פרמביליזציה Hoechst MIX ואת הדגירה 30 דקות ב 37 °C (69 °F). שלב זה חשוב מאוד, שכן, על מנת לקבל מדידה ploidy נקי, RNA יש להשפיל.
- לאחר זמן הדגירה, למדוד דגימות ישירות עם ציטומטר זרימה. אחרת, לשמור את הדגימות ב 4 מעלות צלזיוס, בחושך. למדוד אותם מיד. עם זאת, מאז דגימות אלה קבועים, המדידה יכולה להתעכב אפילו 24-48 שעות. ודא שהדגימה מצליפה ביסודיות לפני המדידה, או מועברת דרך מסננת תאים, כדי להבטיח השעיה של תא בודד.
- פרמטרים מורפומטריים כגון פיזור קדימה וצד אינם נשמרים לאחר קיבוע תאים. ההתוויה פיזור קדימה/צדדי תציג התכווצות של התפלגות התאים לאחר הקיבעון. עם זאת, כתמי סמן פני השטח נשמרים ברובם, ואסטרטגיית הגטינג בקושי משתנה, ומאפשרת ניתוח של מצב הפלוידיה בשלבים השונים של הבידול המוגדרים על ידי שילובי סמן פני השטח.
5. ניתוח בידול ח"כים
הערה: ראינו כי השילוב של CD31/CD71 מאפשר להגדיר מספר שערים התואמים לשלבים שונים של בידול MK. חזרה נוספת עם סמנים ספציפיים לח"כים מאפשרת הפרדה בין חברי כנסת בוגרים ולא בוגרים. יתר על כן, בדגימות טריות, back-gating כדי לאמת את נוכחותם של סמנים אחרים בשימוש, או למקם את האוכלוסיות בצירים פיזור קדימה / צד, מזקק את ההערכה של שלבי בידול MK ומאפשר להשליך סוגי תאים אחרים שיכולים להיות נוכחים על אותן אוכלוסיות.
- השתמש בפאנל של נוגדנים הכולל סמני הקדמה מוקדמים (KIT, CD34), סמני קודמן נפוצים (CD31, CD71) וסמני שושלת, חלקם ספציפיים (CD42A/CD42B, CD49B, CD41/CD61, CLEC2, GPVI וכו ') (ראה טבלאות 1-2). השימוש בקוקטייל שושלת (Lin) (CD3, CD14, CD16, CD19, CD20 ו- CD56), מאפשר גם "לסנן" תאים hematopoietic בוגרים שעשויים להוסיף רעש לניתוח (בעת בחירת לין- אוכלוסייה). כדוגמה, נעבור על ניתוח של חברי כנסת במחשבים אישיים, במח עצם ובאמצעות תרביות תאים שמקורן ב- PBMC בתוצאות הייצוגיות.
6. מיון תאים מקדים של ח"כים וח"כים
הערה: התאים המוכתמים נותחו וממוינים על סדרן תאים המופעל על ידי פלואורסצנטיות FACS Aria IIu המצויד בלייזרים 488 ננומטר ו- 633 ננומטר סטנדרטיים במצב מוצק באמצעות תוכנת FACSDiva; הנתונים נותחו והוצגו בנוסף באמצעות תוכנת FlowJo ו- Cytobank (ניתוח viSNE). טוהר של שברים ממוינים אושר על ידי ניתוח cytometry זרימה של כל אחד מהשברים ממוינים (טוהר מעל 85%).
- בצע מיון תאים בהקדם האפשרי או תוך שעה לאחר הדגירה נוגדן על מנת למנוע הידרדרות התא.
- סנן את המדגם עם מסננת תאים 100 מיקרומטר כדי להבטיח השעיית תא יחיד ואת השלמות של MK גדול.
- השתמש זרבובית קרמיקה 130-μm, לחץ נדן מוגדר 11 פאונד לאינץ ' מרובע (PSI) ותדר כונן טיפה להגדיר 12 kHz כדי לשבור את הזרם לתוך טיפות.
- לפני המיון, לעקר את הזרבובית, נדן, ואת הקווים מדגם על ידי ביצוע רכישה 30 דקות עם פניצילין / סטרפטומיצין מדולל 1:5 במים סטריליים, ואחריו רכישה 10 דקות עם מים סטריליים כדי להסיר decontaminant הנותרים.
- לאחר שהזרם התייצב, התאם את השהיית הירידה עם חרוזים מומלצים כדי למיין במצב כוונון עדין יותר מ-97.5% מהירידות המשתקפות בקצב זרימה של 400-1200 אירועים לשנייה.
- הכינו צינורות FACS איסוף עם 500 μL של 2% BSA ב- PBS. אחוז BSA ניתן להגדיל עד 5-10%.
- צור את תבנית הניסוי עם הפרמטרים המתאימים של מטריצת הפיצוי.
- טען שפופרת FACS לסיטומטר.
- בצע מדידה של המדגם כדי להגדיר את השערים הרצויים ואת הטוהר של אוכלוסיות תאי היעד. שמור את הרשומה מופעלת כדי להציג עד 200,000 אירועים בשערי האוכלוסייה שנבחרו במהלך מיון התאים.
- FACS אריה IIu מאפשר הפרדה של עד 4 אוכלוסיות תאים שונות בו זמנית. צור פריסת מיון חדשה ובחר את התקן האיסוף (4 צינורות) ואת מצב הדיוק המתאים (מומלץ להשתמש במסיכת ביניים של טוהר ושחזור). לבסוף, הוסף את האוכלוסיה המעניינת לכל שדה מיקום מיון (איור 3).

איור 3: ייצוג סכמטי של עקרון מיון התאים המופעל על-ידי פלואורסצנטיות (FACS). החלקיקים עוברים את זרבובית 130 מיקרומטר ונאלצים להתפרק לזרם של טיפות רגילות עקב יישום של רטט לחרבובית. לאחר מכן, הטיפות נחקרות על ידי הלייזר (נקודת ניתוח) והאותות מעובדים כדי לתת את 'החלטת המיון' על ידי החלת חיוב על טיפות אלה. כאשר טיפת טעינה עוברת דרך שדה אלקטרוסטטי במתח גבוה (לוח זיהוי), היא מוטה ונאספת לתוך צינור האיסוף המתאים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- טען את צינורות האיסוף והתחל למיין את אוכלוסיות היעד.
- צנטריפוגה צינורות האיסוף במשך 5 דקות ב 95 x g ו resuspend גלולת התא בנפח המתאים של 2% BSA ב PBS.
- למדוד שוב שבריר של כל מדגם ממוין, כדי לחשב את הטוהר.
- אחסן תאים כראוי לשימוש נוסף. תאים ממוינים יכולים לשמש לניתוחים ציטולוגיים ומולקולריים, או להיות מתורבתים מחדש במטרה לחקור את תהליך הבידול של אוכלוסיית תאים נבחרת.
7. הכנה לדוגמה לאחר המיון
- הכנת ציטוספין לניתוח ציטולוגי עם ציטוצנטריפוגה
- הבא תאים ממוינים לנפח עבודה קל לטיפול של 100-200 μL. קח בחשבון כי צפיפות התא יהיה תלוי בתפוקת האוכלוסייה ממוינת בכל מקרה.
- הנח שקופית נקייה על מחזיק המתכת והנח מסנן עליון. זכור להוסיף תווית לשקופית ולמסנן כדי להימנע מערבוב דוגמאות.
- הוסף PBS של 100 μL על חור המסנן מול השקופית, כך שהמסנן מקבל לחות על שפת החור.
- מניחים את המשפך, סוגרים את מחזיק המתכת ומניחים אותו במקומו בצנטריפוגה.
- הוסף את המדגם (100-200 μL) בתוך המשפך.
- צנטריפוגה ב 36 x g במשך 5 דקות. שקופיות ציטוספין ניתן לאפשר אוויר יבש ב RT (מכוסה כראוי כדי למנוע אבק) והוא יכול להישמר ב RT במשך 1 שבוע לפני immunostaining או היסטוכימיה.
- לחיסון
- לתקן שקופיות ב 2% paraformaldehyde (PFA) מדולל PBS ודגרת במהלך 5min.
- ניתן להשתמש בטווח של 0.5-4% PFA ב- PBS. בידיים שלנו, אנו משתמשים 4% כדי להשיג קיבוע נאות של רקמות או כמה סוגי תאים, ו 0.5% PFA ב PBS מספיק טסיות טיס. בעת הגדרת טכניקה זו, האחוז הנכון של PFA דורש מיטוב לכל סוג תא/מקור.
- דגירה 5 דקות ב- PBS.
- דגירה 5 דקות ב 50% אתנול (EtOH).
- דגירה 5 דקות ב 70% EtOH.
- יש לאחסן ב-70% EtOH ב-20ºC.
- בעת ביצוע האימונוסטיזציה, התפוררות מחדש ובצע נהלים סטנדרטיים (חדירות, כביסה, חסימה, דגירה ראשונית ומשנית של נוגדנים, שימור וכו ').
- לתקן שקופיות ב 2% paraformaldehyde (PFA) מדולל PBS ודגרת במהלך 5min.
- לציטוכימיה:
הערה: ניתן להכתים את השקופיות בכתם מאי-גרינוולד גימסה או בכתמים הנוחים לכל מטרה. - לבדיקה מורפולוגית מיידית
- הוסף טיפה אחת של מדיום הרכבה על הנקודה המכילה תא של ציטוספין ומניחים כיסוי.
- שמור על שקופיות ב 4 °C (60 °F) לא יותר משבוע, אלא אם כן אטום, המאפשר אחסון לטווח ארוך גם ב RT. הרכבה קיבעון בינוני מאפשר אחסון לטווח ארוך ב RT.
תוצאות
מח עצם ופלוידי
באיור 4, אנו מראים ניתוח אימונופנוטיפינג מייצג של מגה-קרויפוזיס בדגימות BM (שאיפה) מחולים. בעת התוויית השבר התאי מול CD71 ו- CD31, יש לנו מגודר שש אוכלוסיות עיקריות: CD31- CD71- (אדום), CD31- CD71+ (כחול), CD31+ CD71- (כתום), CD31
Discussion
רוב המחקר המתמקד במחקר של megakaryopoiesis על ידי cytometry זרימה מוגבל עד כה לזיהוי של תת-קבוצות MK באמצעות סמני משטח ספציפיים לשושלת בלבד (כלומר,CD42A/CD42B, CD41/CD61), בעוד שלבי בידול ח"כים קודמים נבדקו בצורה גרועה. במאמר הנוכחי אנו מראים אסטרטגיה אימונופנוטיפינג כדי לטפל אפיון cytometry זרימה מקיפה של מגה-קר...
Disclosures
ייצור חומר אורקולי נתמך על ידי BD Biosciences.
Acknowledgements
אנו מודים למרקוס פרז בסטרצ'ה, לורנה רודריגז לורנצו ובגוניה גרסיה מנדז (HUCA) ופאלומה סרזו, אלמודנה פיירו ומריה דה לה פוודה-קולומו (HCSC) על תמיכה טכנית. עבודה זו נתמכה בחלקה על ידי מענקים רפואיים (Roche SP200221001) ל- A.B., מלגת RYC (RYC-2013-12587; השר דה אקונומיה y Competitividad, ספרד) ומענק I+D 2017 (SAF2017-85489-P; השריו דה סינסיה, אוניברסיטת אינבאסיון, ספרד ופונדוס פדר) ללוס אנג'לס, מענק סוורו אוצ'ואה (PA-20-PF-BP19-014; קונסטג'ריוה דה סינסיה, איננובאסיון y אוניברסיטאות דל פרינציפאדו דה אסטוריאס, ספרד) לפ.M.ב. ומענק פוסט-דוקטורט תוך-דורי 2018 (Fundación para la Investigación y la Innovación Biosanitaria de Asturias - FINBA, אוביידו, ספרד) ל- A.A.-H. אנו מודים לרנייה ואן דר לינדן על שיתוף הידע (והזמן שלו), במיוחד עצתו החכמה על תערובת פאנל רב צבעים מתויגים-נוגדנים והכנת בקרת חרוזים בצבע יחיד.
Materials
| Name | Company | Catalog Number | Comments |
| 130 micron Nozzle | BD | 643943 | required for MK sorting |
| 5810R Centrifuge | Eppendorf | Cell isolation and washes | |
| A-4-62 Swing Bucket Rotor | Eppendorf | Cell isolation and washes | |
| Aerospray Pro Hematology Slide Stainer / Cytocentrifuge | ELITech Group | Automatized cytology devise, where slides are stained with Mat-Grünwald Giemsa | |
| CO2 Incubator Galaxy 170 S | Eppendorf | Cell Incubation | |
| Cytospin 4 Cytocentrifuge | Thermo Scientific | To prepare cytospins | |
| FACSAria IIu sorter | BD | Lasers 488-nm and 633-nm | |
| FACSCanto II flow cytometer | BD | Lasers 488-nm , 633-nm and 405-nm | |
| Olympus Microscope BX 41 | Olympus | Microphotographs | |
| Olympus Microscope BX 61 | Olympus | Microphotographs | |
| Zoe Fluorescent Cell Imager | BioRad | Microphotographs | |
| To obtain PBMCs | |||
| Lipids Cholesterol Rich from adult bovine serum | Sigma-Aldrich | L4646 | or similar |
| Lymphoprep | Stem Cell Technologies | #07801 | or similar |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | or similar |
| Recombinant human Erythropoietin (EPO) | R&D Systems | 287-TC-500 | or similar |
| Recombinant human stem cell factor (SCF) | Thermo Fisher Scientific, Gibco™ | PHC2115 | or similar |
| Recombinant human thrombopoietin (TPO) | Thermo Fisher Scientific, Gibco™ | PHC9514 | or TPO receptor agonists |
| StemSpan SFEM | Stem Cell Technologies | #09650 | |
| Flow Cytometry Analyses | |||
| Bovine Serum Albumin | Merck | A7906-100G | or similar |
| BD CompBead Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD | 552843 | Antibodies for human cells are generally from mouse. |
| BD Cytofix/Cytoperm | BD | 554714 | or similar |
| BD FACS Accudrop Beads | BD | 345249 | |
| CD31 AF-647 | BD | 561654 | Mouse anti-human |
| CD31 FITC | Immunostep | 31F-100T | |
| CD34 FITC | BD | 555821 | Mouse anti-human |
| CD41 PE | BD | 555467 | Mouse anti-human |
| CD41 PerCP-Cy5.5 | BD | 333148 | Mouse anti-human |
| CD42A APC | Immunostep | 42AA-100T | We observed unspecific binding... that needs to be assessed |
| CD42A PE | BD | 558819 | Mouse anti-human |
| CD42B PerCP | Biolegend | 303910 | Mouse anti-human |
| CD49B PE | BD | 555669 | Mouse anti-human |
| CD61 FITC | BD | 555753 | Mouse anti-human |
| CD71 APC-Cy7 | Biolegend | 334109 | Mouse anti-human |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Human BD Fc Block | BD | 564219 | Fc blocking - control |
| KIT PE-Cy7 | Biolegend | 313212 | Mouse anti-human |
| Lineage Cocktail 2 FITC | BD | 643397 | Mouse anti-human |
| RNAse | Merck | R6513 | or similar |
| Triton X-500 | Merck | 93443-500ML | or similar |
| Cell strainers for sorting | |||
| CellTrics Filters 100 micrometers | Sysmex | 04-004-2328 | Cell strainers |
| Note: we do not specify general reagents/chemicals (PBS, EDTA, etc) or disposables (tubes, etc), or reagents specified in previous published and standard protocols - unless otherwise specified. |
References
- Italiano, J. E. Unraveling Mechanisms That Control Platelet Production. Semin Thrombosis And Haemostasis. 39 (1), 15-24 (2013).
- Machlus, K. R., Italiano, J. E. The Incredible Journey: From Megakaryocyte Development To Platelet Formation. Journal Of Cell Biology. 201 (6), 785-796 (2013).
- Eckly, A., et al. Biogenesis Of The Demarcation Membrane System (DMS) In Megakaryocytes. Blood. 123 (6), 921-930 (2014).
- Couldwell, G., Machlus, K. R. Modulation Of Megakaryopoiesis And Platelet Production During Inflammation. Thrombosis Research. 179, 114-120 (2019).
- Kosaki, G. In Vivo Platelet Production From Mature Megakaryocytes: Does Platelet Release Occur Via Proplatelets. International Journal Of Hematology. 81 (3), 208-219 (2005).
- Lefrancais, E., Looney, M. R. Platelet Biogenesis In The Lung Circulation. Physiology (Bethesda). 34 (6), 392-401 (2019).
- Nieswandt, B., Stritt, S. Megakaryocyte Rupture For Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 327-328 (2015).
- Nishimura, S., et al. IL-1alpha Induces Thrombopoiesis Through Megakaryocyte Rupture In Response To Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 453-466 (2015).
- Sanjuan-Pla, A., et al. Platelet-Biased Stem Cells Reside At The Apex Of The Haematopoietic Stem-Cell Hierarchy. Nature. 502 (7470), 232-236 (2013).
- Notta, F., et al. Distinct Routes Of Lineage Development Reshape The Human Blood Hierarchy Across Ontogeny. Science. 351 (6269), 2116 (2016).
- Yamamoto, R., et al. Clonal Analysis Unveils Self-Renewing Lineage-Restricted Progenitors Generated Directly From Hematopoietic Stem Cells. Cell. 154 (5), 1112-1126 (2013).
- Wang, H., et al. Decoding Human Megakaryocyte Development. Cell Stem Cell. , (2020).
- Meinders, M., et al. Repercussion Of Megakaryocyte-Specific Gata1 Loss On Megakaryopoiesis And The Hematopoietic Precursor Compartment. Plos One. 11 (5), 0154342 (2016).
- Meinders, M., et al. Sp1/Sp3 Transcription Factors Regulate Hallmarks Of Megakaryocyte Maturation And Platelet Formation And Function. Blood. 125 (12), 1957-1967 (2015).
- Salunkhe, V. P., Gutiérrez, L. Culture Of Megakaryocytes From Human Peripheral Blood Mononuclear Cells. Bio-Protocol. 5 (21), 1639 (2015).
- Choudry, F. A., et al. Transcriptional Characterization Of Human Megakaryocyte Polyploidization And Lineage Commitment. Journal Of Thrombosis And Haemostasis. , 15271 (2021).
- Heazlewood, S. Y., Williams, B., Storan, M. J., Nilsson, S. K. The Prospective Isolation Of Viable, High Ploidy Megakaryocytes From Adult Murine Bone Marrow By Fluorescence Activated Cell Sorting. Methods In Molecular Biology. 1035, 121-133 (2013).
- Tomer, A., Harker, L. A., Burstein, S. A. Purification Of Human Megakaryocytes By Fluorescence-Activated Cell Sorting. Blood. 70 (6), 1735-1742 (1987).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. On The Quest For In Vitro Platelet Production By Re-Tailoring The Concepts Of Megakaryocyte Differentiation. Medicina. 56 (12), (2020).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. In Vitro Platelet Production For Transfusion Purposes: Where Are We Now. Transfusion And Apheresis Science. 59 (4), 102864 (2020).
- Butov, K. R., et al. In Vitro Megakaryocyte Culture From Human Bone Marrow Aspirates As A Research And Diagnostic Tool. Platelets. , 1-8 (2020).
- Di Buduo, C. A., et al. A Gold Standard Protocol For Human Megakaryocyte Culture Based On The Analysis Of 1,500 Umbilical Cord Blood Samples. Thrombosis And Haemostasis. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved