JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 1차 출처에서 인간 MK의 면역페노티핑 및 세포 분류 또는 헤마토포이틱 전조자로부터 시험관내 분화
요약
여기서는 메가카요세포 분화의 특성화를 위한 면역페노티핑 전략을 제시하고, 이 전략이 형광 활성화 세포 선별기로 다른 단계에서 메가카요사이클을 분류하는 방법을 보여준다. 방법론은 인체 에 있는 문화에서 생성된 거대 karyocytes뿐만 아니라 인간 1차 조직에적용될 수 있다.
초록
메가카요세포(MK) 분화는 고도의 다중계(>64N) 및 매우 큰 셀(40-60 μm)을 초래하는 다수의 내미토성 주기를 포함한다. 세포 생물학 및 분자 수준에서 메가카요포에이시스에 대한 빠르게 증가하는 지식과는 달리, 유동 세포측정에 의한 메가카르요포에이스의 특성화는 계보 특이적 표면 마커를 이용한 성숙한 MK의 식별에 국한되는 반면, 이전의 MK 분화 단계는 아직 미개척되지 않은 상태로 남아 있다. 여기서는 MK 특이적 및 비특이적 표면 마커를 통합하는 패널이 있는 인간 1차 출처 또는 체외 배양에서 연속MK 분화 단계를 식별할 수 있는 면역페노티핑 전략을 제시합니다. 그 크기와 취약성에도 불구하고, MK는 위에서 언급한 패널을 사용하여 면역페노타입이 될 수 있으며, 압력 및 노즐 직경의 특정 조건하에서 형광 활성화 셀 분류에 의해 농축될 수 있다. 이 접근은 인간에 있는 거대 karyopoiesis 및 혈소판 생산의 복잡성을 더 잘 이해하기 위하여 목적으로, 다중 Omics 연구 결과를 촉진합니다. 메가카요포이스의 더 나은 특성화는 혈통 관련 병리학 및 악성종양의 진단 또는 예후에서 근본적인 자세를 취할 수 있습니다.
서문
메가카요세포(MKs)는 조혈줄기세포(HSC)로부터 개발되어 호르몬 혈전포이에틴(TPO)에 의해 주로 오케스트레이션되는 메가카요포이에이시스(megakaryopoiesis)라는 복잡한 과정을 거쳐 개발한다. 메가카요포이시스의 고전적인 견해는 HSC에서 부터 헌신적인 선조및 전구체 세포의 계층적 단계를 통해 세포 여행을 설명하며 궁극적으로 성숙한 MK로 이어집니다. 성숙 하는 동안, MKs 는 여러 차례의 내시경증을 경험하고, 혈소판 생산을 위한 충분한 멤브레인 표면을 제공하는 복잡한 세포내 경계 막 시스템(DMS)을 개발하고, 성숙한 혈소판1,2,3에의해 상속되는 다양한 과립에 포함된 과다를 효율적으로 생산하고 포장한다. 그 결과, 성숙한 MK는 고다형성 핵(심지어 >64N에 도달)을 특징으로 하는 큰 세포(40-60 μm)이다. 최근 연구에 따르면 HSC가 특정 물리 병리학적조건에 대한 응답으로 전통적인 혈통 약정 체크 포인트를 우회하는 MK로 분화하는 대체 경로를제안4,5,6,7,9,10,11. 이러한 사실 인정은 성숙한 MK를 향한 조혈 분화가 생물학 필요에 반응하는 연속체 및 적응 프로세스이다는 것을 강조합니다.
세포 생물학 및 메가카요포에이시스(12)를 특징짓는 분자 양상에 대한 지식이 증가함에 따라, 유동 세포측정에 의한 공정 연구에 전념하는 대부분의 연구는 계보별 표면 마커(즉, CD42A/B, CD41/CD61)를 이용한 성숙한 MK의 식별으로 제한되며, MK의 초기 상이한 단계는 아직 밝혀지지 않았다. 앞서 마우스골수와 골수 유래 MK배양13,14로메가카요포이스를 무대에 올리는 전략을 문서화하여인간15에적용했다. 본 기사에서는 HSC에서 성숙한 MK에 이르기까지, 인간 원(골수-BM 및 말초 혈액-PB-) 또는 MK 특이적 표면 마커(CD61, CD42B, CD4B, CD4B, CD4B) 및 CD4B9, CD4B1 을 통합하는 패널을 사용하여 체외 배양에 이르기까지 메가karyopoiesis의 특성화를 허용하는 면역페노티핑 전략을 보여줍니다. 큰 크기와 취약성에도 불구하고, MK는 전술한 세포 표면 마커를 사용하여 면역페노타입이 될 수 있으며, 세포 파열 및/또는 손상을 최소화하기 위해 특정 압력 및 노즐 직경의 특정 조건하에서 형광 활성화 셀 분류에 의해 농축될 수 있다. 이 기술은 인간의 건강과 질병에 있는 거대 karyopoiesis 및 혈소판 생산의 복잡성을 더 잘 이해하기 위하여 목적으로, 다중 Omics 접근을 촉진합니다. 주목할만한, 그것은 증가하는 수요의 임상 맥락에서 진단과 예후를 돕기 위하여 유용한 공구로 포즈를 취합니다.
이 원고에서 우리는 기본 소스에서 MK 특이적이고 비특이적 표면 마커를 통합하거나 시험관 내에서생성되는 패널로 인간 메가카요포이스를 무대에 올리는 전략을 문서화합니다. 또한, 형광 활성화 셀 선별기, 바람직한 분획 및 성숙한 MK(도1)를사용하여 분류하는 프로토콜을 제공합니다. 이 단계는 MK의 큰 크기와 취약성으로 인해 기술적으로 어렵기 때문에 인기가 없습니다. 그러나, 마우스와 인간 골수 샘플에서 이전에 사용되었으며, 기술 발전으로 인해매번 16,17,18에더 나은 결과를 초래한다. MKs 또는 MK 전구체가 연구될 수 있는 인간 적인 1차 근원은 골수, 장혈 및 말초 혈액을 포함합니다, 다른 중. 각 샘플에 대한 분석을 위해 관련 셀 분획을 격리하는 적절한 샘플 처리가 중요합니다. 표준 절차는 메가 카요포이시스의 연구를 목표로 할 때 고려해야 할 몇 가지 고려 사항과 함께 통합됩니다.
프로토콜
1964년 헬싱키 선언에 따라 전혈 및 골수 샘플을 채점하고 처리하였다. 전혈 샘플은 우리의 기관 의료 윤리위원회 (병원 Universitario 중앙 드 아스투리아스 -HUCA-)에 의해 승인 된 연구 내에서, 통보 된 동의 (ISPA)를 준 후 건강한 기증자로부터 얻어졌다. 골수 샘플은 병원 Clínico San Carlos (HCSC)의 혈액학부에서 관리되는 환자의 골수 흡인 폐기 물질로부터 수득되었습니다.
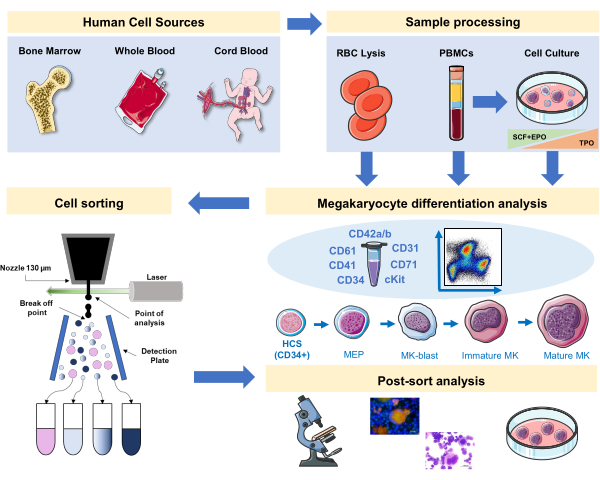
그림 1: 이 원고에 기록된 프로토콜의 회로도 표현입니다. 면역페노티핑을 사용하여 MK 분화가 진행될 수 있는 1차 인간 소스 또는 1차 배양이 표시됩니다. 이러한 면역페노티핑 전략은 1차 근원에서 상이한 계보 관련 병리학 또는 악성종양에서 프로세스의 연구에 적용될 수 있다. 또한 형광 활성화 셀 선별기를 가진 MK 및 전구체의 세포 분류를 가능하게 하여 농축 된 분획을 추가로 분석 할 수 있습니다. 사용되는 이미지는 세르비어 의료 예술 (SMART)의 일부이며 CC BY 3.0에 따라 허가됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 면역 페노티핑 전에 전혈 및 골수 처리
- 기부로부터 전혈(WB)을 1차 공급원으로 사용할 때, 임의로 말초 혈액 단핵세포(PBMC) 성분을 분리한다. 이는 이전에 설명된15와같이 밀도 그라데이션 세포 분리와 결합된 표준 차동 원심분리를 사용하여 달성될 수 있다.
- 간단히 말해서, 원심분리기 혈액은 실온에서 15분(브레이크 3)에 193 x g로 혈액을 검사합니다. 상부 플라즈마 분획을 버리고 버피 링을 수집합니다. 50mL 튜브의 밀도 그라데이션 용액(1.076 g/mL)의 상단에 25mL의 부피와 파이펫을 조심스럽게 25mL의 부피인 인산염 완충액(PBS)/트리나트륨 시타테 디하이드레이트(38g/L, pH 7)로 희석한다.
- 1114 x g (가속기 3, 브레이크 3, 실온)에서 20 분 동안 원심 분리기. 플라즈마 분획을 버리고 PBMC가 들어있는 버피 링을 수집합니다.
- 또는 적혈구(RBC)를 용인하고 철저한 세척을 한 후 면역페노티핑을 위해 WB 샘플(약 100 μL)을 사용하십시오.
- 간단히 말해서, 얼음 차가운 RBC 용해 완충액 (NH4Cl 4.15 g, KHCO3 및 18.5 mg의 EDTA (트리플렉스 III)에서 H2O, pH 7.1-7.4의 500mL로 희석하십시오. 셀 서스펜션이 투명 빨간색(3-5분)이 될 때까지 기다립니다.
- 435 x g에서 4°C에서 원심분리기, PBS에서 세포를 재축한다. 백혈구 펠릿을 얻기 위해 필요한 만큼 절차를 반복하십시오.
- 유사하게, RBC 용해 완충액(참조점 1.2)과 철저한 세척을 통해 골수(흡인)로부터 얻은 샘플을 직접 처리하고, 명확한 단일 세포 현탁액(도1)으로시작한다.
- 깨지기 쉬운 MK를 손상시킬 수 있으므로 처리 중에 샘플을 혼합하기 위해 소용돌이를 사용하지 마십시오.
참고: PBMC를 얻기 위한 밀도 그라데이션은 RBC-lysed WB와 비교하여 더 풍부하고 깨끗한 셀 분획을 초래할 수 있습니다. 그러나, 우리는 고밀도, 성숙한 MKs가 "호중구"분획에서 분실될 수 있다는 것을 명심해야 합니다. 이는 대표 결과에서 논의될 것입니다.
- 깨지기 쉬운 MK를 손상시킬 수 있으므로 처리 중에 샘플을 혼합하기 위해 소용돌이를 사용하지 마십시오.
2. PBMC로부터 생체외 MK 차별화
참고: MK는CD34+ 세포와 같은 초기 전구체로부터 시험관내에서 분화될 수 있으며, 다른 원원(즉, WB/PBMC, 코드 블러드, 골수)과 iPSC로부터 존재한다. 이 끝에 적용 된 다른 프로토콜이 있습니다. 여기서, 우리는 CD34+ 전구체15,19,20,21,22에대한 농축없이, PBMC로부터 MK 차별화를 허용하는 우리에 의해 개발 된 문화 방법을 사용합니다.
- 본 프로토콜은 혈전포이에틴(TPO)의 농도가 초기 전구체(즉, SCF, EPO)의 증식을 선호하는성장인자를 희생하여 서서히 증가하는 3개의 배양 단계로 이루어져 있다(그림2)15.
- 기초 매체에 대 한, 사용 StemSpan SFEM 으로 보충 0.4% 콜레스테롤 풍부한 지질 믹스와 1% 페니실린/연쇄 절제술.
- 단계 I 배지의 경우 SCF(100 ng/mL), 에리스로포이에틴(EPO, 0.5 U/mL) 및 혈전포이에틴(TPO, 30 ng/mL)으로 보충된 기초 매체를 사용한다. 위상 II 배지는 SCF(50 ng/mL), EPO(0.25 U/mL) 및 TPO(50 ng/mL)로 보충된 기초 매체입니다. 단계 III 매체의 경우 TPO(100 ng/mL)로 보충된 기초 매체를 사용합니다.
- 1단계 매체의 문화 PBMC. 6-8일째에 PBMC를 단계 II 배지에 배치하고 9-12일에는 PBMC를 단계 III 배지에 배치합니다.
- 1단계 II단계부터 실온에서 5분 동안 435 x g의 원심 분리 셀로 배지를 교체하고, 단계 II에서 단계 III까지 실온에서 5분 동안 95 x g로 교체하고 신선한 배지로 재보습합니다.
- 37°C에서 인큐베이터내의 배양 세포, 5% CO2. 이러한 1차 문화권에서는 MK 분화가 10~14일 간 지속되며, MK 분화를 따라 문화 기간 동안 다양한 시간에 샘플을 그릴 수 있다.
- 기초 매체에 대 한, 사용 StemSpan SFEM 으로 보충 0.4% 콜레스테롤 풍부한 지질 믹스와 1% 페니실린/연쇄 절제술.
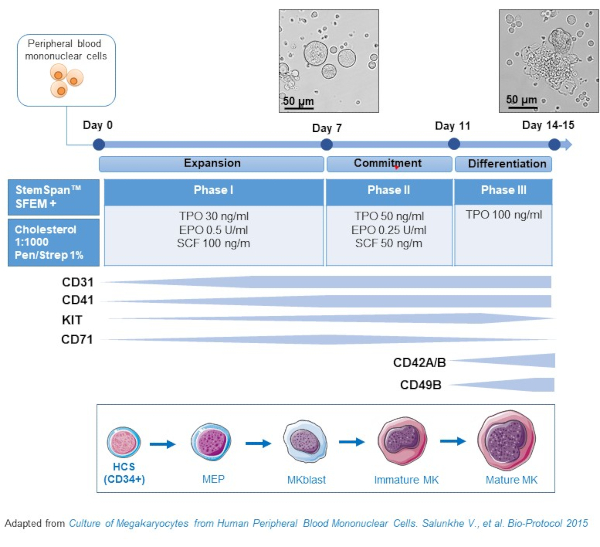
그림 2: PBMC 유래 MK 문화 방법의 회로도 표현. 건강한 기증자로부터의 PBMC는 생체 외에서 MK를 생성하기 위해 우리가 개발한 3상 프로토콜에 따라 배양되었습니다(살룬케 등에서 채택된 계획). 15 10일째와 13일 문화의 사진이 표시됩니다. 사진은 20배 의 목표로 촬영됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 샘플 수집: 5분(95xg)에 저속 원심분리를 적용하여 세포를 세척하고, 소 혈청 알부민(BSA)의 1%를 포함하는 PBS 또는 PBS에서 세포를 재연한다. 면역페노티핑의 경우 이상적인 밀도는 105-106 세포/100 μL(점 3.1 참조)입니다. 배양(즉, 죽은세포, 파편 등의 존재)의 상태에 따라 1 또는 2 개의 세정이 필요할 수 있습니다. 문화 동안 관심의 시점에서 세포를 수집합니다.
3. MK 분화의 면역 페노티핑 - 태그 된 항체 패널로 배양
- 표준 절차에 따라 태그된 항체 패널로 세포 샘플을 배양하여 메가카요퀴트를 처리할 때 저속(95 x g)의 원심분리기에 주의를 기울입니다. 우리는 일반적으로 PBS에서 1 % BSA로 샘플을 4 ° C, 20 분에서 105-106 셀의 범위로 배양합니다.
- 필요한 경우 확장합니다.
- 인큐베이션 후 PBS에 1% BSA의 5mL, 원심분리기는 저속(95xg)으로 추가하고, 슈퍼네티를 흡수하고, PBS에서 2% BSA로 샘플을 재연하여 MK 생존율(2mL)을 보존한다. 1-5 mM EDTA를 추가하여 세포 체재(MK 배양에서 자연적으로 볼 수 있음)를 방해합니다.
- 샘플을 12 x 75mm 원형 바닥 튜브(FACS 튜브) 또는 플레이트로 옮기고, 혈류 세포 분석 또는 세포 분류가 될 때까지 어둠 속에서 유지합니다.
- 단일 항체 및 항체 패널 혼합의 제제; 흐름 사이토미터 설정:
- 항체 패널에서 최적의 농도를 결정하기 위해 사용 전에 항체를 적티산한다. 항체의 최적 농도는 음의 세포로부터 명확하게 양성을 분리하는 가장 낮은 농도입니다 (그리고 발현의 중간 수준의 구별을 허용). 예를 들어, 대부분의 항체는 제조업체에 의해 달리 적정되거나 표시되지 않는 한 1:200 희석(스톡 100 μg/mL)에 사용된다.
- 항체 적정이 결정되면 각 항체의 10배 희석을 준비한다. 이러한 희석은 단일 색상 컨트롤과 패널 믹스를 준비하는 데 사용됩니다. 희석제와 패널 믹스는 준비 후 한 달도 사용할 수 있습니다 (제조업체의 표시가 이러한 저장 조건을 배제하지 않는 한 4 °C에 저장됨). 이렇게 하면 기간 동안 동일한 패널로 샘플을 염색할 수 있습니다.
- 단일 색상 컨트롤과 패널 믹스에 대해 10x 희석의 100 μL당 10 μL을 사용하십시오.
- 단일 색상 컨트롤의 경우 항체 친화성 구슬을 사용하여 항체를 첨가한 후 직접 측정할 수 있습니다. 단일 색상 컨트롤은 적절한 보상 조정(및 분석 소프트웨어로 측정 후 미세 조정)을 허용하기 위해 모든 실험으로 측정되어야 합니다.
- 또는 셀 샘플로 단일 색상 컨트롤을 수행합니다. 그러나, 구슬은 항체/표면 마커에 따라 복잡한 원차 또는 배양 세포 공급원에서 얻을 수 없을 수도 있는 주어진 수의 이벤트의 빠른 측정을 허용한다. 또한 "형광 마이너스 원"(FMO) 패널 믹스로 얼룩진 셀 샘플을 실행하여 적절한 보상 설정(실험을 실행하기 전에)을 설정하는 것이 좋습니다. 이는 보상 문제, 특히 배양 된 MK에서 자동 형광 간섭을 식별하는 것과 관련이 있습니다 (페놀 레드를 포함하는 배양 배지를 사용하는 경우 존재할 것입니다).
- 설계된 패널의 항체를 포함하는 시료의 수에 따라 패널 믹스의 충분한 부피를 준비한다. 우리의 패널의 대부분은 6 개의 항체를 포함 (6 색 패널, 표 1-2참조).
- 이러한 패널의 경우, 유동 사이토미터의 488-nm 및 633-nm 레이저를 사용하지만 패널은 다른 기술적 시나리오에 맞게 조정할 수 있습니다. 또한, 음향 초점 기술이 있는 질량 분광계 기반 유동 세포계 또는 사이토미터를 사용할 때 보상 고려 사항을 모호하게 할 수 있습니다.
- 생존 가능성을 측정하기 위한 염료는 특히 성숙할 때 MK에 대한 허위 정보를 제공할 수 있습니다. MK는 매우 적극적인 업케이트 세포이며, Hoechst, 7-AAD 또는 PE를 가진 양성성은 항상 실제 세포 죽음을 반영하지 않을 수 있습니다. 대안 (세포 죽음 측정이 필요한 경우) 미토콘드리아 얼룩 (CMX 로스) 또는 아민 반응 성 염료 (좀비 또는 유령 염료)의 사용일 수 있습니다.
표 1: 메가카요시틱 계보의 셀 표면 마커에 대한 참고 사항을 보려면 여기를 클릭하여 이 표를 다운로드하십시오.
표 2: 항체 패널은 이 테이블을 다운로드하려면 여기를 클릭하십시오.
4. 6색 패널과 결합된 플로이디 분석
- 플로이디 분석을 위해, 6색 항체 패널과 병용하여 항체 패널과 배양 후 세포의 고정 및 투과화를 진행한다. 이 전략은 세포의 DNA의 염색을 허용하면서 표면 마커 염색의 보존을 허용할 것입니다. 우리는 사용 가능한 보라색 405-nm 레이저로 시각화 할 수 있기 때문에, DNA를 얼룩에 Hoechst 33342를 사용합니다.
- 105-106 세포의 경우, 항체 패널, 원심분리기 세포(95 x g 5분 동안 95 x g)로 배양 한 후, 고정 버퍼의 200 μL에서 재중단하고 실온 (RT)에서 10 분 동안 배양하십시오.
- 위에 표시된 원심분리기 세포는 200 μL 고정 버퍼에서 두 번째로 다시 중단되고 RT에서 10분 더 배양합니다.
- 0.1% 트리톤 X-100, 200 mg/mL RNase 및 20 mg/mL Hoechst 33342 (투약화 Hoechst MIX)를 포함하는 투과화 버퍼를 준비하십시오.
- 위와 같이 원심분리기 세포는, 37°C에서 30분 동안 투과화 Hoechst MIX의 300 μL에서 이를 재보습한다. 이 단계는 깨끗한 계피 측정을 얻기 위해 RNA를 분해해야하기 때문에 매우 중요합니다.
- 인큐베이션 시간 후, 유동 세포계로 직접 샘플을 측정합니다. 그렇지 않으면, 어둠 속에서, 4 °C에서 샘플을 유지합니다. 즉시 측정합니다. 그러나 이러한 샘플이 고정되어 있기 때문에 측정이 24-48시간도 지연될 수 있습니다. 단일 세포 현탁액을 보장하기 위해 측정하기 전에 샘플을 철저히 깜박이거나 세포 여과기를 통과해야 합니다.
- 전방 및 측면 분산과 같은 형태 매개 변수는 셀 고정 후 유지되지 않습니다. 방향/측면 분산 플롯은 고정 후 셀 분포의 수축을 표시합니다. 그러나, 표면 마커 염색은 대부분 보존되고, 게이팅 전략은 거의 변경되지 않으며, 표면 마커 조합에 의해 정의된 분화의 상이한 단계에서 계피 상태의 분석을 허용한다.
5. MK 차별화 분석
참고 : 우리는 CD31 / CD71의 조합이 MK 차별화의 다른 단계에 해당하는 게이트의 수를 설정할 수 있음을 보았다. MK 특이적 마커를 사용하면 성숙하고 미숙한 MK를 분리할 수 있습니다. 또한, 신선한 샘플에서, 사용된 다른 마커의 존재를 확인하기 위해 백 게이팅, 또는 전방 /측면 분산 축에 인구를 배치, MK 분화 단계의 평가를 구체화하고 동일한 인구에 존재 할 수있는 다른 세포 유형을 폐기 할 수 있습니다.
- 초기 전구체 마커(KIT, CD34), 일반적인 전구체 마커(CD31, CD71) 및 계보 마커를 포함하는 항체 패널을 사용하여 일부 특정(CD42A/CD42B, CD49B, CD41/CD61, CLEC2, GPVI 등 참조)를 사용합니다(표 1-2참조). 리니지(Lin) 칵테일(CD3, CD14, CD16, CD19, CD20 및 CD56)을 사용하면 분석(Lin- 모집단을 선택할 때)에 노이즈를 추가할 수 있는 성숙한 조혈 세포를 "필터링"할 수 있습니다. 예를 들어, 우리는 PBMC, 골수 및 PBMC 유래 세포 배양을 통해 대표적인 결과에 있는 MKs의 분석을 통해서 갈 것입니다.
6. MK 및 MK 전구체 셀 분류
참고: 스테인드 셀은 FACSDiva 소프트웨어를 사용하여 488-nm 및 633-nm 표준 고형 상태 레이저를 장착한 형광 활성화 셀 선별기 FACS Aria IIu에서 분석 및 분류되었습니다. 데이터 추가 분석 및 FlowJo 소프트웨어와 사이토 뱅크 (viSNE 분석)를 사용하여 제시되었다. 정렬된 분획의 순도는 정렬된 분획(85% 이상의 순도)의 각 분획의 흐름 세포측정 분석에 의해 확인되었다.
- 세포 열화를 피하기 위해 가능한 한 빨리 또는 항체 배양 후 1 시간 이내에 세포 분류를 수행하십시오.
- 100 μm 셀 스트레이너로 샘플을 필터링하여 단일 셀 서스펜션과 큰 MK의 무결성을 보장합니다.
- 130 μm 세라믹 노즐, 평방 인치 당 11 파운드 (PSI)로 설정된 시스 압력 및 12 kHz로 설정된 드롭 드라이브 주파수를 사용하여 스트림을 낙하시하십시오.
- 정렬하기 전에, 페니실린 /Streptomycin로 30 분 인수를 수행하여 노즐, 칼집 및 샘플 라인을 살균하여 멸균 물에 1:5 희석한 다음 멸균 물로 10 분 동안 획득하여 남은 데콘타민을 제거합니다.
- 스트림이 안정화되면, 초당 400-1200 이벤트의 유량으로 반사 된 방울의 97.5 % 이상 미세 조정 모드에서 정렬하기 위해 권장 구슬로 드롭 지연을 조정합니다.
- PBS에서 2% BSA의 500 μL로 컬렉션 FACS 튜브를 준비합니다. BSA의 비율은 5-10%까지 증가할 수 있습니다.
- 적절한 보정 행렬 매개 변수로 실험 템플릿을 생성합니다.
- FACS 튜브를 사이토미터로 로드합니다.
- 대상 세포 집단의 원하는 게이트 와 순도를 설정하기 위해 시료의 측정을 수행합니다. 셀 정렬 중에 선택한 모집단 게이트에서 최대 200,000개의 이벤트를 표시하도록 활성화된 레코드를 유지합니다.
- FACS Aria IIu는 최대 4개의 다른 세포 집단을 동시에 분리할 수 있도록 허용합니다. 새 정렬 레이아웃을 만들고 수집 장치(4튜브)와 적절한 정밀 모드(순도 및 복구의 중간 마스크권장)를 선택합니다. 마지막으로 각 정렬 위치 필드에 관심 있는 채우기(들)를 추가합니다(그림3).

그림 3: 형광 활성화 세포 분류 (FACS)의 원리의 회로도 표현. 입자는 130 μm-노즐을 통과하며 노즐에 진동을 가하기 때문에 일반 물방울의 흐름으로 분해됩니다. 다음으로, 물방울은 레이저 (분석 지점)에 의해 심문되고 신호는 그 물방울에 요금을 적용하여 '정렬 결정'을 제공하기 위해 처리됩니다. 전하 물방울이 고전압 정전기장(검출 플레이트)을 통과하면 편향되어 해당 수집 튜브로 수집됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 수집 튜브를 로드하고 대상 모집단을 정렬하기 시작합니다.
- 원심 분리는 95 x g에서 5 분 동안 수집 튜브를 원심분리하고 PBS에서 2 % BSA의 적절한 부피로 셀 펠릿을 재연합니다.
- 정렬된 각 샘플의 일부를 다시 측정하여 순도를 계산합니다.
- 추가 사용을 위해 셀을 적절하게 저장합니다. 선별된 세포는 세포학적 및 분자 분석을 위해 사용될 수 있거나, 선택된 세포 집단의 분화 과정을 연구하기 위해 재배양될 수 있다.
7. 정렬 후 샘플 준비
- 세포원심분리기로 세포학적 분석을 위한 세포스핀 준비
- 정렬된 셀을 100-200 μL의 다루기 쉬운 작업 량으로 가져옵니다. 세포 밀도는 각 경우에 정렬된 인구 수율에 따라 달라집니다.
- 금속 홀더에 깨끗한 슬라이드를 놓고 필터 상단을 놓습니다. 샘플혼합을 피하기 위해 슬라이드와 필터에 레이블을 지정해야 합니다.
- 슬라이드에 대한 필터 구멍에 100 μL PBS를 추가하므로 필터가 구멍 림에서 가습됩니다.
- 깔때기를 놓고 금속 홀더를 닫고 원심분리기에 그 자리에 놓습니다.
- 깔때기 내부에 샘플(100-200 μL)을 추가합니다.
- 36 x g의 원심분리기는 5분간. 사이토스핀 슬라이드는 RT에서 공기 건조(먼지 방지를 위해 적절하게 덮어있음)에 공기가 허용될 수 있으며 면역염색 또는 히스토케미케 전에 1주일 동안 RT에 보관할 수 있습니다.
- 면역 염색용
- PBS에서 희석된 2% 파라포름알데히드(PFA)로 슬라이드를 수정하고 5분 동안 배양합니다.
- PBS에서 0.5-4% PFA의 범위가 사용될 수 있다. 우리의 손에, 우리는 조직 또는 일부 세포 유형의 적절한 고정을 얻기 위해 4 %를 사용하고, PBS에서 0.5 % PFA는 혈소판에 충분하다. 이 기술을 설정할 때 PFA의 적절한 백분율은 셀 유형/소스당 최적화가 필요합니다.
- PBS에서 5 분 동안 배양하십시오.
- 50% 에탄올(EtOH)에서 5분 동안 배양합니다.
- 70% EtOH에서 5분 동안 배양하십시오.
- -20ºC에 70% EtOH에 저장합니다.
- 면역 염색을 수행할 때, 수분을 공급하고, 표준 절차(투과, 세척, 차단, 1차 및 이차 항체 배양, 보존 등)를 따릅니다.
- PBS에서 희석된 2% 파라포름알데히드(PFA)로 슬라이드를 수정하고 5분 동안 배양합니다.
- 세포화학의 경우:
참고: 슬라이드는 5월-그룬발트 지름사 염색 또는 각 목적에 대한 편리한 염색으로 얼룩질 수 있습니다. - 즉각적인 형태 검사용
- 사이토스핀의 세포 함유 지점에 마운팅 배지 1방울을 추가하고 커버슬립을 놓습니다.
- RT에서 장기 보관을 허용하는 밀봉이 없는 한 슬라이드를 1주일 이상 4°C로 유지하여 RT에서 장기 보관할 수 있습니다.
결과
골수와 플로이디
도 4에서, 우리는 환자로부터 BM 샘플 (열망)에서 메가 카요포이스의 대표적인 면역 페노티핑 분석을 보여줍니다. CD71 및 CD31에 대한 셀룰러 분획을 플로팅할 때 CD31- CD71- (빨간색), CD31- CD71+ (파란색), CD31+ CD71- (오렌지), CD31+ CD71미드 (밝은 녹색), CD31+ CD71+<...
토론
유동 세포측정에 의한 메가카요포에이시스 연구에 초점을 맞춘 대부분의 연구는 현재까지 계보 별 표면마커(즉,CD42A/CD42B, CD41/CD61)만을 사용하여 MK 서브세트의 식별에 국한된 반면, 이전의 MK 분화 단계는 제대로 조사되지 않았습니다. 본 기사에서는 인간 메가카요포이시스의 포괄적인 유동 세포측정 특성화를 해결하기 위한 면역페노티핑 전략을 보여줍니다. 전반적으로, 우리는 보다 상세?...
공개
시청각 재료 생산은 BD 바이오 사이언스에 의해 지원되었다.
감사의 말
마르코스 페레즈 바스테레헤아, 로레나 로드리게스 로렌조, 베고냐 가르시아 멘데스(HUCA) 및 팔로마 세레조, 알무데나 파에로, 마리아 데 라 포베다 콜로모(HCSC)에 기술 지원을 부탁드립니다. 이 작품은 의학 보조금에 의해 부분적으로 지원되었다 (로슈 SP200221001) A.B., RYC 펠로우십 (RYC-2013-12587; 장관 드 Economía y 경쟁, 스페인) 및 I + D 2017 교부금 (SAF2017-85489-P; 장관 드 시엔시아, 이노바시온 y 유니버시다데스, 스페인 과 폰도스 페더) L.G., 세베로 오초아 그랜트 (PA-20-PF-BP19-014; Consejería de Ciencia, Innovación y Universidades 델 Principado de Asturias, 스페인.M) 및 교내 박사 후 보조금 2018 (Fundación para la Investigación y la Innovación Biosanitaria de Asturias - FINBA, 오비에도, 스페인) A.A.H. 우리는 자신의 지식 (및 시간), 특히 멀티 컬러 태그 항체 패널 믹스와 단일 색상 비드 제어 준비에 대한 그의 현명한 조언을 공유 레이니어 반 데르 린덴 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 130 micron Nozzle | BD | 643943 | required for MK sorting |
| 5810R Centrifuge | Eppendorf | Cell isolation and washes | |
| A-4-62 Swing Bucket Rotor | Eppendorf | Cell isolation and washes | |
| Aerospray Pro Hematology Slide Stainer / Cytocentrifuge | ELITech Group | Automatized cytology devise, where slides are stained with Mat-Grünwald Giemsa | |
| CO2 Incubator Galaxy 170 S | Eppendorf | Cell Incubation | |
| Cytospin 4 Cytocentrifuge | Thermo Scientific | To prepare cytospins | |
| FACSAria IIu sorter | BD | Lasers 488-nm and 633-nm | |
| FACSCanto II flow cytometer | BD | Lasers 488-nm , 633-nm and 405-nm | |
| Olympus Microscope BX 41 | Olympus | Microphotographs | |
| Olympus Microscope BX 61 | Olympus | Microphotographs | |
| Zoe Fluorescent Cell Imager | BioRad | Microphotographs | |
| To obtain PBMCs | |||
| Lipids Cholesterol Rich from adult bovine serum | Sigma-Aldrich | L4646 | or similar |
| Lymphoprep | Stem Cell Technologies | #07801 | or similar |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | or similar |
| Recombinant human Erythropoietin (EPO) | R&D Systems | 287-TC-500 | or similar |
| Recombinant human stem cell factor (SCF) | Thermo Fisher Scientific, Gibco™ | PHC2115 | or similar |
| Recombinant human thrombopoietin (TPO) | Thermo Fisher Scientific, Gibco™ | PHC9514 | or TPO receptor agonists |
| StemSpan SFEM | Stem Cell Technologies | #09650 | |
| Flow Cytometry Analyses | |||
| Bovine Serum Albumin | Merck | A7906-100G | or similar |
| BD CompBead Anti-Mouse Ig, κ/Negative Control Compensation Particles Set | BD | 552843 | Antibodies for human cells are generally from mouse. |
| BD Cytofix/Cytoperm | BD | 554714 | or similar |
| BD FACS Accudrop Beads | BD | 345249 | |
| CD31 AF-647 | BD | 561654 | Mouse anti-human |
| CD31 FITC | Immunostep | 31F-100T | |
| CD34 FITC | BD | 555821 | Mouse anti-human |
| CD41 PE | BD | 555467 | Mouse anti-human |
| CD41 PerCP-Cy5.5 | BD | 333148 | Mouse anti-human |
| CD42A APC | Immunostep | 42AA-100T | We observed unspecific binding... that needs to be assessed |
| CD42A PE | BD | 558819 | Mouse anti-human |
| CD42B PerCP | Biolegend | 303910 | Mouse anti-human |
| CD49B PE | BD | 555669 | Mouse anti-human |
| CD61 FITC | BD | 555753 | Mouse anti-human |
| CD71 APC-Cy7 | Biolegend | 334109 | Mouse anti-human |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | |
| Human BD Fc Block | BD | 564219 | Fc blocking - control |
| KIT PE-Cy7 | Biolegend | 313212 | Mouse anti-human |
| Lineage Cocktail 2 FITC | BD | 643397 | Mouse anti-human |
| RNAse | Merck | R6513 | or similar |
| Triton X-500 | Merck | 93443-500ML | or similar |
| Cell strainers for sorting | |||
| CellTrics Filters 100 micrometers | Sysmex | 04-004-2328 | Cell strainers |
| Note: we do not specify general reagents/chemicals (PBS, EDTA, etc) or disposables (tubes, etc), or reagents specified in previous published and standard protocols - unless otherwise specified. |
참고문헌
- Italiano, J. E. Unraveling Mechanisms That Control Platelet Production. Semin Thrombosis And Haemostasis. 39 (1), 15-24 (2013).
- Machlus, K. R., Italiano, J. E. The Incredible Journey: From Megakaryocyte Development To Platelet Formation. Journal Of Cell Biology. 201 (6), 785-796 (2013).
- Eckly, A., et al. Biogenesis Of The Demarcation Membrane System (DMS) In Megakaryocytes. Blood. 123 (6), 921-930 (2014).
- Couldwell, G., Machlus, K. R. Modulation Of Megakaryopoiesis And Platelet Production During Inflammation. Thrombosis Research. 179, 114-120 (2019).
- Kosaki, G. In Vivo Platelet Production From Mature Megakaryocytes: Does Platelet Release Occur Via Proplatelets. International Journal Of Hematology. 81 (3), 208-219 (2005).
- Lefrancais, E., Looney, M. R. Platelet Biogenesis In The Lung Circulation. Physiology (Bethesda). 34 (6), 392-401 (2019).
- Nieswandt, B., Stritt, S. Megakaryocyte Rupture For Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 327-328 (2015).
- Nishimura, S., et al. IL-1alpha Induces Thrombopoiesis Through Megakaryocyte Rupture In Response To Acute Platelet Needs. Journal Of Cell Biology. 209 (3), 453-466 (2015).
- Sanjuan-Pla, A., et al. Platelet-Biased Stem Cells Reside At The Apex Of The Haematopoietic Stem-Cell Hierarchy. Nature. 502 (7470), 232-236 (2013).
- Notta, F., et al. Distinct Routes Of Lineage Development Reshape The Human Blood Hierarchy Across Ontogeny. Science. 351 (6269), 2116 (2016).
- Yamamoto, R., et al. Clonal Analysis Unveils Self-Renewing Lineage-Restricted Progenitors Generated Directly From Hematopoietic Stem Cells. Cell. 154 (5), 1112-1126 (2013).
- Wang, H., et al. Decoding Human Megakaryocyte Development. Cell Stem Cell. , (2020).
- Meinders, M., et al. Repercussion Of Megakaryocyte-Specific Gata1 Loss On Megakaryopoiesis And The Hematopoietic Precursor Compartment. Plos One. 11 (5), 0154342 (2016).
- Meinders, M., et al. Sp1/Sp3 Transcription Factors Regulate Hallmarks Of Megakaryocyte Maturation And Platelet Formation And Function. Blood. 125 (12), 1957-1967 (2015).
- Salunkhe, V. P., Gutiérrez, L. Culture Of Megakaryocytes From Human Peripheral Blood Mononuclear Cells. Bio-Protocol. 5 (21), 1639 (2015).
- Choudry, F. A., et al. Transcriptional Characterization Of Human Megakaryocyte Polyploidization And Lineage Commitment. Journal Of Thrombosis And Haemostasis. , 15271 (2021).
- Heazlewood, S. Y., Williams, B., Storan, M. J., Nilsson, S. K. The Prospective Isolation Of Viable, High Ploidy Megakaryocytes From Adult Murine Bone Marrow By Fluorescence Activated Cell Sorting. Methods In Molecular Biology. 1035, 121-133 (2013).
- Tomer, A., Harker, L. A., Burstein, S. A. Purification Of Human Megakaryocytes By Fluorescence-Activated Cell Sorting. Blood. 70 (6), 1735-1742 (1987).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. On The Quest For In Vitro Platelet Production By Re-Tailoring The Concepts Of Megakaryocyte Differentiation. Medicina. 56 (12), (2020).
- Martinez-Botia, P., Acebes-Huerta, A., Seghatchian, J., Gutierrez, L. In Vitro Platelet Production For Transfusion Purposes: Where Are We Now. Transfusion And Apheresis Science. 59 (4), 102864 (2020).
- Butov, K. R., et al. In Vitro Megakaryocyte Culture From Human Bone Marrow Aspirates As A Research And Diagnostic Tool. Platelets. , 1-8 (2020).
- Di Buduo, C. A., et al. A Gold Standard Protocol For Human Megakaryocyte Culture Based On The Analysis Of 1,500 Umbilical Cord Blood Samples. Thrombosis And Haemostasis. , (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유