A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
دراسة تطور الخلايا التغصنية بواسطة ضربة قاضية للجين القصير بوساطة الحمض النووي الريبي في جذع مكون للدم وخط خلية سلف في المختبر
In This Article
Summary
نقدم هنا بروتوكولا لفحص عوامل النسخ المحتملة المشاركة في تطوير الخلايا التغصنية (DC) باستخدام نقل الفيروس اللاصق ل shRNA للحصول على خطوط خلايا ضربة قاضية مستقرة لتمايز DC في المختبر .
Abstract
الخلايا التغصنية (DCs) هي خلايا مهمة تقدم المستضدات تربط الاستجابات المناعية الفطرية والتكيفية. والبلدان النامية غير متجانسة ويمكن تقسيمها إلى بلدان متجانسة تقليدية (cDC) وبلدان بلازماسيتويد (pDC). cDCs متخصصة في تقديم المستضدات إلى الخلايا التائية الساذجة وتنشيطها. من ناحية أخرى ، يمكن أن تنتج PDCs كميات كبيرة من الإنترفيرون من النوع الأول (IFN-I) أثناء العدوى الفيروسية. تحدث مواصفات DCs في مرحلة مبكرة من أسلاف DC في نخاع العظم (BM) ويتم تعريفها من خلال شبكة من عوامل النسخ (TFs). على سبيل المثال ، تعبر cDCs بشكل كبير عن ID2 ، بينما تعبر pDCs بشكل كبير عن E2-2. وبما أنه يجري تحديد المزيد والمزيد من المجموعات الفرعية من البلدان النامية، فإن هناك اهتماما متزايدا بفهم أطر عمل محددة تتحكم في تنمية الاعتمادات المستندية. هنا ، أنشأنا طريقة لفحص TFs الحرجة لتمايز DCs في المختبر من خلال توصيل فيروس lenti الذي يحمل الحمض النووي الريبي القصير (shRNA) إلى خط جذعي مكون للدم وخلية سلفية (iHSPCs) مخلدة. بعد الاختيار والتمايز في المختبر ، يتم تحليل إمكانات cDC و pDC لخطوط الخلايا القاضية المستقرة بواسطة قياس التدفق الخلوي. يوفر هذا النهج منصة لتحديد الجينات التي يحتمل أن تحكم مصائر DC من السلف في المختبر.
Introduction
والبلدان النامية هي المنظم الرئيسي للمناعة الفطرية والتكيفية1. وتصنف البلدان النامية أساسا إلى مجموعتين سكانيتين متميزتين وظيفيا، هما البلدان النامية النامية والبلدان النامية. وعلاوة على ذلك، تتألف البلدان النامية من مجموعتين فرعيتين، هما البلدان النامية من النوع الأول والثاني أو cDC1s و cDC2s، على التوالي2. pDCs ، التي تعبر عن BST2 ، Siglec-H ، والمستويات المتوسطة من CD11c في الفئران3,4 ، هي الخلايا التي يمكن أن تفرز كميات كبيرة من IFN-I أثناء الالتهاب والعدوى الفيروسية 5. نظرا لقدرتها القوية على إنتاج IFN-I ، يشتبه أيضا في أنها تلعب دورا رئيسيا في تطور أمراض المناعة الذاتية ، بما في ذلك الذئبة الحمامية الجهازية (SLE)6. cDC1s ، التي يتم تعريفها من خلال التعبير السطحي ل XCR1 و CD8a و CLEC9A و CD103 في الفئران7 ، متخصصة في تنشيط واستقطاب الخلايا التائية CD8 + السامة للخلايا (CTLs) من خلال العرض المتقاطع للمستضد ، وبالتالي بدء مناعة النوع الأول استجابة لمسببات الأمراض داخل الخلايا والسرطان8,9. من ناحية أخرى ، يمكن ل cDC2s ، التي تعبر عن CD11b و CD172α (المعروفة أيضا باسم Sirpα) في كل من البشر والفئران ، تنشيط خلايا CD4 + T وتعزيز الاستجابة المناعية من النوع الثاني ضد مسببات الحساسية والطفيليات10 ، وكذلك تعديل مناعة النوع الثالث بعد البكتيريا خارج الخلية والتعرف على الميكروبات11,12.
يتم تحديد تنويع DCs بواسطة مجموعة من TFs من الخلايا الجذعية والسلف المكونة للدم (HSPCs) في BM. E2-2 (المشفر بواسطة Tcf4) هو منظم رئيسي للتمايز ووظيفة pDCs13,14. وعلى النقيض من ذلك، فإن مثبط ربط الحمض النووي 2 (ID2) يدفع مواصفات cDC ويمنع تطور PDC من خلال منع نشاط البروتين E15. علاوة على ذلك ، يتطلب تطوير cDC1s IRF8 و BATF3 ، في حين أن التمايز بين cDC2s يعتمد بشكل كبير على IRF416. وقد استكشفت الأعمال الأخيرة عدم تجانس pDCs17 و cDCs ولوائحها النسخية18. ونظرا لتعقيد شبكة الاعتمادات المستندية، هناك حاجة لم تتم تلبيتها لإنشاء منصة لتحديد الأفرقة الفنية الأخرى التي تتحكم في تطوير البلدان النامية ووظائفها.
هنا ، استخدمنا iHSPC الذي تم إنشاؤه عن طريق التعبير عن النقل النووي المنظم لهرمون الاستروجين ل Hoxb8 في خلايا BM (يشار إليها أيضا باسم خلايا Hoxb8-FL)19. يمكن أن تتكاثر iHSPCs وتبقى في مرحلة غير متمايزة في وجود β-estradiol و Flt3 ligand (FL) ، في حين أنها تبدأ في التمايز إلى أنواع DC مختلفة في وجود FL عند سحب β-estradiol19. واستنادا إلى هذه الميزة، يمكننا أن نهدم الجينات ذات الأهمية في مرحلة السلف، تليها دراسة التأثير على التمايز في المختبر بين pDCs و cDCs. لذلك ، هذه الطريقة هي أداة قوية لاكتشاف الجينات التي تنظم تطور ووظيفة DCs.
Access restricted. Please log in or start a trial to view this content.
Protocol
يتم التعامل مع فيروس lentivirus وفقا لتنظيم قسم الصحة والسلامة البيئية في كلية الطب بجامعة تايوان الوطنية.
1. إعداد خطوط الخلايا الجذعية المكونة للدم والسلف الخالدة (iHSPCs)
- الحفاظ على خط خلية iHSPC في وسط RPMI 1640 كامل يحتوي على 100 نانوغرام / مل FL و 1 ميكرومتر β-استراديول.
- مرور الخلايا بنسبة 1:10 كل 3 أيام.
ملاحظة: اجعل RPMI 1640 كاملا متوسطا عن طريق المكمل بمصل البقر الجنيني بنسبة 10٪ (FBS) ، و 5 × 10-5 M β-mercaptoethanol ، و 10 ميكروغرام / مل من الجنتاميسين. الفئران المؤتلف FL متاح أيضا تجاريا.
2. نقل الفيروسات اللينتيفيرية
- لوحة iHSPCs بكثافة 1 × 105 خلايا / بئر في 12 لوحة بئر في 1 مل من الوسط الكامل الذي يحتوي على 100 نانوغرام / مل FL ، و 1 ميكرومتر β استراديول ، و 8 ميكروغرام / مل من البوليبرين.
ملاحظة: يعتمد تركيز البوليبرين على أنواع الخلايا وعادة ما يكون في حدود 4-8 ميكروغرام / مل. - أضف فيروس lentivirus الحامل ل shRNA في كل بئر في عدد كبير من العدوى (MOI) من 100.
ملاحظة: الناقل الفيروسي هو pLKO.1-Puro مع علامة اختيار البوروميسين (الشكل 1). يتم سرد التسلسلات المستهدفة من shRNAs مقابل LacZ و Tcf4 و Id2 ، على التوالي ، في جدول المواد. يتم تعريف MOI من خلال عدد الفيروسات التي تضاف لكل خلية أثناء العدوى.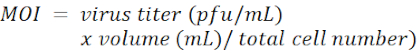
- قم بتدوير الألواح عند 1100 × جم لمدة 90 دقيقة عند 37 درجة مئوية.
ملاحظة: يتم إجراء عدوى الدوران باستخدام دوار دلو التأرجح. - احتضان الصفيحة التي تحتوي على خلايا مصابة بين عشية وضحاها عند 37 درجة مئوية في حاضنة.
ملاحظة: إذا كانت الخلايا حساسة للبوليبرين ، فقم بتحديث الخلايا بالوسط الكامل بدون البوليبرين بعد عدوى الدوران. - تحديث الخلايا مع وسط كامل يحتوي على 100 نانوغرام / مل FL و 1 ميكرومتر β-استراديول 24 ساعة بعد الإصابة.
- أضف 6 ميكروغرام / مل من البيروميسين إلى الوسط لتحديد الخلايا المصابة بعد 24 ساعة إضافية.
ملاحظة: عادة ما يستغرق ناقل الفيروس الخفيف المحول 48 ساعة للتعبير عن الجينات، بما في ذلك الجين المقاوم للبوروميسين. تأكد من تحسين تركيز البوروميسين لكل خط خلية. - قم بتحديث وسيط الاختيار الذي يحتوي على 100 نانوغرام / مل FL و 1 ميكرومتر β-استراديول و 6 ميكروغرام / مل من البوروميسين كل 3 أيام والحفاظ على الخلايا لمدة أسبوع واحد على الأقل لتوسيع خلايا iHSPC المحولة بثبات.
ملاحظة: عادة ما يسري اختيار البوروميسين بعد 48 ساعة، وتعتمد فترة الاختيار على أنواع الخلايا.
3. قياس كفاءة الضربة القاضية عن طريق النسخ العكسي و PCR في الوقت الحقيقي (RT-PCR)
- استخراج الحمض النووي الريبي الكلي من 1 × 107 shLacZ و shTcf4 و shId2 خلايا iHSPC المستقرة باستخدام كاشف استخراج الحمض النووي الريبي التجاري وتعجيل الحمض النووي الريبي من الطبقة المائية مع الأيزوبروبانول ، تليها غسل رواسب الحمض النووي الريبي مع 75 ٪ من الإيثانول.
- قم بإذابة الحمض النووي الريبي (~ 5 ميكروغرام) مع 5 ميكرولتر من H2O المعالج ب DEPC واضبط التركيز على 1 ميكروغرام / ميكرولتر.
- خذ 1-3 ميكروغرام من الحمض النووي الريبي ، واخلطه مع H2O المعالج ب DEPC إلى حجم نهائي قدره 17.4 ميكرولتر ، وأضف 1 ميكرولتر من 1 وحدة / ميكرولتر من DNase I الخالي من RNase I واحتضن لمدة 20 دقيقة عند 37 درجة مئوية.
ملاحظة: هذه الخطوة هي لهضم الحمض النووي الجينومي في عينات الحمض النووي الريبي. - أضف 1 ميكرولتر من 20 mM EDTA إلى عينات الحمض النووي الريبي ، واحتضن عند 65 درجة مئوية لمدة 10 دقائق لتعطيل DNase I ، ووضع عينات الحمض النووي الريبي على الفور عند 4 درجات مئوية.
- أضف 11.6 ميكرولتر من مزيج التفاعل الذي يحتوي على 1 ميكرولتر من التمهيدي oligo (dT) (45 ميكرومتر) ، و 6 ميكرولتر من 5x 1st strand buffer ، و 3 ميكرولتر من dNTP (2 mM) ، و 0.6 μL من مثبط RNase (50 وحدة / ميكرولتر) و 1 ميكرولتر من النسخ العكسي (200 وحدة / ميكرولتر) إلى عينات الحمض النووي الريبي والحضانة عند 40 درجة مئوية لمدة 1 ساعة.
- أوقف التفاعل عن طريق التسخين عند 70 درجة مئوية لمدة 10 دقائق وقم بتخفيف مزيج التفاعل ب 30 ميكرولتر من H2O.
- خذ 2 ميكرولتر من مزيج تفاعل RT المخفف كقالب للحمض النووي وقم بتضخيمه باستخدام التمهيدي ضد Tcf4 أو Id2 (انظر الجدول 1 لمعرفة ظروف الدراجة الحرارية).
ملاحظة: يتم تضمين تسلسلات التمهيدي في جدول المواد.
4. التمايز في المختبر لخطوط خلايا iHSPC الضربة القاضية المستقرة
- الحفاظ على الضربة القاضية المفردة المستقرة ل LacZ (shLacZ) أو Tcf4 (shTcf4) أو Id2 (shId2) في iHSPCs في وسط كامل يحتوي على 100 نانوغرام / مل من FL و 1 ميكرومتر β-استراديول.
- اجمع shLacZ و shTcf4 و shId2 iHSPCs غير المتمايزة في أنبوب سعة 15 مل وجهاز طرد مركزي لمدة 5 دقائق عند 500 × جم لتكوير الخلايا.
- تخلص من المادة الفائقة وأضف 10 مل من PBS لغسل الخلايا. كرر هذه الخطوة مرتين.
- أعد تعليق خلايا iHSPC وبذرها بكثافة 2 × 105 خلايا / مل في صفيحة من 12 بئرا في 1 مل من الوسط الكامل الذي يحتوي على 100 نانوغرام / مل FL فقط.
- أضف 1 مل من الوسط الطازج الكامل الذي يحتوي على 100 نانوغرام/مل FL بعد ثلاثة أيام.
- تحليل الخلايا المتمايزة (shLacZ و shTcf4 و shId2 iHSPCs) عن طريق قياس التدفق الخلوي بعد يومين.
5. تحليل التدفق الخلوي للبلدان النامية المتمايزة
- اجمع الخلايا في أنابيب سعة 1.5 مل عن طريق سحب الخلايا لأعلى ولأسفل 2-3 مرات في اللوحة ، وأجهزة الطرد المركزي لمدة 5 دقائق عند 500 × جم في درجة حرارة الغرفة (RT).
ملاحظة: في المختبر ، سيتم توصيل DCs المتباينة قليلا بالألواح. سيساعد السحب اللطيف على استعادة DCs من اللوحات. - تجاهل supernatant وإعادة تعليق الخلايا في 50 ميكرولتر من المخزن المؤقت FACS. بعد ذلك ، أضف 50 ميكرولتر من الهجين المضاد ل CD16/32 واحتضان لمدة 5-10 دقائق على الجليد.
ملاحظة: يمنع الجسم المضاد المانع Fc الارتباط غير المحدد للأجسام المضادة بمستقبلات Fc التي تعبر عن بعض الخلايا النخاعية والخلايا البائية وهو متاح تجاريا من خلال العديد من البائعين. - أضف الأجسام المضادة المترافقة بصبغة الفلورسنت (0.04 ميكروغرام لكل جسم مضاد) مباشرة إلى الخلايا واحتضنها لمدة 15 دقيقة على الجليد في الظلام. الأجسام المضادة المستخدمة هي APC / cy7 المضادة للفأر CD11c ، FITC المضادة للفأر CD11b ، و PE المضادة للفأر B220.
ملاحظة: يتم تعريف أجهزة تحديد البرامج على أنها CD11c+CD11b-B220+، ويتم تعريف الأقراص المضغوطة على أنها CD11c+CD11b+B220-. - اغسل الخلايا ب 1 مل من المخزن المؤقت FACS وجهاز الطرد المركزي لمدة 5 دقائق عند 500 × جم عند RT.
- إعادة تعليق الخلايا في 100 ميكرولتر من المخزن المؤقت FACS وتحليلها عن طريق قياس التدفق الخلوي.
Access restricted. Please log in or start a trial to view this content.
النتائج
تظهر خريطة ناقل الفيروس الخفيف pLKO.1-Puro (الشكل 1). بعد تسليم الفيروس اللينتي الذي يعبر عن shRNA ضد LacZ (عنصر تحكم غير مستهدف) و Tcf4 و Id2 في iHSPCs ، كشفت كفاءة الضربة القاضية التي أكدتها RT-qPCR أن التعبير عن Tcf4 قد انخفض في shTcf4 iHSPCs ، مقارنة ب shLacZ iHSPCs (ا...
Access restricted. Please log in or start a trial to view this content.
Discussion
غالبا ما تستخدم ناقلات الحمض النووي الريبوزي المرسال القائمة على فيروس لينتي لإسكات الجينات عن طريق النقل الفيروسي إلى الخلايا وتسمح بالاندماج المستقر في الجينوم المضيف. ومع ذلك ، يجب النظر في كفاءة النقل المختلفة في أنواع الخلايا المختلفة ، وقد تم اتخاذ عدد من النهج للتغلب على هذه المشك...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ونحن ممتنون للدعم التقني من الدكتور تز - لينغ تشن. نشكر المرفق الأساسي الوطني للحمض النووي الريبي (أكاديميا سينيكا ، تايوان) على توفير فيروس الحمض النووي الريبي (http://rnai.genmed.sinica.edu.tw). تم دعم هذا العمل من قبل وزارة العلوم والتكنولوجيا ، تايوان (MOST 108-2320-B-002-037-MY3 و MOST 109-2320-B-002-054-MY3).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC/Cy7 anti-mouse CD11c Antibody | Biolegend | 117324 | (Clone: N418) |
| FITC anti-mouse/human CD11b Antibody | Biolegend | 101206 | (Clone: M1/70) |
| PE anti-mouse/human B220 Antibody | Biolegend | 103208 | (Clone: RA3-6B2) |
| Cell culture | |||
| 1.5 mL Micro tube | ExtraGene | TUBE-170-C | |
| 12-well tissue culture-treated plate | Falcon | 353043 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| RPMI 1640 medium | gibco | 11875-085 | |
| Reagent | |||
| β-estradiol | Sigma-Aldrich | E2758-250MG | |
| β-mercaptoethanol (β-ME) | Sigma-Aldrich | M6250 | |
| FACS buffer | home-made | Formula: 1xPBS+0.5 %FBS+0.1%NaN3 | |
| Flt3 ligand (FL) | home-made | ||
| Polybrene | Sigma-Aldrich | TR-1003-G | |
| Puromycin | Invivogen | ant-pr-1 | |
| TRIsure | BIOLINE | BIO-38032 | |
| shRNA (Taregt sequence/clone ID) | Company | ||
| shId2 (GCTTATGTCGAATGATAGCAA/TRCN0000054390) | The RNAi Consortium (TRC) | ||
| shLacZ (CGCGATCGTAATCACCCGAGT/TRCN0000072224) | The RNAi Consortium (TRC) | ||
| shTcf4 (GCTGAGTGATTTACTGGATTT/TRCN0000012094) | The RNAi Consortium (TRC) |
References
- Steinman, R. M., Witmer, M. D. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proceedings of the National Academy of Sciences. 75 (10), 5132-5136 (1978).
- Guilliams, M., et al. Dendritic cells, monocytes and macrophages: a unified nomenclature based on ontogeny. Nature Reviews Immunology. 14 (8), 571-578 (2014).
- Blasius, A. L., Cella, M., Maldonado, J., Takai, T., Colonna, M. Siglec-H is an IPC-specific receptor that modulates type I IFN secretion through DAP12. Blood. 107 (6), 2474-2476 (2006).
- Swiecki, M., Colonna, M. Unraveling the functions of plasmacytoid dendritic cells during viral infections, autoimmunity, and tolerance. Immunology Reviews. 234 (1), 142-162 (2010).
- Liu, Y. -J. IPC: Professional Type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annual Review of Immunology. 23 (1), 275-306 (2005).
- Panda, S. K., Kolbeck, R., Sanjuan, M. A. Plasmacytoid dendritic cells in autoimmunity. Current Opinion in Immunology. 44, 20-25 (2017).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- Mashayekhi, M., et al. CD8α(+) dendritic cells are the critical source of interleukin-12 that controls acute infection by Toxoplasma gondii tachyzoites. Immunity. 35 (2), 249-259 (2011).
- Anderson, D. A., Dutertre, C. -A., Ginhoux, F., Murphy, K. M. Genetic models of human and mouse dendritic cell development and function. Nature Reviews Immunology. 21 (2), 101-115 (2021).
- Plantinga, M., et al. Conventional and monocyte-derived CD11b(+) dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen. Immunity. 38 (2), 322-335 (2013).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Kumamoto, Y., et al. CD301b+ dermal dendritic cells drive T helper 2 cell-mediated immunity. Immunity. 39 (4), 733-743 (2013).
- Cisse, B., et al. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development. Cell. 135 (1), 37-48 (2008).
- Grajkowska, L. T., et al. Isoform-specific expression and feedback regulation of E protein TCF4 control dendritic cell lineage specification. Immunity. 46 (1), 65-77 (2017).
- Jackson, J. T., et al. Id2 expression delineates differential checkpoints in the genetic program of CD8α+ and CD103+ dendritic cell lineages. The EMBO Journal. 30 (13), 2690-2704 (2011).
- Suzuki, S., et al. Critical roles of interferon regulatory factor 4 in CD11bhighCD8alpha- dendritic cell development. Proceedings of the National Academy of Science U. S. A. 101 (24), 8981-8986 (2004).
- Rodrigues, P. F., et al. Distinct progenitor lineages contribute to the heterogeneity of plasmacytoid dendritic cells. Nature Immunology. 19 (7), 711-722 (2018).
- Brown, C. C., et al. Transcriptional basis of mouse and human dendritic cell heterogeneity. Cell. 179 (4), 846-863 (2019).
- Redecke, V., et al. Hematopoietic progenitor cell lines with myeloid and lymphoid potential. Nature Methods. 10 (8), 795-803 (2013).
- Abe, A., Miyanohara, A., Friedmann, T. Polybrene increases the efficiency of gene transfer by lipofection. Gene Therapy. 5 (5), 708-711 (1998).
- Sorgi, F. L., Bhattacharya, S., Huang, L. Protamine sulfate enhances lipid-mediated gene transfer. Gene Therapy. 4 (9), 961-968 (1997).
- Kirkling, M. E., et al. Notch signaling facilitates in vitro generation of cross-presenting classical dendritic cells. Cell Reports. 23 (12), 3658-3672 (2018).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nature Reviews. Immunology. 15 (1), 18-29 (2015).
- Wculek, S. K., Khouili, S. C., Priego, E., Heras-Murillo, I., Sancho, D. Metabolic Control of Dendritic Cell Functions: Digesting Information. Frontiers in Immunology. 10 (775), (2019).
- Saxton, R. A., Sabatini, D. M. mTOR signaling in growth, metabolism, and disease. Cell. 168 (6), 960-976 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved