Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hematopoetik Kök ve Progenitör Hücre Hattı In vitrounda Kısa Saç Tokası RNA Aracılı Gen Knockdown ile Dendritik Hücre Gelişiminin İncelenmesi Çalışması
Bu Makalede
Özet
Burada , in vitro DC farklılaşması için stabil nakavt hücre hatları elde etmek için shRNA'nın lentiviral transdüksiyonunu kullanarak dendritik hücrenin (DC) gelişiminde rol oynayan potansiyel transkripsiyon faktörlerini taramak için bir protokol sunuyoruz.
Özet
Dendritik hücreler (DC' ler), doğuştan gelen ve adaptif immün yanıtları birbirine bağlayan önemli antijen sunan hücrelerdir. DC'ler heterojendir ve geleneksel DC'lere (cDC' ler) ve plazmasikoid DC'lere (PDC'ler) ayrılabilir. cDC'ler naif T hücrelerine antijen sunma ve etkinleştirme konusunda uzmanlaşmıştır. Öte yandan, pDC'ler viral enfeksiyon sırasında büyük miktarlarda I tipi interferonlar (IFN-I) üretebilir. DC spesifikasyonu, kemik iliğindeki (BM) DC atalarının erken bir aşamasında ortaya çıkar ve transkripsiyon faktörleri (TF' ler) ağı ile tanımlanır. Örneğin, cDC'ler ID2'yi yüksek oranda ifade ederken, pDC'ler E2-2'yi yüksek oranda ifade ediyor. Giderek daha fazla DC alt kümesi tanımlandığından, DC gelişimini kontrol eden belirli TF'leri anlamaya yönelik artan bir ilgi vardır. Burada, kısa saç tokası RNA 'sı (shRNA) taşıyan lentivirüsü ölümsüzleştirilmiş hematopoetik kök ve progenitör hücre (iHSPC' ler) hattına ulaştırarak DC'lerin farklılaşması için kritik öneme sahip TF'leri taramak için bir yöntem oluşturuyoruz. Seçim ve in vitro farklılaşmadan sonra, kararlı devirme hücre hatlarının cDC ve pDC potansiyeli akış sitometrisi ile analiz edilir. Bu yaklaşım, potansiyel olarak DC kaderlerini yöneten genleri in vitro atalarından tanımlamak için bir platform sağlar.
Giriş
DC'ler doğuştan gelen ve uyarlanabilir bağışıklığın temel düzenleyicileridir1. DC'ler esas olarak işlevsel olarak farklı iki popülasyona, yani PDC'lere ve CDC'lere ayrılır. Ayrıca, cDC'ler iki alt kümeden oluşur, yani tip I ve tip II cDC'ler veya cDC1'ler ve cDC2'ler, sırasıyla2. farelerde BST2, Siglec-H ve orta düzey CD11c'yi ifade eden pDC'ler3,4, iltihaplanma ve viral enfeksiyon sırasında büyük miktarlarda IFN-I salgılayabilen hücrelerdir5. Sağlam IFN-I-üretim yetenekleri nedeniyle, sistemik lupus eritematozus (SLE)6 da dahil olmak üzere otoimmün hastalıkların ilerlemesinde kilit rol oynadıklarından şüphelenilmektedir. Fare7'de XCR1, CD8a, CLEC9A ve CD103'ün yüzey ekspresyözü ile tanımlanan cDC1'ler, sitotoksik CD8 + T hücrelerinin (CTL' ler) antijen çapraz sunumu yoluyla aktivasyonu ve polarizasyonu konusunda uzmanlaşmıştır, böylece hücre içi patojenlere ve kansere yanıt olarak tip I bağışıklığı başlatılır8,9. Öte yandan, hem insanlarda hem de farelerde CD11b ve CD172α'yı (Sirpα olarak da bilinir) ifade eden cDC2'ler, CD4 + T hücrelerini aktive edebilir ve alerjen ve parazitlere karşı tip II bağışıklık tepkisini teşvik edebilir10, ayrıca hücre dışı bakteriler ve mikrobiyota tanımayı takiben tip III bağışıklığı modüle edebilir11,12.
DC'lerin çeşitlendirilmesi, BM'deki hematopoetik kök ve progenitör hücrelerden (HSPC' ler) bir grup TF tarafından belirlenir. Buna karşılık, DNA bağlama 2 (ID2) inhibitörü cDC spesifikasyonunu yönlendirir ve E protein aktivitesini engelleyerek pDC gelişimini engeller15. Ayrıca, cDC1'lerin geliştirilmesi IRF8 ve BATF3 gerektirirken, cDC2'lerin farklılaşması IRF416'ya bağlıdır. Son çalışmalar pDC'lerin heterojenliğini, CDC'leri17 ve cDC'leri ve transkripsiyonsal düzenlemelerini araştırdı18. DC ağının karmaşıklığı nedeniyle, DC'lerin gelişimini ve işlevselliğini kontrol eden diğer TF'leri tanımlamak için karşılanmamış bir platform kurma ihtiyacı vardır.
Burada, BM hücrelerinde (Hoxb8-FL hücreleri olarak da adlandırılır) Hoxb8'in östrojenle düzenlenmiş nükleer translokasyonunun ifade edildiği bir iHSPC kullandık 19. iHSPC'ler β-estradiol ve Flt3 ligand (FL) varlığında çoğalabilir ve farklılaşmamış bir aşamada kalabilirken, β-estradiol19'un çekilmesiyle FL'nin varlığında farklı DC türlerine farklılaşmaya başlarlar. Bu özelliğe dayanarak, progenitör aşamasında ilgi genlerini devirebilir, ardından PDC'lerin ve CDC'lerin in vitro farklılaşması üzerindeki etkisini inceleyebiliriz. Bu nedenle, bu yöntem DC'lerin gelişimini ve işlevini düzenleyen genleri keşfetmek için güçlü bir araçtır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Lentivirüsün kullanımı, Ulusal Tayvan Üniversitesi Tıp Fakültesi Çevre Sağlığı ve Güvenliği Bölümü'nün düzenlemesine göre gerçekleştirilir.
1. Ölümsüzleştirilmiş hematopoetik gövde ve progenitör hücre hatlarının (iHSPC'ler) hazırlanması
- iHSPC hücre hattını 100 ng/mL FL ve 1 μM β-estradiol içeren eksiksiz RPMI 1640 ortamında koruyun.
- Hücreleri her 3 günde bir 1:10 oranında geçiştirin.
NOT: %10 fetal sığır serumu (FBS), 5 x 10-5 M β-mercaptoethanol ve 10 μg/mL gentamisin ile takviye ederek tam RPMI 1640 ortamı yapın. Rekombinant murine FL ticari olarak da mevcuttur.
2. Lentiviral transdüksiyon
- Plaka iHSPC'leri 100 ng/mL FL, 1 μM β-estradiol ve 8 μg/mL polibren içeren 1 mL'lik komple ortamda 12 kuyu plakalarında 1 x 105 hücre/kuyu yoğunluğunda.
NOT: Polibrenin konsantrasyonu hücre tiplerine bağlıdır ve genellikle 4-8 μg / mL aralığındadır. - 100'lük çok miktarda enfeksiyon (MOI) ile her kuyuya shRNA taşıyan lentivirüs ekleyin.
NOT: Lentiviral vektör pLKO.1-Puro dır ve puromycin seçim işaretleyicisi (Şekil 1). Sırasıyla LacZ, Tcf4 ve Id2'ye karşı shRNA'ların hedef dizileri Malzeme Tablosunda listelenir. MOI, enfeksiyon sırasında hücre başına eklenen virion sayısı ile tanımlanır.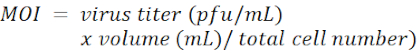
- Plakaları 37 °C'de 90 dakika boyunca 1.100 x g'da döndürün.
NOT: Spin enfeksiyonu bir salıncak kova rotor kullanılarak gerçekleştirilir. - Enfekte hücreler içeren plakayı bir inkübatörde 37 °C'de bir gece kuluçkaya yatırın.
NOT: Hücreler polibrene duyarlıysa, spin enfeksiyonundan sonra hücreleri polibren olmadan tam ortamla yenileyin. - Enfeksiyondan sonra 100 ng/mL FL ve 1 μM β-estradiol 24 saat içeren komple ortam ile hücreleri yenileyin.
- Ek 24 saat sonra enfekte hücreleri seçmek için ortama 6 μg / mL puromycin ekleyin.
NOT: Transdüklenmiş lentiviral vektör genellikle püromisin dirençli gen de dahil olmak üzere genleri ifade etmek için 48 saat sürer. Puromycin konsantrasyonunun her hücre hattı için optimize olduğundan emin olun. - 100 ng/mL FL, 1 μM β-estradiol ve 6 μg/mL puromycin içeren seçim ortamını her 3 günde bir yenileyin ve hücreleri en az bir hafta boyunca muhafaza ederek, saplı olarak transdüklenmiş iHSPC hücrelerini genişletin.
NOT: Puromisin seçimi genellikle 48 saat sonra yürürlüğe girer ve seçim süresi hücre türlerine bağlıdır.
3. Ters transkripsiyon ve gerçek zamanlı PCR (RT-PCR) ile devirme verimliliğinin ölçümü
- Toplam RNA'yı 1 x 107 shLacZ, shTcf4 ve shId2 kararlı devirme iHSPC hücrelerinden ticari RNA ekstraksiyon reaktifi kullanarak çıkarın ve RNA'yı sulu tabakadan izopropanol ile çökeltin, ardından RNA çökeltisini% 75 etanol ile yıkayın.
- RNA'yı (~ 5 μg) 5 μL DEPC ile işlenmiş H2O ile çözün ve konsantrasyonu 1 μg/μL'ye ayarlayın.
- 1-3 μg RNA alın, DEPC ile işlenmiş H2O ile 17,4 μL'lik son hacme karıştırın, 1 μL 1 birim/μL RNase içermeyen DNase I ekleyin ve 37 °C'de 20 dakika kuluçkaya yatırın.
NOT: Bu adım, RNA örneklerindeki genomik DNA'yı sindirmektir. - RNA örneklerine 1 μL 20 mM EDTA ekleyin, DNase I'i devre dışı bırakmak için 10 dakika boyunca 65 °C'de kuluçkaya yatırın ve RNA örneklerini hemen 4 °C'ye koyun.
- 1 μL oligo (dT) astar (45 μM), 6 μL 5x 1. tel tampon içeren reaksiyon karışımının 11,6 μL'sini ekleyin, RNA numunelerine 3 μL dNTP (2 mM), 0,6 μL RNaz inhibitörü (50 Birim/μL) ve 1 μL ters transkriptaz (200 Birim/μL) ve 1 saat boyunca 40 °C'de kuluçkaya yatırın.
- Reaksiyon karışımını 70 °C'de 10 dakika ısıtarak durdurun ve reaksiyon karışımını 30 μL H2O ile seyreltin.
- Seyreltilmiş RT reaksiyon karışımının 2 μL'sini DNA şablonu olarak alın ve PCR, Tcf4 veya Id2'ye karşı astarlar kullanarak yükseltin (termosikler koşullar için Tablo 1'e bakın).
NOT: Astar dizileri Malzeme Tablosu'na dahil edilir.
4. Kararlı devirme iHSPC hücre hatlarının in vitro farklılaşması
- iHSPC'lerde LacZ (shLacZ), Tcf4 (shTcf4) veya Id2'nin (shId2) 100 ng/mL FL ve 1 μM β-estradiol içeren eksiksiz bir ortamda kararlı tek devrilmesini sağlayın.
- Hücreleri peletmek için shLacZ, shTcf4 ve shId2 farklılaştırılmamış iHSPC'leri 15 mL'lik bir tüpe ve santrifüje 5 dakika boyunca 500 x g'da toplayın.
- Üstnatant atın ve hücreleri yıkamak için 10 mL PBS ekleyin. Bu adımı iki kez yineleyin.
- iHSPC hücrelerini 2 x 105 hücre/mL yoğunlukta, yalnızca 100 ng/mL FL içeren 1 mL'lik tam ortamda 12 kuyu plakasına yeniden depolayın ve tohumlayın.
- Üç gün sonra 100 ng/mL FL içeren 1 mL taze komple ortam ekleyin.
- İki gün sonra akış sitometrisine göre farklılaştırılmış hücreleri (shLacZ, shTcf4 ve shId2 iHSPC'ler) analiz edin.
5. Farklılaştırılmış DC'lerin akış sitometrik analizi
- Hücreleri plakada 2-3 kez yukarı ve aşağı pipetleyarak 1,5 mL tüpler halinde toplayın ve oda sıcaklığında (RT) 500 x g'da 5 dakika santrifüjlayın.
NOT: Tüp bebek farklılaştırılmış DC'ler plakalara hafifçe yapışır. Nazik pipetleme, DC'lerin plakalardan kurtarılmasına yardımcı olacaktır. - Süpernatant atın ve hücreleri 50 μL FACS arabelleğine yeniden atın. Ardından, 50 μL anti-CD16/32 hibridoma supernatant ekleyin ve buz üzerinde 5-10 dakika kuluçkaya yatırın.
NOT: Fc blokaj antikor, bazı miyeloid hücreler ve B hücreleri üzerinde ifade eden Fc reseptörlerine antikorların spesifik olmayan bağlanmasını önler ve çeşitli satıcılar aracılığıyla ticari olarak kullanılabilir. - Floresan boya konjuge antikorları (her antikor için 0,04 μg) doğrudan hücrelere ekleyin ve karanlıkta buz üzerinde 15 dakika kuluçkaya yatırın. Kullanılan antikorlar APC/cy7 anti-mouse CD11c, FITC anti-mouse CD11b ve PE anti-mouse B220'dir.
NOT: pDC'ler CD11c+CD11b-B220+ ve cDC'ler CD11c+CD11b+B220- olarak tanımlanır. - RT'de 500 x g'da 5 dakika boyunca 1 mL FACS tampon ve santrifüj ile hücreleri yıkayın.
- Hücreleri 100 μL FACS tamponunda yeniden biriktirin ve akış sitometrisine göre analiz edin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Lentiviral vektör pLKO.1-Puro haritası gösterilmiştir (Şekil 1). LacZ (hedeflenmeyen bir kontrol), Tcf4 ve ID2'ye karşı shRNA'yı ifade eden lentivirüs'ün iHSPC'lerde teslim edildikten sonra, RT-qPCR tarafından onaylanan devirme verimliliği, ShLacZ iHSPC'lere kıyasla Tcf4 iHSPC'lerde Tcf4 ifadesinin azaldığını ortaya koydu (Şekil 2A). Öte yandan, shLacZ iHSPC'ler kontrolüne kıyas...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Lentivirüs bazlı shRNA vektörleri genellikle hücrelere viral transdüksiyon ile gen susturma için kullanılır ve konak genomuna istikrarlı entegrasyona izin verilir. Bununla birlikte, farklı hücre tiplerinde çeşitli transdüksiyon verimliliğinin göz önünde bulundurulması gerekir ve bu sorunun üstesinden gelmek için bir dizi yaklaşımda olunmuştur.
Polibren, hücre zarındaki yükleri nötralize edebilen ve böylece transdüksiyon20 sırasında viryonun hücrelere bağlanma...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Dr. Tz-Ling Chen'in teknik desteği için minnettarız. Ulusal RNAi Çekirdek Tesisi'ne (Academia Sinica, Tayvan) shRNA lentivirüs (http://rnai.genmed.sinica.edu.tw) sağladığı için teşekkür ederiz. Bu çalışma Bilim ve Teknoloji Bakanlığı, Tayvan (MOST 108-2320-B-002-037-MY3 ve MOST 109-2320-B-002-054-MY3) tarafından desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC/Cy7 anti-mouse CD11c Antibody | Biolegend | 117324 | (Clone: N418) |
| FITC anti-mouse/human CD11b Antibody | Biolegend | 101206 | (Clone: M1/70) |
| PE anti-mouse/human B220 Antibody | Biolegend | 103208 | (Clone: RA3-6B2) |
| Cell culture | |||
| 1.5 mL Micro tube | ExtraGene | TUBE-170-C | |
| 12-well tissue culture-treated plate | Falcon | 353043 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| RPMI 1640 medium | gibco | 11875-085 | |
| Reagent | |||
| β-estradiol | Sigma-Aldrich | E2758-250MG | |
| β-mercaptoethanol (β-ME) | Sigma-Aldrich | M6250 | |
| FACS buffer | home-made | Formula: 1xPBS+0.5 %FBS+0.1%NaN3 | |
| Flt3 ligand (FL) | home-made | ||
| Polybrene | Sigma-Aldrich | TR-1003-G | |
| Puromycin | Invivogen | ant-pr-1 | |
| TRIsure | BIOLINE | BIO-38032 | |
| shRNA (Taregt sequence/clone ID) | Company | ||
| shId2 (GCTTATGTCGAATGATAGCAA/TRCN0000054390) | The RNAi Consortium (TRC) | ||
| shLacZ (CGCGATCGTAATCACCCGAGT/TRCN0000072224) | The RNAi Consortium (TRC) | ||
| shTcf4 (GCTGAGTGATTTACTGGATTT/TRCN0000012094) | The RNAi Consortium (TRC) |
Referanslar
- Steinman, R. M., Witmer, M. D. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proceedings of the National Academy of Sciences. 75 (10), 5132-5136 (1978).
- Guilliams, M., et al. Dendritic cells, monocytes and macrophages: a unified nomenclature based on ontogeny. Nature Reviews Immunology. 14 (8), 571-578 (2014).
- Blasius, A. L., Cella, M., Maldonado, J., Takai, T., Colonna, M. Siglec-H is an IPC-specific receptor that modulates type I IFN secretion through DAP12. Blood. 107 (6), 2474-2476 (2006).
- Swiecki, M., Colonna, M. Unraveling the functions of plasmacytoid dendritic cells during viral infections, autoimmunity, and tolerance. Immunology Reviews. 234 (1), 142-162 (2010).
- Liu, Y. -J. IPC: Professional Type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annual Review of Immunology. 23 (1), 275-306 (2005).
- Panda, S. K., Kolbeck, R., Sanjuan, M. A. Plasmacytoid dendritic cells in autoimmunity. Current Opinion in Immunology. 44, 20-25 (2017).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- Mashayekhi, M., et al. CD8α(+) dendritic cells are the critical source of interleukin-12 that controls acute infection by Toxoplasma gondii tachyzoites. Immunity. 35 (2), 249-259 (2011).
- Anderson, D. A., Dutertre, C. -A., Ginhoux, F., Murphy, K. M. Genetic models of human and mouse dendritic cell development and function. Nature Reviews Immunology. 21 (2), 101-115 (2021).
- Plantinga, M., et al. Conventional and monocyte-derived CD11b(+) dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen. Immunity. 38 (2), 322-335 (2013).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Kumamoto, Y., et al. CD301b+ dermal dendritic cells drive T helper 2 cell-mediated immunity. Immunity. 39 (4), 733-743 (2013).
- Cisse, B., et al. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development. Cell. 135 (1), 37-48 (2008).
- Grajkowska, L. T., et al. Isoform-specific expression and feedback regulation of E protein TCF4 control dendritic cell lineage specification. Immunity. 46 (1), 65-77 (2017).
- Jackson, J. T., et al. Id2 expression delineates differential checkpoints in the genetic program of CD8α+ and CD103+ dendritic cell lineages. The EMBO Journal. 30 (13), 2690-2704 (2011).
- Suzuki, S., et al. Critical roles of interferon regulatory factor 4 in CD11bhighCD8alpha- dendritic cell development. Proceedings of the National Academy of Science U. S. A. 101 (24), 8981-8986 (2004).
- Rodrigues, P. F., et al. Distinct progenitor lineages contribute to the heterogeneity of plasmacytoid dendritic cells. Nature Immunology. 19 (7), 711-722 (2018).
- Brown, C. C., et al. Transcriptional basis of mouse and human dendritic cell heterogeneity. Cell. 179 (4), 846-863 (2019).
- Redecke, V., et al. Hematopoietic progenitor cell lines with myeloid and lymphoid potential. Nature Methods. 10 (8), 795-803 (2013).
- Abe, A., Miyanohara, A., Friedmann, T. Polybrene increases the efficiency of gene transfer by lipofection. Gene Therapy. 5 (5), 708-711 (1998).
- Sorgi, F. L., Bhattacharya, S., Huang, L. Protamine sulfate enhances lipid-mediated gene transfer. Gene Therapy. 4 (9), 961-968 (1997).
- Kirkling, M. E., et al. Notch signaling facilitates in vitro generation of cross-presenting classical dendritic cells. Cell Reports. 23 (12), 3658-3672 (2018).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nature Reviews. Immunology. 15 (1), 18-29 (2015).
- Wculek, S. K., Khouili, S. C., Priego, E., Heras-Murillo, I., Sancho, D. Metabolic Control of Dendritic Cell Functions: Digesting Information. Frontiers in Immunology. 10 (775), (2019).
- Saxton, R. A., Sabatini, D. M. mTOR signaling in growth, metabolism, and disease. Cell. 168 (6), 960-976 (2017).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır