A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מחקר של התפתחות תאים דנדריטיים על ידי קצר סיכות ראש RNA מתווך RNA נוקאאוט גזע הגבעול Hematopoietic וקו תא האב הקדמה במבחנה
In This Article
Summary
כאן אנו מספקים פרוטוקול לסינון גורמי שעתוק פוטנציאליים המעורבים בפיתוח של תא דנדריטי (DC) באמצעות transduction lentiviral של shRNA כדי להשיג קווי תא נוק-אאוט יציבים עבור בידול במבחנה DC.
Abstract
תאים דנדריטיים (DCs) הם תאים חשובים המציגים אנטיגן המחברים תגובות חיסוניות מולדות ומסתגלות. בקרי קבוצת מחשבים (DCs) הם הטרוגניים וניתן לחלקם למחשבי DDC (cDCs) קונבנציונליים ולמחשבי DDC (מחשבים אישיים). cDCs מתמחה בהצגת אנטיגנים כדי ולהפעיל תאי T נאיביים. מצד שני, מחשבים אישיים יכולים לייצר כמויות גדולות של אינטרפרונים מסוג I (IFN-I) במהלך זיהום ויראלי. המפרט של DCs מתרחש בשלב מוקדם של אבות DC במח העצם (BM) ומוגדר על ידי רשת של גורמי שעתוק (TFs). לדוגמה, cDCs מבטאים מאוד ID2, בעוד שמחשבי PC מבטאים מאוד E2-2. מאחר שיותר ויותר קבוצות משנה של בקרי מחשבי DVD מזוהות, יש עניין גובר בהבנת TFs ספציפיים השולטים בפיתוח DC. כאן, אנו יוצרים שיטה כדי לסנן TFs קריטי עבור DCs בידול במבחנה על ידי מתן lentivirus נושאת RNA סיכת ראש קצרה (shRNA) לתוך גזע hematopoietic מונצח ותא אב (iHSPCs) קו. לאחר הבחירה ובידול במבחנה , פוטנציאל cDC ו- pDC של קווי התאים הנוק-דאון היציבים מנותחים על-ידי ציטומטריית זרימה. גישה זו מספקת פלטפורמה לזיהוי גנים שעשויים לשלוט בגורל DC מאבות אבותיהם במבחנה.
Introduction
DCs הם רגולטורים מרכזיים של חסינות מולדת ומסתגלת1. בקרי קבוצת מחשבים מסווגים בעיקר לשתי אוכלוסיות נפרדות מבחינה תפקודית, כלומר מחשבי PC ו- cDCs. יתר על כן, cDCs כוללים שתי קבוצות משנה, כלומר, הקלד I וסוג II cDCs או cDC1s ו cDC2s, בהתאמה2. מחשבי PC, המבטאים BST2, Siglec-H ורמות ביניים של CD11c בעכברים 3,4, הם התאים שיכולים להפריש כמויות גדולות של IFN-I במהלך דלקת וזיהום ויראלי5. בשל יכולת הייצור החזקה שלהם IFN-I, הם גם חשודים לשחק תפקיד מפתח בהתקדמות של מחלות אוטואימוניות, כולל זאבת אדמנתית מערכתית (SLE)6. cDC1s, המוגדרים על ידי ביטוי פני השטח של XCR1, CD8a, CLEC9A ו- CD103 בעכברים7, מתמחים בהפעלה וקיטוב של תאי CD8+ T ציטוטוקסיים (CTLs) באמצעות המצגת הצולבת של אנטיגן, ובכך יוזמים חסינות מסוג I בתגובה לפתוגנים תאיים וסרטן8,9. מצד שני, cDC2s, ביטוי CD11b ו CD172α (הידוע גם בשם Sirpα) הן בבני אדם והן בעכברים, יכול להפעיל תאי CD4 + T ולקדם תגובה חיסונית מסוג II נגד אלרגנים וטפילים10, כמו גם לווסת חסינות מסוג III בעקבות חיידקים חוץ תאיים וזיהוי מיקרוביוטה11,12.
גיוון של DCs נקבע על ידי קבוצה של TFs מגזע hematopoietic ותאי אב (HSPCs) ב BM. E2-2 (מקודד על ידי Tcf4) הוא וסת ראשי לבידול ותפקוד של pDCs13,14. לעומת זאת, המעכב של DNA מחייב 2 (ID2) מניע את מפרט cDC ומעכב את התפתחות ה- pDC באמצעות חסימת פעילות חלבון E15. יתר על כן, הפיתוח של cDC1s דורש IRF8 ו BATF3, בעוד בידול של cDC2s תלוי מאוד IRF416. עבודות אחרונות חקרו את ההטרוגניות של מחשבים אישיים17 ו- cDCs ואת תקנות התמלול שלהם18. בשל המורכבות של רשת DC, יש צורך ללא מענה להקים פלטפורמה לזיהוי TFs אחרים השולטים בפיתוח ובפונקציונליות של בקרי קבוצת מחשבים.
כאן, השתמשנו iHSPC שנוצר על ידי ביטוי אסטרוגן מוסדר טרנסלוקציה גרעינית של Hoxb8 בתאי BM (המכונה גם תאי Hoxb8-FL)19. iHSPCs יכול להתרבות ולהישאר בשלב לא מובחן בנוכחות β אסטרדיול ו Flt3 ליגנד (FL), ואילו הם מתחילים להתמיין לסוגי DC שונים בנוכחות FL עם נסיגה של β-אסטרדיול19. בהתבסס על תכונה זו, אנו יכולים להפיל גנים של עניין בשלב האבות, ואחריו לבחון את ההשפעה על בידול במבחנה של מחשבים אישיים ו- cDCs. לכן, שיטה זו היא כלי רב עוצמה כדי לגלות את הגנים המסדירים את הפיתוח והתפקוד של DCs.
Protocol
הטיפול lentivirus מתבצע על פי הרגולציה של המחלקה לבריאות ובטיחות הסביבה של המכללה הלאומית לרפואה של אוניברסיטת טייוואן הלאומית.
1. הכנת גבעול hematopoietic מונצח וקווי תאים אבהיים (iHSPCs)
- שמור על קו התא iHSPC במדיום RPMI 1640 מלא המכיל 100 ננוגרם / מ"ל FL ו 1 מיקרומטר β אסטרדיול.
- מעבר התאים ביחס של 1:10 כל 3 ימים.
הערה: הפוך RPMI 1640 מלא בינוני על ידי שכשהם עם 10% סרום בקר עוברי (FBS), 5 x 10-5 M β-mercaptoethanol, ו 10 מיקרוגרם / מ"ל גנטמיצין. רקומביננטי murine FL זמין גם מסחרית.
2. טרנסדוקציה לנטי-ויראלית
- צלחת iHSPCs בצפיפות של 1 x 105 תאים / גם בלוחות 12-well ב 1 מ"ל של מדיום מלא המכיל 100 ng / mL FL, 1 מיקרומטר β אסטרדיול, ו 8 מיקרוגרם / mL polybrene.
הערה: הריכוז של polybrene תלוי בסוגי התאים והוא בדרך כלל בטווח של 4-8 מיקרוגרם / מ"ל. - הוסף lentivirus נושא shRNA בכל באר בריבוי של זיהום (MOI) של 100.
הערה: וקטור lentiviral הוא pLKO.1-Puro עם סמן בחירת פורומיצין (איור 1). רצפי היעד של shRNAs נגד LacZ, Tcf4 ו - Id2, בהתאמה, מפורטים בטבלת החומרים. ה- MOI מוגדר על ידי מספר הוויריונים המתווספים לכל תא במהלך ההדבקה.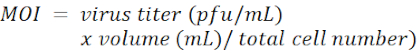
- לסובב את הצלחות ב 1,100 x g במשך 90 דקות ב 37 °C (50 °F).
הערה: זיהום ספין מתבצע באמצעות רוטור דלי נדנדה. - דגירה הצלחת המכילה תאים נגועים למשך הלילה ב 37 °C (50 °F) באינקובטור.
הערה: אם התאים רגישים לפוליברן, רענן את התאים עם המדיום המלא ללא פוליברן לאחר זיהום הספין. - רענן תאים עם מדיום מלא המכיל 100 ng/mL FL ו 1 מיקרומטר β אסטרדיול 24 שעות לאחר הזיהום.
- הוסף 6 מיקרוגרם / מ"ל של פורומיצין למדיום כדי לבחור את התאים הנגועים לאחר 24 שעות נוספות.
הערה: וקטור lentiviral Transduced בדרך כלל לוקח 48 שעות להבעת גנים, כולל גן עמיד בפני פורומיצין. ודא כי הריכוז של puromycin ממוטב עבור כל קו תא. - רענן את מדיום הבחירה המכיל 100 ng/mL FL, 1 μM β-אסטרדיול, ו 6 מיקרוגרם / מ"ל פורומיצין כל 3 ימים ולשמור על התאים במשך שבוע אחד לפחות כדי להרחיב את תאי iHSPC המועברים ביציבות.
הערה: בחירת Puromycin בדרך כלל נכנסת לתוקף 48 שעות מאוחר יותר, ותקופת הבחירה תלויה בסוגי תאים.
3. מדידת יעילות הנוקאאוט על ידי שעתוק הפוך ו-PCR בזמן אמת (RT-PCR)
- יש לחלץ את סך כל הרנ"א מ-1 x 107 shLacZ, shTcf4 ו-shId2 תאי iHSPC יציבים באמצעות ריאגנט מיצוי RNA מסחרי ורנ"א מזורז מהשכבה המימית עם איזופרופנול, ואחריו שטיפת משקעי הרנ"א עם 75% אתנול.
- להמיס את RNA (~ 5 מיקרוגרם) עם 5 μL של DEPC שטופלו H2O ולהתאים את הריכוז ל 1 מיקרוגרם / μL.
- קח 1-3 מיקרוגרם של RNA, לערבב עם H2O שטופלו DEPC לנפח סופי של 17.4 μL, להוסיף 1 μL של 1 יחידה / μL RNase חינם DNase I ודגור במשך 20 דקות ב 37 °C (37 °F).
הערה: שלב זה הוא לעכל את ה- DNA הגנומי בדגימות ה- RNA. - הוסף 1 μL של 20 מ"מ EDTA לדגימות RNA, דגירה ב 65 °C (65 °F) במשך 10 דקות כדי להשבית DNase I, ולשים את דגימות RNA מיד ב 4 °C (60 °F).
- הוסף 11.6 μL של תערובת התגובה המכילה 1 μL של μl של oligo (dT) פריימרים (45 מיקרומטר), 6 μL של 5x 1 חיץ גדיל 1, 3 μL של dNTP (2 מ"מ), 0.6 μL של מעכבי RNase (50 יחידה / μL) ו 1 μL של תמלול הפוך (200 יחידה / μL) לדגימות RNA ודגר ב 40 °C (40 °C ( 50 ° C עבור 1 h.
- לעצור את התגובה על ידי חימום ב 70 °C (70 °F) במשך 10 דקות לדלל את תערובת התגובה עם 30 μL של H2O.
- קח 2 μL של תערובת התגובה RT מדולל כתבנית DNA ו PCR להגביר אותו באמצעות פריימרים נגד Tcf4 או Id2 (ראה טבלה 1 עבור תנאי thermocycler).
הערה: רצפי הפריימר כלולים בטבלת החומרים.
4. בידול במבחנה של קווי התא היציבים של iHSPC
- שמור על נוקאאוט יחיד יציב של LacZ (shLacZ), Tcf4 (shTcf4), או Id2 (shId2) ב- iHSPCs במדיום מלא המכיל 100 ng/mL של FL ו 1 מיקרומטר β אסטרדיול.
- לאסוף shLacZ, shTcf4, ו shId2 iHSPCs לא מובחנים לתוך צינור 15 מ"ל צנטריפוגה במשך 5 דקות ב 500 x גרם כדי גלולה התאים.
- להשליך את supernatant ולהוסיף 10 מ"ל של PBS לשטוף את התאים. חזור על שלב זה פעמיים.
- Resuspend ולזרוע את תאי iHSPC בצפיפות של 2 x 105 תאים / מ"ל לתוך צלחת 12-well ב 1 מ"ל של מדיום מלא המכיל 100 ng / mL FL בלבד.
- הוסף 1 מ"ל של מדיום מלא טרי המכיל 100 ng / mL FL שלושה ימים לאחר מכן.
- נתח את התאים המובחנים (shLacZ, shTcf4 ו- shId2 iHSPCs) על-ידי ציטומטריית זרימה יומיים לאחר מכן.
5. ניתוח ציטומטרי זרימה של בקרי התחום המובחנים
- לאסוף את התאים לתוך צינורות 1.5 מ"ל על ידי צנרת התאים למעלה ולמטה 2-3 פעמים בצלחת, וצנטריפוגה במשך 5 דקות ב 500 x גרם בטמפרטורת החדר (RT).
הערה: בקרי DC מובחנים במבחנה יתחברו מעט ללוחות. צינורות עדינים יעזרו לשחזר DCs מהלוחות. - השלך את supernatant ו resuspened התאים ב 50 μL של מאגר FACS. לאחר מכן, להוסיף 50 μL של אנטי CD16/32 hybridoma supernatant ודגר במשך 5-10 דקות על קרח.
הערה: נוגדן חסימת Fc מונע קשירה לא ספציפית של נוגדנים לקולטני Fc המתבטאים בחלק מתאי המיאלואידים ותאי B וזמינים מסחרית באמצעות ספקים שונים. - הוסיפו נוגדנים מצומדים בצבע פלואורסצנטי (0.04 מיקרוגרם לכל נוגדן) ישירות לתאים ודגרו במשך 15 דקות על קרח בחושך. הנוגדנים המשמשים הם APC/cy7 נגד עכבר CD11c, FITC נגד עכבר CD11b, ו PE אנטי עכבר B220.
הערה: מחשבי pDC מוגדרים כ- CD11c + CD11b-B220+, ו- cDCs מוגדרים כ- CD11c + CD11b +B220-. - לשטוף תאים עם 1 מ"ל של מאגר FACS וצנטריפוגה במשך 5 דקות ב 500 x g ב RT.
- לפנק מחדש את התאים ב 100 μL של מאגר FACS וניתח על ידי cytometry זרימה.
תוצאות
המפה של pLKO.1-Puro וקטור lentiviral מוצגת (איור 1). לאחר המסירה של lentivirus מבטא shRNA נגד LacZ (בקרת אי-מיקוד), Tcf4, ו- Id2 ב- iHSPCs, יעילות הנוקאאוט שאושרה על ידי RT-qPCR חשפה כי הביטוי של Tcf4 הופחת ב- shTcf4 iHSPCs, בהשוואה ל- shLacZ iHSPCs (איור 2A). מצד שני, הירידה בביטוי ?...
Discussion
וקטורים shRNA מבוססי Lentivirus משמשים לעתים קרובות להשתקת גנים על ידי טרנסדוקציה ויראלית לתאים ומאפשרים שילוב יציב בגנום המארח. עם זאת, יש לקחת בחשבון יעילות transduction שונים בסוגי תאים שונים, וננקטו מספר גישות כדי להתגבר על בעיה זו.
Polybrene הוא פולימר פוליקטי שיכול לנטרל את המטענים על ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים על התמיכה הטכנית של ד"ר צ-לינג חן. אנו מודים למתקן הליבה הלאומי RNAi (האקדמיה סיניקה, טייוואן) על מתן shRNA lentivirus (http://rnai.genmed.sinica.edu.tw). עבודה זו נתמכה על ידי משרד המדע והטכנולוגיה, טייוואן (רוב 108-2320-B-002-037-MY3 ורוב 109-2320-B-002-054-MY3).
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC/Cy7 anti-mouse CD11c Antibody | Biolegend | 117324 | (Clone: N418) |
| FITC anti-mouse/human CD11b Antibody | Biolegend | 101206 | (Clone: M1/70) |
| PE anti-mouse/human B220 Antibody | Biolegend | 103208 | (Clone: RA3-6B2) |
| Cell culture | |||
| 1.5 mL Micro tube | ExtraGene | TUBE-170-C | |
| 12-well tissue culture-treated plate | Falcon | 353043 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| RPMI 1640 medium | gibco | 11875-085 | |
| Reagent | |||
| β-estradiol | Sigma-Aldrich | E2758-250MG | |
| β-mercaptoethanol (β-ME) | Sigma-Aldrich | M6250 | |
| FACS buffer | home-made | Formula: 1xPBS+0.5 %FBS+0.1%NaN3 | |
| Flt3 ligand (FL) | home-made | ||
| Polybrene | Sigma-Aldrich | TR-1003-G | |
| Puromycin | Invivogen | ant-pr-1 | |
| TRIsure | BIOLINE | BIO-38032 | |
| shRNA (Taregt sequence/clone ID) | Company | ||
| shId2 (GCTTATGTCGAATGATAGCAA/TRCN0000054390) | The RNAi Consortium (TRC) | ||
| shLacZ (CGCGATCGTAATCACCCGAGT/TRCN0000072224) | The RNAi Consortium (TRC) | ||
| shTcf4 (GCTGAGTGATTTACTGGATTT/TRCN0000012094) | The RNAi Consortium (TRC) |
References
- Steinman, R. M., Witmer, M. D. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proceedings of the National Academy of Sciences. 75 (10), 5132-5136 (1978).
- Guilliams, M., et al. Dendritic cells, monocytes and macrophages: a unified nomenclature based on ontogeny. Nature Reviews Immunology. 14 (8), 571-578 (2014).
- Blasius, A. L., Cella, M., Maldonado, J., Takai, T., Colonna, M. Siglec-H is an IPC-specific receptor that modulates type I IFN secretion through DAP12. Blood. 107 (6), 2474-2476 (2006).
- Swiecki, M., Colonna, M. Unraveling the functions of plasmacytoid dendritic cells during viral infections, autoimmunity, and tolerance. Immunology Reviews. 234 (1), 142-162 (2010).
- Liu, Y. -. J. IPC: Professional Type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annual Review of Immunology. 23 (1), 275-306 (2005).
- Panda, S. K., Kolbeck, R., Sanjuan, M. A. Plasmacytoid dendritic cells in autoimmunity. Current Opinion in Immunology. 44, 20-25 (2017).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- Mashayekhi, M., et al. CD8α(+) dendritic cells are the critical source of interleukin-12 that controls acute infection by Toxoplasma gondii tachyzoites. Immunity. 35 (2), 249-259 (2011).
- Anderson, D. A., Dutertre, C. -. A., Ginhoux, F., Murphy, K. M. Genetic models of human and mouse dendritic cell development and function. Nature Reviews Immunology. 21 (2), 101-115 (2021).
- Plantinga, M., et al. Conventional and monocyte-derived CD11b(+) dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen. Immunity. 38 (2), 322-335 (2013).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Kumamoto, Y., et al. CD301b+ dermal dendritic cells drive T helper 2 cell-mediated immunity. Immunity. 39 (4), 733-743 (2013).
- Cisse, B., et al. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development. Cell. 135 (1), 37-48 (2008).
- Grajkowska, L. T., et al. Isoform-specific expression and feedback regulation of E protein TCF4 control dendritic cell lineage specification. Immunity. 46 (1), 65-77 (2017).
- Jackson, J. T., et al. Id2 expression delineates differential checkpoints in the genetic program of CD8α+ and CD103+ dendritic cell lineages. The EMBO Journal. 30 (13), 2690-2704 (2011).
- Suzuki, S., et al. Critical roles of interferon regulatory factor 4 in CD11bhighCD8alpha- dendritic cell development. Proceedings of the National Academy of Science U. S. A. 101 (24), 8981-8986 (2004).
- Rodrigues, P. F., et al. Distinct progenitor lineages contribute to the heterogeneity of plasmacytoid dendritic cells. Nature Immunology. 19 (7), 711-722 (2018).
- Brown, C. C., et al. Transcriptional basis of mouse and human dendritic cell heterogeneity. Cell. 179 (4), 846-863 (2019).
- Redecke, V., et al. Hematopoietic progenitor cell lines with myeloid and lymphoid potential. Nature Methods. 10 (8), 795-803 (2013).
- Abe, A., Miyanohara, A., Friedmann, T. Polybrene increases the efficiency of gene transfer by lipofection. Gene Therapy. 5 (5), 708-711 (1998).
- Sorgi, F. L., Bhattacharya, S., Huang, L. Protamine sulfate enhances lipid-mediated gene transfer. Gene Therapy. 4 (9), 961-968 (1997).
- Kirkling, M. E., et al. Notch signaling facilitates in vitro generation of cross-presenting classical dendritic cells. Cell Reports. 23 (12), 3658-3672 (2018).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nature Reviews. Immunology. 15 (1), 18-29 (2015).
- Wculek, S. K., Khouili, S. C., Priego, E., Heras-Murillo, I., Sancho, D. Metabolic Control of Dendritic Cell Functions: Digesting Information. Frontiers in Immunology. 10 (775), (2019).
- Saxton, R. A., Sabatini, D. M. mTOR signaling in growth, metabolism, and disease. Cell. 168 (6), 960-976 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved