JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
대장포에이성 줄기및 전구세포주에서 짧은 헤어핀 RNA 중재 유전자 녹다운에 의한 수지상 세포 개발 연구
요약
여기서 우리는 체외 DC 분화에 대한 안정적인 녹다운 세포주를 얻기 위해 shRNA의 렌즈바이러스 트랜스듀션을 사용하여 수지상 세포(DC)의 개발에 관여하는 잠재적 전사 인자를 선별하기 위한 프로토콜을 제공합니다.
초록
수지상 세포 (DC)는 선천적이고 적응성 면역 반응을 연결하는 중요한 항원 제시 세포입니다. DC는 이질적이며 기존의 DC(cDC) 및 플라즈마 사이토이드 DC(pDC)로 나눌 수 있습니다. cDC는 순진한 T 세포를 위한 항원 제시를 전문으로 합니다. 한편, pDC는 바이러스 감염 시 다량의 타입 I 인터페론(IFN-I)을 생성할 수 있다. DC의 사양은 골수(BM)의 DC 전구체의 초기 단계에서 발생하며 전사 인자(TFs)의 네트워크에 의해 정의됩니다. 예를 들어, cDC는 높은 표현 ID2, PC는 높은 표현 E2-2 동안. 점점 더 많은 DC 하위 집합이 식별되고 있기 때문에 DC 개발을 제어하는 특정 TF를 이해하는 데 관심이 증가하고 있습니다. 여기서, 우리는 짧은 머리핀 RNA (shRNA)를 불멸의 조혈 줄기 및 선조 세포 (iHSPC) 라인으로 운반하는 렌즈 바이러스를 전달하여 시험관 내에서 DC 분화에 중요한 TFs를 선별하는 방법을 확립합니다. 안정적인 녹다운 세포 주 cDC 및 pDC 전위는 셀토메트리에 의해 분석된다. 이 접근은 시험관내선에서 선조에게서 DC 운명을 잠재적으로 지배하는 유전자를 확인하는 플랫폼을 제공합니다.
서문
DC는 선천적이고 적응형 면역의 주요 레귤레이터입니다1. DC는 주로 두 개의 기능적으로 구별되는 인구, 즉 pDC 및 cDC로 분류됩니다. 또한 cDC는 각각 I 형 및 유형 II cDC 또는 cDC1 및 cDC2의 두 개의 하위 집합을 포함합니다2. pDC, 발현 BST2, Siglec-H, 및 mice3,4에서 CD11c의 중간 수준은 염증 및 바이러스 감염 동안 많은 양의 IFN-I를 분비할 수 있는 세포입니다5. 그들의 강력한 IFN-I 생산 능력 때문에, 그(것)들은 또한 전신 루푸스 홍반성 (SLE)6를 포함하여 자기 면역 질병의 진행에 있는 중요한 역할을 하기 위하여 의심됩니다. cDC1s는 XCR1, CD8a, CLEC9A 및 CD103의 표면 발현에 의해 정의된 마우스7, 항원 교차 프레젠테이션을 통해 세포독성 CD8+ T 세포(CTL)의 활성화 및 편광에 전문화되어, 세포내 병원체 및 암에 대한 응답으로 I 면역을 시공한다. 한편, 인간과 마우스 모두에서 CD11b 및 CD172α(Sirpα라고도 함)를 발현하는 cDC2s는 CD4+ T 세포를 활성화하고 알레르겐 및 기생충에 대한 II형 면역 반응을 촉진할 수 있으며, 세포외 박테리아 및 미생물 인식에 따른 변조형 III 면역성을 11,12로 촉진할 수 있다.
DC의 다양화는 BM. E2-2(Tcf4에 의해 인코딩)에서 조혈 줄기 및 선조 세포(HSPC)로부터의 TF그룹에 의해 결정되며 pDC13,14의 분화 및 기능에 대한 마스터 레귤레이터이다. 대조적으로, DNA 결합 2(ID2)의 억제제는 cDC 사양을 구동하고 E 단백질 활성을 차단하여 pDC 개발을 억제한다15. 또한 cDC1의 개발은 IRF8 및 BATF3가 필요하며 cDC2의 차별화는 IRF416에 따라 다릅니다. 최근 작품은 pDC17및 cDC와 그들의 전사 규정18의 이질성을 탐구했다. DC 네트워크의 복잡성으로 인해 DC의 개발 및 기능을 제어하는 다른 TF를 식별할 수 있는 플랫폼을 구축해야 합니다.
여기서, 우리는 BM 세포에서 Hoxb8의 에스트로겐 조절 핵 전좌를 표현하여 생성된 iHSPC를 (Hoxb8-FL 세포라고도 함)를 사용했다 19. iHSPC는 β 에스트라디올과 Flt3 리간드(FL)가 있는 상황에서 차별화되지 않은 단계에 남아 있는 반면, β-estradiol19의 철수 시 FL의 존재속에서 다른 DC 유형으로 차별화하기 시작합니다. 이 기능을 바탕으로, 우리는 전조 단계에서 관심의 유전자를 노크 할 수 있습니다, 다음 PDC와 CDC의 체외 분화에 미치는 영향을 검사. 따라서, 이 방법은 DC의 발달 과 기능을 조절하는 유전자를 발견하는 강력한 도구이다.
프로토콜
렌티바이러스의 취급은 국립 대만 대학 의과 대학의 환경 보건 및 안전학과의 규정에 따라 수행됩니다.
1. 불멸의 조혈 줄기 및 선조 세포주 준비 (iHSPC)
- 100 ng/mL FL 및 1 μM β-estradiol을 포함하는 완전한 RPMI 1640 배지에서 iHSPC 세포줄을 유지합니다.
- 3일마다 1:10의 비율로 세포를 통과합니다.
참고: 10% 태아 소 혈청(FBS), 5 x 10-5M β-메르카포에탄올, 10 μg/mL 젠타미신으로 보충하여 완전한 RPMI 1640 배지를 만듭니다. 재조합 뮤린 FL도 시판됩니다.
2. 렌티바이러스 트랜스듀션
- 플레이트 iHSPC는 100 ng/mL FL, 1 μM β-estradiol 및 8 μg/mL 폴리브레인을 포함하는 완전한 배지의 1mL에서 12웰 플레이트에서 1 x 105 셀/웰의 밀도로.
참고: 폴리브레인의 농도는 세포 유형에 따라 다르며 일반적으로 4-8 μg/mL 범위에 있습니다. - 100의 감염 (MOI)의 복합성에 각 우물에 shRNA 운반 렌티 바이러스를 추가합니다.
참고: 렌티바이러스 벡터는 푸오마이신 선택 마커가 있는 pLKO.1-Puro입니다(도 1). LacZ, Tcf4 및 Id2 에 대한 shRNAs의 대상 시퀀스는 각각 재료 표에 나열됩니다. MOI는 감염 도중 세포 당 추가되는 virions의 수에 의해 정의됩니다.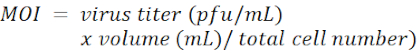
- 37°C에서 90분 동안 1,100 x g 에서 플레이트를 회전시합니다.
참고: 스핀 감염은 스윙 버킷 로터를 사용하여 수행됩니다. - 인큐베이터에서 37°C에서 하룻밤 동안 감염된 세포를 함유하는 플레이트를 배양한다.
참고: 세포가 폴리브레인에 민감한 경우 스핀 감염 후 폴리브레인없이 완전한 배지로 세포를 새로 고칩니다. - 감염 후 100 ng/mL FL 및 1 μM β-estradiol 24 h를 포함하는 완전한 배지를 가진 세포를 새로 고침합니다.
- 추가 24 시간 후에 감염된 세포를 선택하기 위하여 매체에 puromycin의 6 μg/mL를 추가합니다.
참고: 트랜스듀싱렌티바이러스 벡터는 일반적으로 푸오마이신 내성 유전자를 포함한 유전자를 발현하는 데 48h가 소요됩니다. 푸오마이신의 농도가 각 세포주에 최적화되어 있는지 확인하십시오. - 3일마다 100 ng/mL FL, 1μM β-estradiol 및 6 μg/mL 퓨로마이신을 포함하는 선택 배지를 새로 고치고 안정적으로 변환된 iHSPC 세포를 확장하기 위해 적어도 1주일 동안 세포를 유지한다.
참고: Puromycin 선택은 일반적으로 48 시간 후에 효력을 발휘하고, 선택의 기간은 셀 모형에 달려 있습니다.
3. 역전사 및 실시간 PCR(RT-PCR)에 의한 녹다운 효율 측정
- 1 x 107 shLacZ, shTcf4 및 shId2 안정녹다운 iHSPC 세포로부터 의 추출물 총 RNA를 이소프로판올로 수성 층으로부터 시약 및 침전 RNA를 사용하여 RNA를 75% 에탄올로 세척하였다.
- DEPC 처리 H2O의 5 μL로 RNA(~ 5 μg)를 용해하고 농도를 1 μg/μL로 조정합니다.
- RNA의 1-3 μg를 가지고, DEPC 처리 H2O와 혼합 17.4 μL의 최종 부피, 1 단위 / μL RNase 무료 DNase I의 1 μL을 추가하고 37 ° C에서 20 분 동안 배양하십시오.
참고: 이 단계는 RNA 샘플에서 게놈 DNA를 소화하는 것입니다. - RNA 샘플에 20mM EDTA의 1 μL을 추가하고, 65°C에서 10분 동안 배양하여 DNase I를 비활성화하고 RNA 샘플을 즉시 4°C로 넣습니다.
- 올리고(dT) 프라이머(45 μM), 5x 1위 가닥 버퍼의 6μL을 포함하는 반응 믹스의 11.6 μL을 추가, 3 μL 의 dNTP (2 mM), RNase 억제제의 0.6 μL (50 단위 /μL) 및 1 μL의 역 전사제 (200 단위/μL)를 RNA 샘플에 넣고 40 °C에서 1 h.
- 반응을 70°C에서 10분 동안 가열하여 반응을 멈추고 반응 혼합물을 H2O 30μL로 희석시하십시오.
- 희석된 RT 반응 믹스를 DNA 템플릿으로 복용하고 PCR은 Tcf4 또는 Id2에 대한 프라이머를 사용하여 증폭합니다(열사이클러 조건의 표 1 참조).
참고: 프라이머 시퀀스는 재료 표에 포함됩니다.
4. 안정적인 녹다운 iHSPC 세포주 체의 체외 분화
- FL의 100 ng/mL 및 1 μM β-estradiol을 포함하는 완전한 매체에서 LacZ (shLacZ), Tcf4 (shTcf4), 또는 Id2 (shId2)의 안정적인 단일 넉다운을 유지합니다.
- shLacZ, shTcf4 및 shId2 비분화 iHSPC를 15mL 튜브및 원심분리기로 500 x g에서 5분 동안 수집하여 세포를 펠릿합니다.
- 상체를 버리고 10mL의 PBS를 추가하여 세포를 씻으십시오. 이 단계를 두 번 반복합니다.
- iHSPC 세포를 2 x 105 셀/mL의 밀도로 100 ng/mL FL만 함유하는 완전한 배지의 1mL에서 12웰 플레이트로 재일시 중지 및 시드한다.
- 3일 후 100 ng/mL FL을 포함하는 신선한 완전 매체 1mL를 추가합니다.
- 2일 후 혈중 세포측정을 통해 분화세포(shLacZ, shTcf4 및 shId2 iHSPC)를 분석한다.
5. 차별화된 DC의 흐름 세포 측정 분석
- 플레이트에서 2-3배, 실온(RT)에서 500xg에서 5분 동안 원심분리기를 위아래로 피펫하여 세포를 1.5mL 튜브로 채집한다.
참고: 시험관 내 차별화된 DC는 플레이트에 약간 부착됩니다. 부드러운 파이펫팅은 플레이트에서 DC를 복구하는 데 도움이됩니다. - 상체를 버리고 FACS 버퍼의 50 μL에서 셀을 다시 중단합니다. 다음으로, 안티 CD16/32 hybridoma 수퍼나탈의 50 μL을 추가하고 얼음에 5-10 분 동안 배양합니다.
참고: Fc 차단 항체는 일부 골수성 세포 및 B 세포에 발현하는 Fc 수용체에 대한 항체의 비특이적 결합을 방지하고 다양한 공급 업체를 통해 시판됩니다. - 형광염항체(각 항체에 대해 0.04 μg)를 직접 첨가하고 어둠 속에서 얼음에 15분 동안 배양한다. 사용되는 항체는 APC/cy7 항마우스 CD11c, FITC 항마우스 CD11b 및 PE 항마우스 B220이다.
참고: pDC는 CD11c+CD11b-B220+로 정의되며 cDC는 CD11c+CD11b+B220-로 정의됩니다. - RT에서 500 x g 에서 5 분 동안 FACS 버퍼 및 원심 분리기 1 mL로 셀을 세척하십시오.
- FACS 버퍼의 100 μL에서 세포를 다시 중단하고 유동 세포측정에 의해 분석한다.
결과
렌티바이러스 벡터 pLKO.1-Puro의 지도가 표시됩니다(도 1). lacZ에 대한 shRNA를 발현하는 렌즈바이러스(비표적 제어), Tcf4 및 iHSPCPc에서 IHSPCC에서 확인된 녹다운 효율은 tcf4의 발현이 shLacZ iHSPCPC(그림 2A)에 비해 shTcf4 iHSPC에서 감소된 것으로 나타났습니다. 한편, id2의 감소된 발현은 shLacZ iHSPC 제어(
토론
Lentivirus 기반 shRNA 벡터는 종종 세포로 바이러스 성 변환에 의해 유전자 침묵에 사용되며 숙주 게놈으로 안정적인 통합을 허용합니다. 그러나, 상이한 세포 모형에 있는 각종 감과 효율을 고려해야 하고, 이 문제점을 극복하기 위하여 접근의 다수가 취해졌습니다.
폴리브레인은 세포막상에서 전하를 중화시킬 수 있는 다정화 폴리머로, 이를 통해 배관20 동안...
공개
저자는 공개 할 것이 없습니다.
감사의 말
Tz-Ling Chen 박사의 기술 지원에 감사드립니다. 우리는 shRNA 렌즈바이러스 (http://rnai.genmed.sinica.edu.tw)를 제공하는 국립 RNAi 코어 시설 (학계 시니카, 대만)에 감사드립니다. 이 작품은 대만 과학기술부(대부분 108-2320-B-002-037-MY3 및 MOST 109-2320-B-002-002-054-MY3)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC/Cy7 anti-mouse CD11c Antibody | Biolegend | 117324 | (Clone: N418) |
| FITC anti-mouse/human CD11b Antibody | Biolegend | 101206 | (Clone: M1/70) |
| PE anti-mouse/human B220 Antibody | Biolegend | 103208 | (Clone: RA3-6B2) |
| Cell culture | |||
| 1.5 mL Micro tube | ExtraGene | TUBE-170-C | |
| 12-well tissue culture-treated plate | Falcon | 353043 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| RPMI 1640 medium | gibco | 11875-085 | |
| Reagent | |||
| β-estradiol | Sigma-Aldrich | E2758-250MG | |
| β-mercaptoethanol (β-ME) | Sigma-Aldrich | M6250 | |
| FACS buffer | home-made | Formula: 1xPBS+0.5 %FBS+0.1%NaN3 | |
| Flt3 ligand (FL) | home-made | ||
| Polybrene | Sigma-Aldrich | TR-1003-G | |
| Puromycin | Invivogen | ant-pr-1 | |
| TRIsure | BIOLINE | BIO-38032 | |
| shRNA (Taregt sequence/clone ID) | Company | ||
| shId2 (GCTTATGTCGAATGATAGCAA/TRCN0000054390) | The RNAi Consortium (TRC) | ||
| shLacZ (CGCGATCGTAATCACCCGAGT/TRCN0000072224) | The RNAi Consortium (TRC) | ||
| shTcf4 (GCTGAGTGATTTACTGGATTT/TRCN0000012094) | The RNAi Consortium (TRC) |
참고문헌
- Steinman, R. M., Witmer, M. D. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proceedings of the National Academy of Sciences. 75 (10), 5132-5136 (1978).
- Guilliams, M., et al. Dendritic cells, monocytes and macrophages: a unified nomenclature based on ontogeny. Nature Reviews Immunology. 14 (8), 571-578 (2014).
- Blasius, A. L., Cella, M., Maldonado, J., Takai, T., Colonna, M. Siglec-H is an IPC-specific receptor that modulates type I IFN secretion through DAP12. Blood. 107 (6), 2474-2476 (2006).
- Swiecki, M., Colonna, M. Unraveling the functions of plasmacytoid dendritic cells during viral infections, autoimmunity, and tolerance. Immunology Reviews. 234 (1), 142-162 (2010).
- Liu, Y. -. J. IPC: Professional Type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annual Review of Immunology. 23 (1), 275-306 (2005).
- Panda, S. K., Kolbeck, R., Sanjuan, M. A. Plasmacytoid dendritic cells in autoimmunity. Current Opinion in Immunology. 44, 20-25 (2017).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- Mashayekhi, M., et al. CD8α(+) dendritic cells are the critical source of interleukin-12 that controls acute infection by Toxoplasma gondii tachyzoites. Immunity. 35 (2), 249-259 (2011).
- Anderson, D. A., Dutertre, C. -. A., Ginhoux, F., Murphy, K. M. Genetic models of human and mouse dendritic cell development and function. Nature Reviews Immunology. 21 (2), 101-115 (2021).
- Plantinga, M., et al. Conventional and monocyte-derived CD11b(+) dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen. Immunity. 38 (2), 322-335 (2013).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Kumamoto, Y., et al. CD301b+ dermal dendritic cells drive T helper 2 cell-mediated immunity. Immunity. 39 (4), 733-743 (2013).
- Cisse, B., et al. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development. Cell. 135 (1), 37-48 (2008).
- Grajkowska, L. T., et al. Isoform-specific expression and feedback regulation of E protein TCF4 control dendritic cell lineage specification. Immunity. 46 (1), 65-77 (2017).
- Jackson, J. T., et al. Id2 expression delineates differential checkpoints in the genetic program of CD8α+ and CD103+ dendritic cell lineages. The EMBO Journal. 30 (13), 2690-2704 (2011).
- Suzuki, S., et al. Critical roles of interferon regulatory factor 4 in CD11bhighCD8alpha- dendritic cell development. Proceedings of the National Academy of Science U. S. A. 101 (24), 8981-8986 (2004).
- Rodrigues, P. F., et al. Distinct progenitor lineages contribute to the heterogeneity of plasmacytoid dendritic cells. Nature Immunology. 19 (7), 711-722 (2018).
- Brown, C. C., et al. Transcriptional basis of mouse and human dendritic cell heterogeneity. Cell. 179 (4), 846-863 (2019).
- Redecke, V., et al. Hematopoietic progenitor cell lines with myeloid and lymphoid potential. Nature Methods. 10 (8), 795-803 (2013).
- Abe, A., Miyanohara, A., Friedmann, T. Polybrene increases the efficiency of gene transfer by lipofection. Gene Therapy. 5 (5), 708-711 (1998).
- Sorgi, F. L., Bhattacharya, S., Huang, L. Protamine sulfate enhances lipid-mediated gene transfer. Gene Therapy. 4 (9), 961-968 (1997).
- Kirkling, M. E., et al. Notch signaling facilitates in vitro generation of cross-presenting classical dendritic cells. Cell Reports. 23 (12), 3658-3672 (2018).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nature Reviews. Immunology. 15 (1), 18-29 (2015).
- Wculek, S. K., Khouili, S. C., Priego, E., Heras-Murillo, I., Sancho, D. Metabolic Control of Dendritic Cell Functions: Digesting Information. Frontiers in Immunology. 10 (775), (2019).
- Saxton, R. A., Sabatini, D. M. mTOR signaling in growth, metabolism, and disease. Cell. 168 (6), 960-976 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유