A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الاختبار السريع لمقاومة الأخشاب للتحلل البيولوجي من قبل القشريات البحرية المملة الخشب
In This Article
Summary
يقدم هذا البروتوكول طريقة لتقييم معدل تغذية القشريات المملة بالخشب، ليموريا، من خلال قياس إنتاج الكريات البرازية. وقد صممت هذه الطريقة للاستخدام في مختبرات غير متخصصة، ولها إمكانية دمجها في بروتوكولات الاختبار القياسية، لتقييم متانة الخشب المعززة في ظل الظروف البحرية.
Abstract
اللافقاريات المملة بالخشب تدمر بسرعة الأخشاب البحرية والبنية التحتية الساحلية الخشبية، مما يسبب مليارات الدولارات من الأضرار في جميع أنحاء العالم كل عام. وبما أن علاجات الخشب ذات المبيدات الحيوية واسعة الطيف، مثل الكريوسوت ومؤخرات النحاس الكرومات، مقيدة الآن في الاستخدام البحري بموجب التشريع، فإن الأنواع الخشبية المعمرة بشكل طبيعي وطرق الحفظ الجديدة للخشب مطلوبة. وتخضع هذه الأساليب للاختبار من أجل الوفاء بالمعايير التنظيمية، مثل المعيار الأوروبي لاختبار المواد الحافظة للأخشاب ضد البور البحري، EN 275. ويمكن إجراء التحقيقات الأولية في أنواع الأخشاب المعمرة أو علاجات حافظة للأخشاب بسرعة وبتكلفة زهيدة من خلال الاختبارات المختبرية، التي توفر مزايا كثيرة على التجارب الميدانية البحرية التي عادة ما تكون مكلفة، والمساعي الطويلة الأجل. العديد من أنواع ليموريا (غريبل) هي القشريات البحرية الخشبية مملة. تعتبر ليموريا مثالية للاستخدام في الاختبارات المختبرية للتحلل البيولوجي للخشب بواسطة الأخشاب البحرية ، نظرا لعدم التطبيق العملي لمربيتها في الدلو وسهولة قياس معدلات تغذيتها على الخشب. وفي هذه الخانة، نحدد الخطوط العريضة لاختبار مختبري موحد لتقييم التحلل البيولوجي للأخشاب باستخدام الجرب.
Introduction
ويمكن أن تسبب الأخشاب أضرارا كبيرة للهياكل الخشبية البحرية، مثل الدفاعات البحرية والأرصفة وهياكل الاستزراع المائي؛ استبدال أو استعادة التي تكلف مليارات الدولارات سنويا في جميع أنحاء العالم1،2،3. ومن أجل حماية هذه الهياكل، غالبا ما تعالج الأخشاب للحد من التحلل البيولوجي. ومع ذلك، وبسبب تقييد استخدام المبيدات الحيوية واسعة الطيف في أستراليا والاتحاد الأوروبي والمملكة المتحدة والولايات المتحدة الأمريكية، في البيئة البحرية، يتم البحث عن تقنيات تعديل جديدة وأنواع من الخشب التي هي دائمة بشكل طبيعي للبورات بعد 4،5،6،7. وتتطلب التقنيات الجديدة لحفظ الخشب في البيئة البحرية إجراء اختبار شامل من أجل الوفاء بالمعايير التنظيمية والحد من الآثار البيئية الناجمة عن المخاطر مثل ترشيح أي مادة حافظة كيميائية. فعلى سبيل المثال، يستخدم المعيار الأوروبي EN 275، وهو المعيار الأوروبي الحالي منذ عام 1992، لتقييم علاجات الحفاظ على الخشب ضد أضرار الأخشاب البحرية 8،9. ويستلزم هذا المعيار، إلى جانب تشريعات أخرى ضد استخدام مركبات الإبادة البيولوجية، مثل CCA4,5,6,7 و creosote10، أساليب مستدامة وغير سامة لحماية الأخشاب واستخدام أنواع خشبية دائمة بشكل طبيعي لتحل محل علاجات الإبادة البيولوجية11,12 . وتتطلب التجارب البحرية، مثل تلك المحددة في EN 275، فترات تعرض طويلة، وبالتالي فهي مكلفة وبطيئة في تحقيق نتائج ذات مغزى. غير أن الاختبارات المختبرية توفر بديلا أسرع بكثير لاختبار أساليب الحفاظ على منتجات الأخشاب ضد هجوم الأخشاب البحرية، مما يسمح بإجراء تقييم سريع للتعديلات على جداول المعالجة(13). وقد صممت نتائج هذه التجربة المختبرية السريعة لإبلاغ عمليات تعديل جديدة للأخشاب وتحديد أنواع الأخشاب ذات المتانة الطبيعية لتلف البورر. يمكن أن يشير انخفاض معدل التغذية والحيوية إلى زيادة المقاومة في المنتجات المحتملة ويمكن بعد ذلك تغذية هذه المعلومات مرة أخرى إلى شركاء الصناعة للسماح لهم بتحسين التصاميم. تسمح طريقتنا باستجابة ذكية وسريعة ، وهذا أمر مرغوب فيه في الصناعة ، وبمجرد تحديد المنتجات الواعدة ، يمكن استكمال النتائج بالنتائج من التجارب البحرية.
Gribbles (Limnoria) هي جنس من القشريات isopod في Limnoriidae الأسرة. هناك أكثر من 60 نوعا من ليموريا في جميع أنحاء العالم13,14,15، مع ثلاثة أنواع شائعة موجودة في المملكة المتحدة، ليمنيوريا ليغنروم، ليمنيوريا تريبونكتاتا وليمنيوريا quadripunctata16. وكانت تحمل أنفاقا على سطح الخشب غارقة في مياه البحر، مما يتسبب في كثير من الأحيان في أضرار كبيرة من الناحية الاقتصادية. الغريبل وفيرة للغاية في المياه الساحلية في المملكة المتحدة وسهلة الصيانة في ظل ظروف المختبر، مما يجعلها كائنات مثالية لدراسة التحلل البيولوجي الخشب عن طريق اللافقاريات البحرية مملة الخشب. ويمكن لتقييم معدلات التغذية وحيوية الشجيرات على مختلف أنواع الأخشاب وأساليب الحفاظ على الخشب أن يحدد فعالية مقاومتها للتحلل البيولوجي. يحدد البروتوكول التالي طريقة قياسية لقياس معدلات التغذية بالنسب، تم تطويرها من تلك التي وصفها بورخيس وزملاؤه12,17، بالإضافة إلى تبسيط إدخال تحليل الصور لجعل العملية قابلة للتشغيل في مختبرات غير متخصصة. كما يستخدم تحليل الصور للحد من القيود العملية للعد اليدوي لعدد كبير من العينات. المتانة في الاختبارات البحرية على المدى الطويل، وفقا لمعيار EN350-1:1994 البريطانية، يتم تصنيفها في إشارة إلى بينوس سيلفستريس sapwood18. في الاختبار المختبري على المدى القصير المعروضة هنا، ونحن نستخدم الصنوبر الاسكتلندي (بينوس سيلفستريس L) sapwood كتحكم لاختبار خشب القلب من الأنواع إيكي (لوفيرا ألاتا بانكس السابق C.F Gaertn)، الزان (فاغوس سيلفاتيكا L)، الكستناء الحلو (كاستانيا ساتيفا ميل) والتربنتين (Syncarpia glomulifera (Sm.) نيد). واستخدم متوسط إنتاج وحيوية الكريات البرازية بين ثماني نسخ متماثلة لكل نوع من أنواع الخشب كمؤشر على المتانة. نحن نقدم بيانات توضيحية تم جمعها من تقييم نموذجي ، وذلك باستخدام الأنواع limnoria quadripunctata ومجموعة من أنواع الأخشاب دائمة بشكل طبيعي. تم اختيار Limnoria quadripunctata ، التي حددتها المفاتيح التي قدمها Menzies (1951) ، كنوع مثالي لتجارب التحلل الحيوي نظرا لأنه أكثر أفراد الأسرة دراسة جيدا وهو راسخ كنوع نموذجي لاستخدامه في تجارب التحلل الحيوي. ينطبق هذا البروتوكول أيضا على اختبار الغابة من العلاجات المختلفة على الرغم من أن التحكم المستخدم يجب أن يكون تكرارات غير معالجة لنفس النوع.
Protocol
1. إعداد اختبار العصي
- بعد اكتمال أي عمليات علاج، قطع الخشب الجاف إلى اختبار العصي إلى حجم 2 مم × 4 ملم × 20 ملم (الشكل 1). الهواء الجاف العصي إلى وزن ثابت، في ظل ظروف المختبر. استخدام ما لا يقل عن 5 نسخ متماثلة من كل الخشب يجري اختبارها.

الشكل 1: اختبار العصي المستخدمة في الاختبارات المختبرية قصيرة الأجل لتقييم معدلات التغذية الجرب. اختبار العصي الخشب الحجم 2 مم × 4 ملم × 20 ملم. من اليسار إلى اليمين: إيكي، التربنتين، الكستناء الحلو والزان خشب القلب والاسكتلنديين الصنوبر sapwood. شريط مقياس 4 ملم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- تفريغ الفراغ
- إعداد الخشب آخر (أي، وقطع والعلاج، إذا كان ذلك ممكنا)، ووضع العصي تحت شبكة في وعاء من البلاستيك آمنة للأغذية، داخل مجفف فراغ واستبدال الغطاء ضمان وجود ختم ضيق، التي يسهلها طلاء الشحوم فراغ (الشكل 2).
- قم بإرفاق صمام ثلاثي بين الأنابيب التي تربط المجفف والمضخة، مع أنبوب ثالث يؤدي إلى الهواء الطلق (الشكل 2). تأكد من أن صمام ثلاثية مغلقة قبالة للهواء وتشغيل المضخة لتحقيق فراغ بين -0.75 إلى -1.0 شريط داخل فراغ المجفف وعقد هذا الفراغ لمدة 45 دقيقة - 1 ساعة.
- غمر الطرف المفتوح من الأنبوب الثالث في حاوية من مياه البحر. قم بإيقاف تشغيل المضخة وإغلاق الصمام المؤدي إلى المضخة، ثم افتح الصمام ببطء حتى يتم سحب مياه البحر بواسطة الفراغ إلى المجفف. السماح للماء بالتدفق حتى يملأ الحاوية البلاستيكية، فوق مستوى الشبكة.
- ثم سحب الأنبوب من مياه البحر في الحاوية، مما يسمح للهواء بالدخول، حتى يعود المجفف إلى الضغط الجوي. إبقاء العصي مغمورة تحت شبكة حتى تغرق إلى الجزء السفلي من الحاوية البلاستيكية.

الشكل 2: المعدات المستخدمة لتفريغ العصي الخشبية الملقحة بمياه البحر، استعدادا للتغذية إلى الفقاعات أثناء فحص التغذية المختبرية. أ) فراغ المجفف؛ ب) مضخة؛ ج) مقياس الضغط لمجفف فراغ؛ د) صمام ثلاثية تؤدي إلى فراغ المجفف، مضخة والهواء الطلق أو مياه البحر (أنبوب برتقالي). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- الرشح الخشب
- غمر العصي اختبار المشبعة بمياه البحر في مياه البحر الواردة في أنابيب 50 مل (الشكل 3). استبدال المياه بانتظام لمدة 20 يوما.
ملاحظة: تنطبق عملية الرشح على أي خشب تجريبي قيد الاختبار، بما في ذلك الغابات المعالجة أو الطبيعية.
- غمر العصي اختبار المشبعة بمياه البحر في مياه البحر الواردة في أنابيب 50 مل (الشكل 3). استبدال المياه بانتظام لمدة 20 يوما.

الشكل 3: الرشح من العصي الخشبية لإعداد التغذية إلى الشجيرات خلال فحص التغذية المختبرية. الخشب الذي كان مغمورا بالكامل في مياه البحر الواردة في أنبوب فالكون 50 مل، مع تغيير المياه العادية (1-3 أيام)، أنتجت رشح الملونة بشكل واضح. من اليسار إلى اليمين رشح من خشب القلب من; الكستناء الحلو، التربنتين، إيكي، والزان والاسكتلنديين الصنوبر sapwood. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. استخراج غريبل
- استخراج عينات فردية من الجريبل من كتلة الخشب الموبوءة. استخدام زوج من ملقط غرامة ورقيقة (حجم 000/0.4 ملم أو أصغر) فرشاة الرسم. قشر بعناية مرة أخرى أي الخشب الذي يغطي جحر جريبل مع ملقط
ملاحظة: توجد الجحور على سطح الخشب ويمكن التعرف عليها بواسطة ثقوب صغيرة (الشكل 4). - مرة واحدة وقد تعرضت gribble، واستخدام فرشاة لالتقاط بلطف الأفراد من تحت وإيداع في طبق بتري مليئة بمياه البحر. تحقق من الجريبل تحت المجهر لتحديد الأنواع وضمان عدم حدوث أي ضرر أثناء الاستخراج.
ملاحظة: الضرب pleopods هي علامة على الحيوية.- تجاهل أي الإناث المكتئب البيض والإناث gravid لديها قدرة التغذية أقل.

الشكل 4: صورة جحر جريبل مع اثنين من فتحات التهوية النموذجية. ل. جحر رباعي الثقوب على عصا من خشب الصنوبر Radiata، بحجم 2 مم × 4 مم × 20 ملم. ويمكن رؤية اثنين من فتحات التهوية أصغر بجوار مدخل الجحر. شريط مقياس 2 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- تحديد ليمنيوريا رباعية ال وربونكتاتا
- تحديد Limnoria quadripunctata تحت مجسمة من قبل الدرنات الأربعة متميزة، مرتبة في نمط مربع، على pleotelson الحيوان بالإضافة إلى كارينا على شكل X على pleonite19 الخامس (الشكل 5).

الشكل 5: Limnoria رباعية البونكتاتا تحديد السمات. صورة للسطح الظهري Limnoria quadripunctata، التي اتخذت على منظار ستيريوميكروميسكوب في التكبير x20. تحديد الميزات التي تظهر بواسطة السهم الأحمر - يشير إلى كارينا على شكل حرف X والسهم الأزرق - يشير إلى أربعة درنات على pleotelson. شريط مقياس 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد لوحات الآبار
- في لوحات متعددة الآبار مع آبار قطرها 20 ملم، ضع عصا اختبار واحدة و 5 مل من مياه البحر غير المصفاة، بين 32-35 وحدة دعم المشاريع، لكل بئر (الشكل 6).
- وضع العلاجات / أنواع الخشب بشكل منهجي في جميع أنحاء لوحة البئر بحيث يتم تمثيل كل نوع من الخشب مرة واحدة على الأقل لكل لوحة. إضافة جريبل واحد لكل بئر.
ملاحظة: يجب أن تبقى درجة الحرارة مستقرة في حاضنة عند 20 درجة مئوية ± 2 درجة مئوية للأنواع L. يمكن استخدام quadripunctata ، أنواع أخرى من ليمنيوريا مع تعديلات على درجة الحرارة التي تناسب الأنواع المحددة. - احتفظ بالألواح في ظروف مظلمة ثابتة لأن الضوابير الضوئية ليس لها تأثير على معدل التغذية الجريبل15.

الشكل 6: إعداد تجريبي لإجراء فحص تغذية التجريب. مثال على 12 لوحة متعددة الآبار المستخدمة في الاختبار المختبري لمعدل التغذية الجريبل. ويحتوي كل بئر على 5 مل من مياه البحر وعصا اختبار واحدة (20 مم × 4 مم × 2 مم) من أنواع خشبية مختلفة؛ الاسكتلنديون باين سابوود وإيكي، الزان، الكستناء الحلو، والربنتين خشب القلب. شريط مقياس 20 ملم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
4. جمع وعد الكريات البراز وتقييم الحيوية.
- مرتين في الأسبوع، وإزالة عصا الاختبار وكل جريبل (واحد لكل بئر) من لوحة البئر ووضعها في لوحة بئر أعدت مسبقا حديثا (تحتوي على 5 مل من مياه البحر لكل بئر [32-35 وحدة دعم النظام البيئي، 18-22 درجة مئوية]).
- استخدام فرشاة الطلاء لفرشاة بلطف قبالة أي الكريات البراز من العصا قبل نقل والاحتفاظ الكريات البراز داخل البئر الأصلي.
ملاحظة: قبل نقل النبل إلى طبق بئر طازج، يمكن تقييم الحيوية على مقياس من 1-5. 1 = ميت، 2 = سلبي، وليس على الخشب، 3 = السباحة بنشاط أو الضرب pleopods، وليس على الخشب، 4 = الزحف على سطح الخشب، 5 = محفورة في الخشب. - معالجة الصور
- استخدام فرشاة الطلاء غرامة لفصل أي كتل بحيث الكريات الفردية مرئية وفرشاة الكريات بعيدا عن حواف البئر. التقط صورة تفصيلية تحت مجهر ستيريو، عند تكبير x4 وتحميلها على جهاز كمبيوتر (الشكل 7).
ملاحظة: تأكد من أن الكريات في بؤرة التركيز والخلفية موحدة، مع عدم وجود ظلال أو انعكاسات ضوئية على سطح الماء.
- استخدام فرشاة الطلاء غرامة لفصل أي كتل بحيث الكريات الفردية مرئية وفرشاة الكريات بعيدا عن حواف البئر. التقط صورة تفصيلية تحت مجهر ستيريو، عند تكبير x4 وتحميلها على جهاز كمبيوتر (الشكل 7).
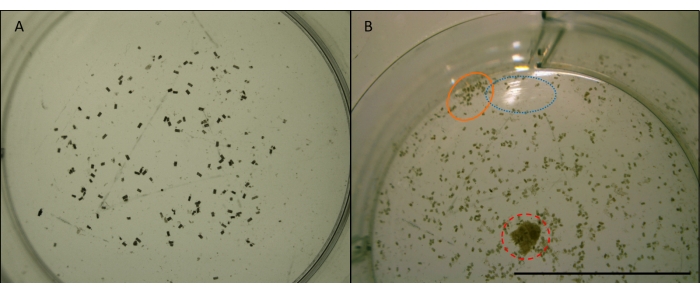
الشكل 7: صورة الكريات البرازية. ل. الكريات البرازية رباعية الربوكتاتا (حبيبات صغيرة أسطوانية وبنية) من التغذية على خشب الصنوبر Radiata في بئر واحد من لوحة متعددة الآبار. اتخذت في التكبير x4. الصور قبل التلاعب لتحليل الصور (انظر الشكل 7). أ) مثال على صورة مناسبة لاستخدامها في العد الآلي في ImageJ. الكريات تنتشر بما فيه الكفاية وبعيدا عن حواف البئر. يتمركز البئر ولا توجد عوائق أو انعكاسات. ب) مثال على صورة غير مناسبة لتحليل الصور. البئر خارج المركز، يقطع النصف السفلي. تظهر الدائرة الزرقاء (المنقطة) انعكاس الضوء قبالة سطح الماء. البرتقالي (الصلبة) دائرة يظهر الكريات التي تتجمع بشكل وثيق جدا معا وقريبة جدا من حافة البئر. دائرة حمراء (متقطعة) يظهر رقاقة الخشب التي لم تتم إزالتها. شريط مقياس 10 ملم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- عملية لتوليد عدد بيليه البراز باستخدام ImageJ.
- تحميل ImageJ (أحدث إصدار اعتبارا من 03/08/21، 1.8.0_172) من https://imagej.nih.gov/ij/download.html أو تشغيل من متصفح الكمبيوتر.
- تحميل مجموعة من الصور عن طريق سحب وإسقاط أو عن طريق تحديد ملف | استيراد | | تسلسل الصور تصفح. لا تقم بتغيير أية معلمات ثم حدد موافق.
- بعد ذلك ، استخدم أداة الدائرة لتحديد القسم السفلي من البئر الذي يحتوي على الكريات البرازية. إزالة حواف البئر، حدد تحرير | واضحة في الخارج. جعل الصورة ثنائية، حدد عملية | جعل ثنائي.
- معايرة عن طريق تحديد تحليل | تعيين مقياس واختيار عدد وحدات البكسل لكل ملليمتر للصورة (على سبيل المثال 10 بكسل = 1 مم). عد الكريات، حدد تحليل | تحليل الجسيمات.
- في المربع المجاور للحجم (unit2)، حدد عتبة أقل هي نفسها أصغر بيليه حجم، وذلك باستخدام مقياس الوحدة الذي تم تعيينه سابقا (على سبيل المثال، إذا كان 10 بكسل = 1 مم وأصغر بيليه هو 0.5 مم، اختر 5-infinity).
- في المربع إظهار المنسدلة، حدد المخططات التفصيلية ثم حدد ملخص واضغط على موافق (الشكل 8).
ملاحظة: يمكن العثور على مزيد من المعلومات في https://imagej.nih.gov/ij/docs/guide/index.html

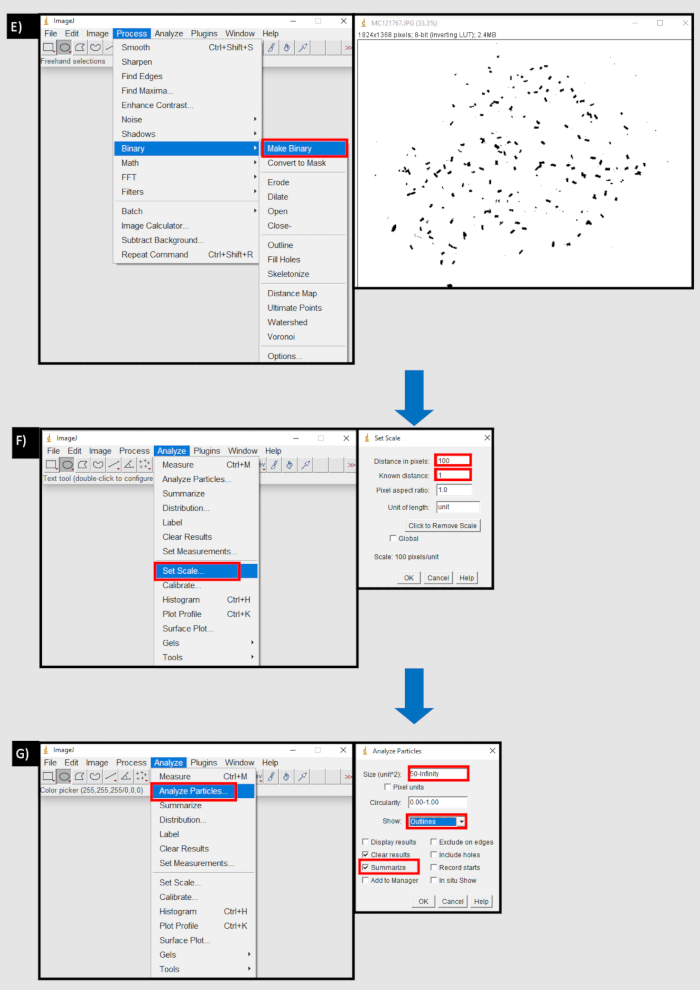
الشكل 8: رسم تخطيطي لتدفق العملية المستخدمة في ImageJ لحساب الكريات البرازية. أ) استيراد تسلسل صورة في علامة التبويب ملف ImageJ. ب) زر الاستعراض في مربع الحوار "استيراد تسلسل الصور" لاستيراد سلسلة من الصور من جهاز محلي. ج) باستخدام أداة دائرة لتحديد المنطقة التي تحتوي على الكريات البراز D) مسح خارج زر في منطقة التبويب تحرير لإزالة خارج منطقة مختارة. E) جعل زر ثنائي في علامة التبويب عملية. F) تعيين زر مقياس في علامة التبويب تحليل. المسافة بالبكسل تعادل عدد وحدات البكسل لوحدة قياس واحدة (مم). G) زر تحليل الجسيمات في علامة التبويب تحليل. الحجم (الوحدة^2) المعين إلى العتبة السفلية لحجم الكريات البرازية، بالبكسل، إلى ما لا نهاية. يتم تحديد إظهار "المخططات التفصيلية" و"التلخيص". يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
-
تحليل البيانات
- تحويل عدد الكريات إلى الكريات يوميا، والذي يعطي وقياس غير مباشر لمعدل التغذية. تجاهل البيانات من أي أفراد moulting في الأيام التي وقعت moulting (الشكل 9).
ملاحظة: يحدث Moulting على مدى 1-3 أيام ويمكن التعرف عليه عندما يمكن رؤية مولت كامل من الهيكل الخارجي.
- تحويل عدد الكريات إلى الكريات يوميا، والذي يعطي وقياس غير مباشر لمعدل التغذية. تجاهل البيانات من أي أفراد moulting في الأيام التي وقعت moulting (الشكل 9).

الشكل 9: مثال على المولت الزجري. Gribble (L. quadripunctata) moulting، على عصا اختبار خشب الصنوبر Radiata الحجم 20 ملم × 4 ملم × 2 ملم. ويشار إلى مولتس من قبل الدوائر الحمراء. شريط مقياس 2 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تجربة تغذية L. أجريت quadripunctata على مدى 20 يوما، وذلك باستخدام خمسة أنواع مختلفة من الخشب (الاسكتلنديين الصنوبر (بينوس سيلفستريس L) sapwood، وخشب القلب من الزان (فاغوس سيلفاتيكا L)، إيكي (لوفيرا ألاتا بانكس السابق C. F Gaertn)، الكستناء الحلو (كاستانيا ساتيفا ميل)، والتربنتي...
Discussion
قبل اختيار عينات الجربعة لاستخدامها في تجربة التغذية ، يجب فحص الأفراد لتقييم مدى ملاءمتها. يمكن أن يكون هناك بعض الاختلاف في معدل التغذية بين الأفراد بسبب الاختلافات في الحجم ، لذلك يجب اختيار عينات البالغين الكاملة النمو فقط. لم يتم الكشف عن أي فرق كبير بين معدل تغذية الأفراد بين 1.5 مم و ...
Disclosures
لا يوجد لدى المؤلفين تضارب في المصالح فيما يتعلق بهذه الدراسة.
Acknowledgements
شكرا لمجلس البحوث النرويجي (صندوق أوسلو الإقليمي، 269707 الكوفوفجور) وجامعة بورتسموث (منحة أبحاث دكتوراه كلية العلوم) لتوفير التمويل لدراسات لوسي مارتن. أيضا، لجيرفيه س. سوير الذي قدم الخشب المستخدمة لتوليد النتائج التمثيلية. تم توفير توربنتين من قبل البروفيسور فيليب إيفانز من جامعة كولومبيا البريطانية.
Materials
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
References
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved