È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Test rapidi di resistenza del legno alla biodegradazione da parte di crostacei marini che annoiano il legno
In questo articolo
Riepilogo
Questo protocollo presenta un metodo per valutare la velocità di alimentazione del crostaceo legnoso, Limnoria, misurando la produzione di pellet fecale. Questo metodo è progettato per l'uso in laboratori non specializzati e ha il potenziale per l'incorporazione nei protocolli di test standard, per valutare una maggiore durata del legno in condizioni marine.
Abstract
Gli invertebrati che trivellano il legno distruggono rapidamente i legni marini e le infrastrutture costiere in legno, causando miliardi di dollari di danni in tutto il mondo ogni anno. Poiché i trattamenti del legno con biocidi ad ampio spettro, come il creosoto e l'arseniato di rame cromato (CCA), sono ora limitati nell'uso marino dalla legislazione, sono necessarie specie di legno naturalmente durevoli e nuovi metodi di conservazione del legno. Questi metodi sono sottoposti a test al fine di soddisfare gli standard normativi, come la norma europea per il collaudo dei conservanti del legno contro le trivellatrici marine, EN 275. L'indagine iniziale su specie di legni durevoli o trattamenti di conservazione del legno può essere ottenuta in modo rapido ed economico attraverso test di laboratorio, che offrono molti vantaggi rispetto alle prove marine sul campo che sono in genere costose e a lungo termine. Molte specie di Limnoria (gribble) sono crostacei marini che annoiano il legno. I Limnoria sono ideali per l'uso in test di laboratorio di biodegradazione del legno da parte di piralide marine, grazie alla praticità di allevarli in acquari e alla facilità di misurare i loro tassi di alimentazione su legno. Qui, delineiamo un test di laboratorio standardizzabile per valutare la biodegradazione del legno utilizzando il gribble.
Introduzione
Le piralide possono causare ingenti danni alle strutture marine in legno, come le difese marine, i moli e le strutture di acquacoltura; la cui sostituzione o ripristino costa miliardi di dollari all'anno in tutto il mondo1,2,3. Per proteggere queste strutture, il legname viene spesso trattato per ridurre la biodegradazione. Tuttavia, a causa della restrizione dell'uso di biocidi ad ampio spettro in Australia, UE, Regno Unito e Stati Uniti, nell'ambiente marino, sono ricercate nuove tecniche di modifica e specie di legno che sono naturalmente durevoli per le trivellatrici4,5,6,7. Le nuove tecniche per la conservazione del legno nell'ambiente marino richiedono test approfonditi al fine di soddisfare gli standard normativi e limitare gli impatti ambientali derivanti da pericoli come la lisciviazione di qualsiasi conservante chimico. Ad esempio, la norma europea, EN 275, che è l'attuale norma europea del 1992, viene utilizzata per valutare i trattamenti di conservazione del legno contro i danni da piralide marina8,9. Questa norma, insieme ad altre legislazioni contro l'uso di composti biocidi, come CCA4,5,6,7 e creosoto10, richiede metodi sostenibili e non tossici di protezione del legno e l'uso di specie legnose naturalmente durevoli per sostituire i trattamenti biocidi11,12 . Le prove marine, come quelle specificate nella norma EN 275, richiedono lunghi periodi di esposizione e sono quindi costose e lente a produrre risultati significativi. I test di laboratorio, tuttavia, forniscono un'alternativa molto più rapida ai metodi di prova per preservare i prodotti del legno contro l'attacco della piralide marina, consentendo una rapida valutazione delle regolazioni dei programmi di trattamento13. I risultati di questo rapido esperimento di laboratorio sono progettati per informare nuovi processi di modifica del legno e per identificare le specie di legno con una durata naturale ai danni della piralide. Un basso tasso di alimentazione e vitalità possono indicare una maggiore resistenza nei potenziali prodotti e queste informazioni possono quindi essere restituite ai partner industriali per consentire loro di migliorare i progetti. Il nostro metodo consente una risposta agile e rapida, che è auspicabile nell'industria, e una volta identificati i prodotti promettenti, i risultati possono essere integrati con quelli delle prove marine.
Gribbles (Limnoria) è un genere di crostacei isopodi della famiglia Limnoriidae. Ci sono oltre 60 specie di Limnoria in tutto il mondo13,14,15, con tre specie comuni trovate nel Regno Unito, Limnoria lignorum, Limnoria tripunctata e Limnoria quadripunctata16. Hanno scavato tunnel sulla superficie del legno che è sommerso dall'acqua di mare, causando spesso danni economicamente significativi. I gribbles sono molto abbondanti nelle acque costiere del Regno Unito e sono facili da mantenere in condizioni di laboratorio, rendendoli organismi ideali per lo studio della biodegradazione del legno da parte di invertebrati marini. La valutazione dei tassi di alimentazione e della vitalità dei gribbl su diverse specie di legno e i metodi di conservazione del legno possono determinare l'efficacia della loro resistenza alla biodegradazione. Il seguente protocollo stabilisce un metodo standard per misurare i tassi di alimentazione dei gribble, sviluppato a partire da quello descritto da Borges e colleghi12,17, oltre a semplificare l'introduzione dell'analisi delle immagini per rendere il processo operabile in laboratori non specializzati. L'analisi delle immagini viene anche utilizzata per ridurre i limiti pratici del conteggio manuale di un gran numero di campioni. La durata nei test marini a lungo termine, secondo lo standard britannico EN350-1:1994, è classificata in riferimento all'alburno pinus sylvestris18. Nei test di laboratorio a breve termine qui presentati, utilizziamo l'alburno di pino silvestre (Pinus sylvestris L) come controllo per testare il durame delle specie ekki (Lophira alata Banks ex C.F Gaertn), faggio (Fagus sylvatica L), castagno dolce (Castanea sativa Mill) e trementina (Syncarpia glomulifera (Sm.) Nied). La produzione media di pellet fecale e la vitalità tra otto repliche per specie di legno sono state utilizzate come indicatore di durata. Forniamo dati illustrativi raccolti da una valutazione tipica, utilizzando la specie di gribble Limnoria quadripunctata e una gamma di specie di legname naturalmente durevoli. Limnoria quadripunctata, identificata dalle chiavi fornite da Menzies (1951), è stata selezionata come specie ottimale per gli studi di biodegradazione a causa del fatto che è il membro più ben studiato della famiglia ed è ben consolidato come specie modello per l'uso in studi di biodegradazione. Questo protocollo è applicabile anche per testare legni di trattamenti diversi, anche se il controllo utilizzato dovrebbe essere repliche non trattate della stessa specie.
Protocollo
1. Preparazione dei bastoncini di prova
- Al termine di qualsiasi processo di trattamento, tagliare il legno secco in bastoncini di prova a dimensioni 2 mm x 4 mm x 20 mm (Figura 1). L'asciugatura all'aria si attacca a un peso costante, in condizioni di laboratorio. Utilizzare almeno 5 repliche di ogni legno testato.

Figura 1: Bastoncini di prova utilizzati nei test di laboratorio a breve termine per valutare i tassi di alimentazione dei gribble. Test bastoncini di legno di dimensioni 2 mm x 4 mm x 20 mm. Da sinistra a destra: ekki, trementina, durame di castagno dolce e faggio e alburno di pino silvestre. Barra della scala 4 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Impregnazione sottovuoto
- Post preparazione del legno (cioè taglio e trattamento, se applicabile), posizionare i bastoncini sotto una rete in un contenitore di plastica sicuro per gli alimenti, all'interno dell'essiccatore sottovuoto e sostituire il coperchio assicurandosi che vi sia una tenuta ermetica, facilitata da un rivestimento di grasso sottovuoto (Figura 2).
- Collegare una valvola a tre vie tra il tubo che collega l'essiccatore e la pompa, con un terzo tubo che porta all'aria aperta (Figura 2). Assicurarsi che la valvola a tre vie sia chiusa all'aria e far funzionare la pompa per ottenere un vuoto compreso tra -0,75 e -1,0 bar all'interno dell'essiccatore a vuoto e mantenere questo vuoto per 45 minuti - 1 ora.
- Immergere l'estremità aperta del terzo tubo in un contenitore di acqua di mare. Spegnere la pompa e chiudere la valvola che porta alla pompa, quindi aprire lentamente la valvola fino a quando l'acqua di mare non viene aspirata dal vuoto nell'essiccatore. Lasciare scorrere l'acqua fino a riempire il contenitore di plastica, sopra il livello della rete.
- Quindi prelevare il tubo dall'acqua di mare nel contenitore, consentendo all'aria di entrare, fino a quando l'essiccatore ritorna alla pressione atmosferica. Tenere i bastoncini immersi sotto la rete fino a quando non affondano sul fondo del contenitore di plastica.

Figura 2: Apparecchiature utilizzate per l'incollaggio di bastoncini di legno con acqua di mare, in preparazione per l'alimentazione a gribbles durante un test di alimentazione di laboratorio. A) Essiccatore sottovuoto; B) Pompa; C) Manometro per l'essiccatore del vuoto; D) La valvola a tre vie che porta all'essiccatore a vuoto, alla pompa e all'aria aperta o all'acqua di mare (tubo arancione). Fare clic qui per visualizzare una versione più grande di questa figura.
- Lisciviazione del legno
- Immergere i bastoncini di prova saturi di acqua di mare nell'acqua di mare contenuta in tubi da 50 ml (Figura 3). Sostituire regolarmente l'acqua per un periodo di 20 giorni.
NOTA: Il processo di lisciviazione si applica a qualsiasi legno sperimentale in prova, compresi i legni trattati o naturali.
- Immergere i bastoncini di prova saturi di acqua di mare nell'acqua di mare contenuta in tubi da 50 ml (Figura 3). Sostituire regolarmente l'acqua per un periodo di 20 giorni.

Figura 3: Percolato da bastoncini di legno per la preparazione per l'alimentazione a gribbles durante un test di alimentazione di laboratorio. Il legno che era completamente immerso nell'acqua di mare contenuta in un tubo Falcon da 50 ml, con regolare ricambio d'acqua (1-3 giorni), produceva percolato distintamente colorato. Da sinistra a destra percolato da durame di; castagne dolci, trementina, ekki, faggio e alburno di pino silvestre. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Estrazione di Gribble
- Estrarre singoli esemplari di gribble da un blocco di legno infestato. Utilizzare un paio di pinze sottili e un pennello sottile (dimensioni 000/0,4 mm o più piccole). Staccare con cura qualsiasi legno che copre la tana di gribble con la pinza
NOTA: Le tane si trovano sulla superficie del legno e possono essere identificate da piccoli fori (Figura 4). - Una volta che il gribble è stato esposto, usa un pennello per raccogliere delicatamente gli individui da sotto e depositarli in una capsula di Petri piena di acqua di mare. Controllare il gribble al microscopio per identificare le specie e per assicurarsi che non siano stati causati danni durante l'estrazione.
NOTA: Battere i pleopodi è un segno di vitalità.- Scartare le femmine che covano le uova poiché le femmine gravide hanno una ridotta capacità di alimentazione.

Figura 4: Immagine di una tana di gribble con due tipici fori di ventilazione. L. tana quadripunctata su un bastone di legno di pino Radiata, dimensioni 2 mm x 4 mm x 20 mm. Due fori di ventilazione più piccoli possono essere visti accanto all'ingresso della tana. Barra della scala 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Identificazione di Limnoria quadripunctata
- Identificare Limnoria quadripunctata sotto uno stereomicroscopio dai quattro tubercoli distinti, disposti in uno schema quadrato, sul pleotelson dell'animale oltre a una carina a forma di X sulla quinta pleonite19 (Figura 5).

Figura 5: Limnoria quadripunctata che identifica le caratteristiche. Immagine della superficie dorsale Limnoria quadripunctata, presa su uno stereomicroscopio con ingrandimento x20. Le caratteristiche identificative mostrate dalla freccia rossa - indica la carina a forma di X e la freccia blu - indicano quattro tubercoli su pleotelson. Barra della scala 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Preparare i piatti del pozzo
- In piastre multi-pozzo con pozzetti di diametro 20 mm, posizionare un bastone di prova e 5 ml di acqua di mare non filtrata, tra 32-35 PSU, per pozzetto (Figura 6).
- Posizionare sistematicamente i trattamenti/specie di legno in tutta la piastra del pozzo in modo che ogni tipo di legno sia rappresentato almeno una volta per piastra. Aggiungi un gribble per pozzetto.
NOTA: La temperatura deve essere mantenuta stabile in un incubatore a 20 °C ± 2 °C per la specie L. quadripunctata, altre specie di Limnoria possono essere utilizzate con regolazioni della temperatura fatte per adattarsi alla specie specifica. - Mantenere le piastre in condizioni di buio costante poiché il fotoperiodo non ha un effetto sulla velocità di alimentazione del gribble15.

Figura 6: Configurazione sperimentale per il test di alimentazione del gribble. Un esempio di una piastra multi-pozzo 12 utilizzata nei test di laboratorio della velocità di alimentazione del gribble. Ogni pozzo contiene 5 ml di acqua di mare e un bastoncino di prova (20 mm x 4 mm x 2 mm) di diverse specie legnose; Alburno di pino silvestre ed ekki, faggio, castagno dolce e durame di trementina. Barra della scala 20 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Raccolta e conteggio dei pellet fecali e valutazione della vitalità.
- Due volte a settimana, rimuovere il bastoncino di prova e ogni gribble (uno per pozzetto) dalla piastra del pozzo e metterla in una piastra di pozzo appena pre-preparata (contenente 5 ml di acqua di mare per pozzetto [32-35 PSU, 18-22 °C]).
- Utilizzare un pennello per spazzolare delicatamente via eventuali pellet fecali dal bastoncino prima di trasferire e trattenere i pellet fecali all'interno del pozzo originale.
NOTA: Prima di trasferire il gribble in un piatto di pozzo fresco, la vitalità può essere valutata su una scala da 1 a 5; 1= morto, 2 = passivo, non sul legno, 3 = nuotare attivamente o battere i pleopodi, non sul legno, 4 = strisciare sulla superficie del legno, 5 = scavato nel legno. - Elaborazione di immagini
- Utilizzare un pennello fine per separare eventuali grumi in modo che i singoli pellet siano visibili e spazzolare i pellet lontano dai bordi del pozzo. Scatta una fotografia dettagliata al microscopio stereo, con ingrandimento x4 e caricala su un computer (Figura 7).
NOTA: Assicurarsi che i pellet siano a fuoco e che lo sfondo sia uniforme, senza ombre o riflessi di luce sulla superficie dell'acqua.
- Utilizzare un pennello fine per separare eventuali grumi in modo che i singoli pellet siano visibili e spazzolare i pellet lontano dai bordi del pozzo. Scatta una fotografia dettagliata al microscopio stereo, con ingrandimento x4 e caricala su un computer (Figura 7).
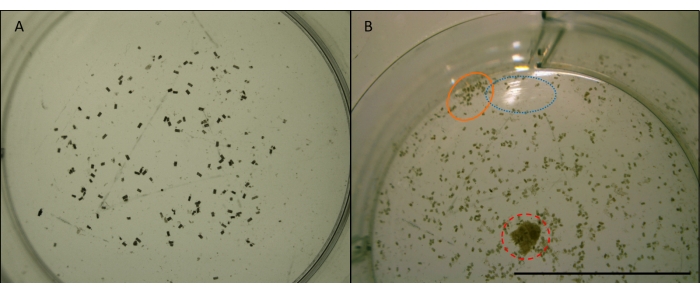
Figura 7: Immagine di pellet fecali gribble. L. pellet fecali quadripunctata (pellet piccoli, cilindrici, marroni) dall'alimentazione di legno di pino Radiata in un pozzo di una piastra multi-pozzo. Preso con ingrandimento x4. Immagini prima della manipolazione per l'analisi delle immagini (vedere la Figura 7). A) Esempio di un'immagine adatta da utilizzare per il conteggio automatico in ImageJ. I pellet sono sufficientemente sparsi e lontani dai bordi del pozzo. Il pozzo è centrato e non ci sono ostruzioni o riflessi. B) Un esempio di immagine che non è adatta per l'analisi dell'immagine. Il pozzo è fuori centro, tagliando la metà inferiore. Il cerchio blu (punteggiato) mostra il riflesso della luce dalla superficie dell'acqua. Il cerchio arancione (solido) mostra i pellet che sono raggruppati troppo strettamente tra loro e troppo vicino al bordo del pozzo. Il cerchio rosso (tratteggiato) mostra un truciolo di legno che non è stato rimosso. Barra della scala 10 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Processo per generare il conteggio del pellet fecale utilizzando ImageJ.
- Scarica ImageJ (ultima versione del 03/08/21, 1.8.0_172) da https://imagej.nih.gov/ij/download.html o eseguilo dal browser del computer.
- Carica una pila di immagini trascinando e rilasciando o selezionando File | Importa | | della sequenza di immagini Sfoglia. Non modificare alcun parametro, quindi selezionare OK.
- Quindi, utilizzare lo strumento cerchio per selezionare la sezione inferiore del pozzo contenente i pellet fecali. Rimuovete gli spigoli del pozzo, selezionate Modifica | Chiaro all'esterno. Rendi l'immagine binaria, seleziona Elabora | Crea binario.
- Calibrare selezionando Analizza | Impostare la scala e scegliere il numero di pixel per millimetro per l'immagine (ad esempio 10 pixel = 1 mm). Conta i pellet, seleziona Analizza | Analizzare le particelle.
- Nella casella accanto a Dimensioni (unità2), selezionare una soglia inferiore uguale al pellet di dimensioni più piccole, utilizzando la scala unitaria impostata in precedenza (ad esempio, se 10 pixel = 1 mm e il pellet più piccolo è 0,5 mm, scegliere 5-infinito).
- Nella casella a discesa Mostra selezionare Contorni, quindi selezionare Riepilogo e premere OK (Figura 8).
NOTA: Ulteriori informazioni sono disponibili all'indirizzo https://imagej.nih.gov/ij/docs/guide/index.html

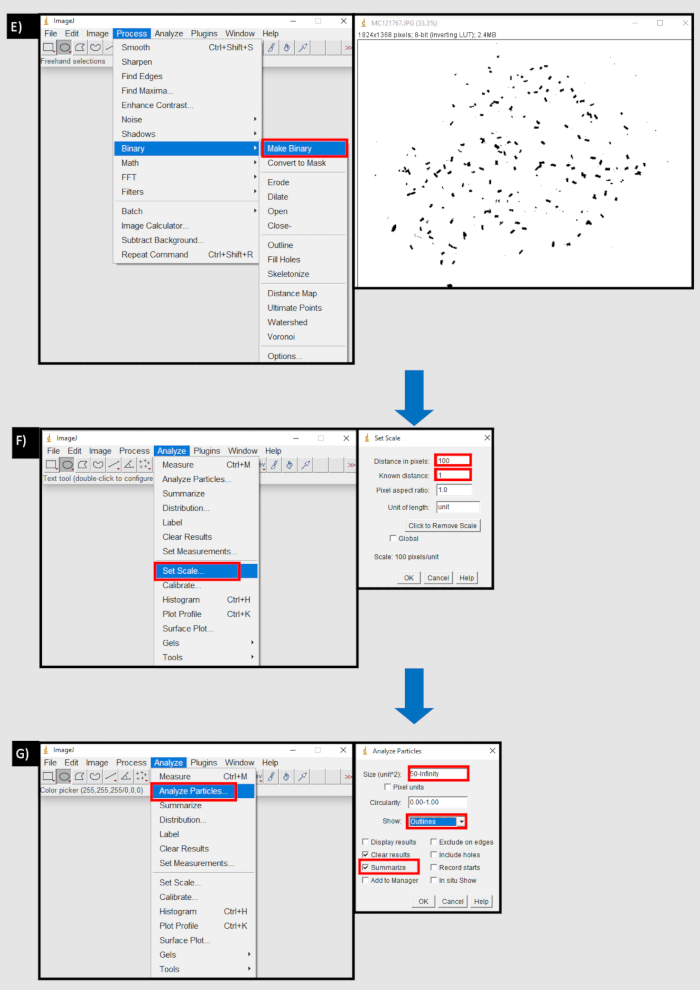
Figura 8: Diagramma di flusso del processo utilizzato in ImageJ per contare i pellet fecali. A) Importazione di una sequenza di immagini nella scheda File di ImageJ. B) Il pulsante Sfoglia nella finestra di dialogo "Importa sequenza immagine" per importare una sequenza di immagini da un dispositivo locale. C) Utilizzo dello strumento cerchio per selezionare l'area contenente pellet fecali D) Cancella pulsante esterno nell'area della scheda di modifica per rimuovere al di fuori dell'area selezionata. E) Crea pulsante binario nella scheda processo. F) Imposta pulsante scala nella scheda Analizza. La distanza in pixel è equivalente al numero di pixel per un'unità di misura (mm). G) Pulsante Analizza particelle nella scheda Analizza. Dimensione (unità^2) impostata sulla soglia inferiore della dimensione del pellet fecale, in pixel, all'infinito. Mostra 'contorni' e 'riepiloga' sono selezionati. Fare clic qui per visualizzare una versione più grande di questa figura.
-
Analisi dei dati
- Convertire i conteggi dei pellet in pellet al giorno, che fornisce una misura indiretta della velocità di alimentazione. Scartare i dati di qualsiasi individuo muta nei giorni in cui si è verificata la muta (Figura 9).
NOTA: la muta si verifica nell'arco di 1-3 giorni e può essere identificata quando si può vedere una muta completa dell'esoscheletro.
- Convertire i conteggi dei pellet in pellet al giorno, che fornisce una misura indiretta della velocità di alimentazione. Scartare i dati di qualsiasi individuo muta nei giorni in cui si è verificata la muta (Figura 9).

Figura 9: Esempio di muta di gribble. Gribble (L. quadripunctata) muta, su un bastoncino di prova in legno di pino Radiata delle dimensioni di 20 mm x 4 mm x 2 mm. Le mute sono indicate da cerchi rossi. Barra della scala 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Un esperimento di alimentazione di L. quadripunctata è stata condotta per 20 giorni, utilizzando cinque diversi tipi di legno (pino silvestre (Pinus sylvestris L) alburno e durame di faggio (Fagus sylvatica L), ekki (Lophira alata Banks ex C. F Gaertn), castagno dolce (Castanea sativa Mil) e trementina (Syncarpia glomulifera (Sm.) Neid)) (Vedi Tabella dei materiali), nel novembre 2020. Otto bastoncini replicati sono stati utilizzati per spe...
Discussione
Prima di selezionare i campioni di gribble da utilizzare nell'esperimento di alimentazione, gli individui devono essere sottoposti a screening per valutarne l'idoneità. Ci può essere qualche variazione nel tasso di alimentazione tra gli individui a causa di differenze di dimensioni, quindi dovrebbero essere selezionati solo esemplari adulti completamente cresciuti. Nessuna differenza significativa tra la velocità di alimentazione degli individui tra 1,5 mm e 3 mm di lunghezza è stata rilevata da Borges et al.,
Divulgazioni
Gli autori non hanno conflitti di interesse relativi a questo studio.
Riconoscimenti
Grazie al Consiglio di ricerca della Norvegia (Fondo regionale di Oslo, Alcofur rffofjor 269707) e all'Università di Portsmouth (borsa di ricerca della Facoltà di Scienze) per aver fornito finanziamenti per gli studi di Lucy Martin. Inoltre, a Gervais S. Sawyer che ha fornito il legno utilizzato per generare i risultati rappresentativi. La trementina è stata fornita dal Prof. Philip Evans dell'Università della British Columbia.
Materiali
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
Riferimenti
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon