Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Pruebas rápidas de resistencia de la madera a la biodegradación por crustáceos perforadores de madera marina
En este artículo
Resumen
Este protocolo presenta un método para evaluar la tasa de alimentación del crustáceo perforador de madera, Limnoria, mediante la medición de la producción de pellets fecales. Este método está diseñado para su uso en laboratorios no especializados y tiene potencial para su incorporación en protocolos de prueba estándar, para evaluar la durabilidad mejorada de la madera en condiciones marinas.
Resumen
Los invertebrados perforadores de madera destruyen rápidamente las maderas marinas y la infraestructura costera de madera, causando miles de millones de dólares en daños en todo el mundo cada año. Como los tratamientos de la madera con biocidas de amplio espectro, como la creosota y el arseniato de cobre cromado (CCA), ahora están restringidos en el uso marino por la legislación, se requieren especies de madera naturalmente duraderas y nuevos métodos de preservación de la madera. Estos métodos se someten a pruebas para cumplir con las normas reglamentarias, como la norma europea para probar conservantes de madera contra barrenadores marinos, EN 275. La investigación inicial de especies de maderas duraderas o tratamientos conservantes de madera se puede lograr de manera rápida y económica a través de pruebas de laboratorio, lo que ofrece muchas ventajas sobre los ensayos de campo marinos que suelen ser costosos y a largo plazo. Muchas especies de Limnoria (gribble) son crustáceos perforadores de madera marina. Limnoria son ideales para su uso en pruebas de laboratorio de biodegradación de madera por barrenadores de madera marinos, debido a la practicidad de criarlos en acuarios y la facilidad de medir sus tasas de alimentación en madera. A continuación, describimos una prueba de laboratorio estandarizable para evaluar la biodegradación de la madera utilizando gribble.
Introducción
Los barrenadores de la madera pueden causar daños extensos a las estructuras marinas de madera, como las defensas marinas, los muelles y las estructuras acuícolas; cuyo reemplazo o restauración cuesta miles de millones de dólares anuales en todo el mundo1,2,3. Con el fin de proteger estas estructuras, la madera a menudo se trata para reducir la biodegradación. Sin embargo, debido a la restricción del uso de biocidas de amplio espectro en Australia, la UE, el Reino Unido y los Estados Unidos, en el medio marino, se buscan nuevas técnicas de modificación y especies de madera que sean naturalmente duraderas para los barrenadores4,5,6,7. Las nuevas técnicas para la preservación de la madera en el medio marino requieren pruebas exhaustivas para cumplir con las normas reglamentarias y limitar los impactos ambientales de peligros como la lixiviación de cualquier conservante químico. Por ejemplo, la norma europea, EN 275, que es la norma europea actual de 1992, se utiliza para evaluar los tratamientos de conservación de la madera contra el daño del barrenador de la madera marina8,9. Esta norma, junto con otras legislaciones contra el uso de compuestos biocidas, como CCA4,5,6,7 y creosota10, requiere métodos sostenibles y no tóxicos de protección de la madera y el uso de especies de madera naturalmente duraderas para reemplazar los tratamientos biocidas11,12 . Los ensayos marinos, como los especificados en la norma EN 275, requieren largos períodos de exposición y, por lo tanto, son costosos y lentos para producir resultados significativos. Las pruebas de laboratorio, sin embargo, proporcionan una alternativa mucho más rápida a los métodos de prueba para preservar los productos de madera contra el ataque del barrenador de la madera marina, lo que permite una evaluación rápida de los ajustes a los programas de tratamiento13. Los resultados de este rápido experimento de laboratorio están diseñados para informar nuevos procesos de modificación de la madera e identificar especies de madera con durabilidad natural para el daño del barrenador. Una baja tasa de alimentación y vitalidad puede indicar una mayor resistencia en los productos potenciales y esta información se puede devolver a los socios de la industria para permitirles mejorar los diseños. Nuestro método permite una respuesta ágil y rápida, que es deseable en la industria, y una vez que se han identificado productos prometedores, los resultados se pueden complementar con los de los ensayos marinos.
Limnoria es un género de crustáceos isópodos de la familia Limnoriidae. Hay más de 60 especies de Limnoria en todo el mundo13,14,15, con tres especies comunes que se encuentran en el Reino Unido, Limnoria lignorum, Limnoria tripunctata y Limnoria quadripunctata16. Perforaron túneles en la superficie de la madera que está sumergida en el agua de mar, a menudo causando daños económicamente significativos. Los gribbles son muy abundantes en las aguas costeras del Reino Unido y son fáciles de mantener en condiciones de laboratorio, lo que los convierte en organismos ideales para el estudio de la biodegradación de la madera por invertebrados perforadores de madera marina. La evaluación de las tasas de alimentación y la vitalidad de las planchas en diferentes especies de madera y los métodos de preservación de la madera pueden determinar la eficacia de su resistencia a la biodegradación. El siguiente protocolo establece un método estándar para medir las tasas de alimentación de gribble, desarrollado a partir del descrito por Borges y colegas12,17, además de agilizar la introducción del análisis de imágenes para que el proceso sea operable en laboratorios no especializados. El análisis de imágenes también se utiliza para reducir las limitaciones prácticas de contar manualmente un gran número de muestras. La durabilidad en las pruebas marinas a largo plazo, de acuerdo con la norma británica EN350-1:1994, se clasifica en referencia a la albura Pinus sylvestris18. En las pruebas de laboratorio a corto plazo presentadas aquí, utilizamos albura de pino silvestre (Pinus sylvestris L) como control para probar el duramen de las especies ekki (Lophira alata Banks ex C.F Gaertn), haya (Fagus sylvatica L), castaño dulce (Castanea sativa Mill) y trementina (Syncarpia glomulifera (Sm.) Nied). La producción promedio de pellets fecales y la vitalidad entre ocho réplicas por especie de madera se utilizó como indicador de durabilidad. Proporcionamos datos ilustrativos recopilados de una evaluación típica, utilizando la especie gribble Limnoria quadripunctata y una gama de especies de madera naturalmente duraderas. Limnoria quadripunctata, identificada por las claves proporcionadas por Menzies (1951), fue seleccionada como la especie óptima para los ensayos de biodegradación debido al hecho de que es el miembro más estudiado de la familia y está bien establecido como una especie modelo para su uso en ensayos de biodegradación. Este protocolo también es aplicable para ensayar maderas de diferentes tratamientos aunque el control utilizado debe ser replicaciones no tratadas de la misma especie.
Protocolo
1. Preparación de palos de prueba
- Una vez completados los procesos de tratamiento, corte la madera seca en varillas de prueba de 2 mm x 4 mm x 20 mm (Figura 1). El secado al aire se adhiere a un peso constante, en condiciones de laboratorio. Use al menos 5 réplicas de cada madera que se esté probando.

Figura 1: Varillas de prueba utilizadas en pruebas de laboratorio a corto plazo para evaluar las tasas de alimentación con gribble. Varillas de madera de prueba de tamaño 2 mm x 4 mm x 20 mm. De izquierda a derecha: ekki, trementina, castaña dulce y duramen de haya y albura de pino silvestre. Barra de escala de 4 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Impregnación al vacío
- Después de la preparación de la madera (es decir, corte y tratamiento, si corresponde), coloque los palitos debajo de una malla en un recipiente de plástico seguro para los alimentos, dentro del desecador al vacío y reemplace la tapa para garantizar que haya un sello hermético, facilitado por un recubrimiento de grasa al vacío (Figura 2).
- Conecte una válvula de tres vías entre el tubo que conecta el desecador y la bomba, con un tercer tubo que conduce al aire libre (Figura 2). Asegúrese de que la válvula de tres vías esté cerrada al aire y haga funcionar la bomba para lograr un vacío de entre -0.75 a -1.0 bar dentro del desecador de vacío y mantenga este vacío durante 45 minutos - 1 hora.
- Sumerja el extremo abierto del tercer tubo en un recipiente de agua de mar. Apague la bomba y cierre la válvula que conduce a la bomba, luego abra lentamente la válvula hasta que el vacío extraiga el agua de mar hacia el desecador. Deje que el agua fluya hasta que llene el recipiente de plástico, por encima del nivel de la malla.
- Luego retire el tubo del agua de mar en el recipiente, permitiendo que entre aire, hasta que el desecador regrese a la presión atmosférica. Mantenga los palos sumergidos debajo de la malla hasta que se hundan en el fondo del recipiente de plástico.

Figura 2: Equipo utilizado para impregnar al vacío palos de madera con agua de mar, en preparación para la alimentación a gribbles durante un ensayo de alimentación de laboratorio. A) Desecador de vacío; B) Bomba; C) Manómetro para el desecador de vacío; D) La válvula de tres vías que conduce al desecador de vacío, a la bomba y al aire libre o al agua de mar (tubo naranja). Haga clic aquí para ver una versión más grande de esta figura.
- Lixiviación de madera
- Sumergir las varillas de ensayo saturadas de agua de mar en agua de mar contenida en tubos de 50 ml (Figura 3). Reemplace el agua regularmente durante un período de 20 días.
NOTA: El proceso de lixiviación se aplica a cualquier madera experimental bajo prueba, incluidas las maderas tratadas o naturales.
- Sumergir las varillas de ensayo saturadas de agua de mar en agua de mar contenida en tubos de 50 ml (Figura 3). Reemplace el agua regularmente durante un período de 20 días.

Figura 3: Lixiviado de palos de madera para la preparación para la alimentación a gribbles durante un ensayo de alimentación de laboratorio. La madera que estaba completamente sumergida en agua de mar contenida en un tubo Falcon de 50 ml, con cambio regular de agua (1-3 días), producía lixiviados de colores distintos. De izquierda a derecha lixiviado de duramen de; castaña dulce, trementina, ekki, y albura de haya y pino silvestre. Haga clic aquí para ver una versión más grande de esta figura.
2. Extracción de Gribble
- Extraiga especímenes individuales de gribble de un bloque de madera infestado. Use un par de pinzas finas y un pincel delgado (tamaño 000/0.4 mm o menor). Pelar con cuidado cualquier madera que esté cubriendo la madriguera gribble con las pinzas
NOTA: Las madrigueras se encuentran en la superficie de la madera y se pueden identificar por pequeños agujeros (Figura 4). - Una vez que la plancha haya sido expuesta, use un pincel para recoger suavemente a las personas de debajo y depositarlas en una placa de Petri llena de agua de mar. Verifique el gribble bajo un microscopio para identificar especies y asegurarse de que no se causaron daños durante la extracción.
NOTA: Vencer a los pleópodos es un signo de vitalidad.- Descarte cualquier hembra que cría huevos ya que las hembras grávidas tienen una capacidad de alimentación reducida.

Figura 4: Imagen de una madriguera de gribble con dos orificios de ventilación típicos. L. madripunctata quadripunctata sobre un palo de madera de pino Radiata, de tamaño 2 mm x 4 mm x 20 mm. Dos agujeros de ventilación más pequeños se pueden ver junto a la entrada de la madriguera. Barra de escala de 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Identificación de Limnoria quadripunctata
- Identificar Limnoria quadripunctata bajo un estereomicroscopio por los cuatro tubérculos distintos, dispuestos en un patrón cuadrado, en el pleotelson del animal, además de una carina en forma de X en el quinto pleonito19 (Figura 5).

Figura 5: Características identificativas de Limnoria quadripunctata . Imagen de la superficie dorsal Limnoria quadripunctata, tomada en un estereomicroscopio a un aumento x20. Las características de identificación mostradas por la flecha roja - indica la carina en forma de X y la flecha azul - indica cuatro tubérculos en pleotelson. Barra de escala de 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación de placas de pozo
- En placas de pozos múltiples con pozos de diámetro 20 mm, coloque una varilla de prueba y 5 ml de agua de mar sin filtrar, entre 32-35 PSU, por pozo (Figura 6).
- Coloque tratamientos/especies de madera sistemáticamente en toda la placa del pozo para que cada tipo de madera esté representada al menos una vez por placa. Agregue un gribble por pozo.
NOTA: La temperatura debe mantenerse estable en una incubadora a 20 °C ± 2 °C para la especie L. quadripunctata, otras especies de Limnoria se pueden utilizar con ajustes a la temperatura realizados para adaptarse a la especie específica. - Mantenga las placas en condiciones de oscuridad constantes, ya que el fotoperíodo no tiene un efecto sobre la velocidad de alimentación del gribble15.

Figura 6: Configuración experimental para el ensayo de alimentación de gribble. Un ejemplo de una placa de 12 pocillos múltiples utilizada en las pruebas de laboratorio de la tasa de alimentación de gribble. Cada pozo contiene 5 ml de agua de mar y una varilla de ensayo (20 mm x 4 mm x 2 mm) de diferentes especies de madera; Albura de pino silvestre y ekki, haya, castaña dulce y duramen de trementina. Barra de escala de 20 mm. Haga clic aquí para ver una versión más grande de esta figura.
4. Recolección y conteo de pellets fecales y evaluación de la vitalidad.
- Dos veces por semana, retire la varilla de prueba y cada plancha (una por pozo) de la placa del pozo y colóquela en una placa de pozo recién preparada (que contenga 5 ml de agua de mar por pozo [32-35 PSU, 18-22 ° C]).
- Use un pincel para cepillar suavemente cualquier gránulo fecal del palo antes de transferir y retener los gránulos fecales dentro del pozo original.
NOTA: Antes de transferir el gribble a un plato de pozo fresco, la vitalidad se puede evaluar en una escala de 1 a 5; 1= muerto, 2 = pasivo, no en la madera, 3 = nadar o golpear activamente pleópodos, no en la madera, 4 = gatear en la superficie de la madera, 5 = excavado en la madera. - Tratamiento de imágenes
- Use un pincel fino para separar cualquier grupo para que los gránulos individuales sean visibles y cepille los gránulos lejos de los bordes del pozo. Tome una fotografía detallada bajo un microscopio estereoscópico, con aumento x4 y cárguela en una computadora (Figura 7).
NOTA: Asegúrese de que los gránulos estén enfocados y que el fondo sea uniforme, sin sombras ni reflejos de luz en la superficie del agua.
- Use un pincel fino para separar cualquier grupo para que los gránulos individuales sean visibles y cepille los gránulos lejos de los bordes del pozo. Tome una fotografía detallada bajo un microscopio estereoscópico, con aumento x4 y cárguela en una computadora (Figura 7).
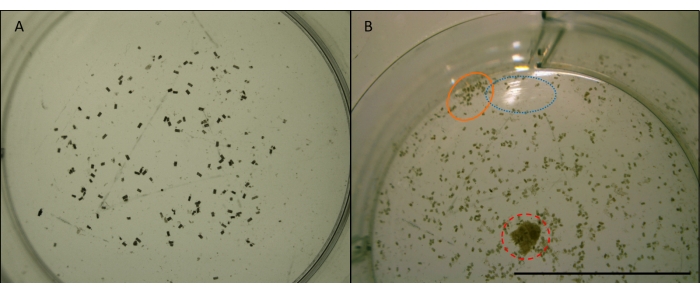
Figura 7: Imagen de pellets fecales gribulables. L. gránulos fecales quadripunctata (gránulos pequeños, cilíndricos y marrones) que se alimentan de madera de pino Radiata en un pozo de una placa de varios pozos. Tomado a aumento x4. Imágenes previas a la manipulación para el análisis de imágenes (ver Figura 7). A) Ejemplo de una imagen adecuada para ser utilizada para el conteo automatizado en ImageJ. Los gránulos están suficientemente extendidos y lejos de los bordes del pozo. El pozo está centrado y no hay obstrucciones ni reflejos. B) Un ejemplo de una imagen que no es adecuada para el análisis de imágenes. El pozo está descentrado, cortando la mitad inferior. El círculo azul (punteado) muestra la reflexión de la luz de la superficie del agua. El círculo naranja (sólido) muestra gránulos que se agrupan demasiado juntos y demasiado cerca del borde del pozo. El círculo rojo (discontinuo) muestra una astilla de madera que no se quitó. Barra de escala de 10 mm. Haga clic aquí para ver una versión más grande de esta figura.
- Proceso para generar el recuento de pellets fecales utilizando ImageJ.
- Descargue ImageJ (última versión a partir del 03/08/21, 1.8.0_172) desde https://imagej.nih.gov/ij/download.html o ejecute desde el navegador de la computadora.
- Cargue una pila de imágenes arrastrando y soltando o seleccionando Archivo | Importar | Secuencia de | de imágenes Navegar. No cambie ningún parámetro y, a continuación, seleccione Aceptar.
- A continuación, use la herramienta de círculo para seleccionar la sección inferior del pozo que contiene los gránulos fecales. Elimine los bordes del pozo, seleccione Editar | Despejar por fuera. Haga que la imagen sea binaria, seleccione Procesar | Hacer binario.
- Calibrar seleccionando Analizar | Establezca la escala y elija el número de píxeles por milímetro para la imagen (por ejemplo, 10 píxeles = 1 mm). Cuente los pellets, seleccione Analizar | Analizar partículas.
- En el cuadro situado junto a Tamaño (unidad2), seleccione un umbral inferior que sea el mismo que el pellet de tamaño más pequeño, utilizando la escala unitaria establecida anteriormente (por ejemplo, si 10 píxeles = 1 mm y el gránulo más pequeño es 0,5 mm, elija 5-infinito).
- En el cuadro desplegable Mostrar , seleccione Contornos y, a continuación, marque Resumir y presione Aceptar (Figura 8).
NOTA: Puede encontrar más información en https://imagej.nih.gov/ij/docs/guide/index.html

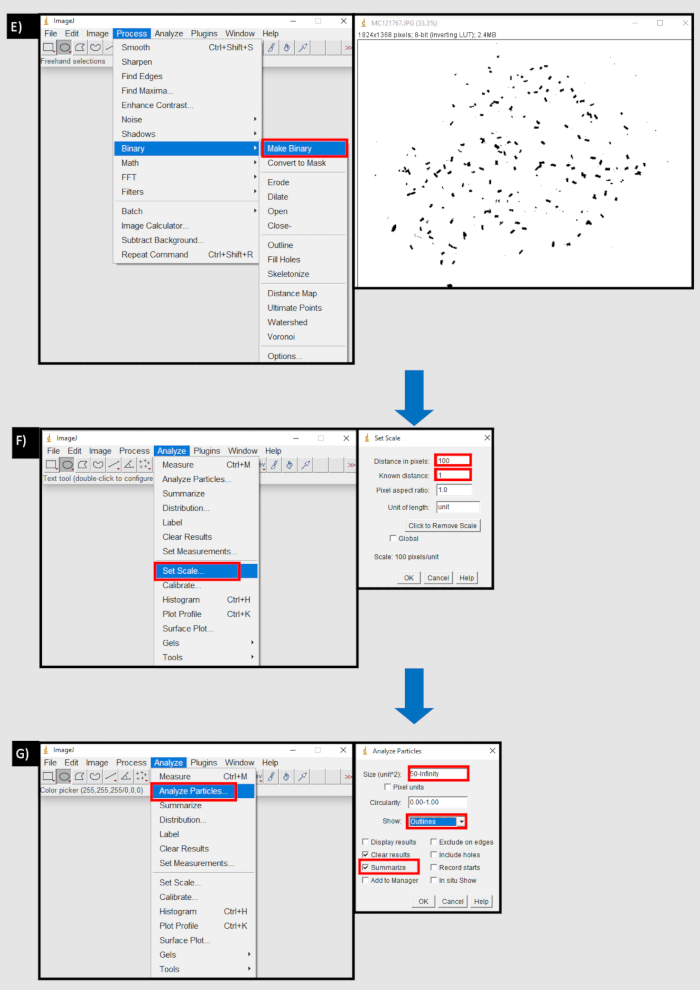
Figura 8: Un diagrama de flujo del proceso utilizado en ImageJ para contar los gránulos fecales. A) Importar una secuencia de imágenes en la pestaña Archivo de ImageJ. B) El botón examinar en el cuadro de diálogo 'Importar secuencia de imágenes' para importar una secuencia de imágenes desde un dispositivo local. C) Uso de la herramienta de círculo para seleccionar el área que contiene gránulos fecales D) Botón Borrar exterior en el área de la pestaña de edición para eliminar fuera del área seleccionada. E) Hacer botón binario en la pestaña proceso. F) Establecer botón de escala en la pestaña Analizar. La distancia en píxeles es equivalente al número de píxeles a una unidad de medida (mm). G) Botón Analizar partículas en la pestaña Analizar. Tamaño (unidad^2) establecido en el umbral inferior del tamaño de la bolita fecal, en píxeles, hasta el infinito. Se seleccionan mostrar 'esquemas' y 'resumen'. Haga clic aquí para ver una versión más grande de esta figura.
-
Análisis de datos
- Convierta los recuentos de pellets en pellets por día, lo que da una medida indirecta de la tasa de alimentación. Descarte los datos de cualquier individuo que muda en los días en que ocurrió la muda (Figura 9).
NOTA: La muda ocurre durante 1-3 días y se puede identificar cuando se puede ver una muda completa del exoesqueleto.
- Convierta los recuentos de pellets en pellets por día, lo que da una medida indirecta de la tasa de alimentación. Descarte los datos de cualquier individuo que muda en los días en que ocurrió la muda (Figura 9).

Figura 9: Ejemplo de muda de gribble. Muda de gribble (L. quadripunctata), sobre una varilla de prueba de madera de pino Radiata de 20 mm x 4 mm x 2 mm. Las mudas están indicadas por círculos rojos. Barra de escala de 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Un experimento de alimentación de L. quadripunctata se realizó durante 20 días, utilizando cinco tipos diferentes de madera (albura de pino silvestre (Pinus sylvestris L) y duramen de haya (Fagus sylvatica L), ekki (Lophira alata Banks ex C. F Gaertn), castaño dulce (Castanea sativa Mil) y trementina (Syncarpia glomulifera (Sm.) Neid)) (Ver Tabla de materiales), en noviembre de 2020. Se utilizaron ocho palos replicados por especie de mad...
Discusión
Antes de seleccionar los especímenes de gribble para ser utilizados en el experimento de alimentación, los individuos deben ser examinados para evaluar su idoneidad. Puede haber alguna variación en la tasa de alimentación entre los individuos debido a las diferencias de tamaño, por lo que solo se deben seleccionar especímenes adultos completamente desarrollados. Borges et al., 200917 no detectaron diferencias significativas entre la velocidad de alimentación de los individuos entre 1,5 mm y 3 mm...
Divulgaciones
Los autores no tienen conflictos de intereses relacionados con este estudio.
Agradecimientos
Gracias al Consejo de Investigación de Noruega (Fondo Regional de Oslo, Alcofur rffofjor 269707) y a la Universidad de Portsmouth (beca de investigación de doctorado de la Facultad de Ciencias) por proporcionar fondos para los estudios de Lucy Martin. También, a Gervais S. Sawyer quien proporcionó la madera utilizada para generar los resultados representativos. La trementina fue proporcionada por el Prof. Philip Evans de la Universidad de Columbia Británica.
Materiales
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
Referencias
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados