Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстрое тестирование устойчивости древесины к биодеградации морскими древесными ракообразными
В этой статье
Резюме
Этот протокол представляет собой метод оценки скорости кормления древесно-бурового ракообразного , Limnoria, путем измерения производства фекальных гранул. Этот метод предназначен для использования в неспециализированных лабораториях и имеет потенциал для включения в стандартные протоколы испытаний для оценки повышенной долговечности древесины в морских условиях.
Аннотация
Древовидные беспозвоночные быстро разрушают морскую древесину и деревянную прибрежную инфраструктуру, нанося ущерб на миллиарды долларов по всему миру каждый год. Поскольку обработка древесины биоцидами широкого спектра действия, такими как креозот и хромированный арсенат меди (ОАС), в настоящее время ограничена в морском использовании законодательством, требуются естественно прочные породы древесины и новые методы сохранения древесины. Эти методы проходят испытания на соответствие нормативным стандартам, таким как европейский стандарт для тестирования консервантов древесины против морских буров, EN 275. Первоначальное исследование долговечных пород древесины или обработки древесины консервантами может быть достигнуто быстро и недорого с помощью лабораторных испытаний, которые предлагают множество преимуществ по сравнению с морскими полевыми испытаниями, которые, как правило, являются дорогостоящими, долгосрочными усилиями. Многие виды Limnoria (gribble) являются морскими древовидными ракообразными. Лимнории идеально подходят для использования в лабораторных испытаниях биодеградации древесины морскими лесорубами, благодаря практичности выращивания их в аквариумах и простоте измерения скорости их питания на древесине. Здесь мы описываем стандартизируемый лабораторный тест для оценки биодеградации древесины с использованием грибка.
Введение
Дровосеки могут нанести значительный ущерб морским деревянным конструкциям, таким как морские оборонительные сооружения, пирсы и сооружения аквакультуры; замена или восстановление которых обходится в миллиарды долларов в год во всем мире1,2,3. Чтобы защитить эти структуры, древесину часто обрабатывают, чтобы уменьшить биодеградацию. Однако из-за ограничения использования биоцидов широкого спектра действия в Австралии, ЕС, Великобритании и США в морской среде востребованы новые методы модификации и породы древесины, которые естественным образом долговечны для бурильщиков4,5,6,7. Новые методы сохранения древесины в морской среде требуют тщательного тестирования в целях соблюдения нормативных стандартов и ограничения воздействия на окружающую среду таких опасностей, как выщелачивание любого химического консерванта. Например, европейский стандарт EN 275, который является действующим европейским стандартом с 1992 года, используется для оценки обработки древесины на предмет повреждения морской древесиной8,9. Настоящий стандарт, наряду с другими законодательными актами, запрещающими использование биоцидных соединений, таких как CCA4,5,6,7 и creosote10, требует устойчивых, нетоксичных методов защиты древесины и использования естественно прочных древесных пород для замены биоцидных обработок11,12 . Морские испытания, такие как те, которые указаны в EN 275, требуют длительных периодов воздействия и, таким образом, являются дорогостоящими и медленными для получения значимых результатов. Лабораторные испытания, однако, обеспечивают гораздо более быструю альтернативу методам испытаний древесины против нападения морских дровосек, что позволяет быстро оценить корректировки графиков обработки13. Результаты этого быстрого лабораторного эксперимента предназначены для информирования о новых процессах модификации древесины и выявления пород древесины с естественной стойкостью к повреждению. Низкая скорость кормления и жизнеспособность могут указывать на повышенную устойчивость потенциальных продуктов, и эта информация затем может быть передана партнерам по отрасли, чтобы позволить им улучшить конструкции. Наш метод позволяет гибко и быстро реагировать, что желательно в промышленности, и как только перспективные продукты были идентифицированы, результаты могут быть дополнены результатами морских испытаний.
Limnoria — род изоподовых ракообразных из семейства Limnoriidae. Существует более 60 видов Limnoria во всем мире13,14,15, с тремя распространенными видами, найденными в Великобритании: Limnoria lignorum, Limnoria tripunctata и Limnoria quadripunctata16. Они прокладывали туннели на поверхности древесины, которая погружается в морскую воду, часто нанося экономически значительный ущерб. Грибы очень распространены в прибрежных водах Великобритании и их легко поддерживать в лабораторных условиях, что делает их идеальными организмами для изучения биодеградации древесины морскими древесными беспозвоночными. Оценка скорости кормления и жизнеспособности грибков на различных породах древесины и методов сохранения древесины может определить эффективность их устойчивости к биодеградации. Следующий протокол устанавливает стандартный метод измерения скорости подачи грибка, разработанный на основе того, что описан Борхесом и его коллегами12,17, в дополнение к упрощению внедрения анализа изображений, чтобы сделать процесс работоспособным в неспециализированных лабораториях. Анализ изображений также используется для уменьшения практических ограничений ручного подсчета большого количества образцов. Долговечность при длительных морских испытаниях, согласно британскому стандарту EN350-1:1994, оценивается по отношению к заболоне Pinus sylvestris18. В краткосрочном лабораторном тестировании, представленном здесь, мы используем заболонью сосну обыкновенную (Pinus sylvestris L) в качестве контроля для тестирования сердцевины пород экки (Lophira alata Banks ex C.F Gaertn), бука (Fagus sylvatica L), сладкого каштана (Castanea sativa Mill) и скипидара (Syncarpia glomulifera (Sm.) Nied). В качестве показателя долговечности использовалось среднее производство фекальных гранул и жизнеспособность среди восьми реплик на одну породу древесины. Мы предоставляем иллюстративные данные, собранные из типичной оценки, с использованием вида Limnoria quadripunctata и ряда естественно прочных пород древесины. Limnoria quadripunctata, идентифицированная ключами, предоставленными Menzies (1951), была выбрана в качестве оптимального вида для испытаний биодеградации из-за того, что она является наиболее хорошо изученным членом семейства и хорошо зарекомендовала себя в качестве модельного вида для использования в испытаниях биодеградации. Этот протокол также применим для тестирования древесины с различными обработками, хотя используемый контроль должен быть необработанными репликациями одного и того же вида.
протокол
1. Подготовка тестовых палочек
- После завершения любых процессов обработки нарежьте сухую древесину на испытательные палочки размером 2 мм x 4 мм x 20 мм (рисунок 1). Воздух сухой прилипает к постоянному весу, в лабораторных условиях. Используйте не менее 5 реплик каждой тестируемой древесины.

Рисунок 1: Тестовые палочки, используемые в краткосрочных лабораторных испытаниях для оценки скорости кормления гриба. Тестовые деревянные палочки размером 2 мм x 4 мм x 20 мм. Слева направо: экки, скипидар, сладкий каштан и буковое сердцевина и заболонь сосны обыкновенной. Шкала 4 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Вакуумная пропитка
- После подготовки древесины (т.е. резки и обработки, если это применимо) поместите палочки под сетку в безопасный для пищевых продуктов пластиковый контейнер внутри вакуумного осушителя и замените крышку, обеспечив плотное уплотнение, чему способствует покрытие из вакуумной смазки (рисунок 2).
- Прикрепите трехходовой клапан между трубкой, соединяющей адсорбатор и насос, с третьей трубкой, ведущей на открытый воздух (рисунок 2). Убедитесь, что трехсторонний клапан закрыт для воздуха, и запустите насос для достижения вакуума от -0,75 до -1,0 бар в вакуумном осушителе и удерживайте этот вакуум в течение 45 минут - 1 часа.
- Погрузите открытый конец третьей трубы в емкость с морской водой. Выключите насос и закройте клапан, ведущий к насосу, затем медленно откройте клапан, пока морская вода не будет втянута вакуумом в осушитель. Дайте воде течь, пока она не наполнит пластиковый контейнер, выше уровня сетки.
- Затем извлеките трубку из морской воды в контейнер, позволив воздуху войти, пока осушитель не вернется к атмосферному давлению. Держите палочки погруженными под сетку, пока они не опустятся на дно пластикового контейнера.

Рисунок 2: Оборудование, используемое для вакуумной пропитки древесных палочек морской водой, при подготовке к кормлению грибов во время лабораторного анализа кормления. А) Вакуумный осушитель; Б) Насос; В) Манометр для вакуумного осушителя; D) Трехходовой клапан, ведущий к вакуумному осушителю, насосу и к открытому воздуху или морской воде (оранжевая трубка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Выщелачивание древесины
- Погружайте насыщенные морской водой тест-палочки в морскую воду, содержащуюся в пробирках объемом 50 мл (рисунок 3). Регулярно заменяйте воду в течение 20 дней.
ПРИМЕЧАНИЕ: Процесс выщелачивания применяется к любой экспериментальной древесине, проходящей испытания, включая обработанную или натуральную древесину.
- Погружайте насыщенные морской водой тест-палочки в морскую воду, содержащуюся в пробирках объемом 50 мл (рисунок 3). Регулярно заменяйте воду в течение 20 дней.

Рисунок 3: Выщелачивание из древесных палочек для подготовки к подкормке грибов во время лабораторного анализа кормления. Древесина, которая была полностью погружена в морскую воду, содержащуюся в 50 мл falcon tube, с регулярной сменой воды (1-3 дня), производила отчетливо окрашенный фильтрат. Слева направо выщелачивается из сердцевины; сладкий каштан, скипидар, экки, бук и сосновая заболонь обыкновенная. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Извлечение грибка
- Извлеките отдельные образцы грибка из зараженного деревянного блока. Используйте пару мелких щипцов и тонкую (размером 000/0,4 мм или меньше) кисть. Тщательно отклеивайте любую древесину, которая покрывает щипцами нору
ПРИМЕЧАНИЕ: Норы находятся на поверхности древесины и могут быть идентифицированы по небольшим отверстиям (рисунок 4). - После того, как грибок был обнажен, используйте кисть, чтобы осторожно поднять людей снизу и положить в чашку Петри, наполненную морской водой. Проверьте грибок под микроскопом, чтобы идентифицировать виды и убедиться, что во время извлечения не было нанесено никакого ущерба.
ПРИМЕЧАНИЕ: Избиение плеоподов является признаком жизненной силы.- Отбросьте любые самки, выводящие яйца, так как гравидные самки имеют сниженную способность к питанию.

Рисунок 4: Изображение норы с двумя типичными вентиляционными отверстиями. Л. квадрипунктата нора на палочке из сосны Радиата, размером 2 мм х 4 мм х 20 мм. Два меньших вентиляционных отверстия можно увидеть рядом с входом в нору. Шкала 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Идентификация Limnoria quadripunctata
- Идентифицируйте Limnoria quadripunctata под стереомикроскопом по четырем различным бугоркам, расположенным в квадратном рисунке, на плеотельсоне животного в дополнение к X-образной киле на пятом плеоните19 (рисунок 5).

Рисунок 5: Limnoria quadripunctata идентифицирующие признаки. Изображение дорсальной поверхности Limnoria quadripunctata, сделанное на стереомикроскопе при увеличении x20. Идентифицирующие признаки показаны красной стрелкой - указывает на X-образную килю, а синяя стрелка - указывает на четыре бугорка на плеотельсоне. Шкала 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Подготовка плит колодца
- В многоскважинных плитах с скважинами диаметром 20 мм поместите одну испытательную палочку и 5 мл нефильтрованной морской воды, между 32-35 ПГУ, на скважину (рисунок 6).
- Систематически размещайте обработки/породы древесины по всей плите колодца таким образом, чтобы каждый тип древесины был представлен по крайней мере один раз на плиту. Добавьте по одному крупицу на колодец.
ПРИМЕЧАНИЕ: Температура должна поддерживаться стабильной в инкубаторе при 20 °C ± 2 °C для вида L. quadripunctata, другие виды Limnoria могут использоваться с поправками на температуру, сделанную в соответствии с конкретным видом. - Храните пластины в постоянных темных условиях, так как фотопериод не влияет на скорость подачи грибка15.

Рисунок 6: Экспериментальная установка для анализа кормления гриббла. Пример 12 многоскважинной пластины, используемой при лабораторных испытаниях скорости подачи грунта. Каждая скважина содержит 5 мл морской воды и одну пробную палочку (20 мм х 4 мм х 2 мм) различных пород древесины; Сосна обыкновенная, заболонь и экки, бук, сладкий каштан и сердцевина скипидара. Шкала 20 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Сбор и подсчет фекальных гранул и оценка жизнеспособности.
- Два раза в неделю извлекайте пробную палочку и каждую крупу (по одной на лунку) из плиты скважины и помещайте в свежеподготовленную плиту скважины (содержащую 5 мл морской воды на скважину [32-35 ПСС, 18-22 °C]).
- Используйте кисть, чтобы аккуратно смахнуть любые фекальные гранулы с палочки перед переноской и сохранить фекальные гранулы в оригинальной лунке.
ПРИМЕЧАНИЕ: Перед переносом грибка на свежую луночную тарелку жизнеспособность можно оценить по шкале 1-5; 1 = мертвые, 2 = пассивные, не на дереве, 3 = активно плавающие или бьющие плеоподы, не по дереву, 4 = ползающие по поверхности леса, 5 = зарытые в лес. - Обработка изображений
- Используйте тонкую кисть, чтобы отделить любые комки, чтобы были видны отдельные гранулы и отмахивались от самых краев колодца. Сделайте детальную фотографию под стереомикроскопом, с увеличением x4 и загрузите на компьютер (рисунок 7).
ПРИМЕЧАНИЕ: Убедитесь, что гранулы находятся в фокусе, а фон равномерный, без теней или отражений света на поверхности воды.
- Используйте тонкую кисть, чтобы отделить любые комки, чтобы были видны отдельные гранулы и отмахивались от самых краев колодца. Сделайте детальную фотографию под стереомикроскопом, с увеличением x4 и загрузите на компьютер (рисунок 7).
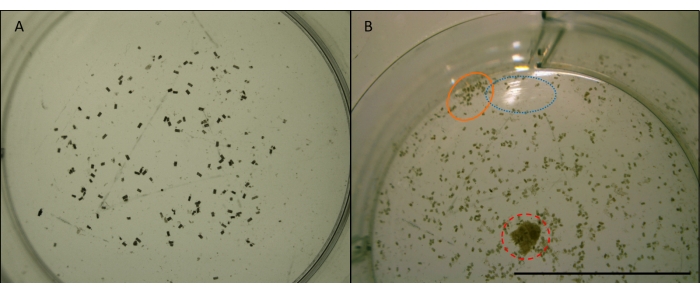
Рисунок 7: Изображение фекальных гранул. Л. quadripunctata фекальные гранулы (мелкие, цилиндрические, коричневые гранулы) от кормления на древесине сосны Radiata в одном колодце многолуночной плиты. Взято при увеличении x4. Изображения до манипуляции для анализа изображений (см. рисунок 7). A) Пример подходящего изображения для использования для автоматического подсчета в ImageJ. Пеллеты достаточно растянуты и удалены от краев колодца. Колодец центрирован, и нет никаких препятствий или отражений. Б) Пример изображения, которое не подходит для анализа изображения. Скважина находится вне центра, отсекая нижнюю половину. Синий (пунктирный) круг показывает отражение света от поверхности воды. Оранжевый (твердый) круг показывает гранулы, которые сломлены слишком близко друг к другу и слишком близко к краю колодца. Красный (пунктирный) круг показывает щепу, которая не была удалена. Шкала 10 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Процесс для создания количества фекальных гранул с помощью ImageJ.
- Скачайте ImageJ (последняя версия от 08.03.21, 1.8.0_172) с https://imagej.nih.gov/ij/download.html или запустите из браузера компьютера.
- Загрузите стопку изображений, перетащив ее или выбрав Файл | Импорт | | последовательности изображений Обзор. Не изменяйте параметры, затем выберите ОК.
- Затем с помощью инструмента «Круг» выберите нижнюю часть скважины, содержащую фекальные гранулы. Удалите края колодца, выберите Изменить | Очистите снаружи. Сделайте изображение двоичным, выберите Обработать | Сделать двоичным.
- Выполните калибровку, выбрав анализ | Установите масштаб и выберите количество пикселей на миллиметр для изображения (например, 10 пикселей = 1 мм). Подсчитайте гранулы, выберите Анализ | Анализ частиц.
- В поле Рядом с полем Размер (блок2) выберите более низкий порог, который совпадает с наименьшим размером гранулы, используя шкалу единиц, установленную ранее (например, если 10 пикселей = 1 мм, а наименьшая гранула составляет 0,5 мм, выберите 5-бесконечность).
- В раскрывающемся списке Показать выберите Контуры , а затем установите флажок Сводка и нажмите Ok (рисунок 8).
ПРИМЕЧАНИЕ: Дополнительную информацию можно найти по адресу https://imagej.nih.gov/ij/docs/guide/index.html

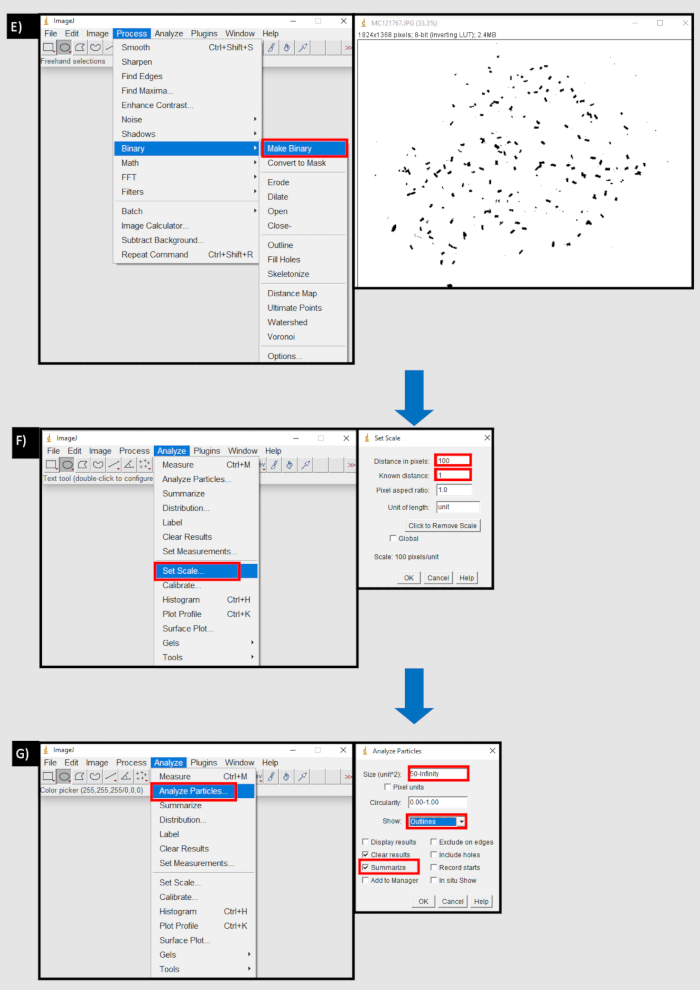
Рисунок 8: Блок-схема процесса, используемого в ImageJ для подсчета фекальных гранул. A) Импорт последовательности изображений на вкладке Файл ImageJ. B) Кнопка обзора в диалоговом окне «Импорт последовательности изображений» для импорта последовательности изображений с локального устройства. C) Использование инструмента «Круг» для выбора области, содержащей фекальные гранулы D) Очистить снаружи кнопку в области вкладки редактирования, чтобы удалить за пределами выбранной области. Д) Сделайте двоичную кнопку на вкладке процесса. F) Установите кнопку масштабирования на вкладке Анализ. Расстояние в пикселях эквивалентно количеству пикселей до одной единицы измерения (мм). G) Кнопка "Анализировать частицы" на вкладке "Анализ". Размер (единица^2) установлен на нижний порог размера фекальной гранулы, в пикселях, до бесконечности. Показать «контуры» и «резюме» выбраны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
-
Анализ данных
- Перевести количество гранул в гранулы в сутки, что дает и косвенный показатель скорости подачи. Отбросьте данные от любых линяющих особей в дни, когда произошла линька (рисунок 9).
ПРИМЕЧАНИЕ: Линька происходит в течение 1-3 дней и может быть идентифицирована, когда можно увидеть полную линьку экзоскелета.
- Перевести количество гранул в гранулы в сутки, что дает и косвенный показатель скорости подачи. Отбросьте данные от любых линяющих особей в дни, когда произошла линька (рисунок 9).

Рисунок 9: Пример линьки. Линька gribble (L. quadripunctata) на испытательной палочке из соснового дерева Radiata размером 20 мм x 4 мм x 2 мм. Линьки обозначены красными кружками. Шкала 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Эксперимент по кормлению Л. квадрипунктата проводилась в течение 20 дней с использованием пяти различных типов древесины (сосна обыкновенная (Pinus sylvestris L) заболони и сердцевина бука (Fagus sylvatica L), экки (Lophira alata Banks ex C. F Gaertn), сладкого каштана (Castanea sativa Mil) и скипида?...
Обсуждение
Прежде чем выбрать образцы грибка для использования в эксперименте по кормлению, особи должны быть проверены, чтобы оценить их пригодность. Могут быть некоторые различия в скорости кормления между особями из-за различий в размерах, поэтому следует отбирать только полностью взрослые э?...
Раскрытие информации
У авторов нет конфликта интересов, связанного с данным исследованием.
Благодарности
Спасибо Исследовательскому совету Норвегии (Региональный фонд Осло, Alcofur rffofjor 269707) и Университету Портсмута (исследовательская стипендия факультета естественных наук) за предоставление финансирования исследований Люси Мартин. Кроме того, Жерве С. Сойеру, который предоставил древесину, используемую для получения репрезентативных результатов. Скипидар был предоставлен профессором Филиппом Эвансом из Университета Британской Колумбии.
Материалы
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
Ссылки
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены